Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
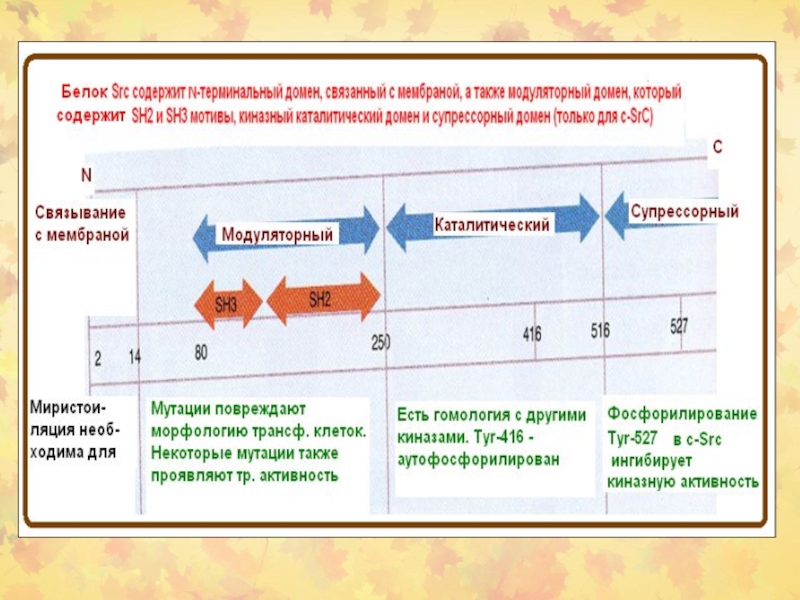
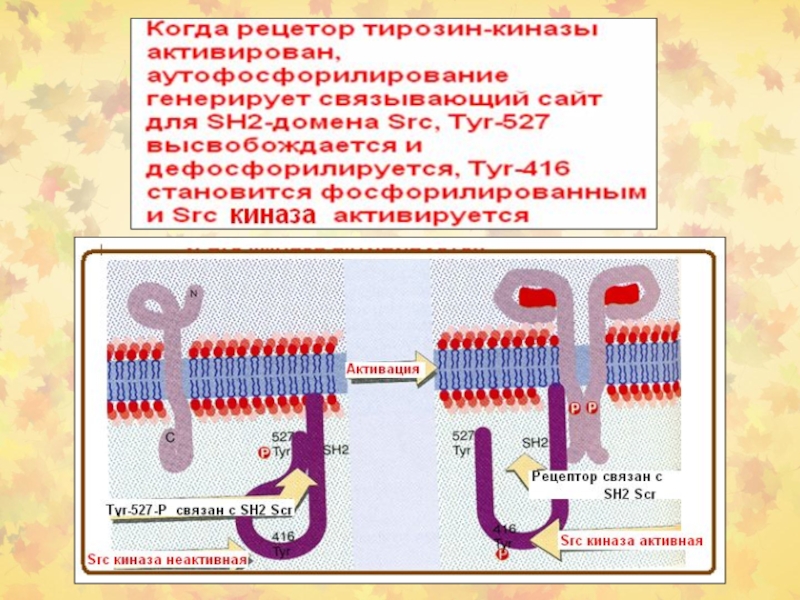
5.2.2. Ассоциированные с мембраной белки (на примере RAS и SRC )
Содержание
- 1. 5.2.2. Ассоциированные с мембраной белки (на примере RAS и SRC )
- 2. Слайд 2
- 3. Слайд 3
- 4. Слайд 4
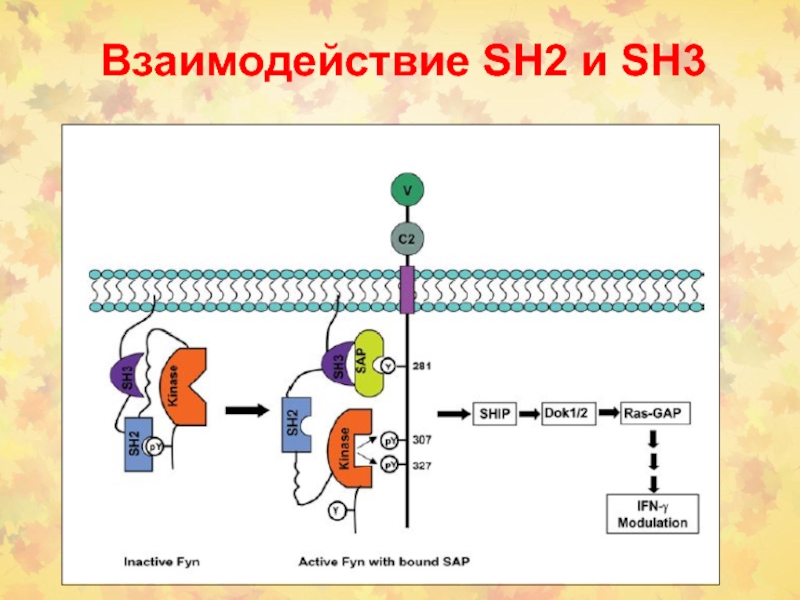
- 5. Взаимодействие SH2 и SH3
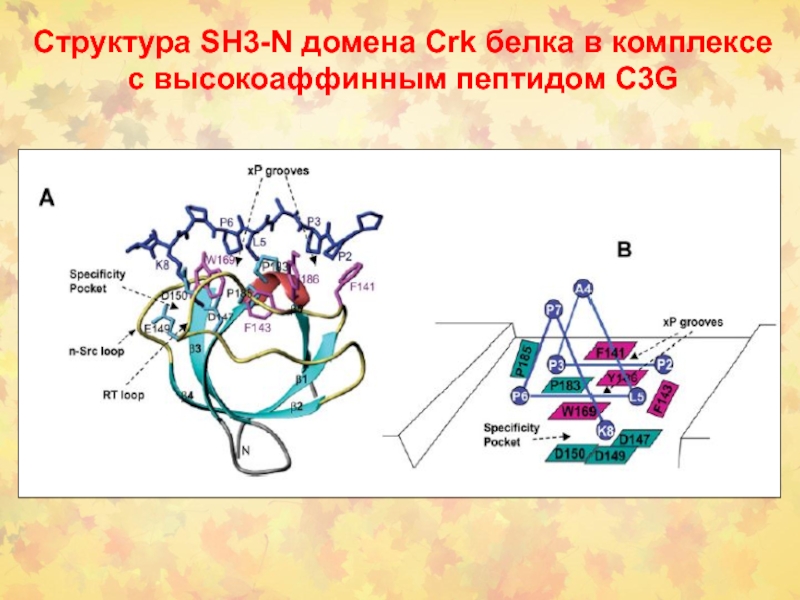
- 6. Структура SH3-N домена Crk белка в комплексе с высокоаффинным пептидом C3G
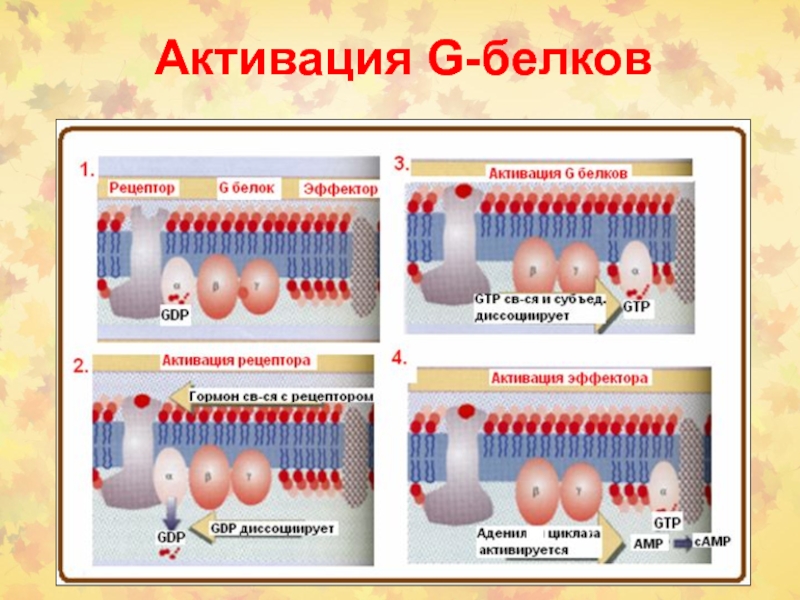
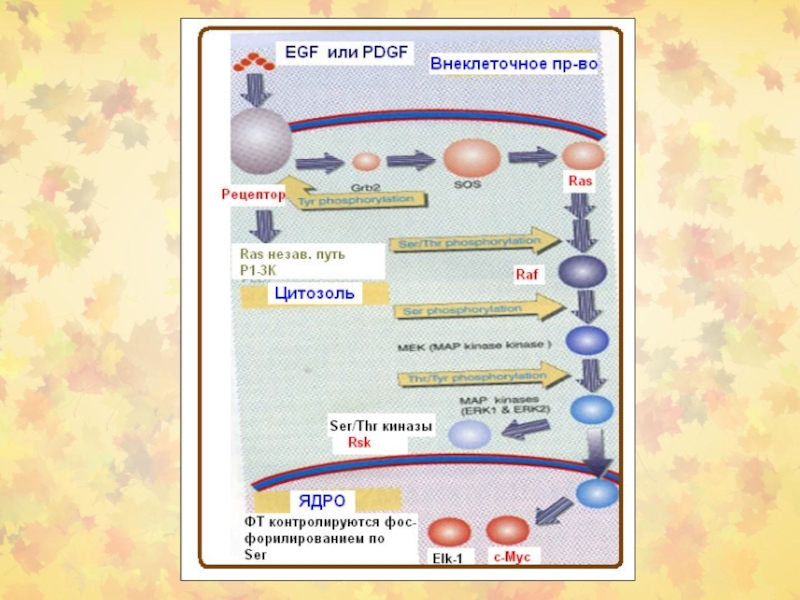
- 7. Активация G-белков
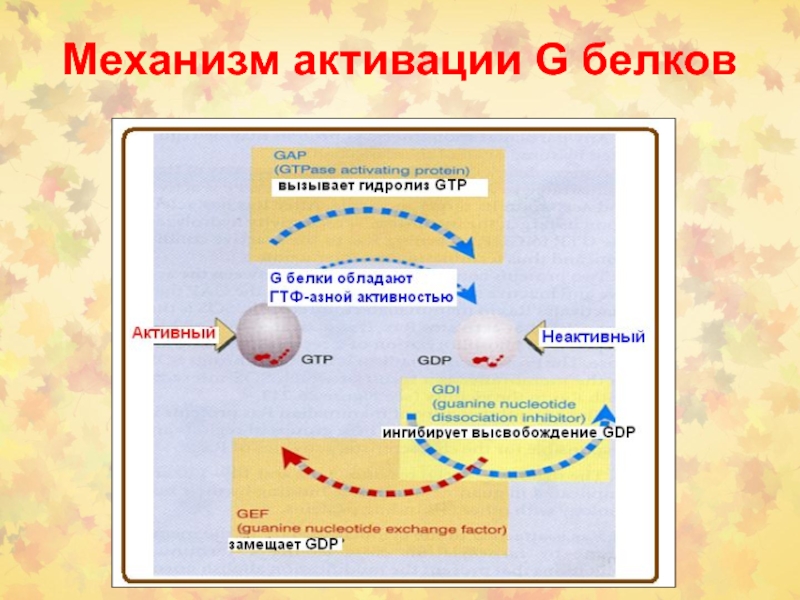
- 8. Механизм активации G белков
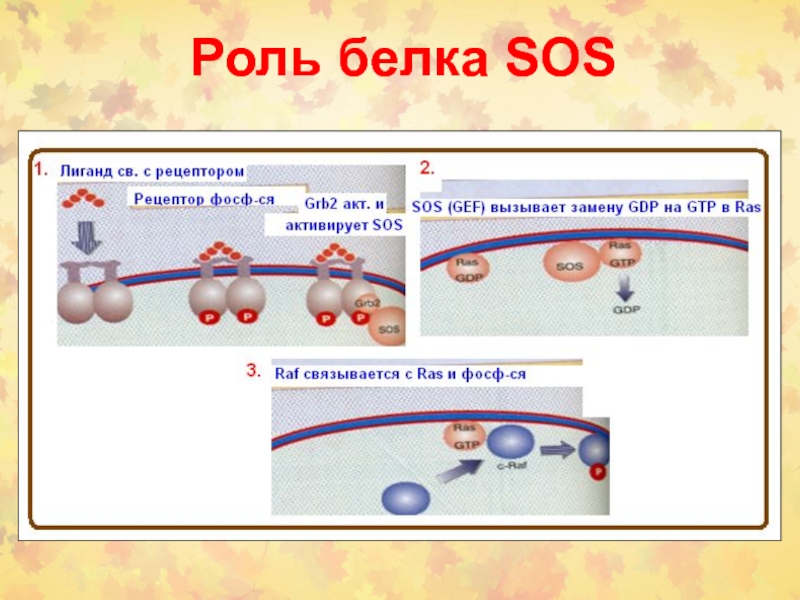
- 9. Роль белка SOS
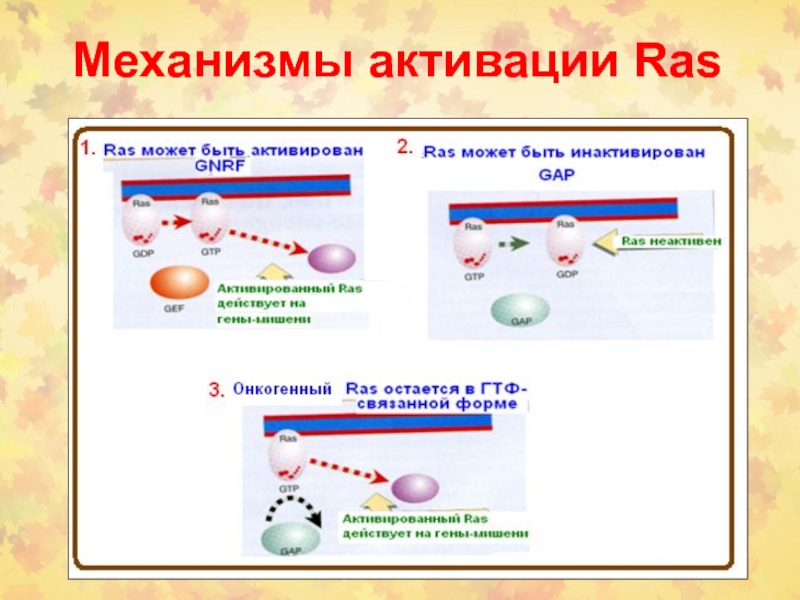
- 10. Механизмы активации Ras
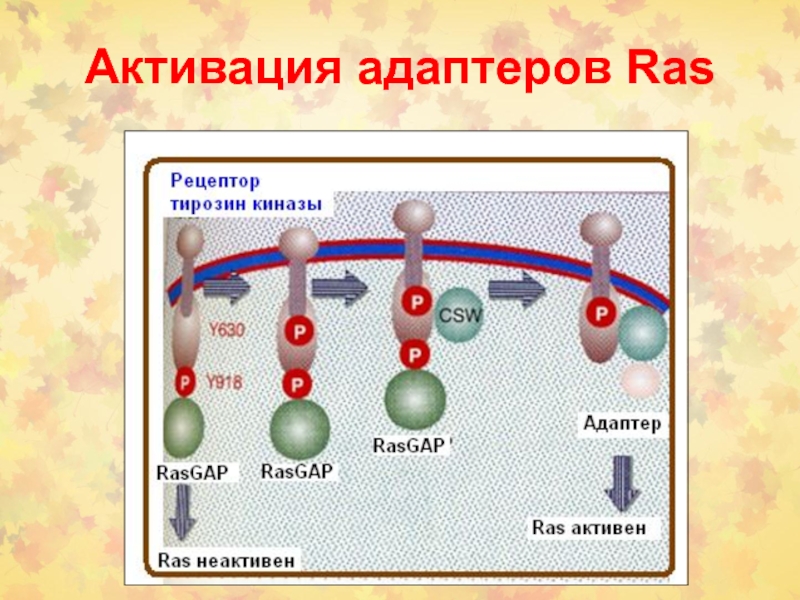
- 11. Активация адаптеров Ras
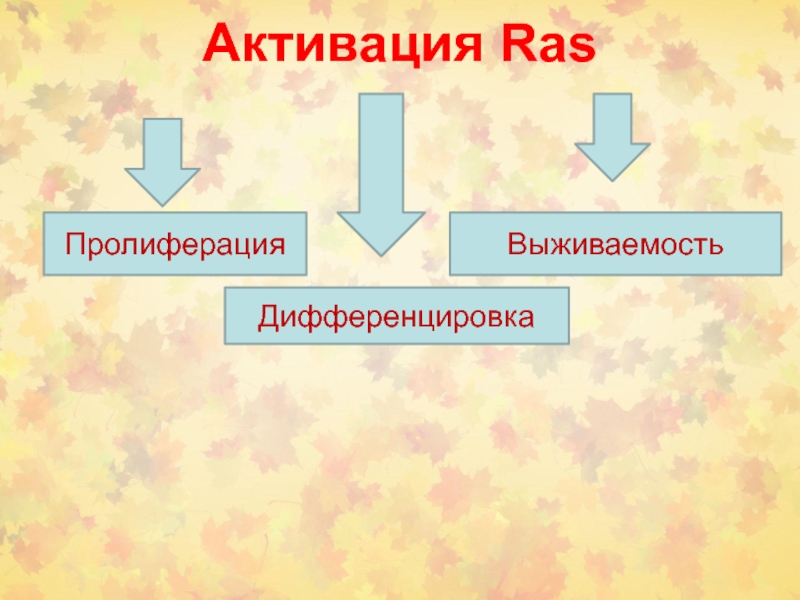
- 12. Активация Ras Пролиферация ДифференцировкаВыживаемость
- 13. Кристаллическая структура Ras
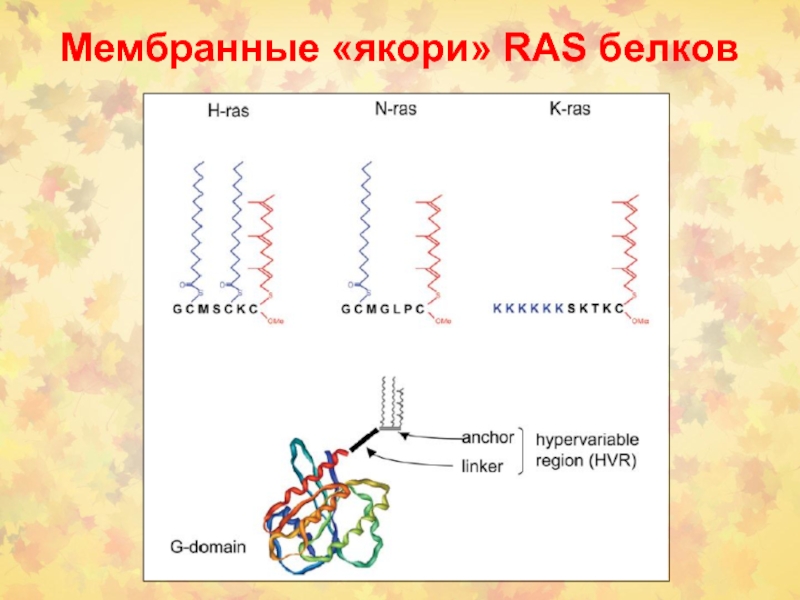
- 14. Мембранные «якори» RAS белков
- 15. Изоформы RASRAS-гипервариабельная (HVR) область способна взаимодействовать с
- 16. Слайд 16
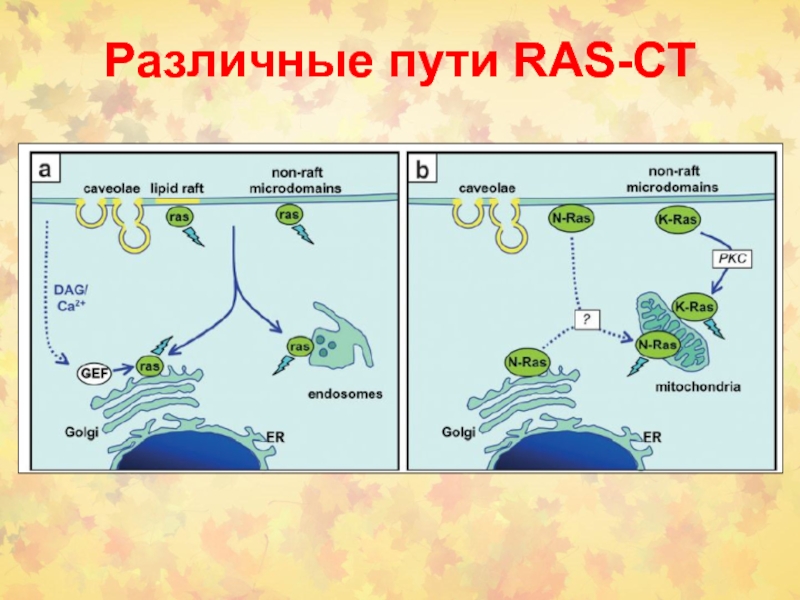
- 17. Различные пути RAS-СТ
- 18. Регуляция RAS
- 19. Слайд 19
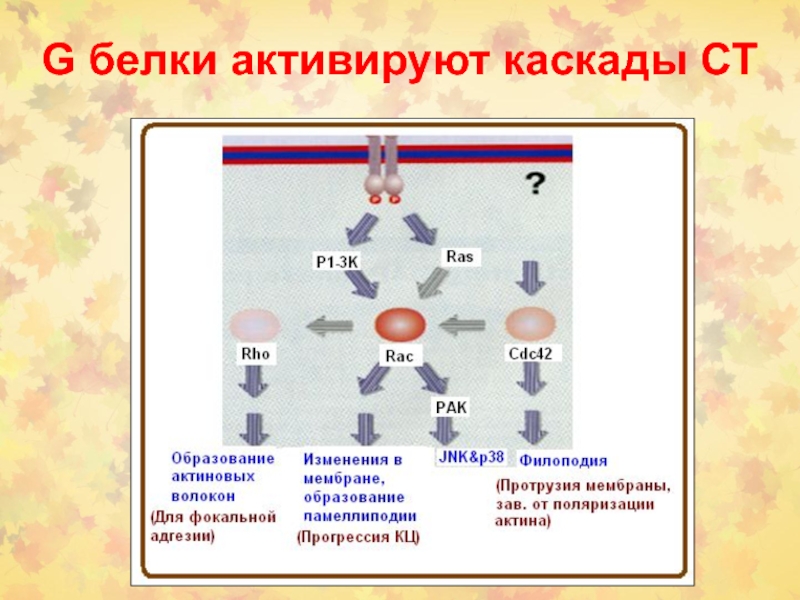
- 20. G белки активируют каскады СТ
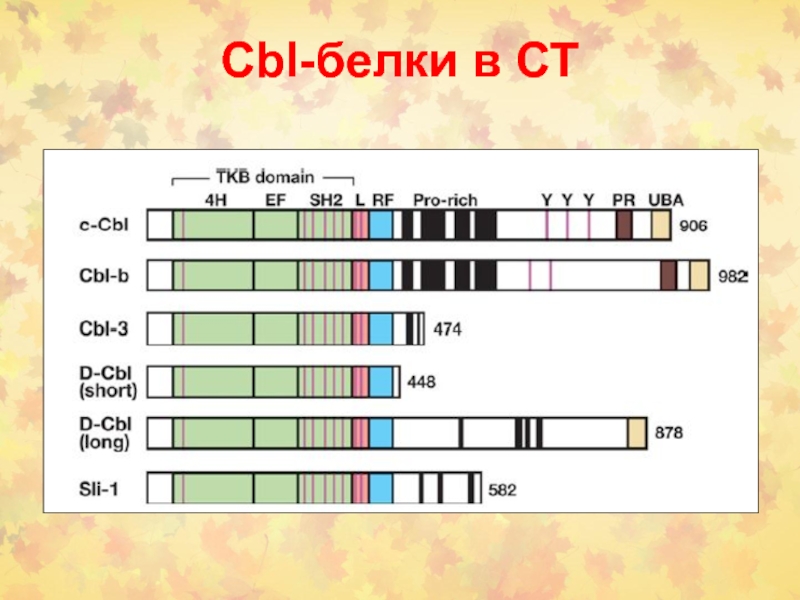
- 21. Cbl-белки в СТ
- 22. Cbl-направленная интернализация, мультиубиквитиляция и деградация активированных RTKsа).
- 23. TKB домен имеет свободный доступ к рецептору
- 24. 5.2.3. Цитозольные белки (RAF и MAP)
- 25. Слайд 25
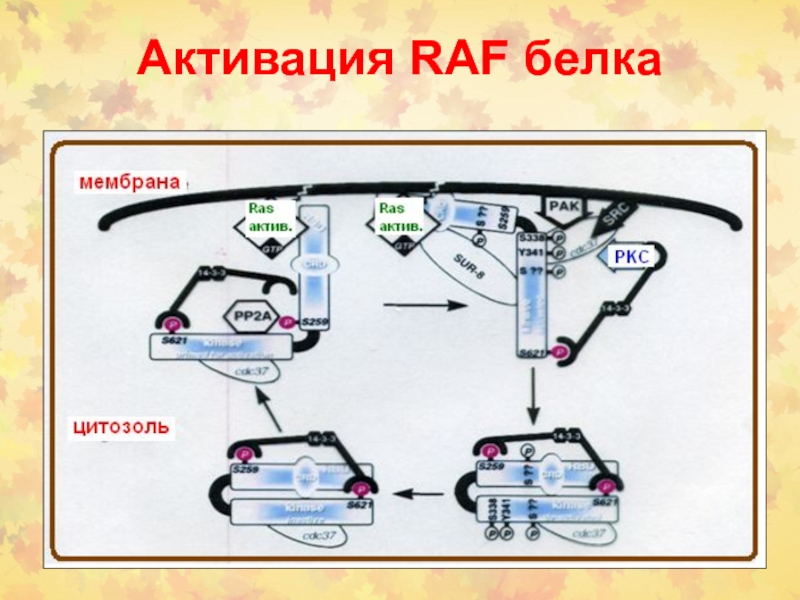
- 26. Активация RAF белка
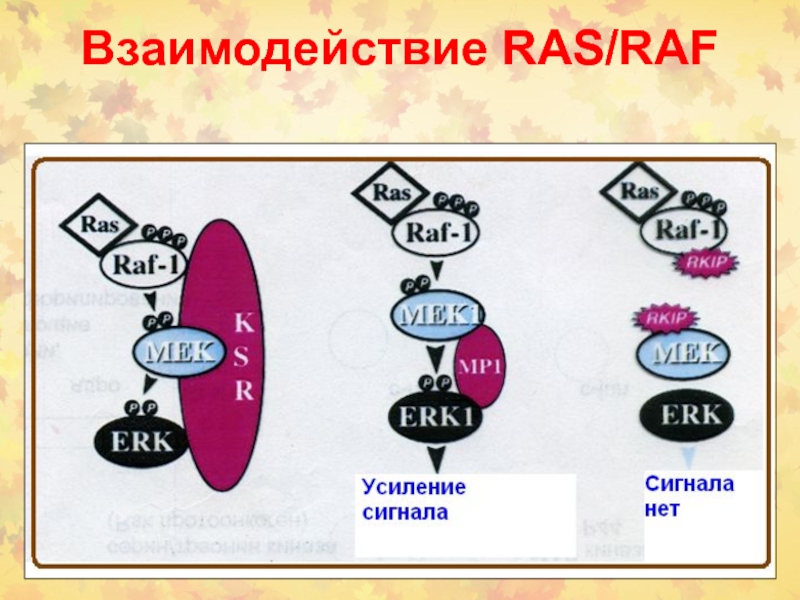
- 27. Взаимодействие RAS/RAF
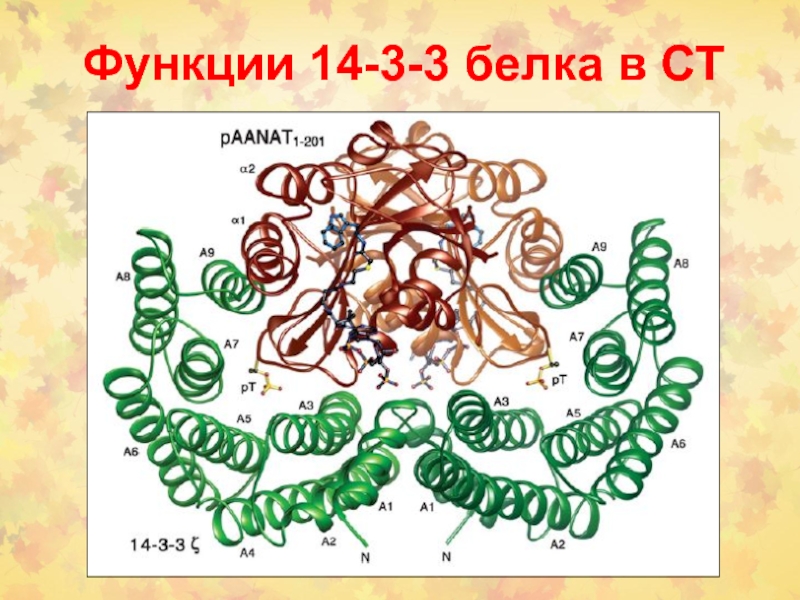
- 28. Функции 14-3-3 белка в СТ
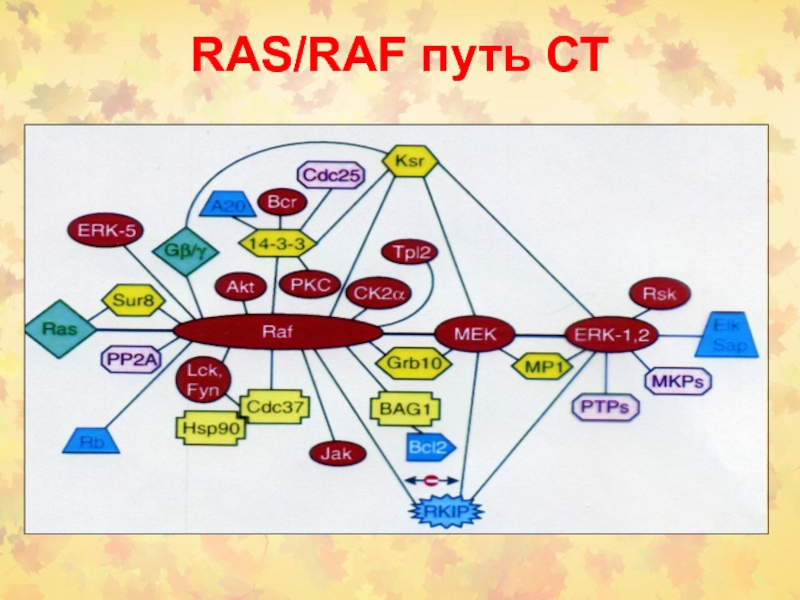
- 29. RAS/RAF путь СТ
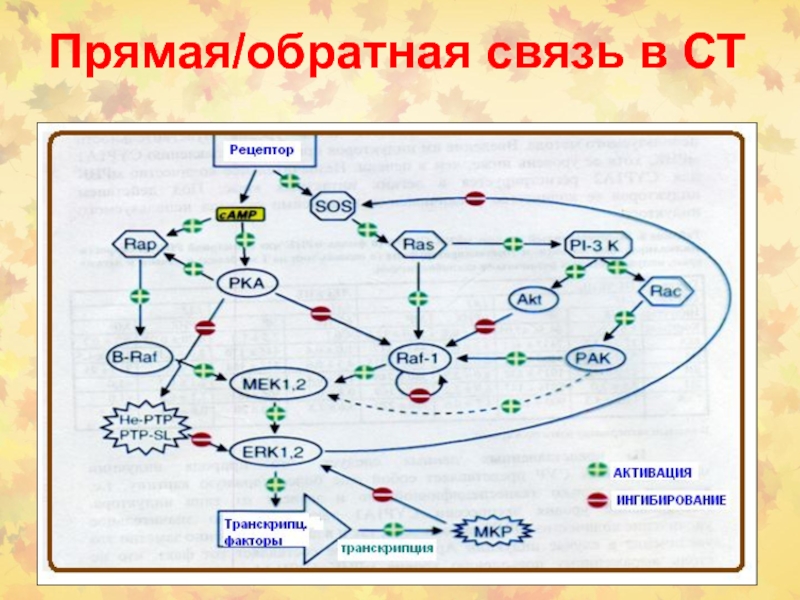
- 30. Прямая/обратная связь в СТ
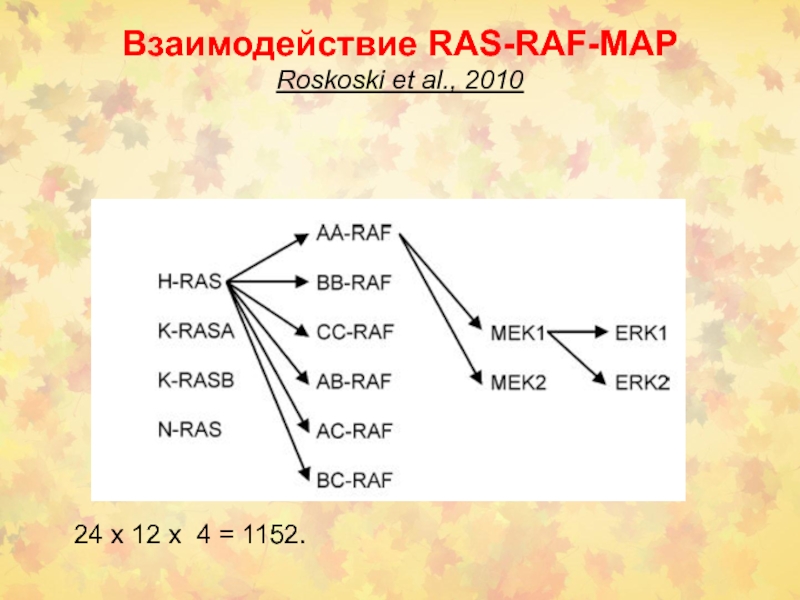
- 31. Взаимодействие RAS-RAF-MAP Roskoski et al., 2010 24 х 12 х 4 = 1152.
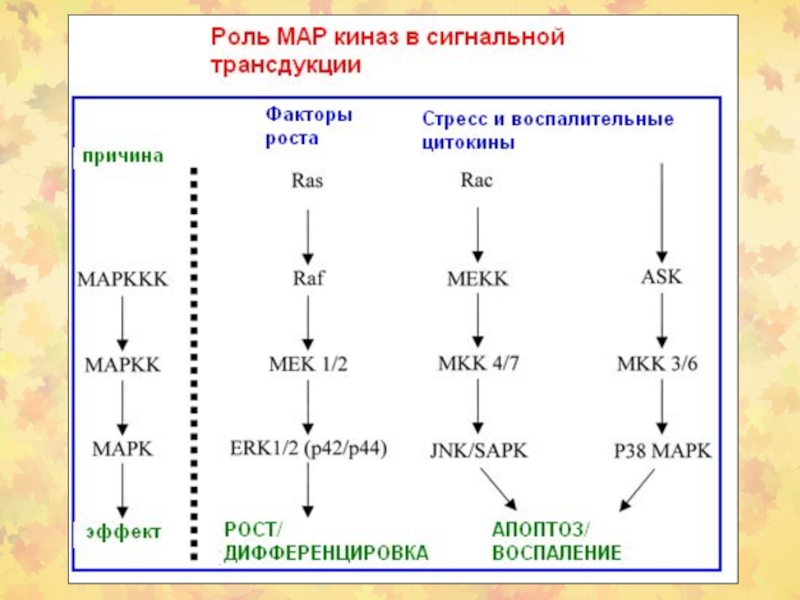
- 32. 5.2.4. Этап МАР киназ
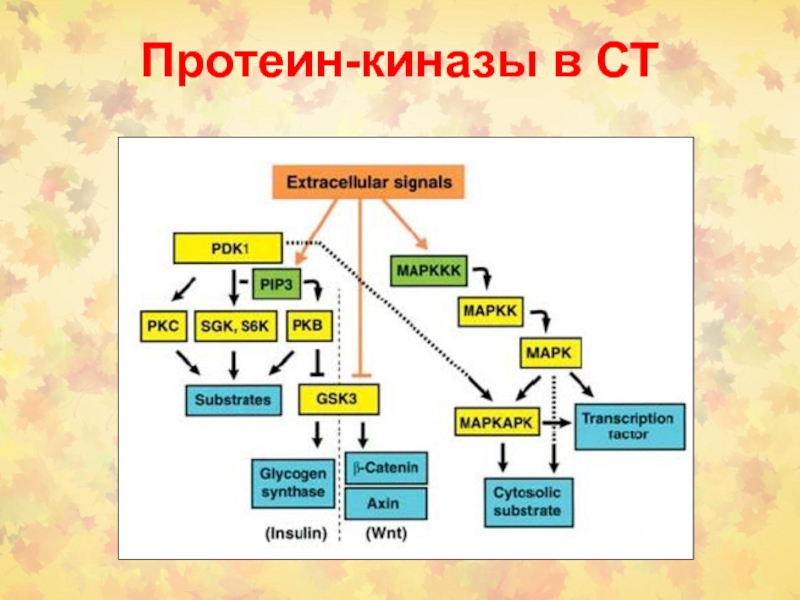
- 33. Протеин-киназы в СТ
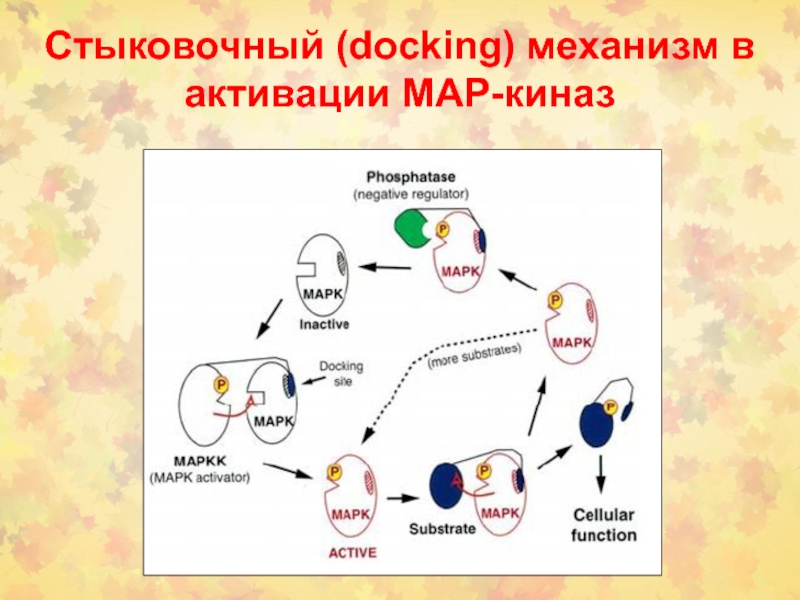
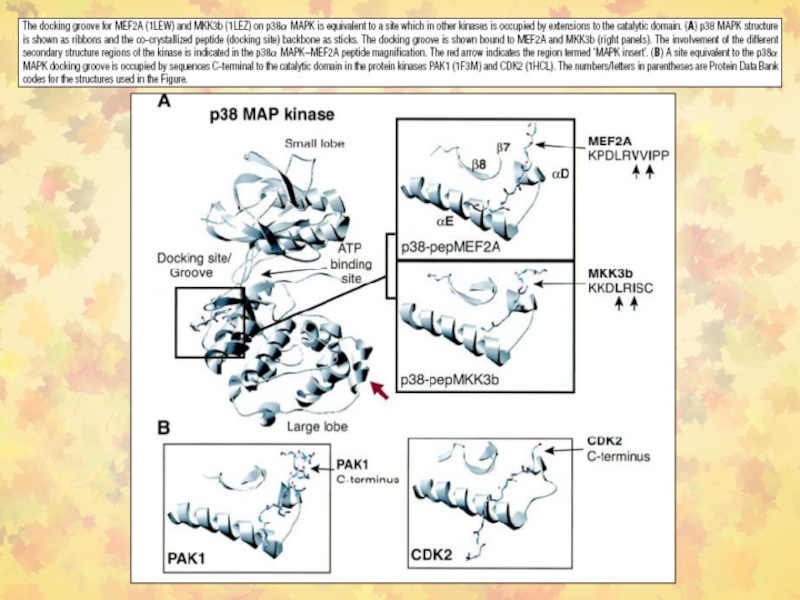
- 34. Стыковочный (docking) механизм в активации МАР-киназ
- 35. Слайд 35
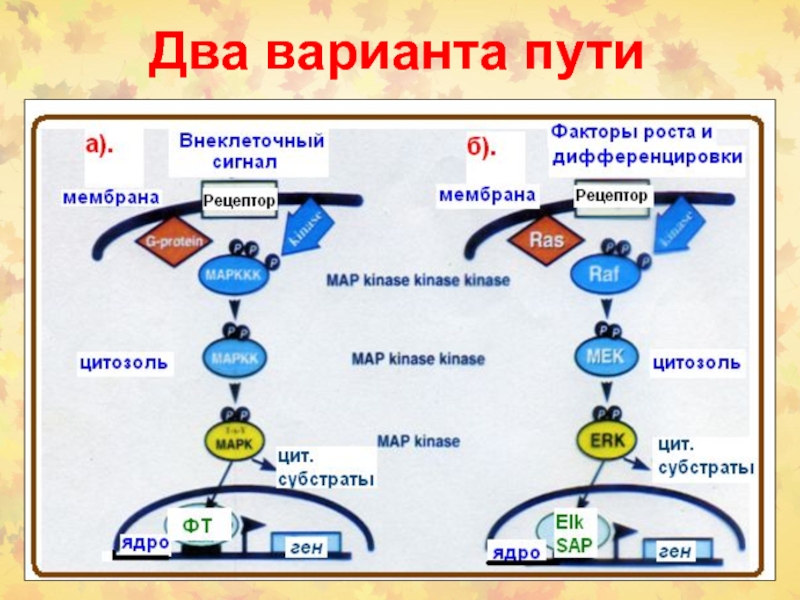
- 36. Два варианта пути
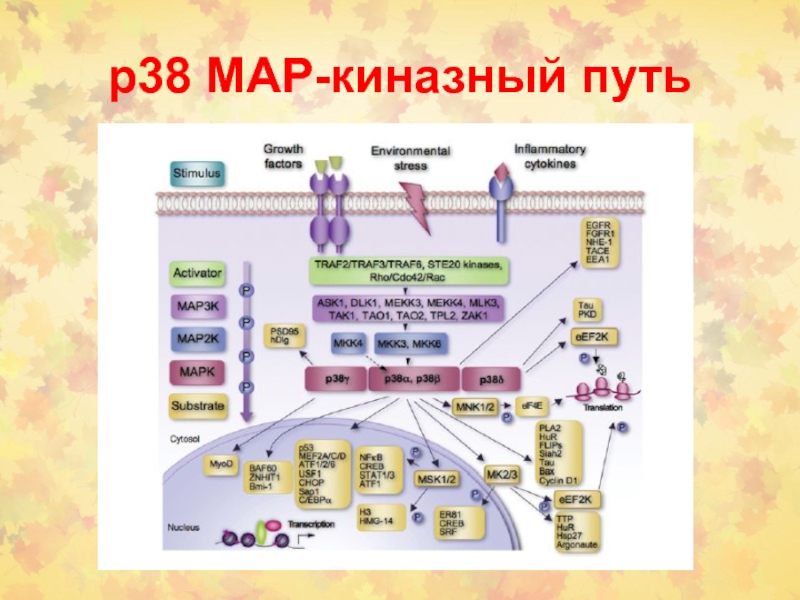
- 37. р38 МАР-киназный путь
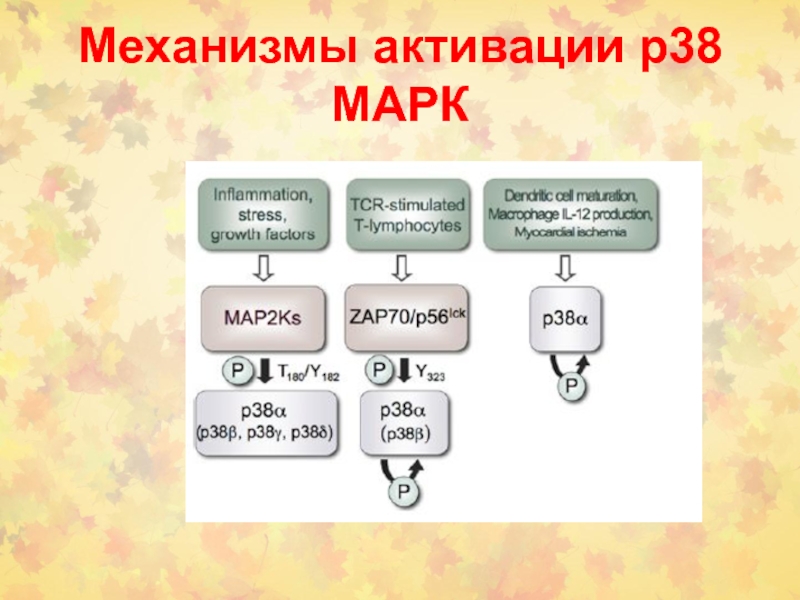
- 38. Механизмы активации р38 МАРК
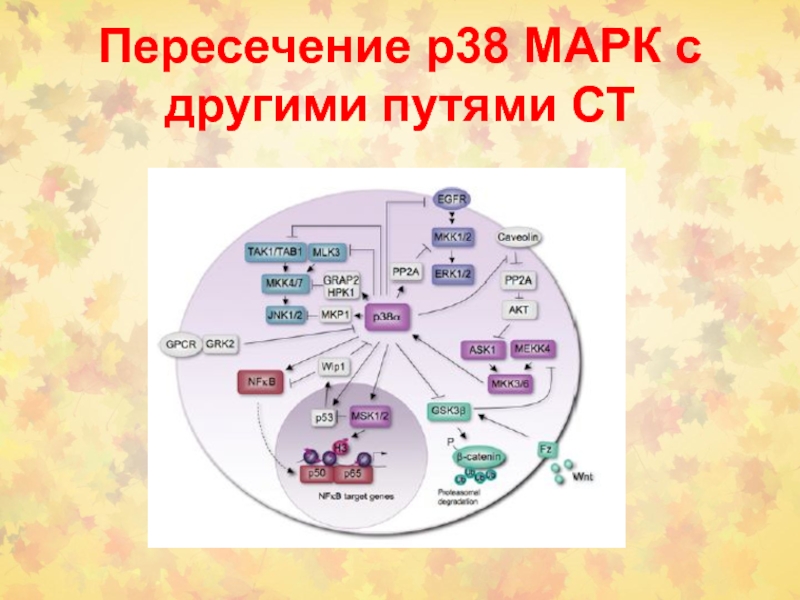
- 39. Пересечение р38 МАРК с другими путями СТ
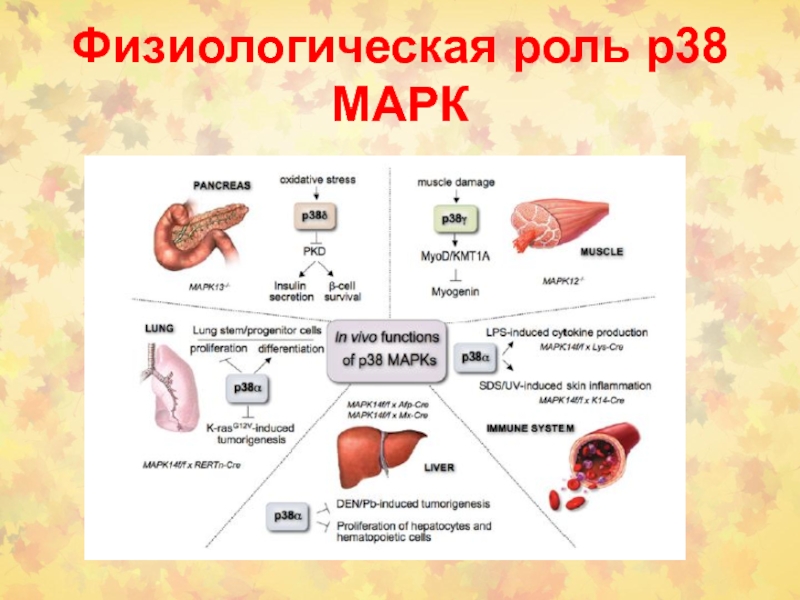
- 40. Физиологическая роль р38 МАРК
- 41. Слайд 41
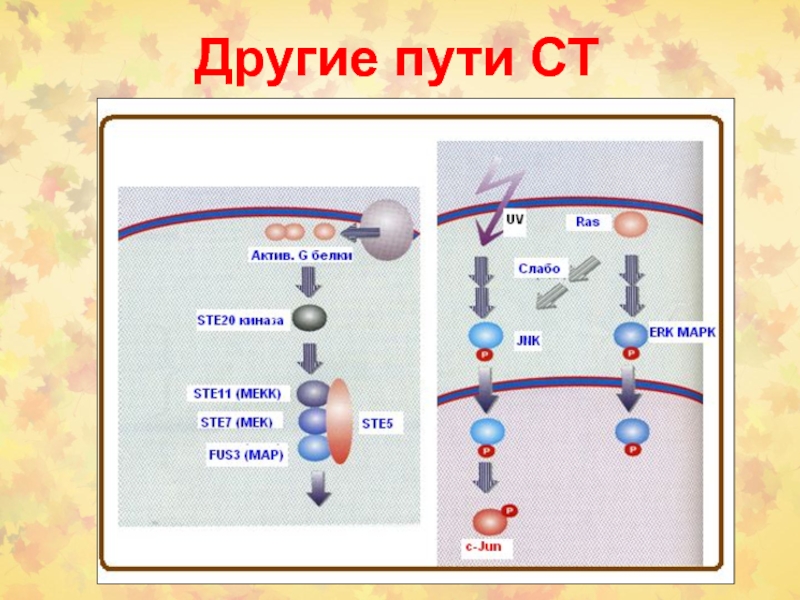
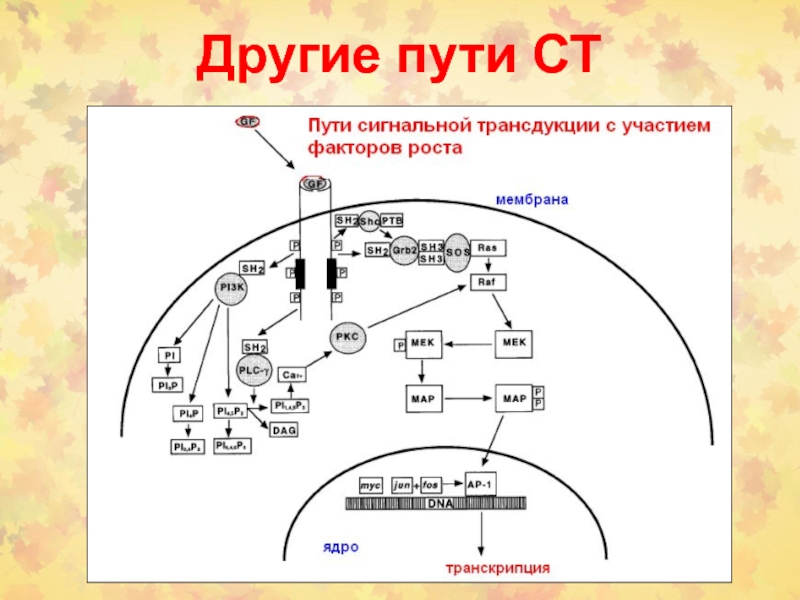
- 42. Другие пути СТ
- 43. Другие пути СТ
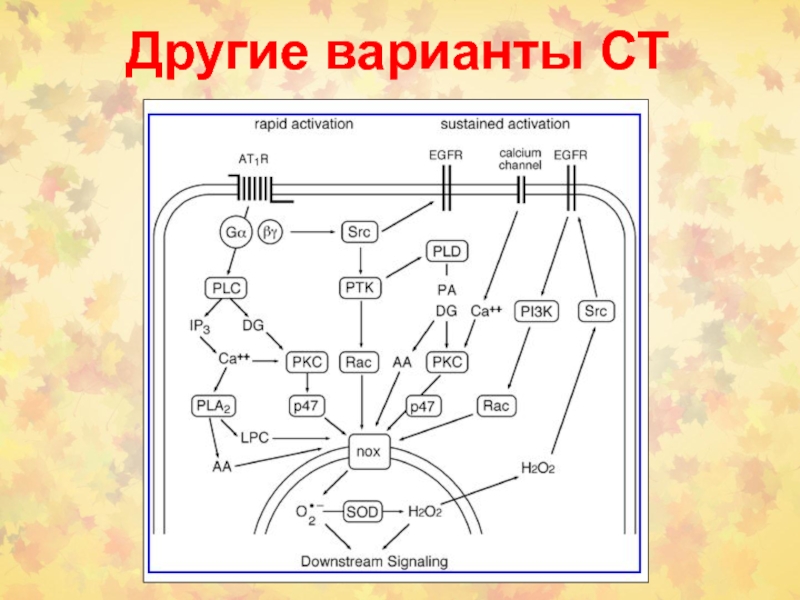
- 44. Другие варианты СТ
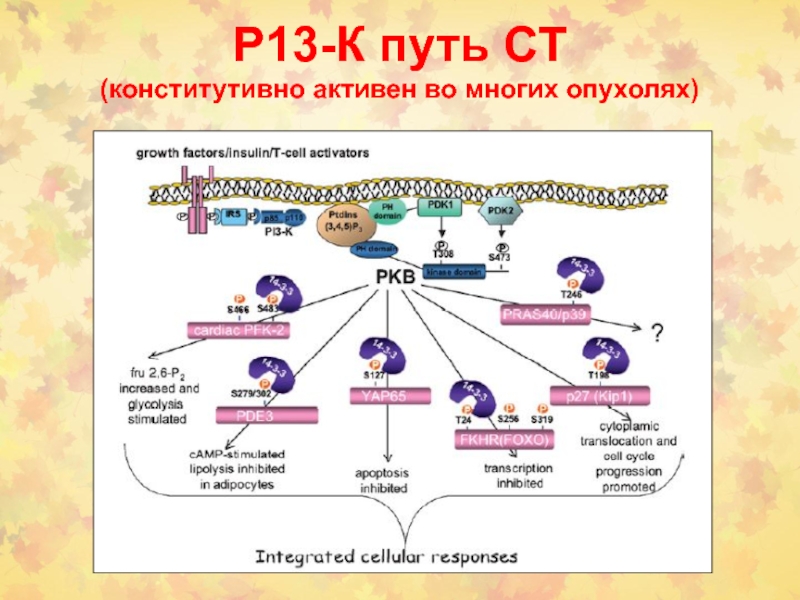
- 45. Р13-К путь СТ (конститутивно активен во многих опухолях)
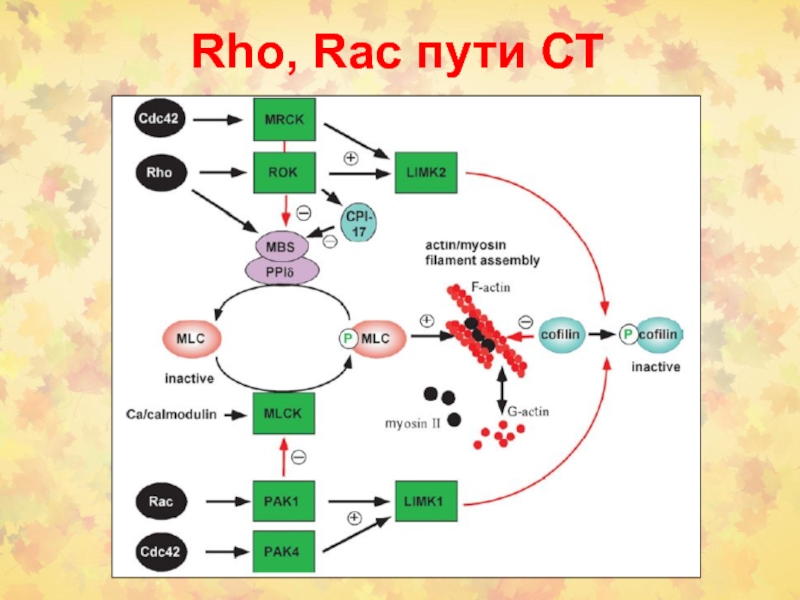
- 46. Rho, Rac пути СТ
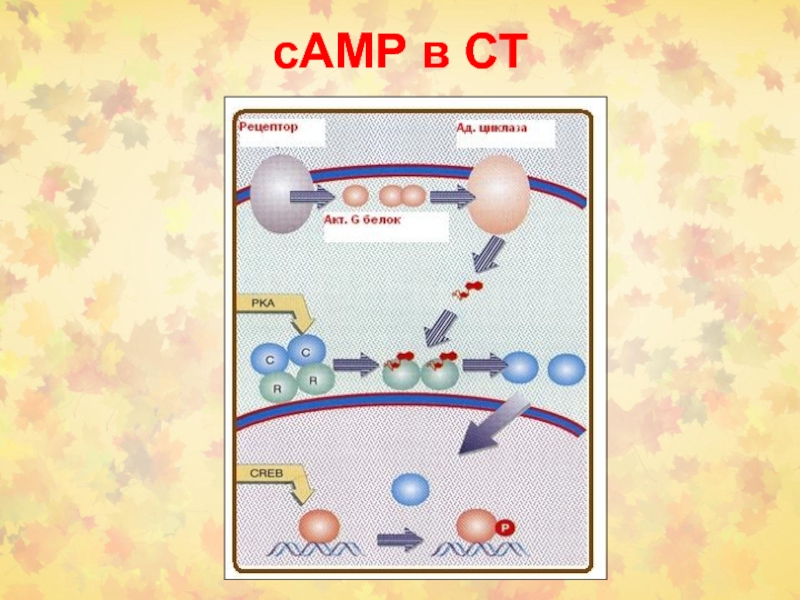
- 47. cАМP в СТ
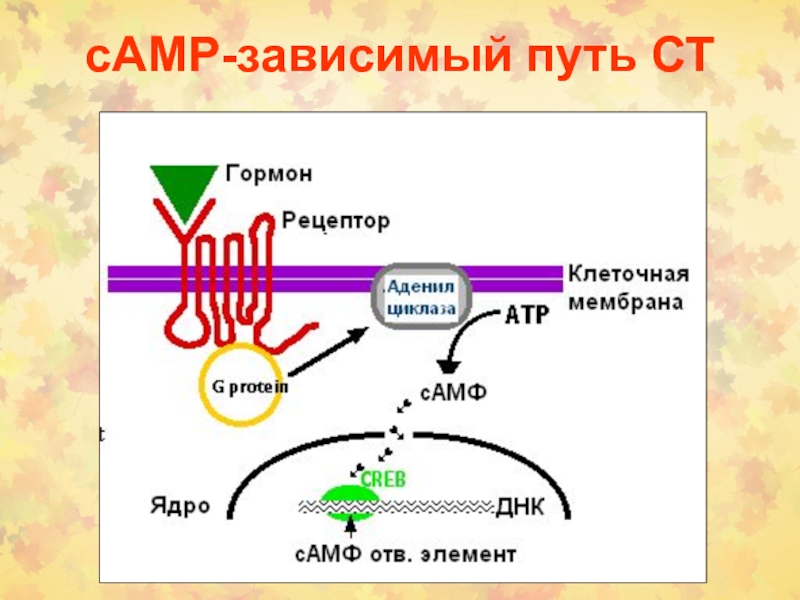
- 48. сАМP-зависимый путь СТ
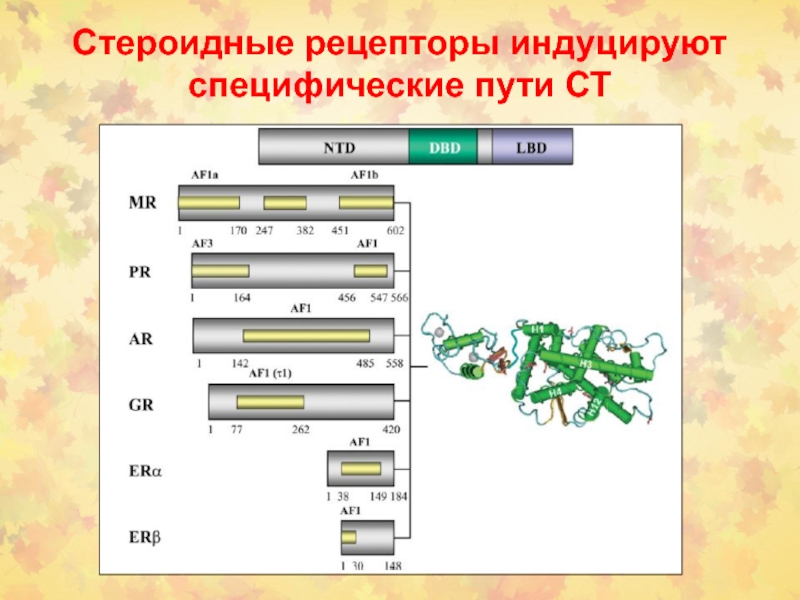
- 49. Стероидные рецепторы индуцируют специфические пути СТ
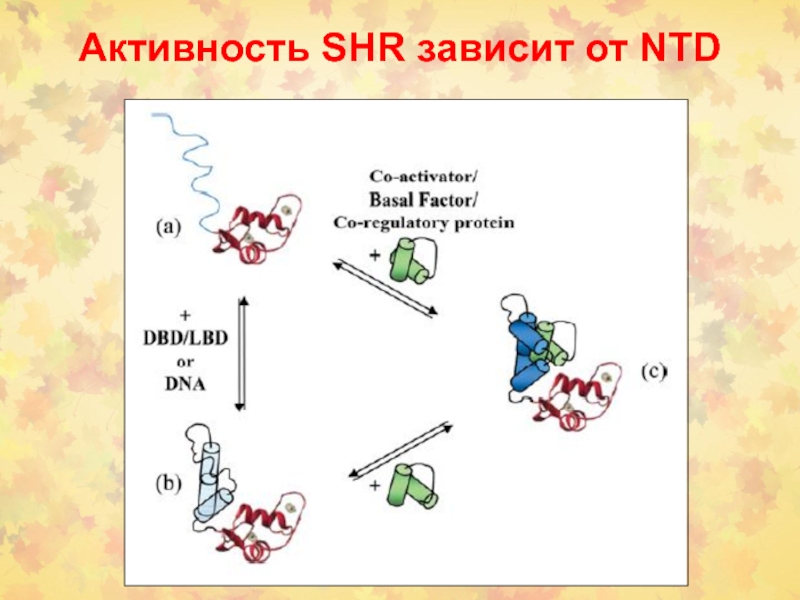
- 50. Активность SHR зависит от NTD
- 51. Слайд 51
- 52. Слайд 52
- 53. NOTCH1-сигнальный путьВзаимодействие NOTCH1 рецептора с Delta-like и
- 54. Онкогенные формы NOTCH1 при T-ALLАберрантная активация NOTCH
- 55. Распределение мутаций при лейкемии (T-ALL)
- 56. 5.2.5. Факторы транскрипции
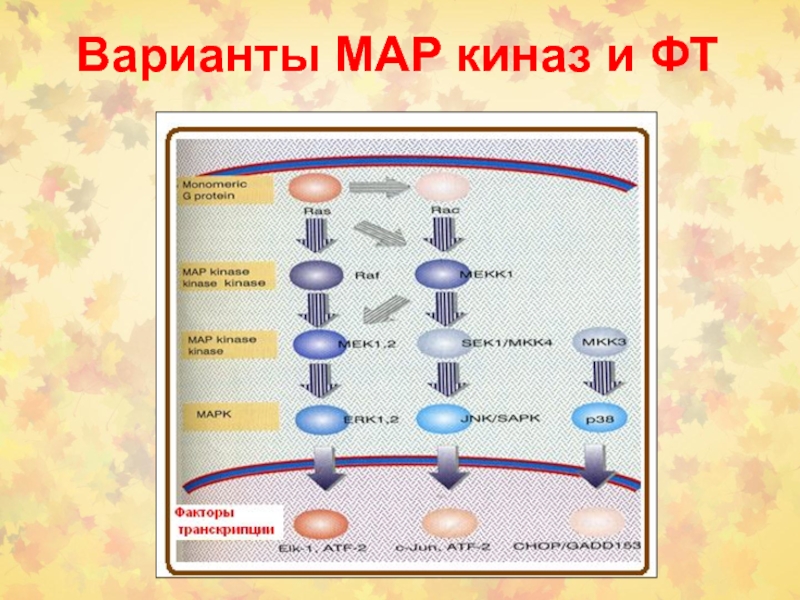
- 57. Варианты МАР киназ и ФТ
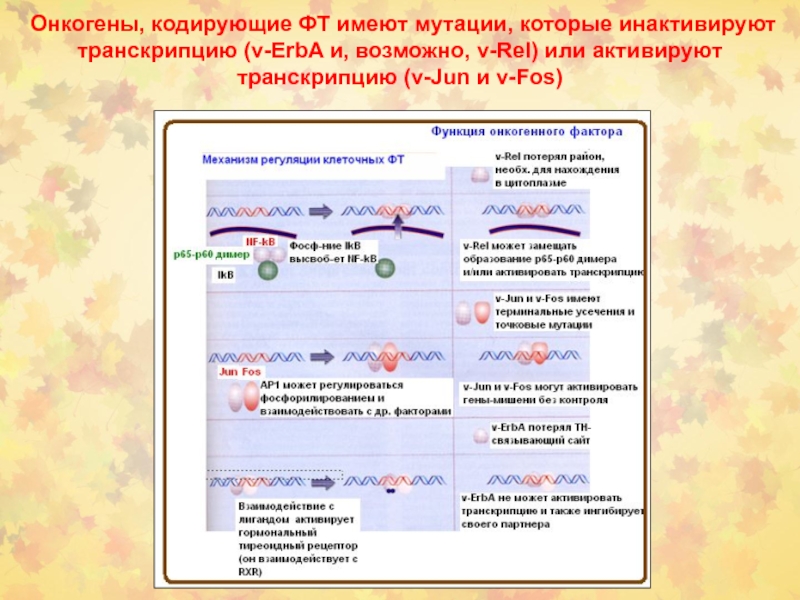
- 58. Онкогены, кодирующие ФТ имеют мутации, которые инактивируют
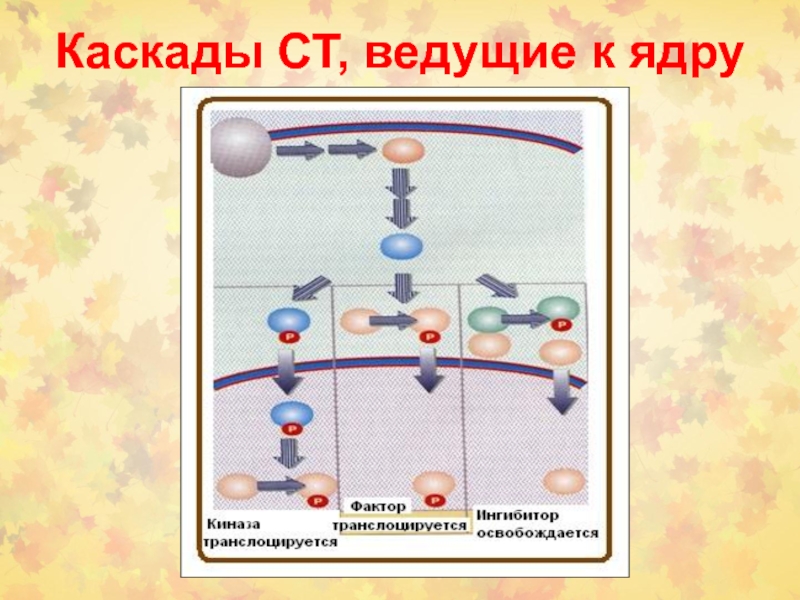
- 59. Каскады СТ, ведущие к ядру
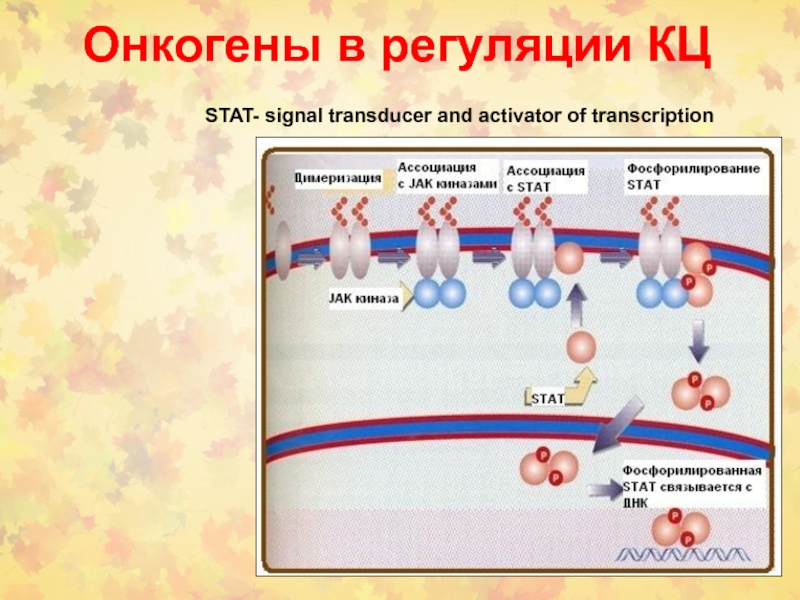
- 60. Онкогены в регуляции КЦSTAT- signal transducer and activator of transcription
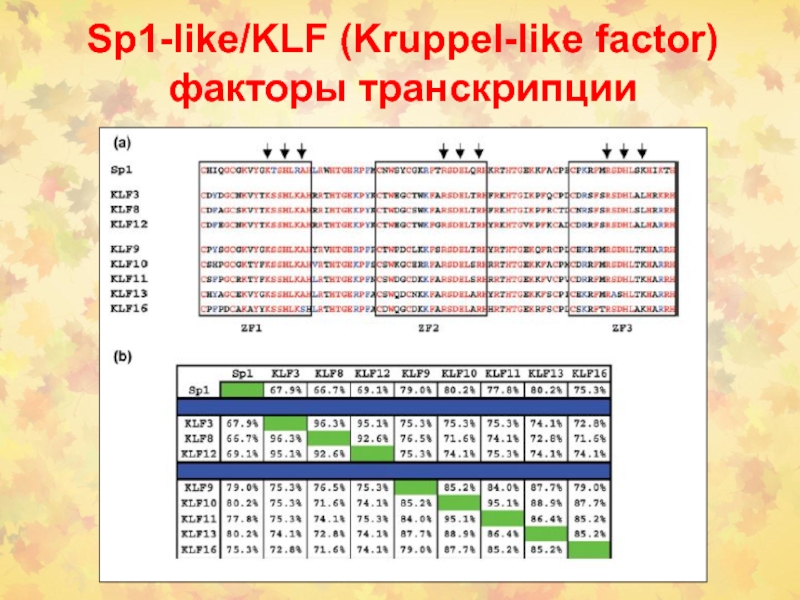
- 61. Sp1-like/KLF (Kruppel-like factor) факторы транскрипции
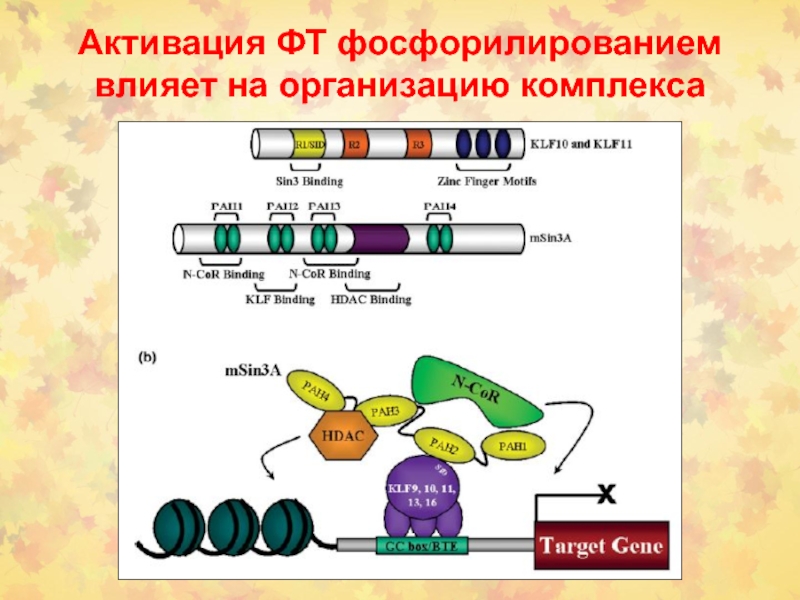
- 62. Активация ФТ фосфорилированием влияет на организацию комплекса
- 63. Слайд 63
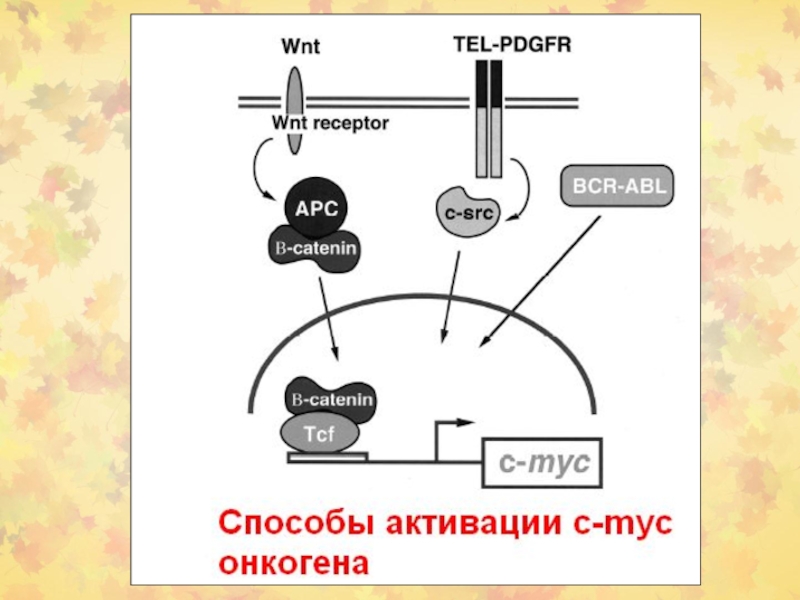
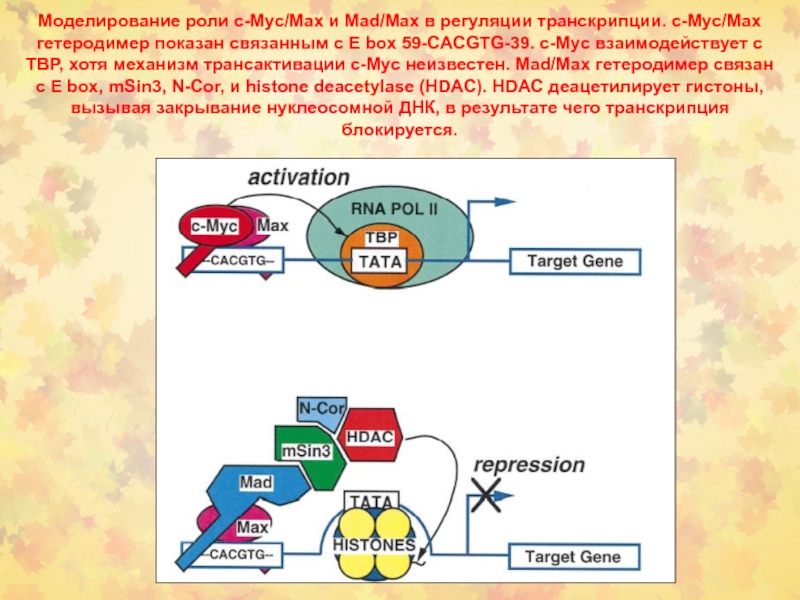
- 64. Моделирование роли c-Myc/Max и Mad/Max в регуляции
- 65. Слайд 65
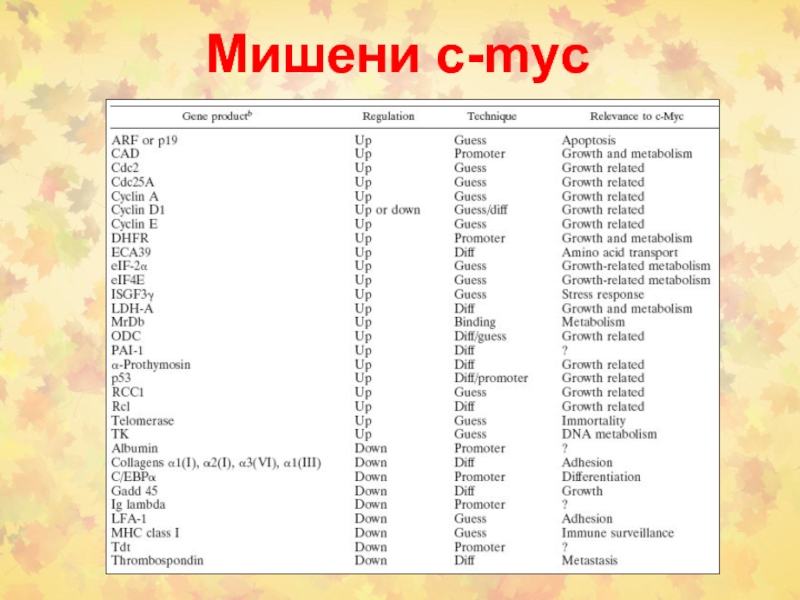
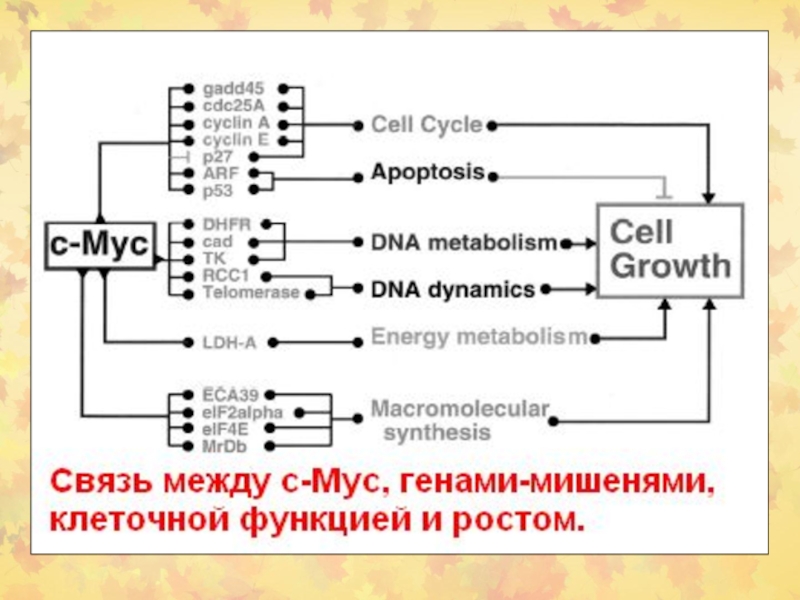
- 66. Мишени c-myc
- 67. Слайд 67
- 68. NF-kB семейство(p50/p105), NF-kB2 (p52/ p100), RelA (p65),
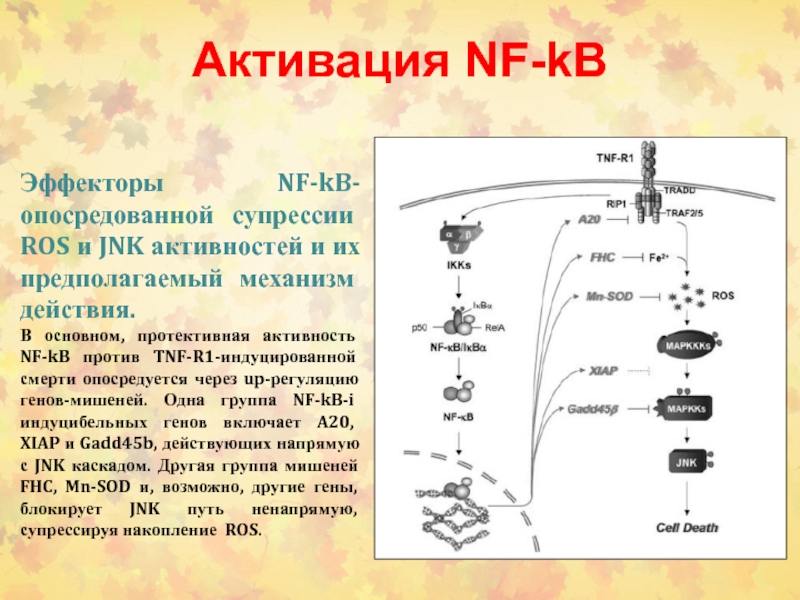
- 69. Активация NF-kBЭффекторы NF-kB-опосредованной супрессии ROS и JNK
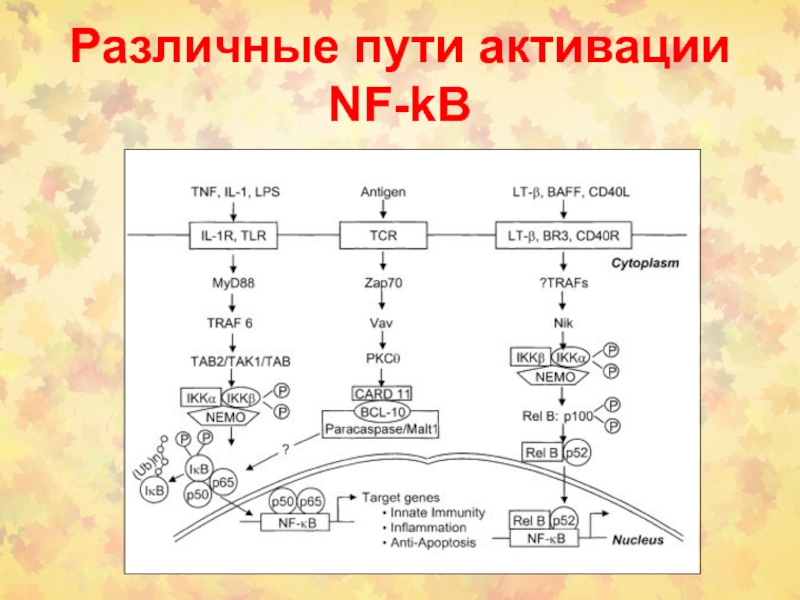
- 70. Различные пути активации NF-kB
- 71. Пространственная структура фактора транскрипции NF-кB
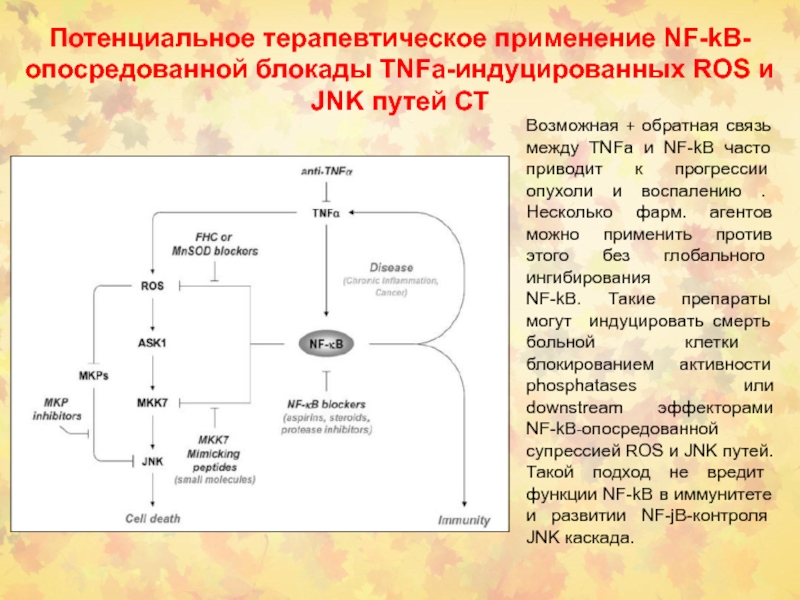
- 72. Потенциальное терапевтическое применение NF-kB-опосредованной блокады TNFa-индуцированных ROS
- 73. АР1 семействоActivator protein 1 (AP-1) семейство белков
- 74. Структура АР1
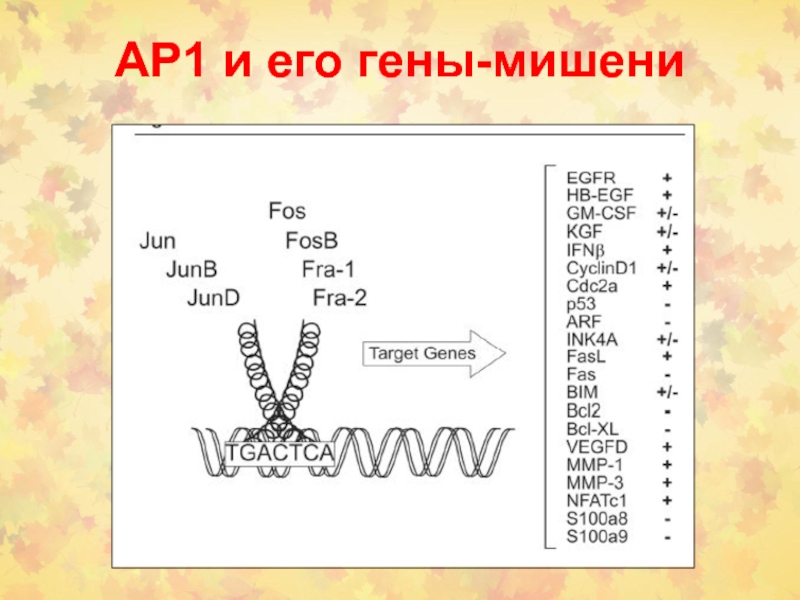
- 75. АР1 и его гены-мишени
- 76. Функции Jun и Fos белков (мыши)
- 77. Функции Jun и Fos белков (мыши) - продолжение
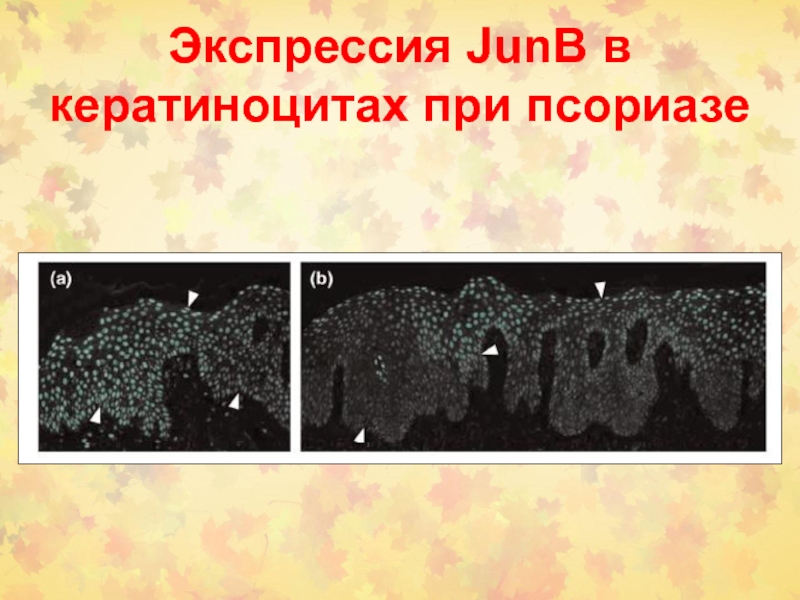
- 78. Экспрессия JunB в кератиноцитах при псориазе
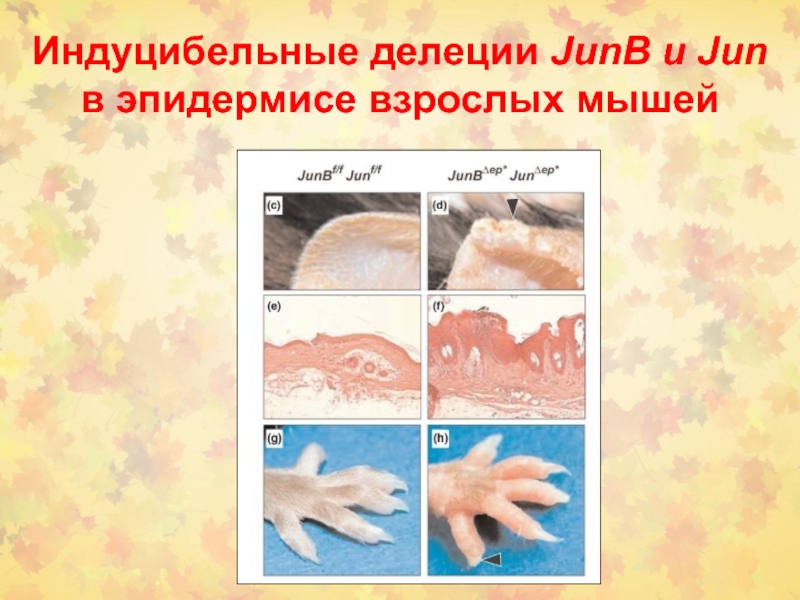
- 79. Индуцибельные делеции JunB и Jun в эпидермисе взрослых мышей
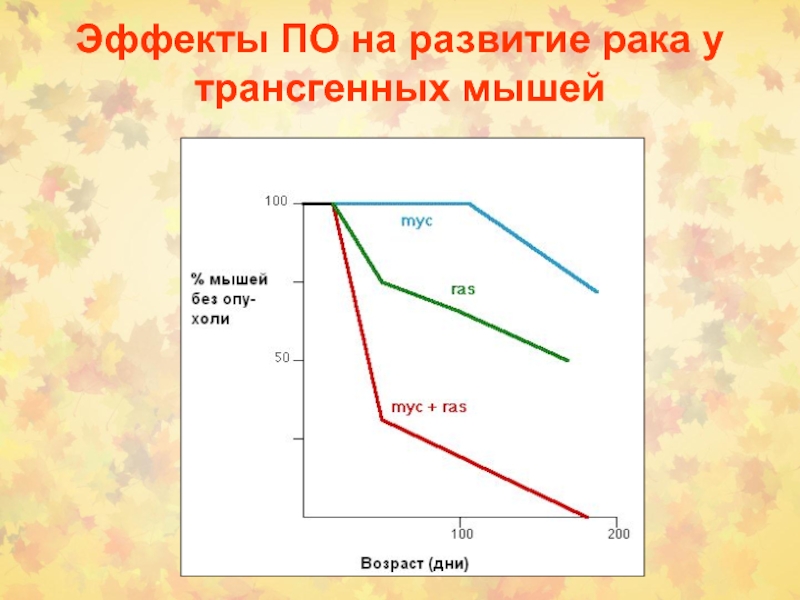
- 80. Эффекты ПО на развитие рака у трансгенных мышей
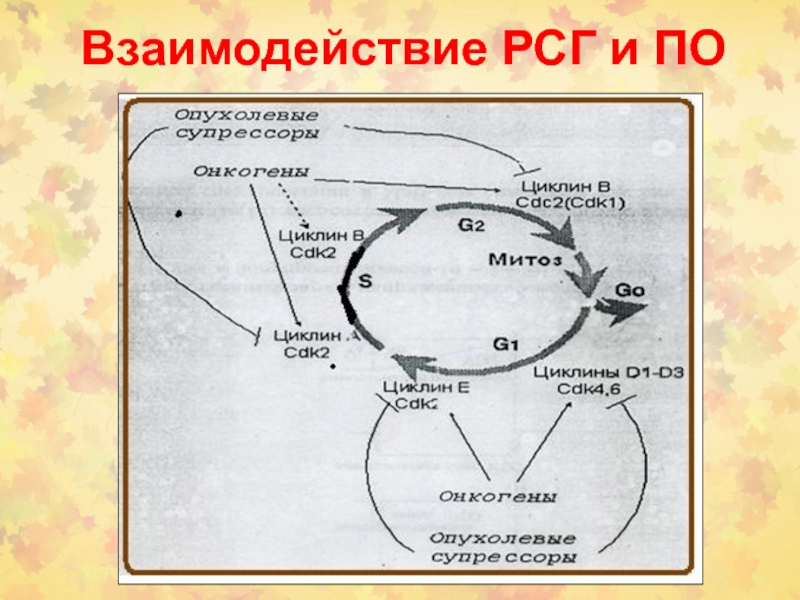
- 81. Взаимодействие РСГ и ПО
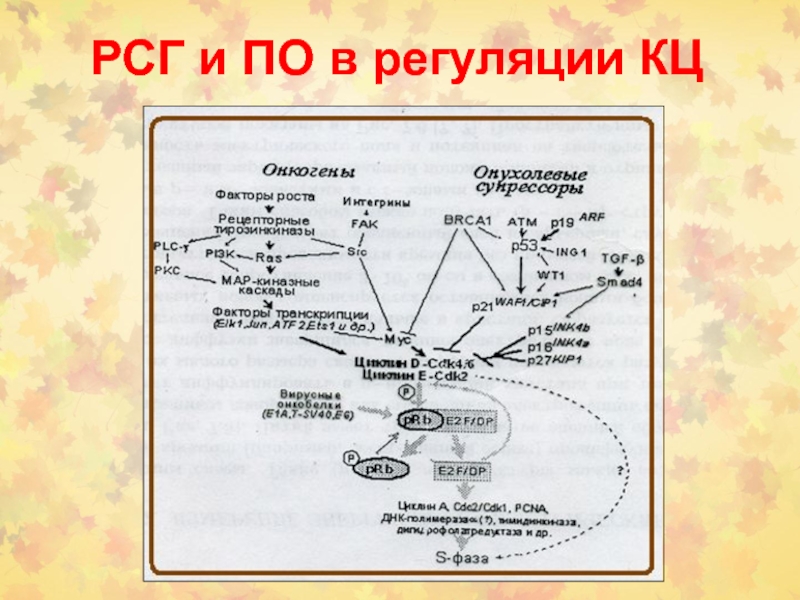
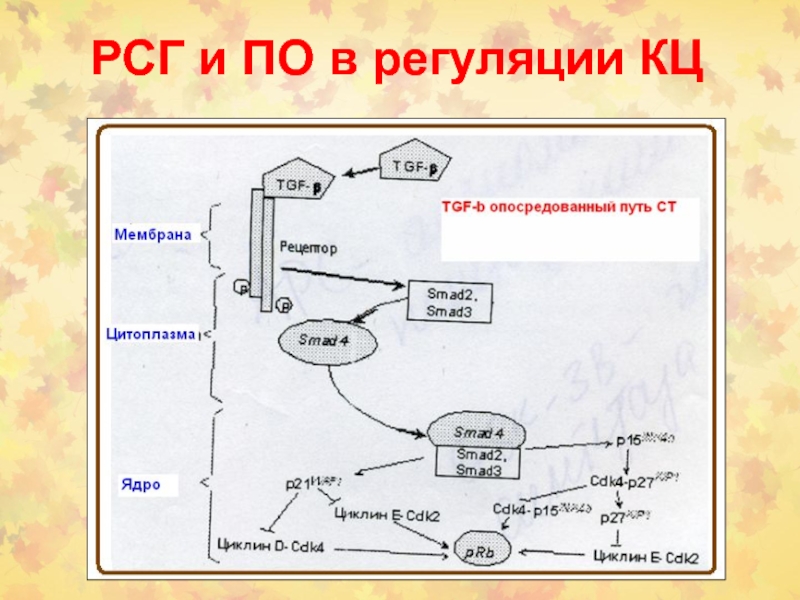
- 82. РСГ и ПО в регуляции КЦ
- 83. РСГ и ПО в регуляции КЦ
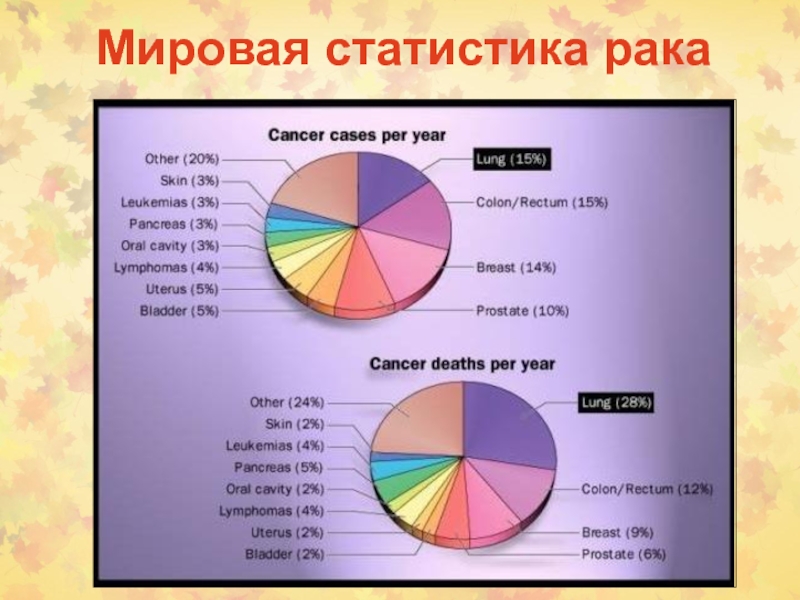
- 84. Мировая статистика рака
- 85. Сигнальные молекулы – мишени в терапии рака
- 86. Механизмы гормонального канцерогенеза- генотоксичный (повреждение ДНК метаболитами эстрогенов)- эпигенетический (активация ERs)
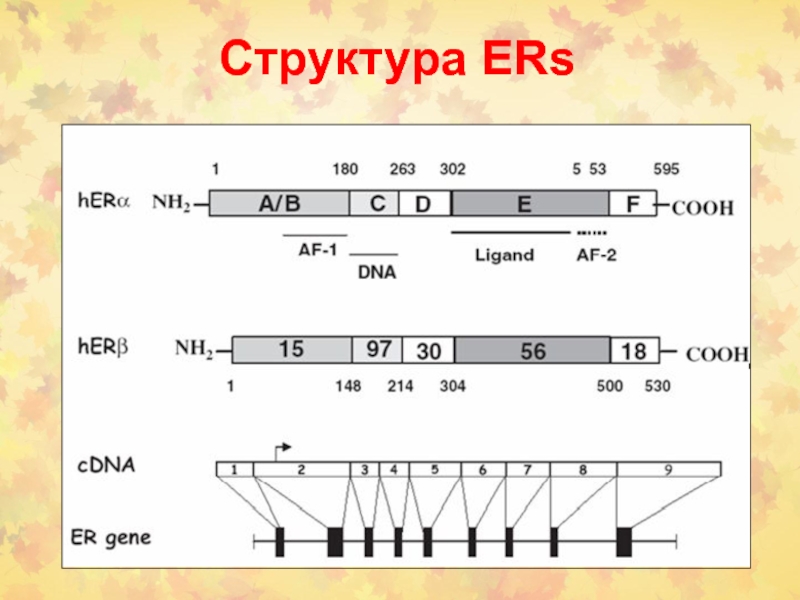
- 87. Структура ERs
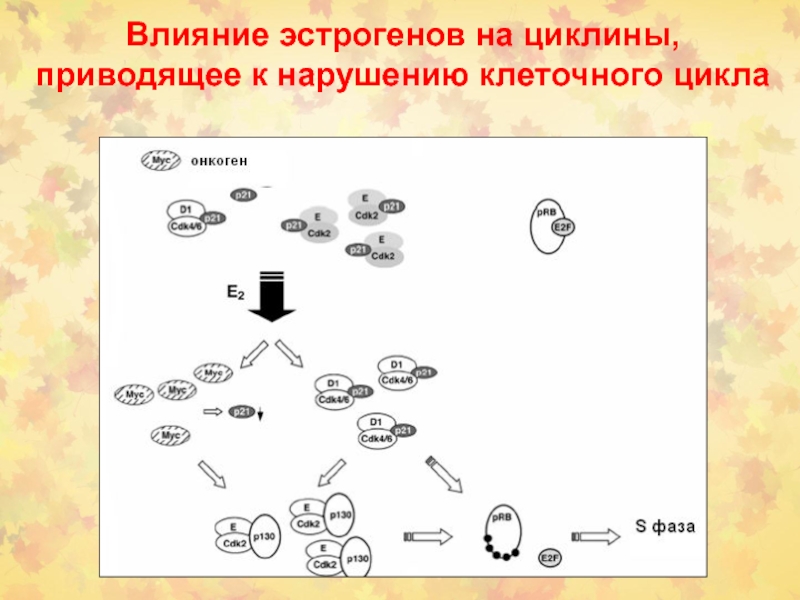
- 88. Влияние эстрогенов на циклины, приводящее к нарушению клеточного цикла
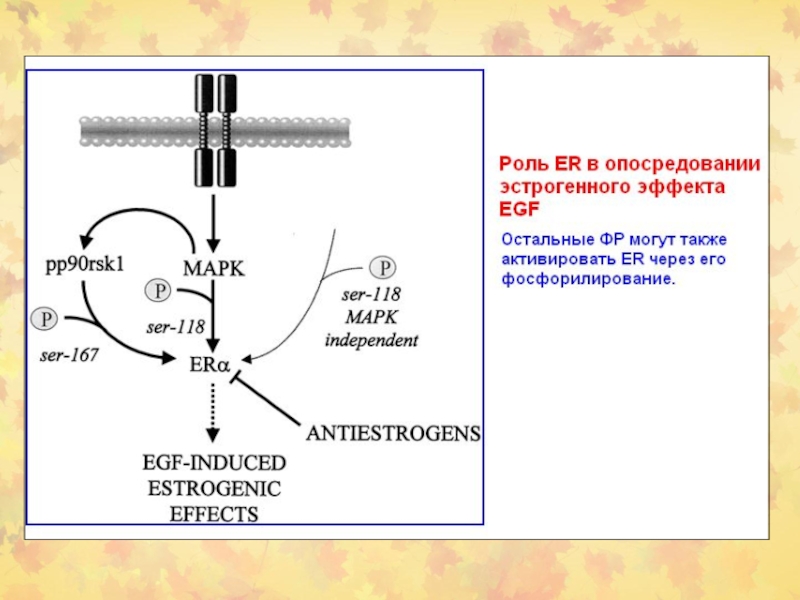
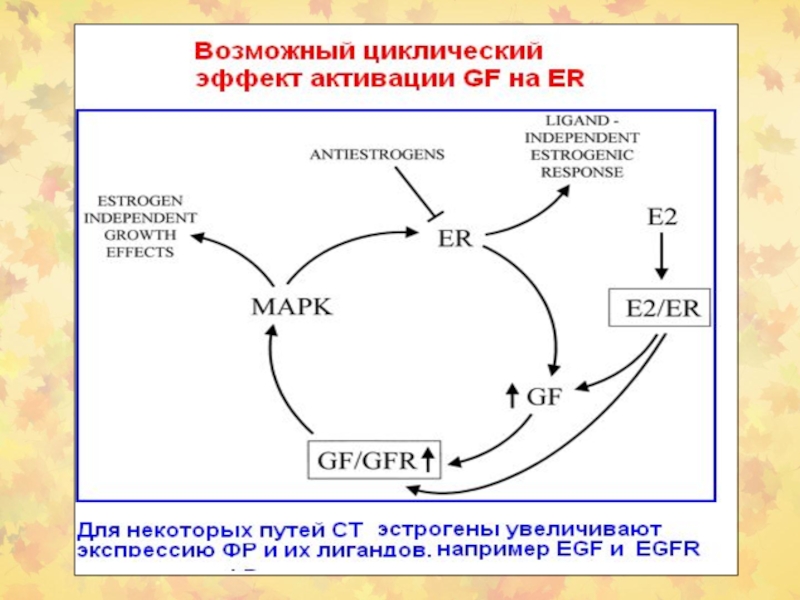
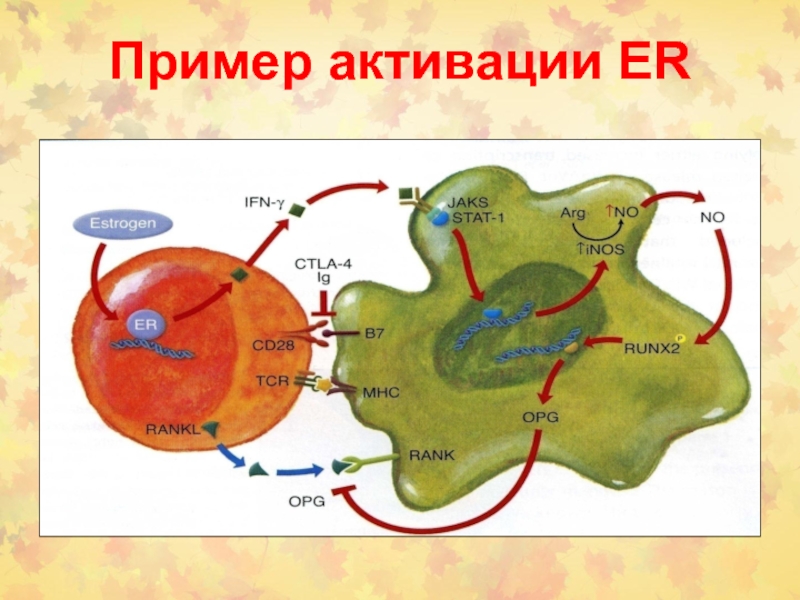
- 89. Пример активации ER
- 90. Слайд 90
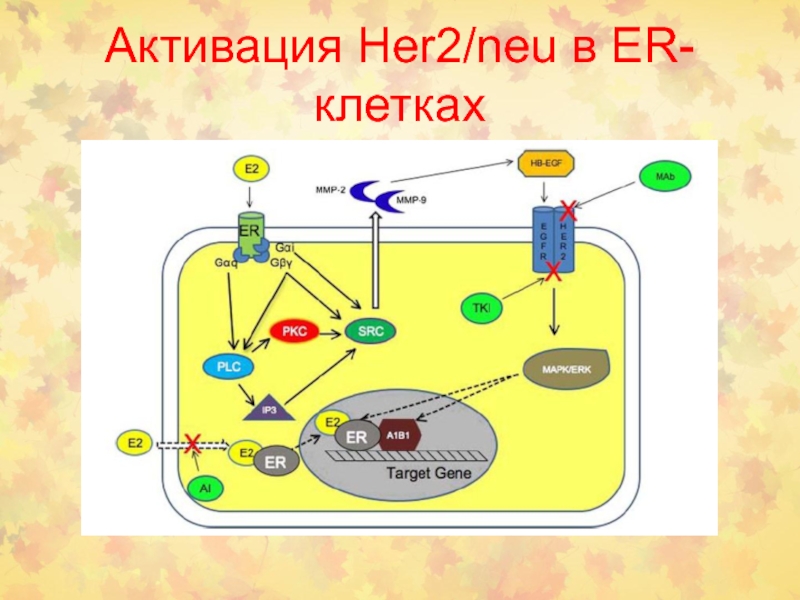
- 91. Активация Her2/neu в ER-клетках
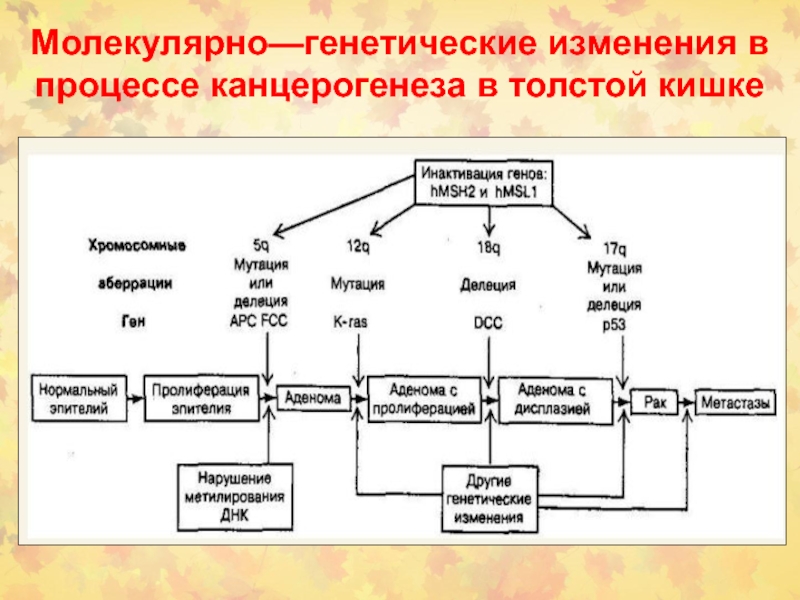
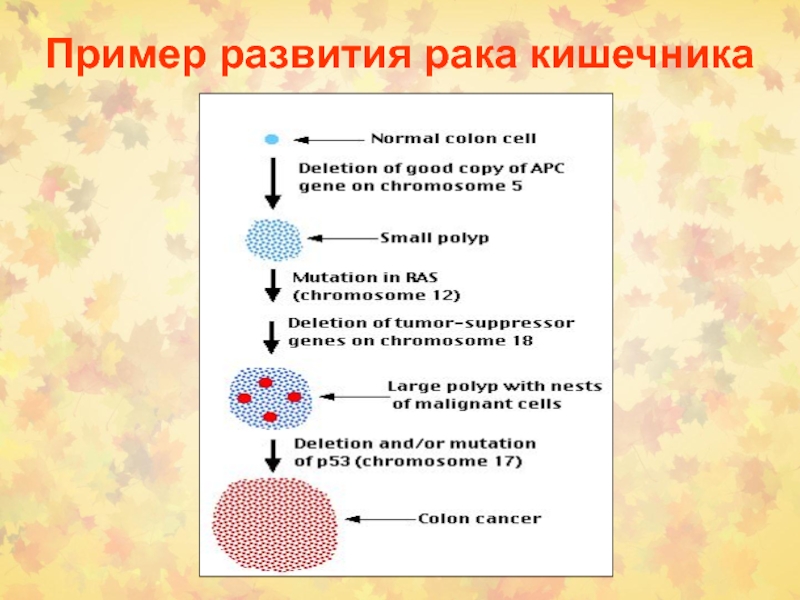
- 92. Молекулярно—генетические изменения в процессе канцерогенеза в толстой кишке
- 93. Пример развития рака кишечника
- 94. Слайд 94
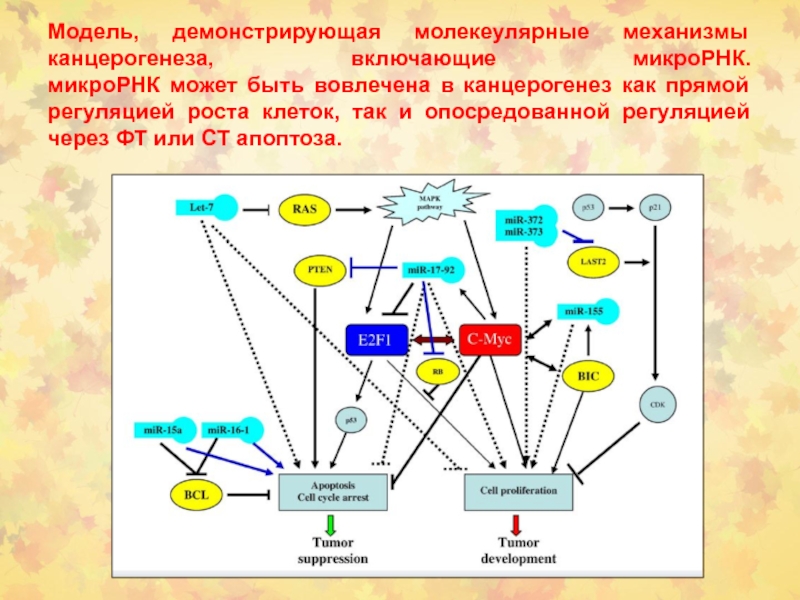
- 95. Модель, демонстрирующая молекеулярные механизмы канцерогенеза, включающие микроРНК.
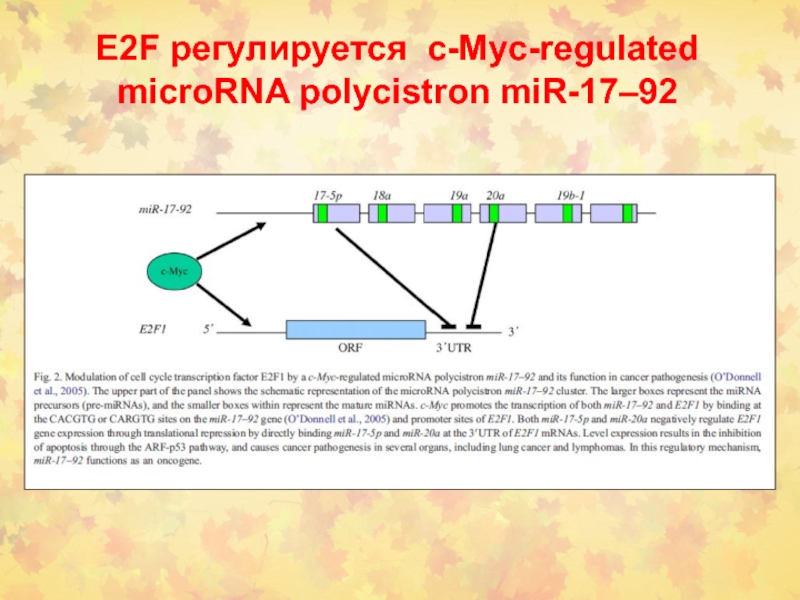
- 96. E2F регулируется c-Myc-regulated microRNA polycistron miR-17–92
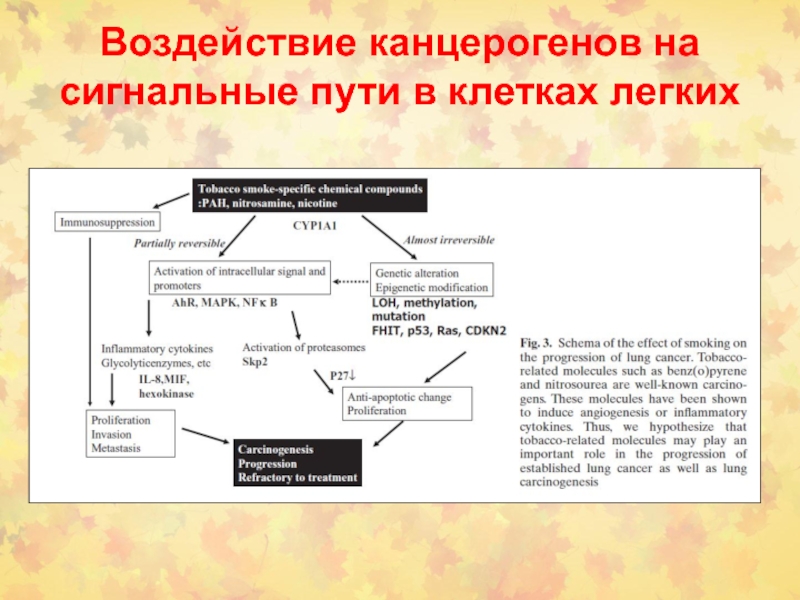
- 97. Воздействие канцерогенов на сигнальные пути в клетках легких
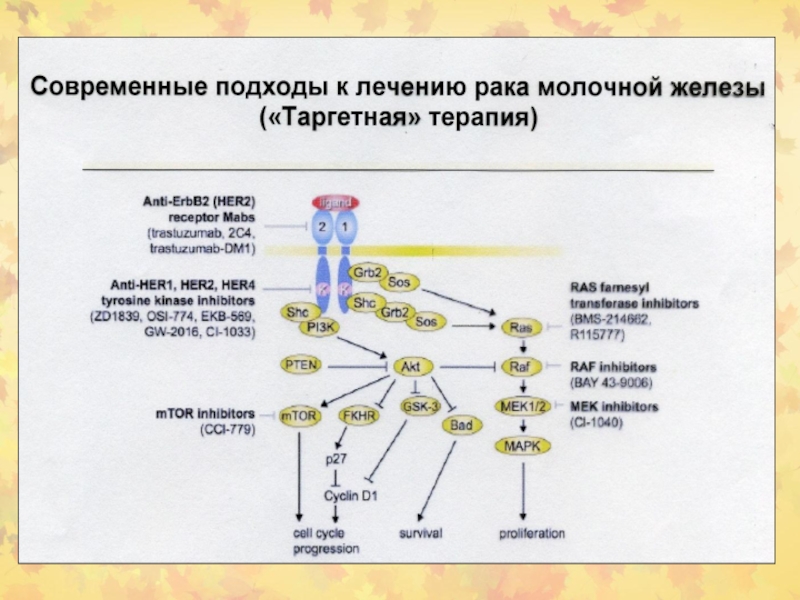
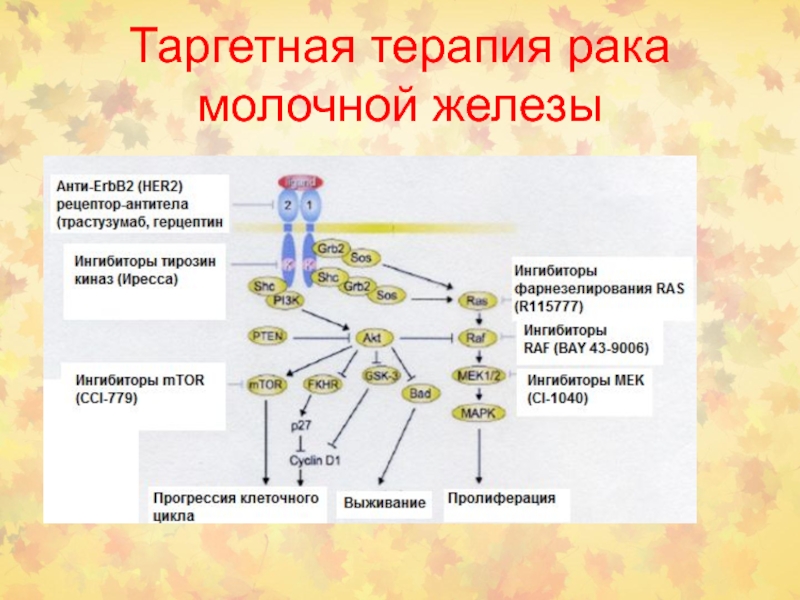
- 98. Таргетная терапия рака молочной железы
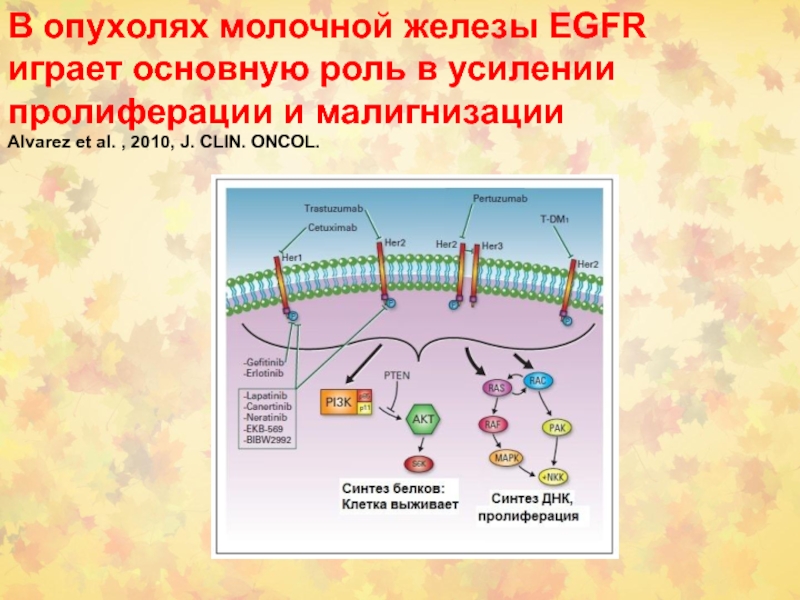
- 99. В опухолях молочной железы EGFR играет
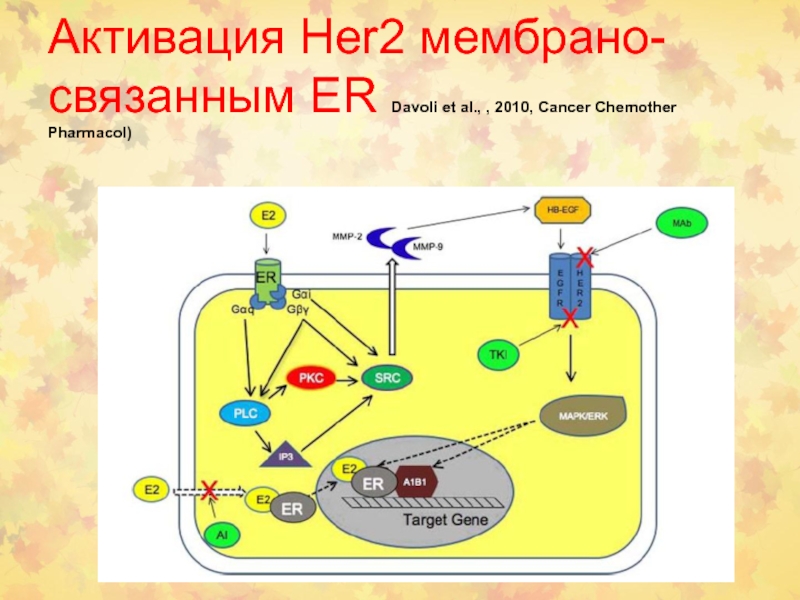
- 100. Активация Her2 мембрано-связанным ER Davoli et al., , 2010, Cancer Chemother Pharmacol)
- 101. Семейство Vascular endothelial growth
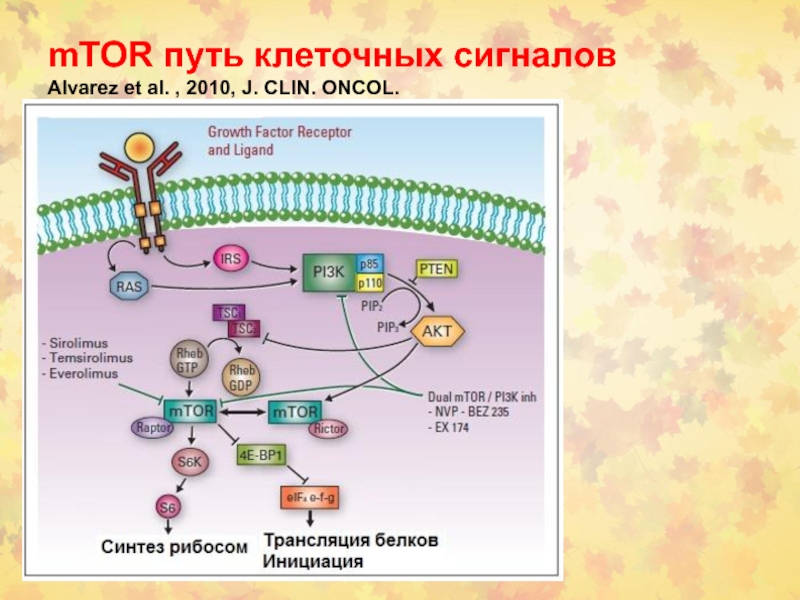
- 102. mTOR путь клеточных сигналов Alvarez et al. , 2010, J. CLIN. ONCOL.
- 103. Таргетная терапия в лечении рака легкогоNSCLC –
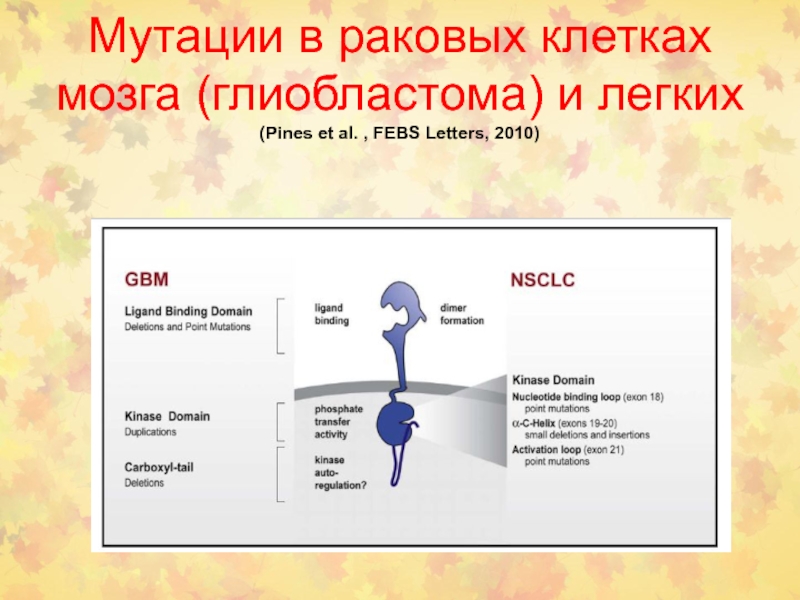
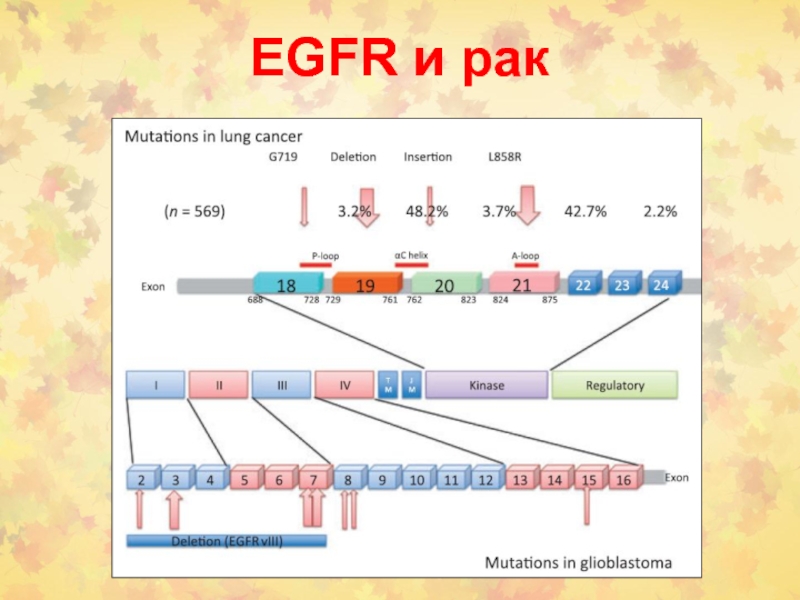
- 104. Мутации в раковых клетках мозга (глиобластома) и легких (Pines et al. , FEBS Letters, 2010)
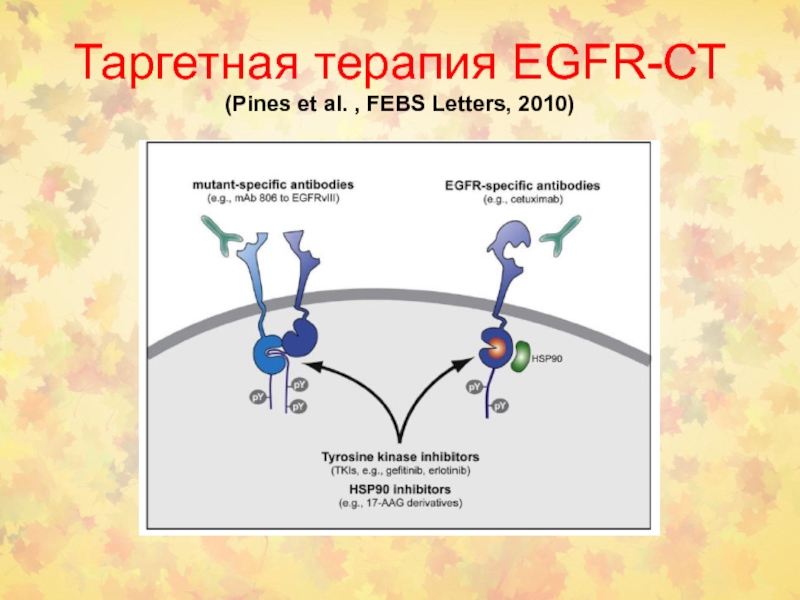
- 105. Таргетная терапия EGFR-СТ (Pines et al. , FEBS Letters, 2010)
- 106. EGFR и рак
- 107. Таргетная терапия в лечении рака кишечникаPanitumumab –
- 108. Мутации в опухолях кишечника (586 случаев)
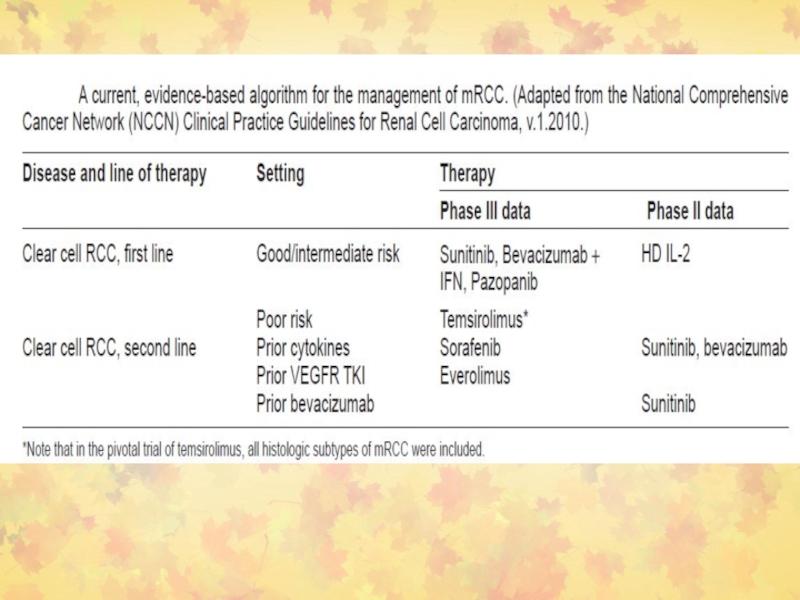
- 109. Ренальная карцинома2 категории терапии:(1) vascular endothelial growth
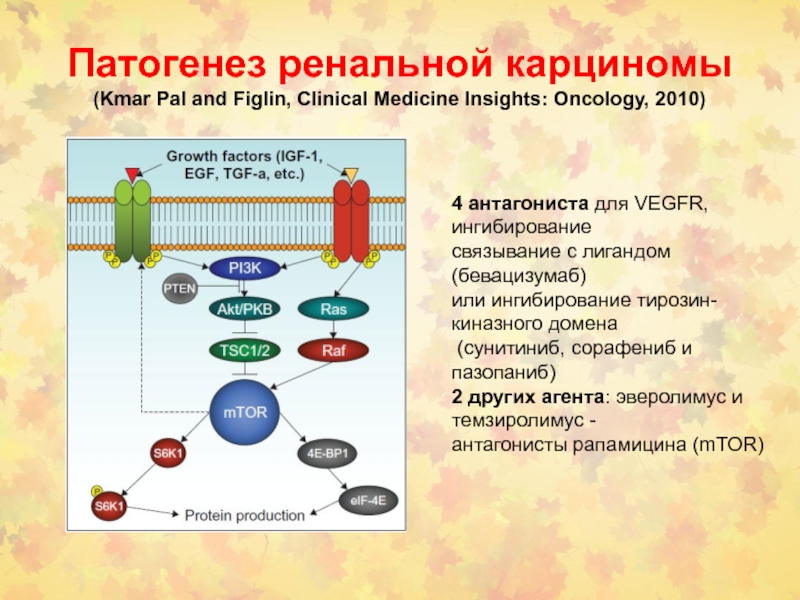
- 110. Патогенез ренальной карциномы (Kmar Pal and
- 111. Слайд 111
- 112. Слайд 112
- 113. Применение ингибиторов RAFB-RAF мутации встречаются в 30–60%
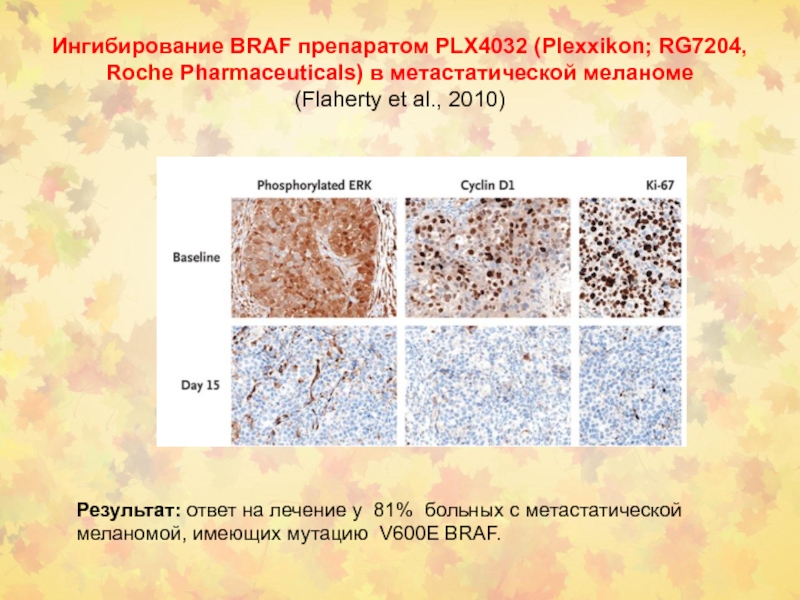
- 114. Ингибирование BRAF препаратом PLX4032 (Plexxikon;
- 115. Перспективы изучения СТСигнальная трансдукцияФундаментальные механизмы в клеточной
- 116. Скачать презентанцию
Слайды и текст этой презентации
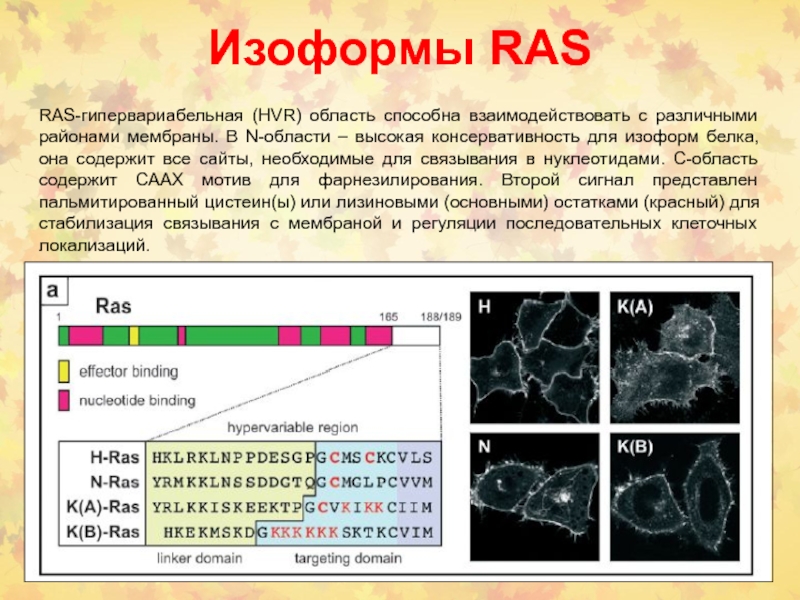
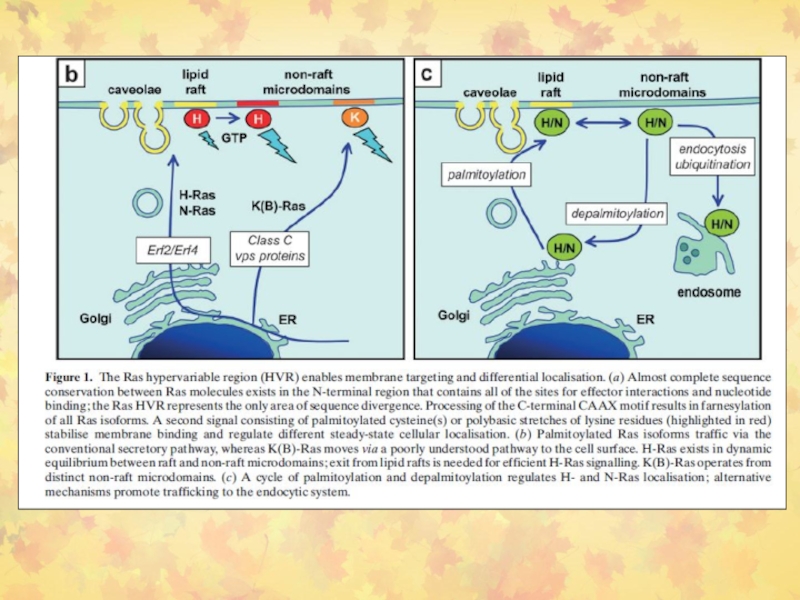
Слайд 15Изоформы RAS
RAS-гипервариабельная (HVR) область способна взаимодействовать с различными районами мембраны.
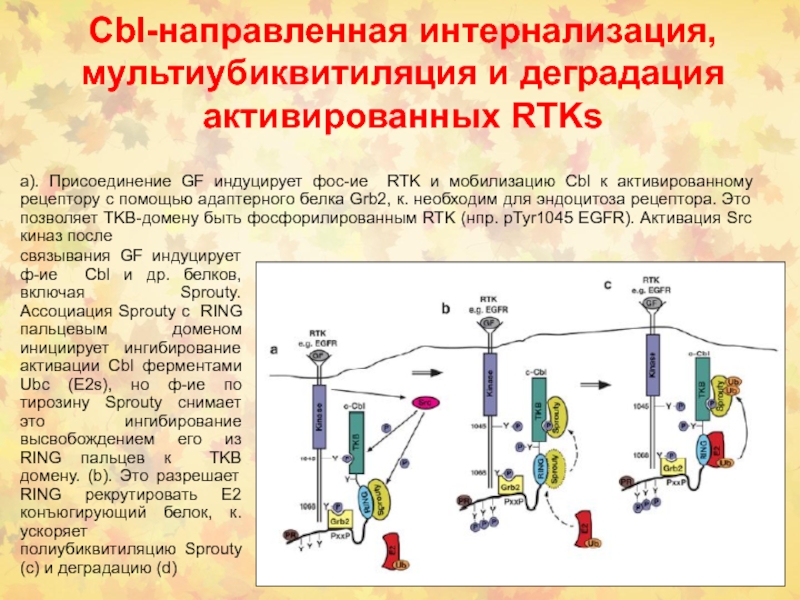
Слайд 22Cbl-направленная интернализация, мультиубиквитиляция и деградация активированных RTKs
а). Присоединение GF индуцирует
фос-ие RTK и мобилизацию Cbl к активированному рецептору с помощью
адаптерного белка Grb2, к. необходим для эндоцитоза рецептора. Это позволяет TKB-домену быть фосфорилированным RTK (нпр. pTyr1045 EGFR). Активация Src киназ послесвязывания GF индуцирует ф-ие Cbl и др. белков, включая Sprouty. Ассоциация Sprouty с RING пальцевым доменом инициирует ингибирование активации Cbl ферментами Ubc (E2s), но ф-ие по тирозину Sprouty снимает это ингибирование высвобождением его из RING пальцев к TKB домену. (b). Это разрешает RING рекрутировать E2 конъюгирующий белок, к. ускоряет полиубиквитиляцию Sprouty (с) и деградацию (d)
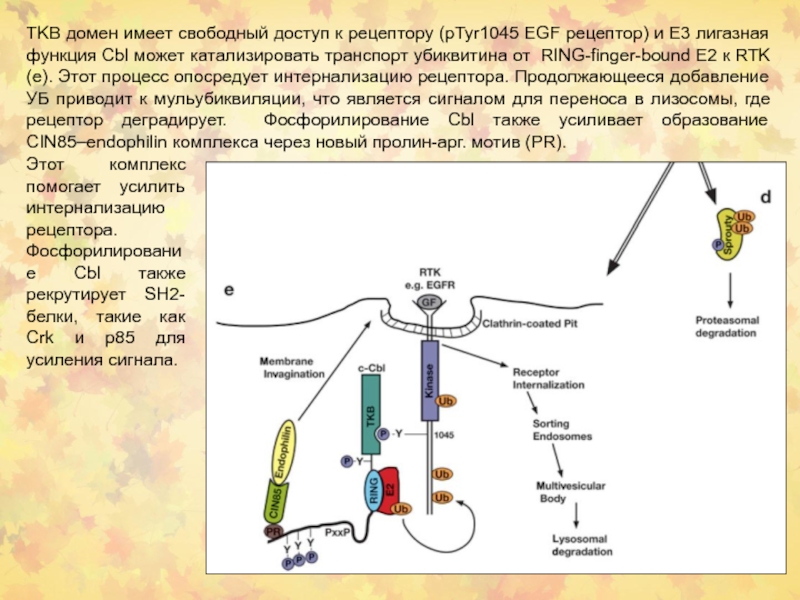
Слайд 23TKB домен имеет свободный доступ к рецептору (pTyr1045 EGF рецептор)
и E3 лигазная функция Cbl может катализировать транспорт убиквитина от
RING-finger-bound E2 к RTK (e). Этот процесс опосредует интернализацию рецептора. Продолжающееся добавление УБ приводит к мульубиквиляции, что является сигналом для переноса в лизосомы, где рецептор деградирует. Фосфорилирование Cbl также усиливает образование CIN85–endophilin комплекса через новый пролин-арг. мотив (PR).Этот комплекс помогает усилить интернализацию рецептора. Фосфорилирование Cbl также рекрутирует SH2-белки, такие как Crk и p85 для усиления сигнала.
Слайд 53NOTCH1-сигнальный путь
Взаимодействие NOTCH1 рецептора с Delta-like и Jagged лигандами, экспрессирующимися
на поверхности соседних клеток индуцирует протеолитическое расщепление рецептора, в первую
очередь, ADAM 10 металлопротеиназа (S2 cleavage) и затем γ-secretase комплекс (S3 cleavage), которые высвобождают внутриклеточный домен NOTCH1 (ICN1) из мембраны . ICN1 транслоцируется в ядро и взаимодействует с ДНК через RBPJ/CSL – ДНК-связывающие белки, рекрутируют коактиваторы для экспрессии генов-мишеней NOTCH1Слайд 54Онкогенные формы NOTCH1 при T-ALL
Аберрантная активация NOTCH может происходить из-за
мутаций. (А) рецептор дикого типа; (b) Транслокация NOTCH1 в TCR
локус индуцирует усеченные формы NOTCH1. (c) NOTCH1 HD мутации класса 1 дестабилизируют структуру HD-LNR повторов, ответственных за поддержание конфигурации рецептора (d) NOTCH1 H1545P мутации повреждают защиту от S2 расщепления у HD-LNR (e) NOTCH1 HD мутации класса 2 располагают S2 МР сайт расщепления вне HD-LNR комплекса (f) NOTCH1 JME усиливает выделение HD-LNR повторного комплекса из мембраны (g) NOTCH1 ΔPEST у C-конца рецептора нарушает деградацию активного NOTCH1 в ядре.Слайд 58Онкогены, кодирующие ФТ имеют мутации, которые инактивируют транскрипцию (v-ErbA и,
возможно, v-Rel) или активируют транскрипцию (v-Jun и v-Fos)
Слайд 64Моделирование роли c-Myc/Max и Mad/Max в регуляции транскрипции. c-Myc/Max гетеродимер
показан связанным с E box 59-CACGTG-39. c-Myc взаимодействует с TBP,
хотя механизм трансактивации c-Myc неизвестен. Mad/Max гетеродимер связан с E box, mSin3, N-Cor, и histone deacetylase (HDAC). HDAC деацетилирует гистоны, вызывая закрывание нуклеосомной ДНК, в результате чего транскрипция блокируется.Слайд 68NF-kB семейство
(p50/p105), NF-kB2 (p52/ p100), RelA (p65), Rel (c-Rel) и
RelB.
Для них характерно: Rel homology domain (RHD), который опосредует связывание
с ДНК, димеризацию и связывание с группой ингибиторов IkBIkB киназный комплекс (IKK) состоит из 3-х субъединиц: IKKa, IKKb и IKKg/NEMO и убиквитина.
Слайд 69Активация NF-kB
Эффекторы NF-kB-опосредованной супрессии ROS и JNK активностей и их
предполагаемый механизм действия.
В основном, протективная активность NF-kB против TNF-R1-индуцированной
смерти опосредуется через up-регуляцию генов-мишеней. Одна группа NF-kB-i индуцибельных генов включает A20, XIAP и Gadd45b, действующих напрямую с JNK каскадом. Другая группа мишеней FHC, Mn-SOD и, возможно, другие гены, блокирует JNK путь ненапрямую, супрессируя накопление ROS.Слайд 72Потенциальное терапевтическое применение NF-kB-опосредованной блокады TNFa-индуцированных ROS и JNK путей
СТ
Возможная + обратная связь между TNFa и NF-kB часто приводит
к прогрессии опухоли и воспалению . Несколько фарм. агентов можно применить против этого без глобального ингибирования NF-kB. Такие препараты могут индуцировать смерть больной клетки блокированием активности phosphatases или downstream эффекторами NF-kB-опосредованной супрессией ROS и JNK путей. Такой подход не вредит функции NF-kB в иммунитете и развитии NF-jB-контроля JNK каскада.
Слайд 73АР1 семейство
Activator protein 1 (AP-1) семейство белков – содержат лейциновый
зиппер (bZIP). Они регулируют многие клеточные процессы, включая пролиферацию, выживание,
рост, дифференцировку, апоптоз, трансформацию.У млекопитающих это гомо- или гетеродимеры, которые формируются jun (c-jun, junB, junD), fos (c-fos, fra-1, fra-2) или atf белками.
Слайд 86Механизмы гормонального канцерогенеза
- генотоксичный (повреждение ДНК метаболитами эстрогенов)
- эпигенетический (активация
ERs)
Слайд 95Модель, демонстрирующая молекеулярные механизмы канцерогенеза, включающие микроРНК. микроРНК может быть вовлечена
в канцерогенез как прямой регуляцией роста клеток, так и опосредованной
регуляцией через ФТ или СТ апоптоза.Слайд 99 В опухолях молочной железы EGFR играет основную роль в усилении
пролиферации и малигнизации
Alvarez et al. , 2010, J. CLIN. ONCOL.
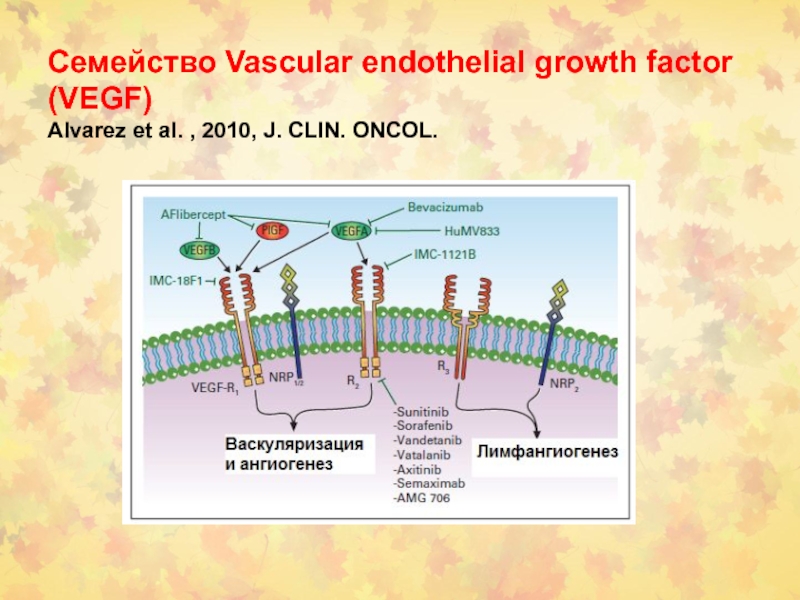
Слайд 101 Семейство Vascular endothelial growth factor (VEGF) Alvarez et al. ,
2010, J. CLIN. ONCOL.
Слайд 103Таргетная терапия в лечении рака легкого
NSCLC – немелкоклеточный рак легкого
vascular endothelial growth factor (VEGF)
Bevacizumab ингибирует VEGF
Cetuximab – Mab против
epidermal growth factor receptor (EGFR)
Gefitinib и erlotinib - монотерапия
Слайд 104Мутации в раковых клетках мозга (глиобластома) и легких (Pines et
al. , FEBS Letters, 2010)
Слайд 107Таргетная терапия в лечении рака кишечника
Panitumumab – антитела против EGFR,
связывают лиганд-связывающий экстраклеточный домен, ингибируя димеризацию рецептора
Слайд 108Мутации в опухолях кишечника (586 случаев) Kopper L. Pathol. Oncol.
Res. (2010)
Среди 208 больных, принимавших панитумумаб, 17% с диким типом
KRAS показали объективный ответ, но не пациенты с мутациями (84 больных)Слайд 109Ренальная карцинома
2 категории терапии:
(1) vascular endothelial growth factor receptor (VEGFR)-направленная
терапия
(2) Ингибиторы mTOR (аналоги рапамицина).
Слайд 110Патогенез ренальной карциномы (Kmar Pal and Figlin, Clinical Medicine Insights:
Oncology, 2010)
4 антагониста для VEGFR, ингибирование
связывание с лигандом (бевацизумаб)
или ингибирование тирозин-киназного домена
(сунитиниб, сорафениб и пазопаниб)
2 других агента: эверолимус и темзиролимус -
антагонисты рапамицина (mTOR)
Слайд 113Применение ингибиторов RAF
B-RAF мутации встречаются в 30–60% меланом, 30–50% тиреоидного
рака, 5–20% рака кишечника
Ингибиторы RAF киназ (Sorafenib) эффективно блокируют
MEK1/2 и ERK1/2 активацию в клетках, содержащих онкогенный B-RAF Val600Glu (активирующая мутация).Ингибиторы RAF киназ приводят к парадоксальному увеличению активности RAF в клетках, содержащих дикий тип B-RAF или активированный мутантный RAS. C-RAF играет ключевую роль в усилении MEK-ERK активации.