Основные понятия
Ок.-восст. реакция (переход электронов от восстановителя к окислителю) –
основа эл.хим.процесса, если ∆G < 0 - самопроизв. процесс, ∆G > 0 - нет Если полуреакции разделены в пространстве протекает электрический ток
Электрохимическая система (ЭХC)–в ней протекают эл.хим.процессы
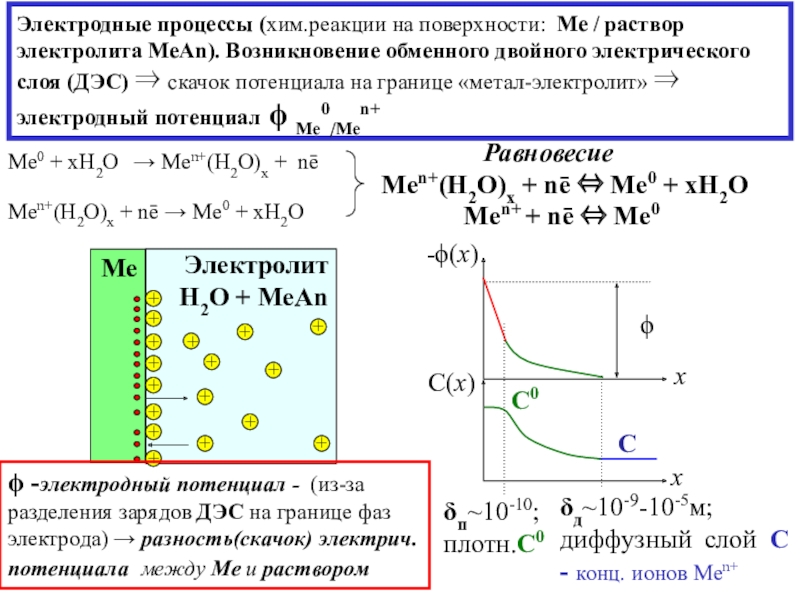
1-электроды(Ме)- ē проводимость, на поверхн. Ме:окисление –анод А, восстановлен.–катод К [электрод - контакт 2-х фаз: 1-(эл.) и 2-(ионн)]
2 -электролиты(проводники с ионной пров.)
3 -внешняя цепь для перехода электронов,
5 -внутренняя цепь для перехода ионов,
проводник электр.тока (ионная проводимость)
проводник электр.тока (электронная провод-ть)
4 –внешний источник электрич.энергии
Схема эл.хим.системы
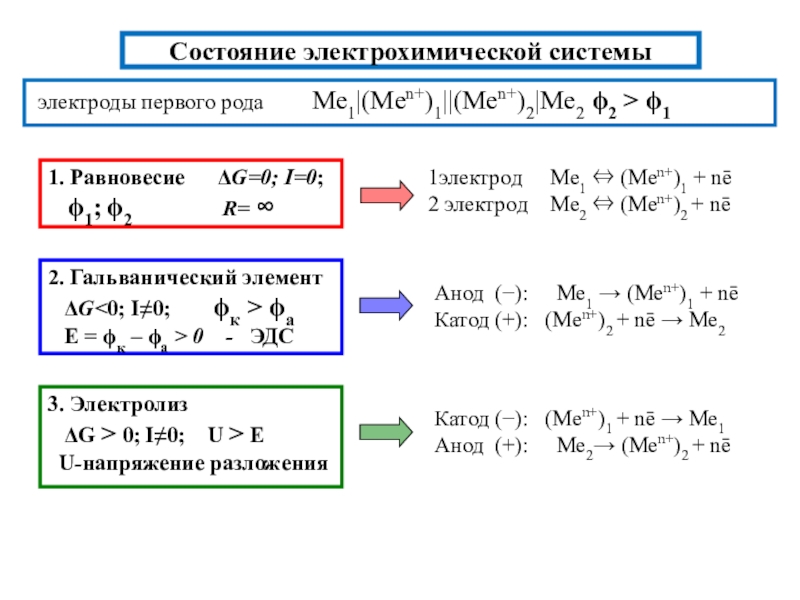
Zn|ZnSO4||CuSO4|Cu
Zn|Zn+2||Cu+2|Cu



![7-ЭЛЕКТРОХИМИЯ Уравнение Нернста для электродного потенциала [φ = f (C Me(n+), T Уравнение Нернста для электродного потенциала [φ = f (C Me(n+), T )] – термодинамич.подход Men+(H2O)x+nē ](/img/tmb/7/627708/2b2d73f28eb671ddd56958fc09f1f255-800x.jpg)






![7-ЭЛЕКТРОХИМИЯ Поляризация электродов – [] (приводит к сближению потенциалов катода и анода Поляризация электродов – [] (приводит к сближению потенциалов катода и анода и уменьшению ЭДС (∆φ) при](/img/tmb/7/627708/ce3c963ce0cffb7534e7ff91c56ef769-800x.jpg)