Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛЬДЕГИДЫ
Содержание
- 1. АЛЬДЕГИДЫ
- 2. Физические свойстванизшие имеют резкий запах хорошо растворимые
- 3. Физические свойства альдегидовформальдегидуксусный альдегид
- 4. Формальдегид (от лат. formīca «муравей»), муравьиный альдегид, метаналь. бесцветный
- 5. Уксусный альдегид (этаналь, ацетальдегид, метилформальдегид). Летучая жидкость;
- 6. КЕТОНЫ низшие представители – жидкость, растворимые в
- 7. Ацетонбесцветная горючая жидкость с характерным запахом;хорошо растворяется
- 8. Реакции присоединения:А) реакция гидрированияБ) реакция присоединения NaHSO3В)
- 9. Химические свойства альдегидовРеакции присоединения водорода (гидрирование)
- 10. Химические свойства альдегидов Па) с образованием полуацеталей.
- 11. Химические свойства альдегидовПрисоединение циановодорода с образованием нитрилов
- 12. Реакция "серебряного" зеркала. Качественная реакция на альдегидную группуРеакции окисления
- 13. Реакция с гидроксидом меди при нагревании. Качественная реакция на альдегидную функциональную группу.
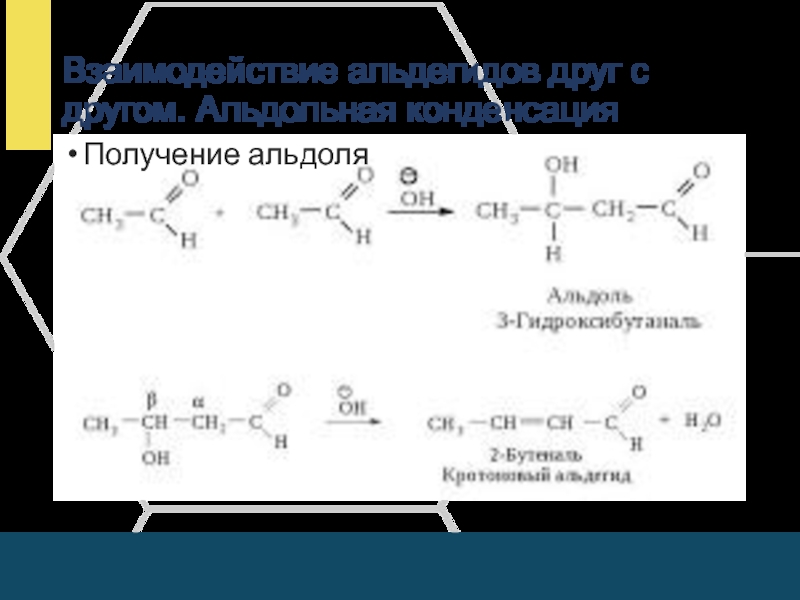
- 14. Взаимодействие альдегидов друг с другом. Альдольная конденсацияПолучение альдоля
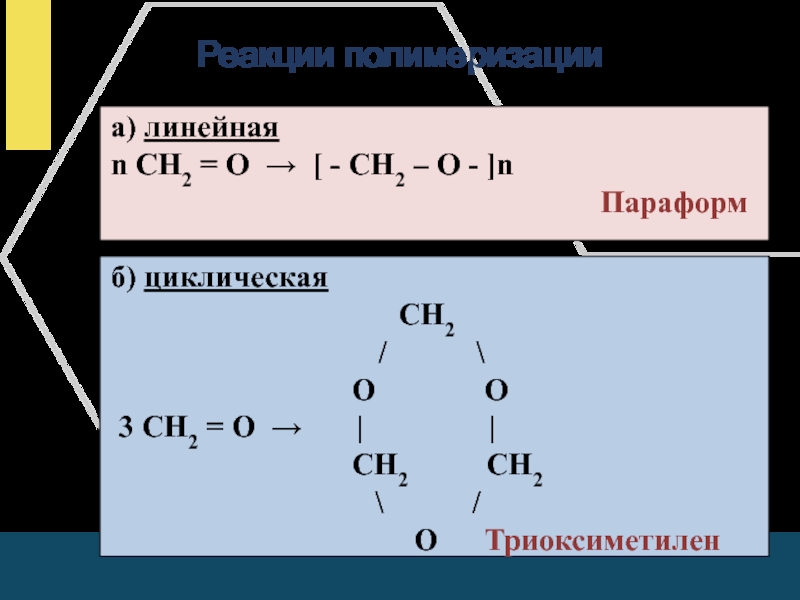
- 15. Реакции полимеризации
- 16. Химические свойства кетоновГидрирование кетонов
- 17. Слайд 17
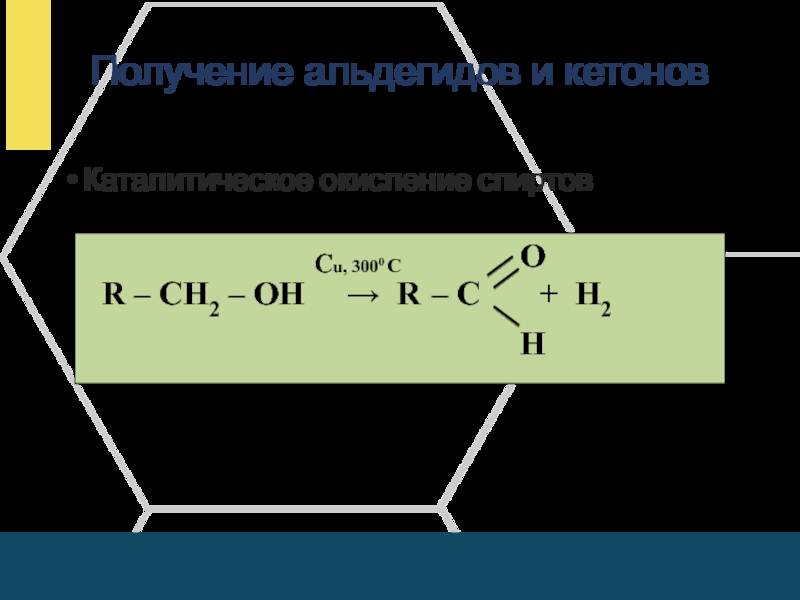
- 18. Получение альдегидов и кетоновКаталитическое окисление спиртов
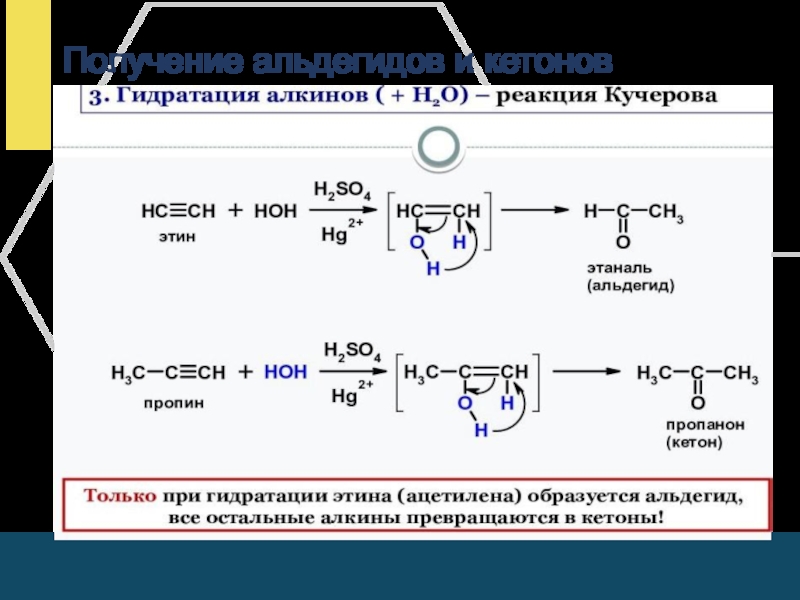
- 19. Получение альдегидов и кетонов
- 20. Получение альдегидовОкисление спиртов разными окислителями (CuO, KMnO4,
- 21. Получение кетонов
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Физические свойства
низшие имеют резкий запах хорошо растворимые в воде с
С 1-3;
имеют душистый запах с С8-12 , хорошо растворяются в
органических растворителях;t кипения увеличивается при увеличением числа углеродов
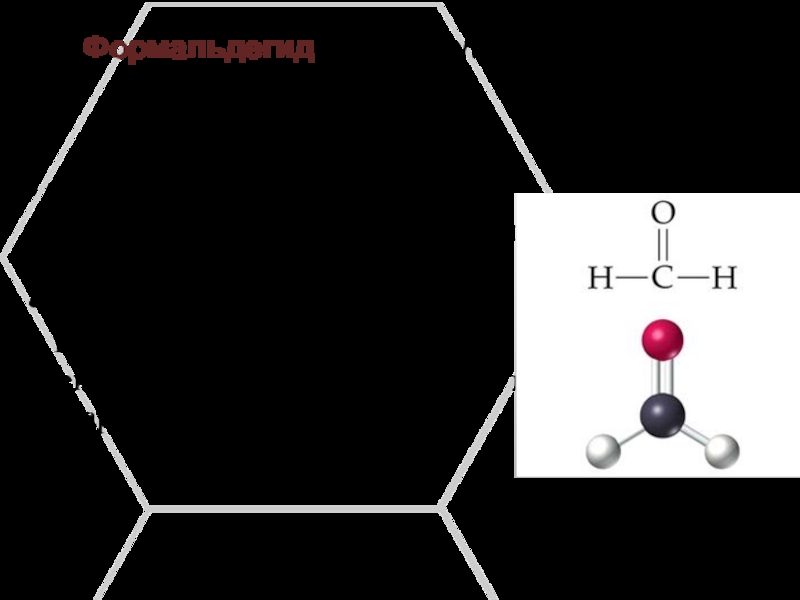
Слайд 4Формальдегид (от лат. formīca «муравей»), муравьиный альдегид, метаналь.
бесцветный газ с резким
запахом;
хорошо растворимый в воде, спиртах и полярных растворителях;
токсичен;
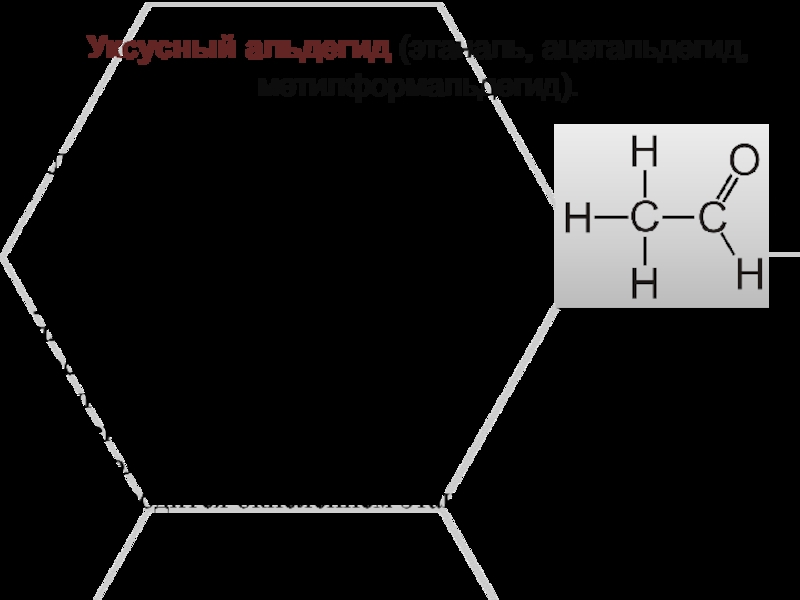
применяют для производства фенолформальдегидных пластмасс и лекарственных препаратов.Слайд 5Уксусный альдегид (этаналь, ацетальдегид, метилформальдегид).
Летучая жидкость;
хорошо растворимая в
воде;
ядовит;
используется для производства уксусной
кислоты, различных пластмасс и ацетатного волокна;встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма;
производится окислением этанола.
Слайд 6КЕТОНЫ
низшие представители – жидкость, растворимые в воде со своеобразным
запахом.
высшие - твердые вещества, без запаха, не растворимые в
воде. все кетоны растворяются в органических растворителях.
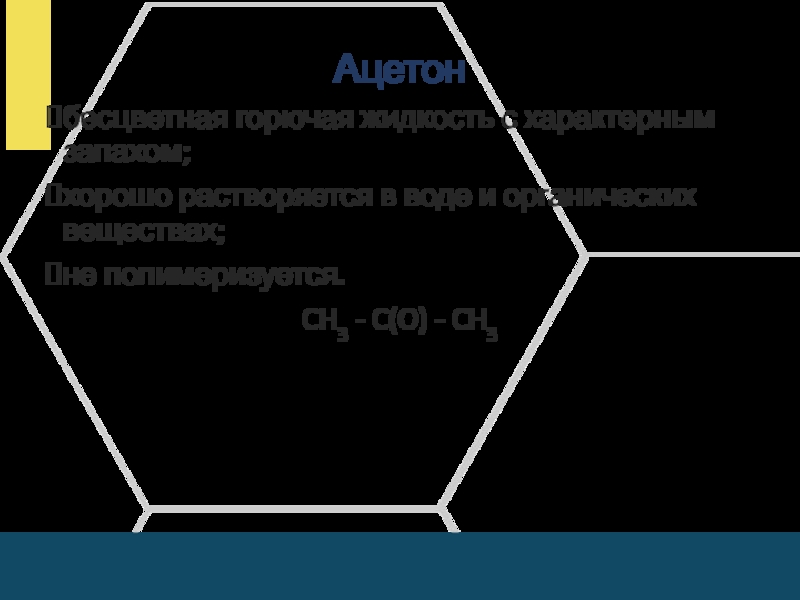
Слайд 7Ацетон
бесцветная горючая жидкость с характерным запахом;
хорошо растворяется в воде и
органических веществах;
не полимеризуется.
CH3 - C(O) - CH3
Слайд 8Реакции присоединения:
А) реакция гидрирования
Б) реакция присоединения NaHSO3
В) присоединение спиртов
Г) присоединение
синильной кислоты
2. Реакции окисления:
А) реакция серебряного зеркала
Б) реакция светофор
3. Реакция
поликонденсации4. Реакция полимеризации
Слайд 10Химические свойства альдегидов
П
а) с образованием полуацеталей.
СН3- СН2
– СОН + С2Н5ОН ↔ СН3 – СН2 – СН
– О – С2Н5|
OH
б) с образованием ацеталей (приятного, часто фруктового запаха).
Н⁺
СН3 - СН2- СОН + 2СН3ОН ↔ СН3 – СН2 – СН (ОСН3)₂ + Н2О
Слайд 11Химические свойства альдегидов
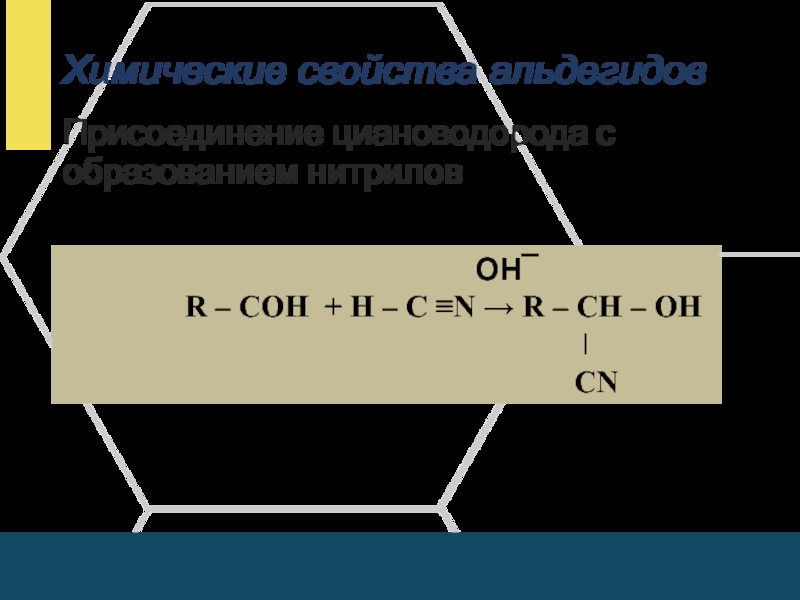
Присоединение циановодорода с образованием нитрилов
ОН¯
R – СОН + Н – С ≡N → R – СН – ОН
ǀ
СN
Слайд 13Реакция с гидроксидом меди при нагревании. Качественная реакция на альдегидную
функциональную группу.
Слайд 15Реакции полимеризации
а) линейная
n СН2
= О → [ - СН2 – О - ]nПараформ
б) циклическая
СН2
̸ \
О О
3 СН2 = О → | |
СН2 СН2
\ ̸
О Триоксиметилен
Слайд 16Химические свойства кетонов
Гидрирование кетонов
Ni
R1 —
C — R2 + H2 → R1 — CH — R2Ӏ Ӏ Ӏ
O OH
2. Окисление до кислот
CH3
\
C =O + 3 [O] → CH3COOH+ HCOOH → CO2+ H2O
/
CH3
Для кетонов не характерны реакции с Ag2O и c Cu(OH)2
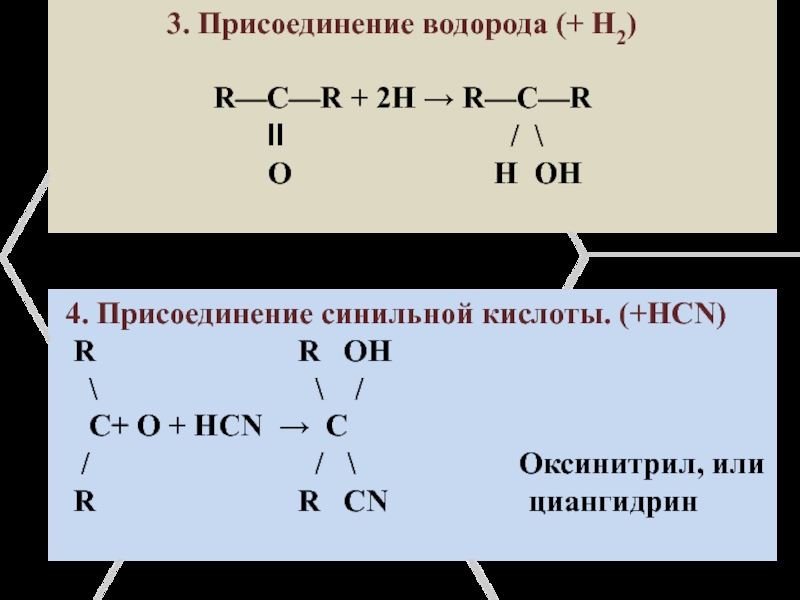
Слайд 17 3. Присоединение водорода
(+ H2)
R—C—R + 2H → R—C—RӀӀ / \
O H OH
4. Присоединение синильной кислоты. (+HCN)
R R OH
\ \ /
C+ O + HCN → C
/ / \ Оксинитрил, или
R R CN циангидрин
Слайд 20Получение альдегидов
Окисление спиртов разными окислителями (CuO, KMnO4, K2Cr2O7 и др.)
R
– СH2 – OH
[O]
H2O
+
R – СH – СН3
OH
–
[O]
H2O
+
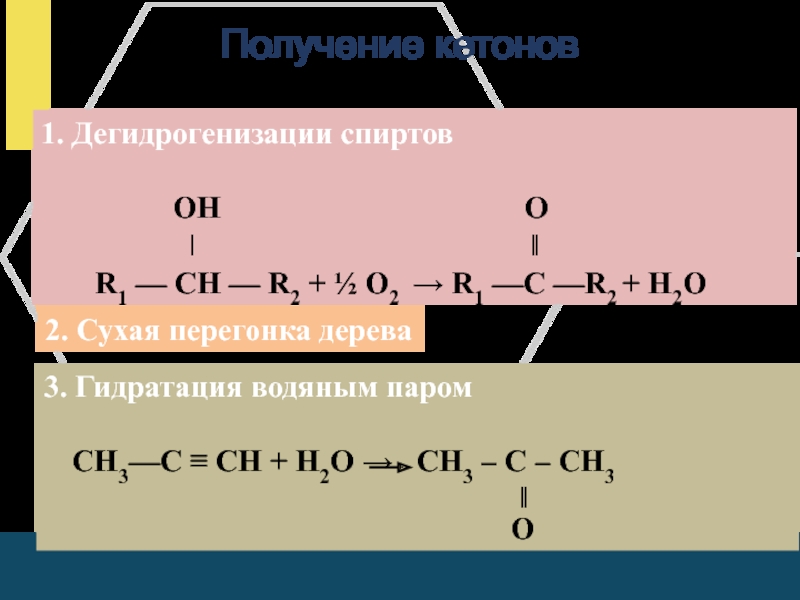
Слайд 21Получение кетонов
1. Дегидрогенизации спиртов
ОН O
ǀ ‖
R1 — CН — R2 + ½ О2 → R1 —C —R2 + Н2О
2. Сухая перегонка дерева
3. Гидратация водяным паром
СН3—С ≡ СН + Н2О → СН3 – С – СН3
‖
О







![АЛЬДЕГИДЫ Получение альдегидовОкисление спиртов разными окислителями (CuO, KMnO4, K2Cr2O7 и др.)R – Получение альдегидовОкисление спиртов разными окислителями (CuO, KMnO4, K2Cr2O7 и др.)R – СH2 – OH [O]H2O+R – СH](/img/thumbs/f0b9924f3d3deb3a18ac1a2ba80f0adb-800x.jpg)