Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛЬДЕГИДЫ И КЕТОНЫ
Содержание
- 1. АЛЬДЕГИДЫ И КЕТОНЫ
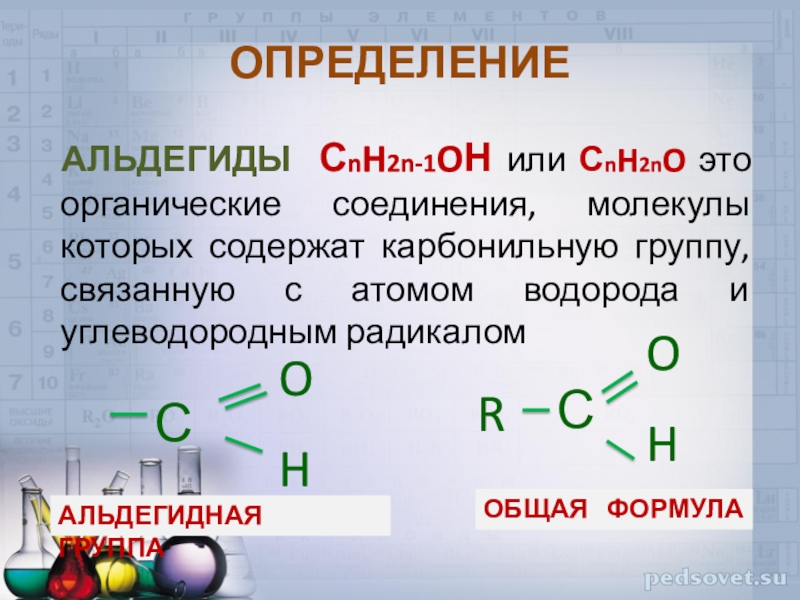
- 2. ОПРЕДЕЛЕНИЕ АЛЬДЕГИДЫ СnH2n-1OН или СnH2nO это органические
- 3. ОПРЕДЕЛЕНИЕКЕТОНЫ – органические вещества, в молекулах которых
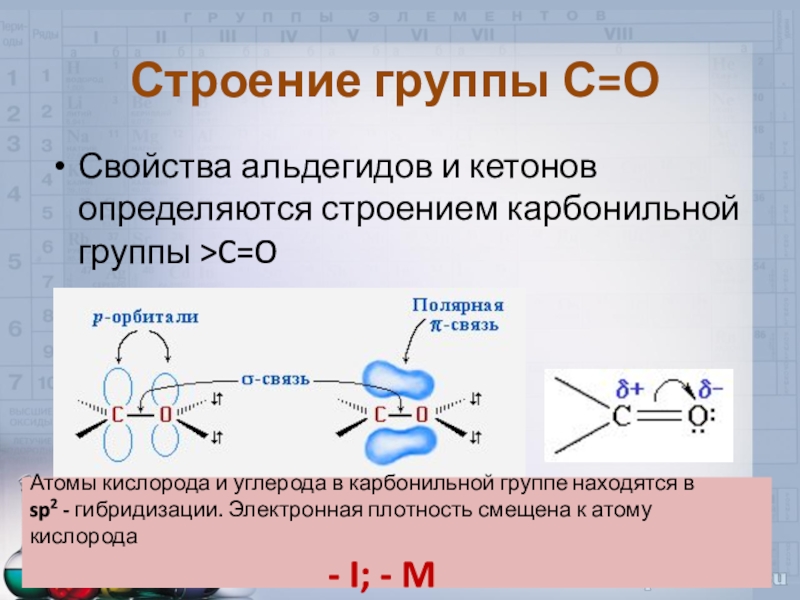
- 4. Строение группы С=ОСвойства альдегидов и кетонов определяются
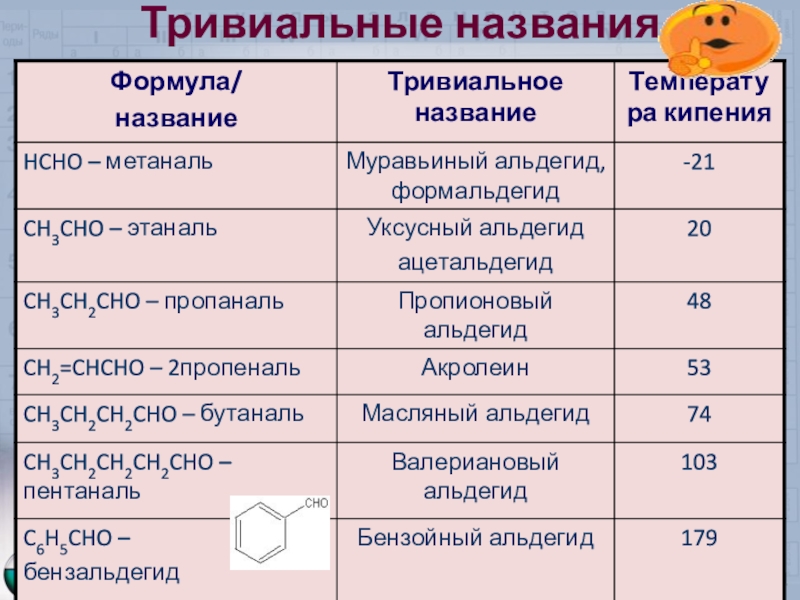
- 5. Тривиальные названия
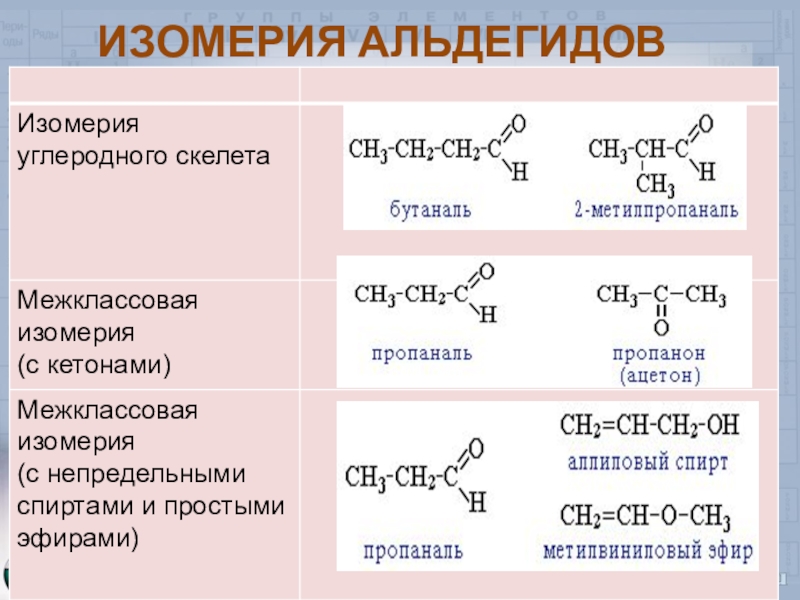
- 6. ИЗОМЕРИЯ АЛЬДЕГИДОВ
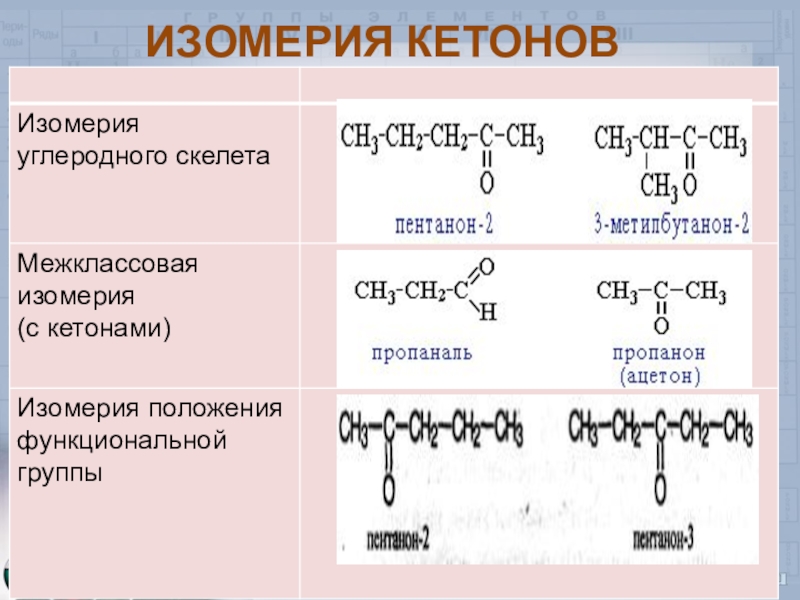
- 7. ИЗОМЕРИЯ КЕТОНОВ
- 8. Изомерия и номенклатура
- 9. С1 – газ
- 10. Физические свойства кетоновКетоны — летучие жидкости. Кетоны
- 11. Отличительной чертой многих альдегидов является
- 12. Булочки ванильные, корицы аромат,Амаретто, шоколадАльдегидов вкус таят.В
- 13. В плодах ванили
- 14. Запах цитрусовых обусловлен данным диеновым
- 15. Коричный альдегид Коричный альдегид содержится
- 16. Бензальдегид Бензальдегид – жидкость с
- 17. ФенилэтанальФенилэтаналь по сравнению с бензальдегидом лучше соответствует
- 18. n-Гидроксифенилбутанон-2 Этот кетон обуславливает в основном
- 19. ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИЯ ВОССТАНОВЛЕНИЯ О
- 20. ХИМИЧЕСКИЕ СВОЙСТВАРеакции нуклеофильного присоединения
- 21. ХИМИЧЕСКИЕ СВОЙСТВАПрисоединение гидросульфитов
- 22. Альдегиды довольно сильные восстановители, и поэтому легко
- 23. ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ
- 24. Допишите ОВРCH3COH + KMnO4 →CH3COH + K2Cr2O7
- 25. Муравьиный альдегид окисляется до CO2
- 26. Допишите ОВРHCOH + KMnO4(изб) + H2SO4 →HCOH + [Ag(NH3)2OH] →HCOH + Cu(OH)2 →
- 27. Кетоны окисляются в более жёстких условиях с
- 28. ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ Реакция серебряного зеркала- качественная
- 29. Реакция с гидроксидом меди качественная реакция
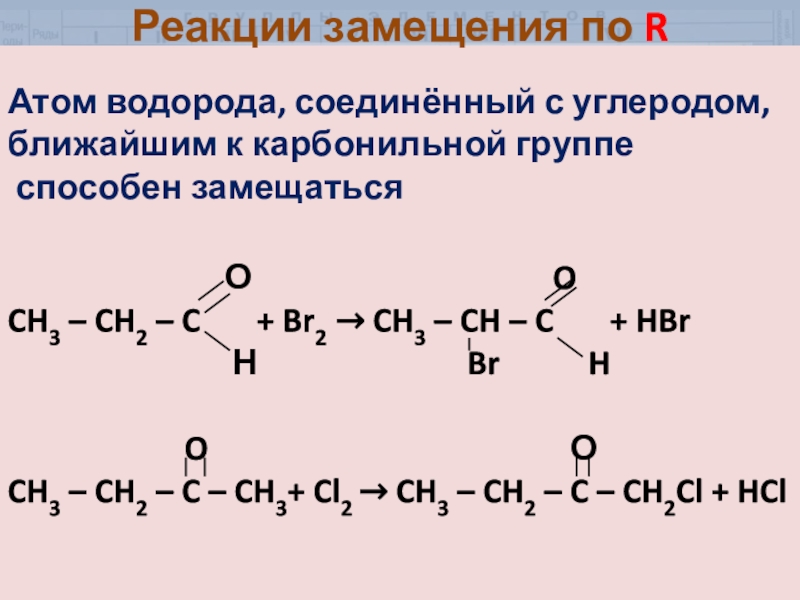
- 30. Атом водорода, соединённый с углеродом, ближайшим к
- 31. Реакции замещения по R На свету атом брома может замещать любой из атомов водорода
- 32. Реакции замещения по связи С=О 1). С
- 33. Реакция альдегидов со спиртами Синтез полуацеталей и
- 34. СПОСОБЫ ПОЛУЧЕНИЯГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова) HgSO4,H2SO4,t
- 35. СПОСОБЫ ПОЛУЧЕНИЯДЕГИДРИРОВАНИЕ СПИРТОВ
- 36. СПОСОБЫ ПОЛУЧЕНИЯОКИСЛЕНИЕ СПИРТОВ
- 37. СПОСОБЫ ПОЛУЧЕНИЯОКИСЛЕНИЕ АЛКЕНОВКУМОЛЬНЫЙ СПОСОБ
- 38. Слайд 38
- 39. Слайд 39
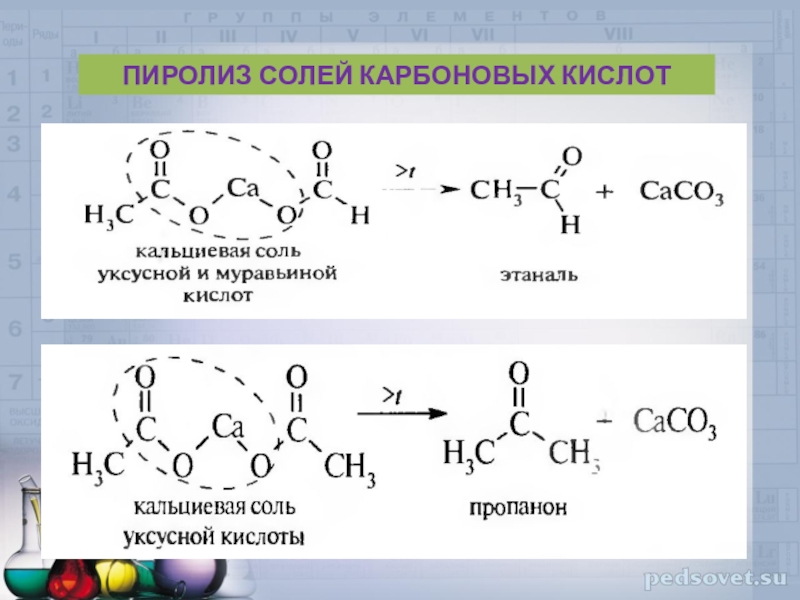
- 40. ПИРОЛИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ
- 41. ПРИМЕНЕНИЕ АЛЬДЕГИДОВПарфюмерияАльдегид анисовый, обепин – жидкость с
- 42. ПРИМЕНЕНИЕ АЛЬДЕГИДОВПолимерные материалыФенолформальдегидные смолы
- 43. ПРИМЕНЕНИЕ АЛЬДЕГИДОВПроизводство веществУксусная кислотаЭтилацетатФормалин
- 44. Контрольные вопросыНайдите формулу альдегида: 2. Исключите лишнее
- 45. 6. Укажите формулу 2,3-диметилпентаналя:7. Общая формула гомологического
- 46. 9. Гидратацией какого алкина можно получить альдегид?
- 47. Ответы 1)б
- 48. СПАСИБО ЗА ВНИМАНИЕ!
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2ОПРЕДЕЛЕНИЕ
АЛЬДЕГИДЫ СnH2n-1OН или СnH2nO это органические соединения, молекулы которых
содержат карбонильную группу, связанную с атомом водорода и углеводородным радикалом
общая
формулаальдегидная группа
Слайд 3ОПРЕДЕЛЕНИЕ
КЕТОНЫ – органические вещества, в молекулах которых карбонильная группа связана
с двумя углеводородными радикалами
С = О - кетогруппа
R1 – C
– R2||
O
Общая формула
Слайд 4Строение группы С=О
Свойства альдегидов и кетонов определяются строением карбонильной группы
>C=O
Атомы кислорода и углерода в карбонильной группе находятся в
sp2
- гибридизации. Электронная плотность смещена к атому кислорода- I; - M
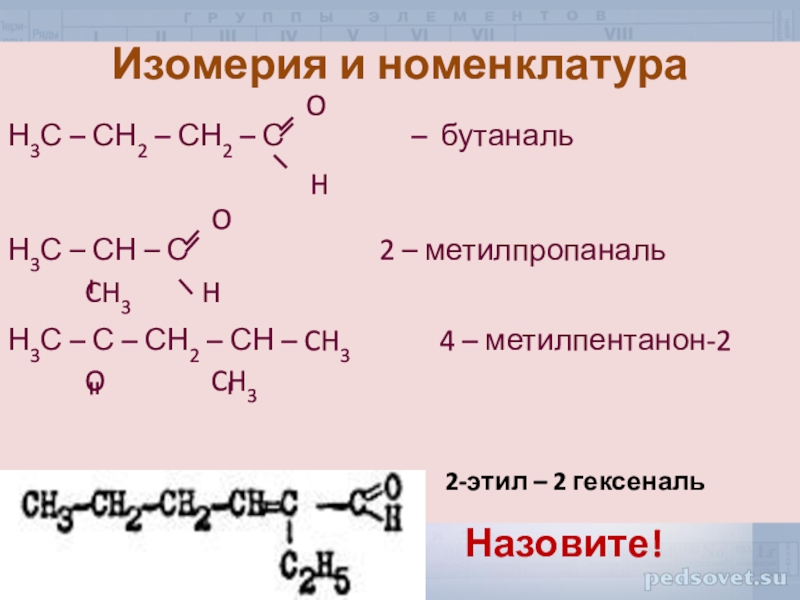
Слайд 8Изомерия и номенклатура
O
Н3С – СН2 – СН2 – С – бутаналь
H
O
Н3С – СН – С 2 – метилпропаналь
CH3 H
Н3С – С – СН2 – СН – CH3 4 – метилпентанон-2
O CH3
2-этил – 2 гексеналь
Назовите!
Слайд 9С1 – газ с резким запахом
С2
– С3 – жидкости с резким запахом
С4 – С6 –
жидкости с неприятным запахом>С6 – высшие (особенно непредельные или ароматические) – твердые, нерастворимые в воде с цветочным запахом
НСОН - формальдегид – газ с резким удушливым запахом, хорошо растворимый в воде, t кип. - 19,3С, ядовит. 40% раствор формальдегида называется формалином
СН3СОН – уксусный альдегид – жидкость с запахом зелёного яблока, растворимая в воде t кип. 21С
у этих альдегидов температуры кипения ниже, чем у соответствующих спиртов
Физические свойства альдегидов
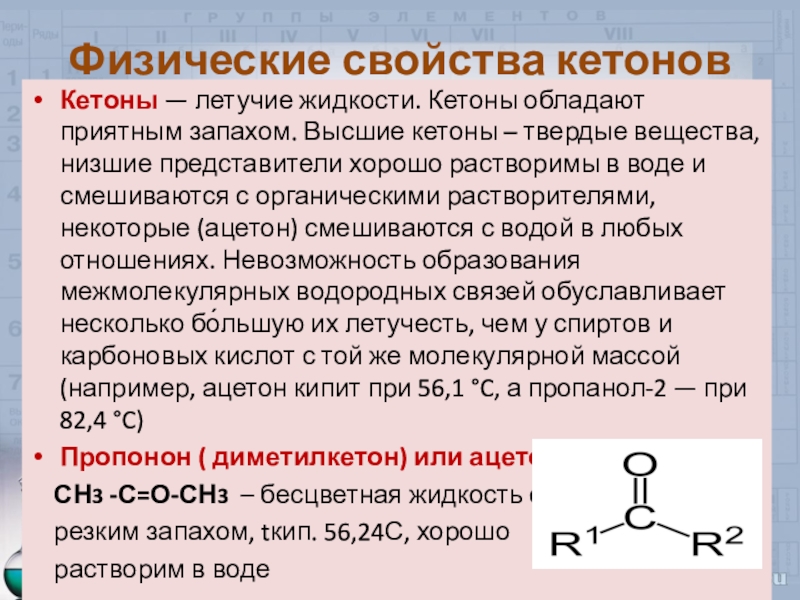
Слайд 10Физические свойства кетонов
Кетоны — летучие жидкости. Кетоны обладают приятным запахом.
Высшие кетоны – твердые вещества, низшие представители хорошо растворимы в
воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых отношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой (например, ацетон кипит при 56,1 °C, а пропанол-2 — при 82,4 °C)Пропонон ( диметилкетон) или ацетон
СН3 -С=О-СН3 – бесцветная жидкость с
резким запахом, tкип. 56,24С, хорошо
растворим в воде
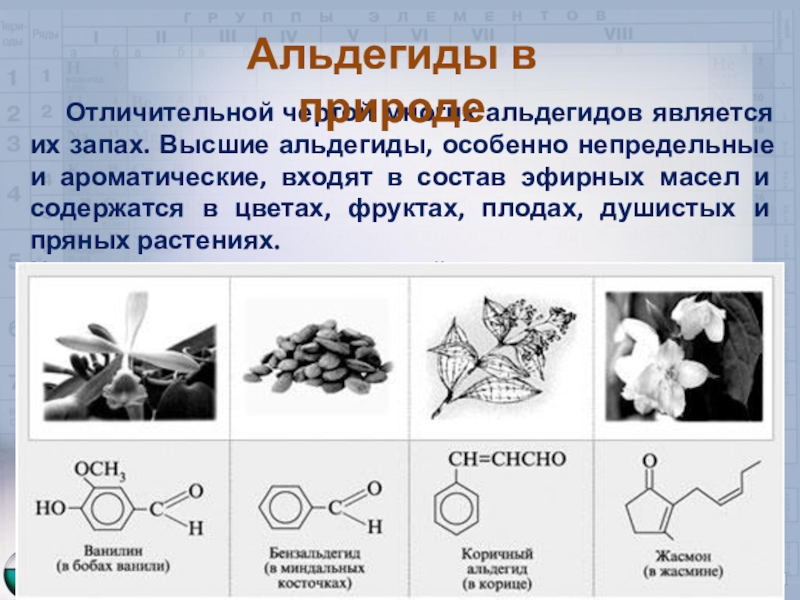
Слайд 11 Отличительной чертой многих альдегидов является их запах. Высшие
альдегиды, особенно непредельные и ароматические, входят в состав эфирных масел
и содержатся в цветах, фруктах, плодах, душистых и пряных растениях.Их используют в пищевой промышленности и парфюмерии.
Альдегиды в природе
Слайд 12Булочки ванильные, корицы аромат,
Амаретто, шоколад
Альдегидов вкус таят.
В землянике и кокосе,
И
в жасмине, и в малине,
И в духах, и в еде
Альдегидов
след везде.Что за запах, что за прелесть,
И откуда эта свежесть?!
Это высший альдегид
Аромат вам свой дарит!
Альдегиды в природе
Слайд 13 В плодах ванили содержится ароматический альдегид,
который придает им характерный запах.
Ванилин применяется в парфюмерии,
кондитерской промышленности, для маскирования запахов некоторых продуктовВанилин
Альдегиды в природе
Слайд 14 Запах цитрусовых обусловлен данным диеновым альдегидом. Его применяют
в качестве отдушки средств бытовой химии, косметических и парфюмерных веществ
Цитраль
Альдегиды
в природеСлайд 15Коричный альдегид
Коричный альдегид содержится в масле корицы,
его получают перегонкой коры дерева корицы .
Применяется в кулинарии
в виде палочек или порошка Альдегиды в природе
Слайд 16Бензальдегид
Бензальдегид – жидкость с запахом горького
миндаля.
Встречается в косточках и семечках (абрикос, персик)
Альдегиды в природе
Слайд 17Фенилэтаналь
Фенилэтаналь по сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха.
Фенилэтаналь пахнет гиацинтом.
Альдегиды
в природеСлайд 18n-Гидроксифенилбутанон-2
Этот кетон обуславливает в основном запах спелых ягод
малины.
Его включают в состав синтетических душистых композиций
Кетоны
в природеСлайд 19ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИЯ ВОССТАНОВЛЕНИЯ
О t,Pt
СН3
С + Н2 → СН3
СН2 ОНэтаналь Н этанол
CH3 – C – CH3 + H2 CH3 – CH – CH3
| | |
O OH
ацетон пропанол-2
t,Pt
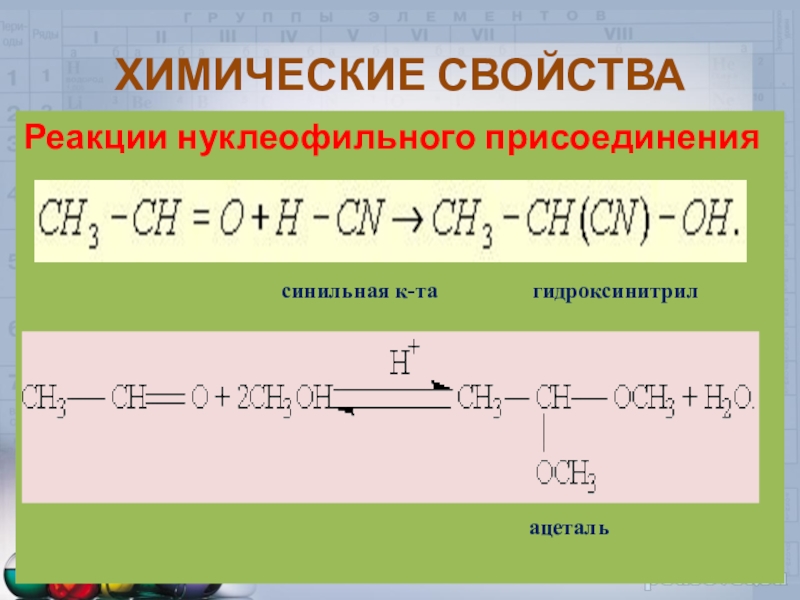
Слайд 20ХИМИЧЕСКИЕ СВОЙСТВА
Реакции нуклеофильного присоединения
ацеталь
Слайд 21ХИМИЧЕСКИЕ СВОЙСТВА
Присоединение гидросульфитов
Гидросульфитные производные
альдегидов и кетонов при нагревании с кислотами разлагаются с образованием
первоначальных карбонильных соединенийOH O
СН3 – С – SO3Na + HCl →CH3–C + NaCl + SO2↑ + H2O
H H
Реактив Гриньяра
Используя эту реакцию, из формальдегида получают первичный спирт, из любого другого альдегида – вторичный спирт, а из кетона третичный спирт
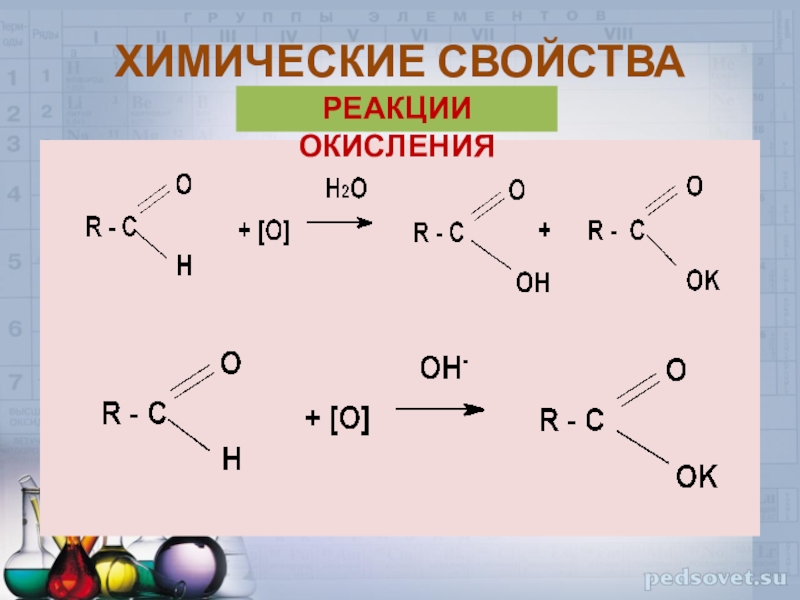
Слайд 22Альдегиды довольно сильные восстановители, и поэтому легко окисляются различными окислителями,
например: КМnO4, K2Cr2O7, [Ag(NH3)2OH], Cu(OH)2. Все реакции идут при нагревании
альдегид карбоновая кислотаХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯ
Слайд 24Допишите ОВР
CH3COH + KMnO4 →
CH3COH + K2Cr2O7 + H2SO4 →
CH3COH
+ KMnO4 + KOH →
CH3COH + KMnO4 + H2SO4 →
Слайд 25Муравьиный альдегид окисляется до CO2
или карбонатов:
НСОН
+ К2Сr2O7 + H2SO4→CO2 + Cr2(SO4)3 + K2SO4 + H2O
Расставьте коэффициенты!
3НСОН + 2К2Сr2O7 + 8H2SO4→3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯ
Слайд 27Кетоны окисляются в более жёстких условиях с разрывом связи
С-С
около карбонильной группы и образованием смеси
карбоновых кислот. Метильные радикалы
окисляются до СО2О O
СН3 – С – СН3 + [O] → CH3 – C + CO2
OH
О 1 O
CH3 – CH2 – C – CH3 → 2CH3– C
1 2 OH
O
2 CH3 – CH2 – C + CO2
OH
ОКИСЛЕНИЕ КЕТОНОВ
Слайд 28ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯ
Реакция серебряного зеркала- качественная реакция
О О
СН3 С + 2[Ag(NH3)2]OH → СН3
С + 2Ag + 4NH3 + 2H2O Н OН
О О
СН3 С + 2[Ag(NH3)2]OH → СН3 С + 2Ag + 3NH3 + 2H2O
Н ONH4
Слайд 29Реакция с гидроксидом меди качественная реакция
О
О
СН3 С + 2Cu(OH)2
→ СН3 С + 2H2O + Cu2O этаналь Н этановая кислота OН гидроксид меди (I)
(кирпично-красный)
РЕАКЦИИ ОКИСЛЕНИЯ
ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 30
Атом водорода, соединённый с углеродом, ближайшим к карбонильной группе
способен
замещаться
О OCH3 – CH2 – C + Br2 → CH3 – CH – C + HBr
Н Br H
O О
CH3 – CH2 – C – CH3+ Cl2 → CH3 – CH2 – C – CH2Cl + HCl
Реакции замещения по R
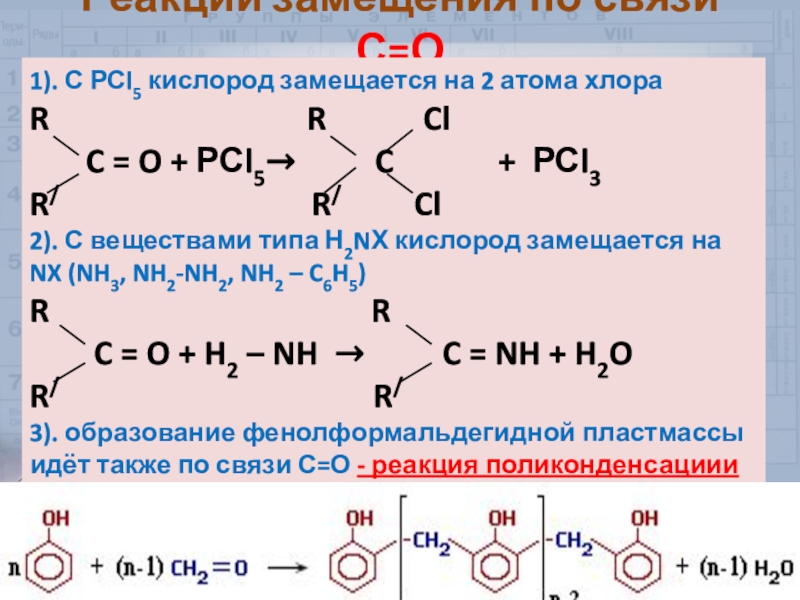
Слайд 32Реакции замещения по связи С=О
1). С РСl5 кислород замещается на
2 атома хлора
R
R ClC = O + РСl5→ C + РСl3
R/ R/ Cl
2). С веществами типа Н2NХ кислород замещается на NX (NH3, NH2-NH2, NH2 – C6H5)
R R
C = O + H2 – NH → C = NH + H2O
R/ R/
3). образование фенолформальдегидной пластмассы идёт также по связи С=О - реакция поликонденсациии
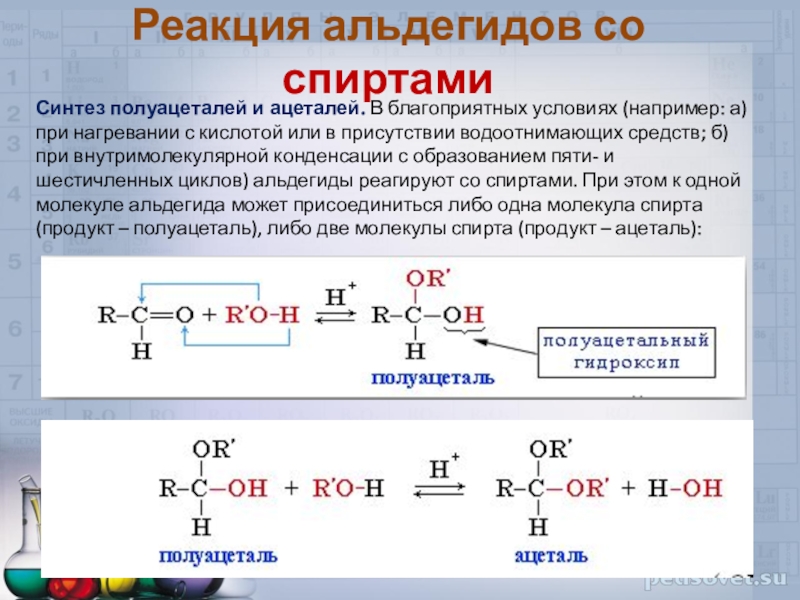
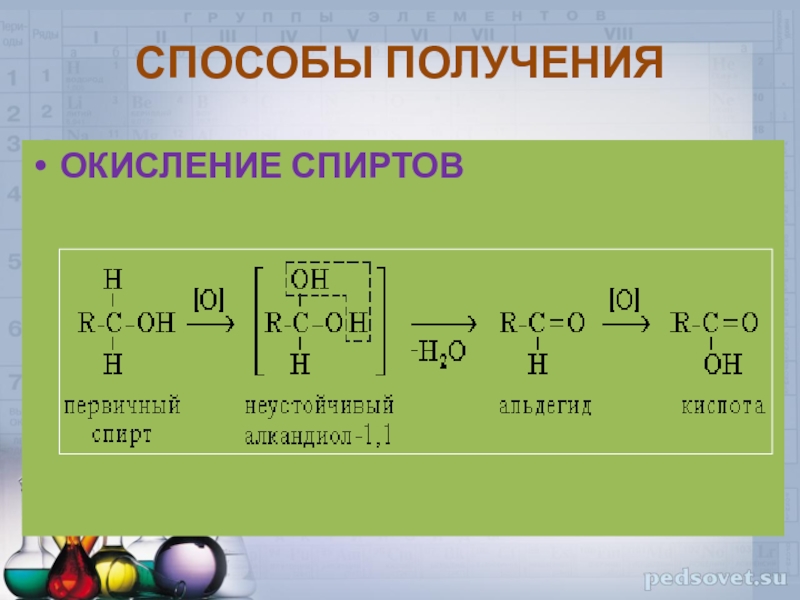
Слайд 33Реакция альдегидов со спиртами
Синтез полуацеталей и ацеталей. В благоприятных
условиях (например: а) при нагревании с кислотой или в присутствии
водоотнимающих средств; б) при внутримолекулярной конденсации с образованием пяти- и шестичленных циклов) альдегиды реагируют со спиртами. При этом к одной молекуле альдегида может присоединиться либо одна молекула спирта (продукт – полуацеталь), либо две молекулы спирта (продукт – ацеталь):Слайд 34СПОСОБЫ ПОЛУЧЕНИЯ
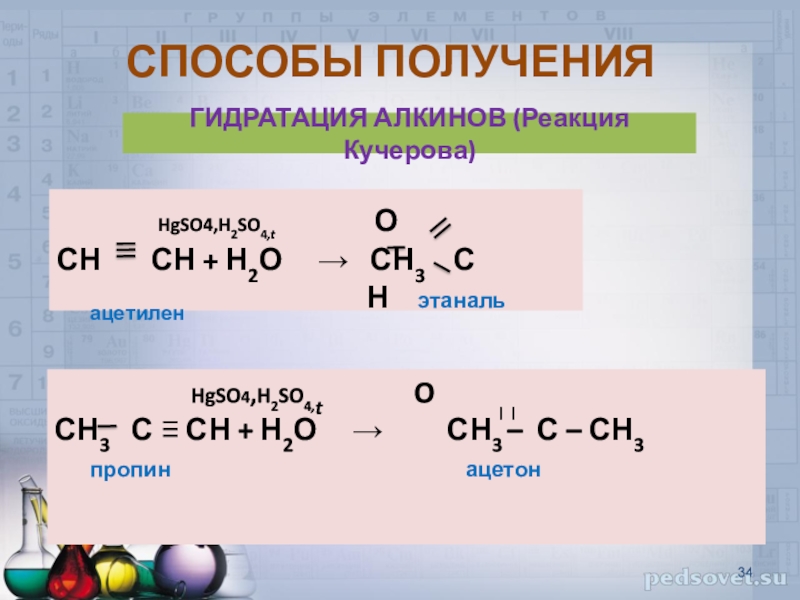
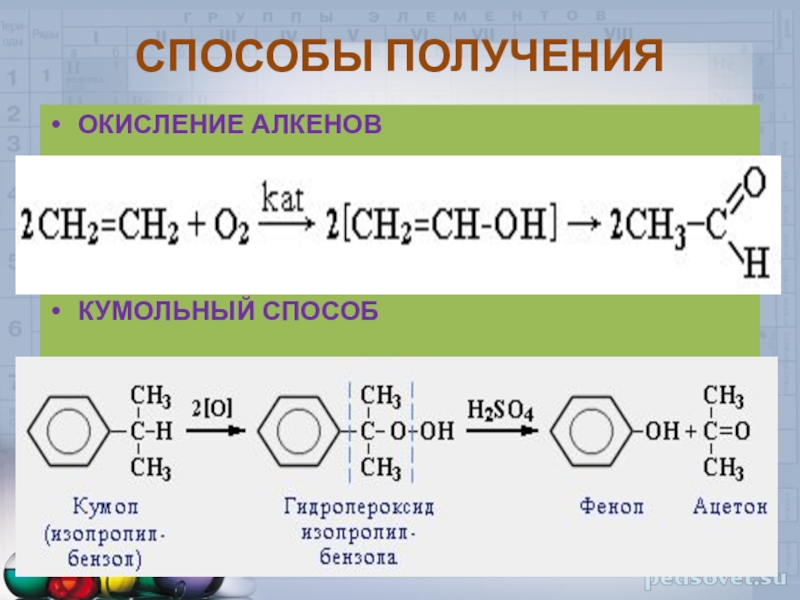
ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)
HgSO4,H2SO4,t
О
СН СН +
Н2О → СН3 Сацетилен Н этаналь
HgSO4,H2SO4,t O
СН3 С ≡ СН + Н2О → СН3 – С – СН3
пропин ацетон
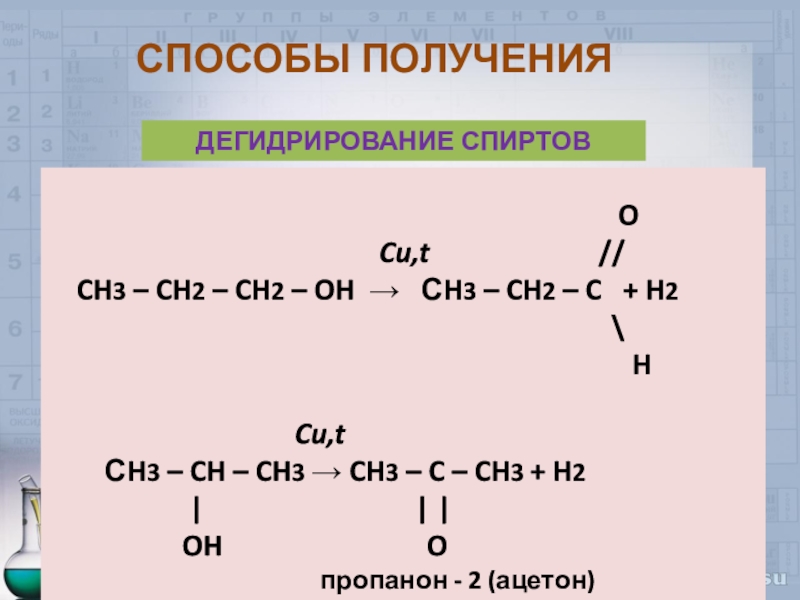
Слайд 35СПОСОБЫ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ СПИРТОВ
O
Cu,t //
CH3 – CH2 – CH2 – OH СH3 – CH2 – C + H2
\
H
Cu,t
СH3 – CH – CH3 CH3 – C – CH3 + H2
| | |
OH O
пропанон - 2 (ацетон)
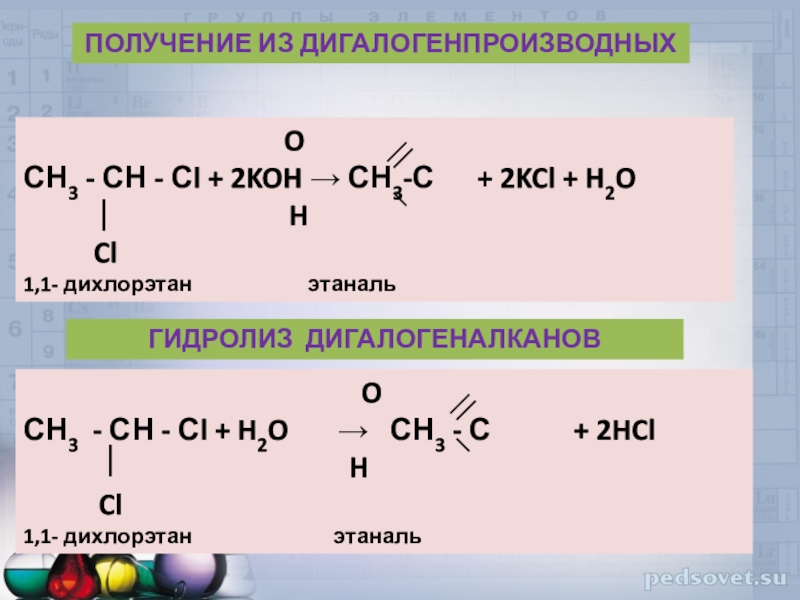
Слайд 38
O
СН3 - СН - Сl + 2KOH → СН3-С
+ 2KCl + H2OH
Cl
1,1- дихлорэтан этаналь
ПОЛУЧЕНИЕ ИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ
O
СН3 - СН - Сl + H2O → СН3 - С + 2HCl
H
Cl
1,1- дихлорэтан этаналь
ГИДРОЛИЗ ДИГАЛОГЕНАЛКАНОВ
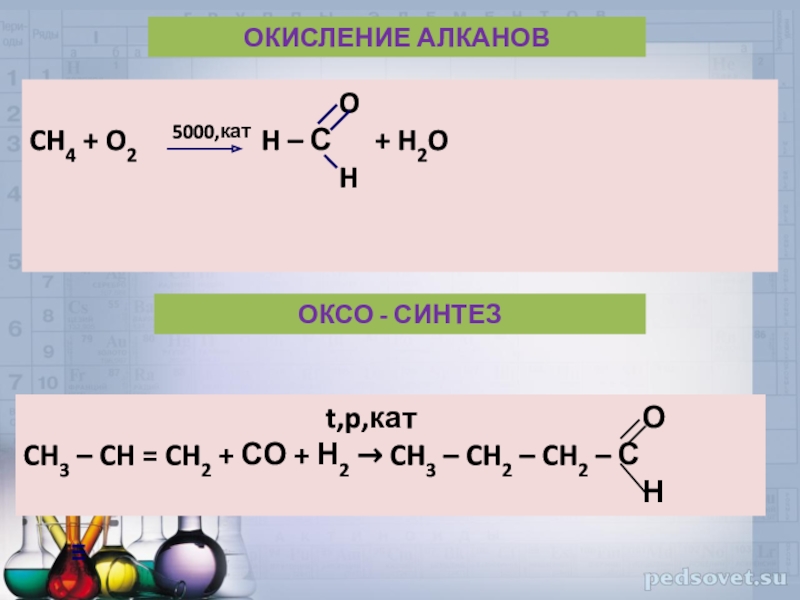
Слайд 39
O
CH4 + O2 5000,кат H – С + H2O
H
ОКИСЛЕНИЕ АЛКАНОВ
ОКСО - СИНТЕЗ
t,p,кат О
CH3 – CH = CH2 + СО + Н2 → CH3 – CH2 – CH2 – С
Н
Слайд 41ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
Парфюмерия
Альдегид анисовый, обепин – жидкость с приятным запахом мимозы
Альдегид
дециловый, деканаль – при разбавлении появляются нотки запаха апельсиновой корки
Слайд 44Контрольные вопросы
Найдите формулу альдегида:
2. Исключите лишнее вещество в ряду:
3.
Какая функциональная группа называется карбонильной?
4. Атом углерода в альдегидной группе
находится в состоянии гибридизации:а) sp б) sp2 в) sp3 г) не гибридизован
5. Назовите вещества с формулой
а) 2-метилбутанон-3, б) 3-метилбутанон-2,
в) 3-метилбутаналь, г) 1,2-диметилпентаналь
Слайд 456. Укажите формулу 2,3-диметилпентаналя:
7. Общая формула гомологического ряда предельных альдегидов:
а) CnH2nO б) CnH2n+2O
в) CnH2n-2O г) CnH2nO28. Укажите формулу 4,4-диметилпентанона-2:
Слайд 469. Гидратацией какого алкина можно получить альдегид? Напишите уравнение реакции,
укажите условия её проведения.
а) этина
б) пропинав) бутина г) изобутина
10. Нагреваем соли ацетата кальция можно получить:
а) метаналь б) этаналь в) пропаналь г) пропанон
11. Какие признаки верно отражают физические свойства метаналя: 1) бесцветная жидкость, 2) газообразное вещество, 3) имеется характерный запах, 4) плохо растворим в воде, 5) молекула полярная.
а) 1, 3, 4 б) 2, 3, 5 в) 3, 4, 5 г) 2, 4, 5
12. Какая из реакций носит имя М. Г. Кучерова.
а) гидратация ацетилена б) тримеризация ацетилена
в) гидрирование ацетилена г) бромирование ацетилена












![АЛЬДЕГИДЫ И КЕТОНЫ Альдегиды довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: Альдегиды довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: КМnO4, K2Cr2O7, [Ag(NH3)2OH], Cu(OH)2. Все реакции](/img/tmb/7/610341/756c51ed1178bc0ea57a9d404e5989e5-800x.jpg)


![АЛЬДЕГИДЫ И КЕТОНЫ Допишите ОВРHCOH + KMnO4(изб) + H2SO4 →HCOH + [Ag(NH3)2OH] →HCOH + Cu(OH)2 → Допишите ОВРHCOH + KMnO4(изб) + H2SO4 →HCOH + [Ag(NH3)2OH] →HCOH + Cu(OH)2 →](/img/tmb/7/610341/fcf5b3305f69abd7f688ec38fb96edb1-800x.jpg)