Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкины
Содержание
- 1. Алкины
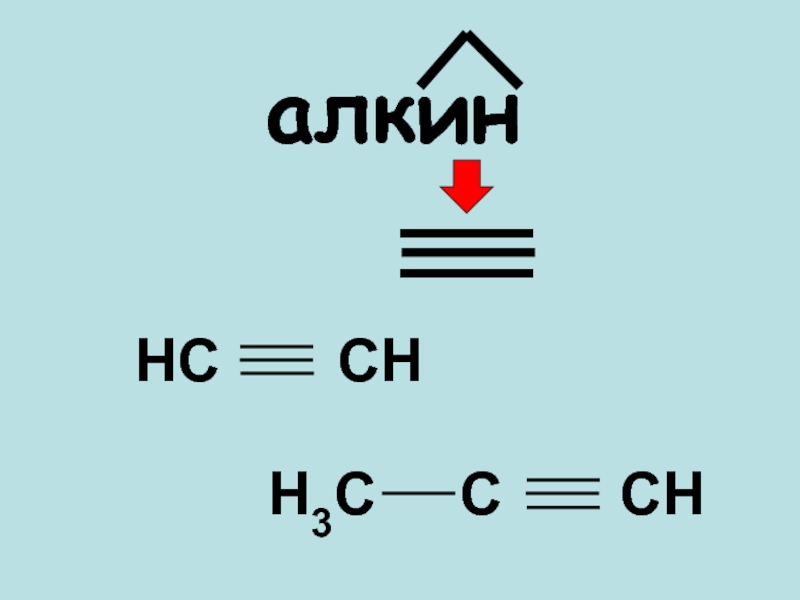
- 2. алкинНС СНН3С С СН
- 3. Общая формула алкиновCnH2n-2
- 4. АЛКИНЫАлки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода. CnH2n-2
- 5. Дайте названия углеводородам:НС СНН3С
- 6. Строение алкинов
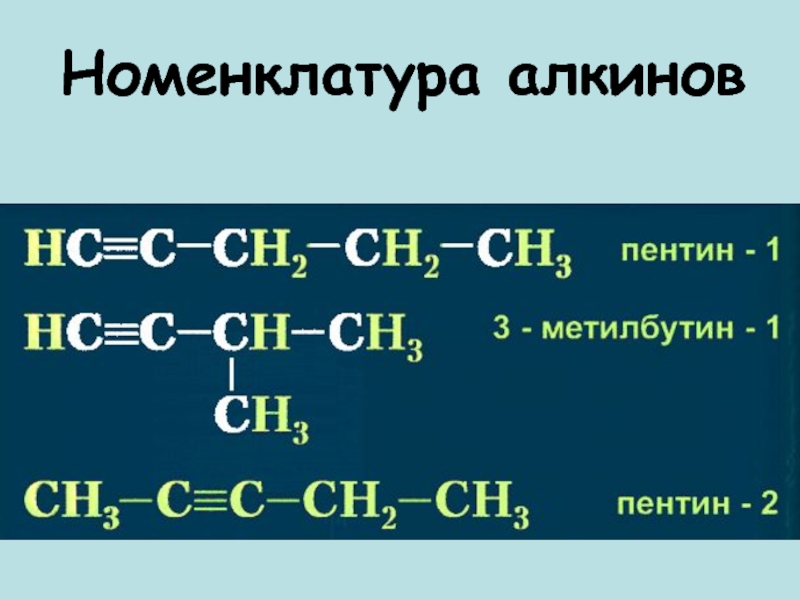
- 7. Формулы и названия алкинов.
- 8. Номенклатура алкинов
- 9. ИЗОМЕРИЯ АЛКИНОВ. Изомерия положения тройной связи
- 10. ПОЛУЧЕНИЕ.1) В промышленноси ацетилен получают высокотемпературным пиролизом метана.
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА.При обычных условиях алкиныС2Н2-С4Н6 – газы,
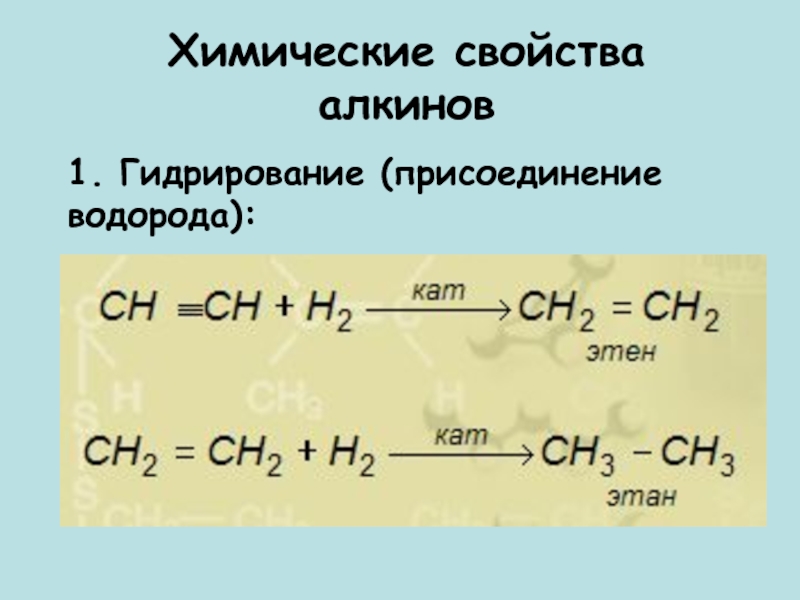
- 12. Химические свойства алкинов1. Гидрирование (присоединение водорода):
- 13. 2. Гидрогалогенирование (присоединение галогенводородов):
- 14. 3. Реакция полимеризации (тримеризации): Реакция Зелинского
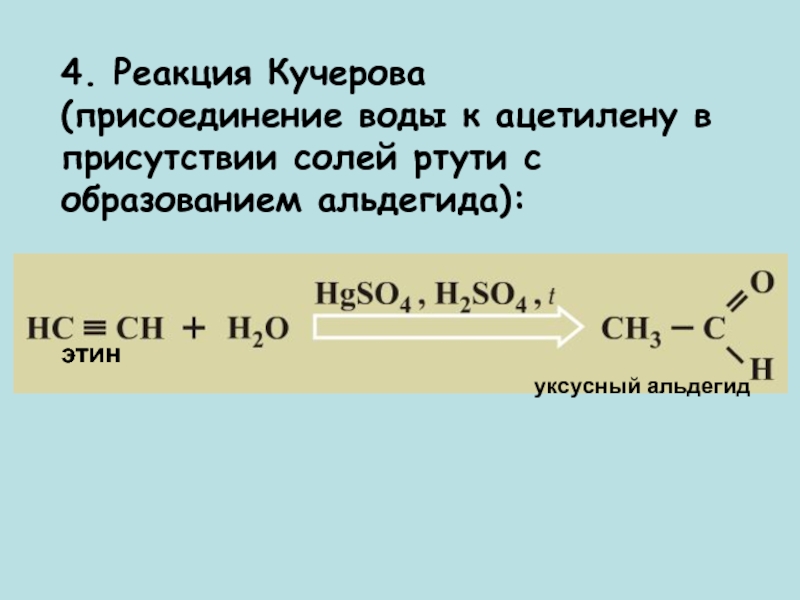
- 15. 4. Реакция Кучерова
- 16. Кислотные свойства. 6) Водородные атомы
- 17. Окисление. 7) Горение. 2СН≡ СН +
- 18. Слайд 18
- 19. ПРИМЕНЕНИЕ.Создание высокотемпературного пламени при газовой сварке, применение
- 20. Выводы:Углеводороды с общей формулой СnH2n-2,
- 21. Слайд 21
- 22. Скачать презентанцию
алкинНС СНН3С С СН
Слайды и текст этой презентации
Слайд 4АЛКИНЫ
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между
атомами углерода.
CnH2n-2
Слайд 9ИЗОМЕРИЯ АЛКИНОВ.
Изомерия положения тройной связи (начиная с С4Н6):
Изомерия углеродного скелета ( с С5Н8):
Межклассовая
изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:Слайд 10ПОЛУЧЕНИЕ.
1) В промышленноси ацетилен получают высокотемпературным пиролизом метана.
1500ºС
2CH4 → HC≡CH + 3H2
2) Дегидрирование алканов
CH3 – CH3 (Ni, t)↔ 2H2 + CH ≡ CH
3) Ацетилен получают карбидным способом при разложении карбида кальция водой.
CaC2 + 2H2O → Ca(OH)2 + HC≡CH
Слайд 11ФИЗИЧЕСКИЕ СВОЙСТВА.
При обычных условиях алкины
С2Н2-С4Н6 – газы,
С5Н8-С16Н30 – жидкости,
с С17Н32 – твердые вещества.
имеют более высокие температуры кипения,
чем аналоги в алкенах. плохо растворимы в воде, лучше — в органических растворителях.
Слайд 154. Реакция Кучерова (присоединение воды
к ацетилену в присутствии солей ртути с образованием альдегида):
этин
уксусный
альдегидСлайд 16 Кислотные свойства.
6) Водородные атомы ацетилена способны
замещаться металлами с образованием ацетиленидов. Так, при действии на ацетилен
металлического натрия или амида натрия образуется ацетиленид натрия.HC≡CH + 2Na → NaC≡CNa + H2
Ацетилениды серебра и меди получают взаимодействием с аммиачными растворами соответственно оксида серебра и хлорида меди. HC≡CH + Ag2O → AgC≡CAg↓+ H2O
(аммиачный р-р)
HC≡CH + CuCl2 → CuC≡CCu↓+ 2HCl
(аммиачный р-р)
Слайд 17Окисление.
7) Горение.
2СН≡ СН + 4O2 →CO2 +
2H2O + 3C↓ Так как много углерода в молекулах алкинов, они
горят коптящим пламенем. При вдувании кислорода - светятся, t = 2500ºC.2C2H2 + 5O2 → 4CO2 + 2H2O +Q
8) В присутствии перманганата калия ацетилен легко окисляется в до щавелевой кислоты (обесцвечивание раствора KMnO4 является качественной реакцией на наличие тройной связи).
3C2H2 + 8KMnO4 + 4H2O → 3HOOC-COOH + +8MnO2 + 8KOH
Слайд 19ПРИМЕНЕНИЕ.
Создание высокотемпературного пламени при газовой сварке, применение для целей органического
синтеза.
Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан а
отщеплением от последнего молекулы хлороводорода — 1,1,2-трихлорэтен. Оба этих вещества являются весьма ценными и широко применяемыми растворителями.Полимеры. Из ацетилена получают, в частности, поливинилхлорид, который очень широко применяется в промышленности и в быту.
Слайд 20Выводы:
Углеводороды с общей формулой СnH2n-2,
в молекулах которых имеется одна тройная
связь, называются алкинами.Наиболее характерной реакцией для алкинов является реакция присоединения.
Присоединение воды к ацетилену в присутствии солей ртути приводит к образованию альдегида и называется реакцией Кучерова.
Алкины применяются для синтеза галогенпроизводных, широко используются как растворители и для получения полимеров.
Теги