Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алюминий
Содержание
- 1. Алюминий
- 2. Al13Алюминий (лат. Aluminium) 38226,98153s2 3p1
- 3. Al13Алюминий Был впервые получен датским физиком Х.К.
- 4. Al13Алюминий (лат. Aluminium) 38226,98153s2 3p1Порядковый номер. Химический элемент III группы главной подгруппы 3-го периода.
- 5. Al13Алюминий (лат. Aluminium) 38226,98153s2 3p1Атомная масса элемента
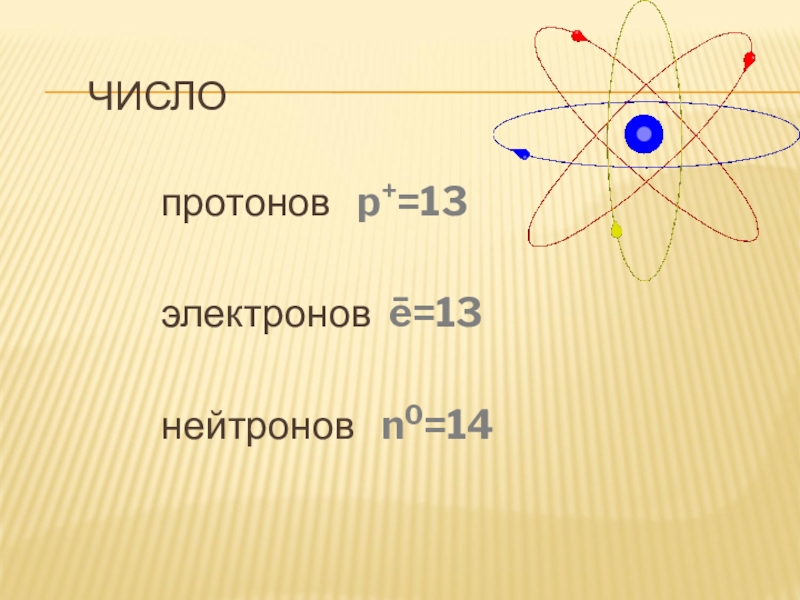
- 6. Числопротонов p+=13электронов ē=13 нейтронов n0=14
- 7. Изотопы алюминия В природе представлен лишь один стабильный
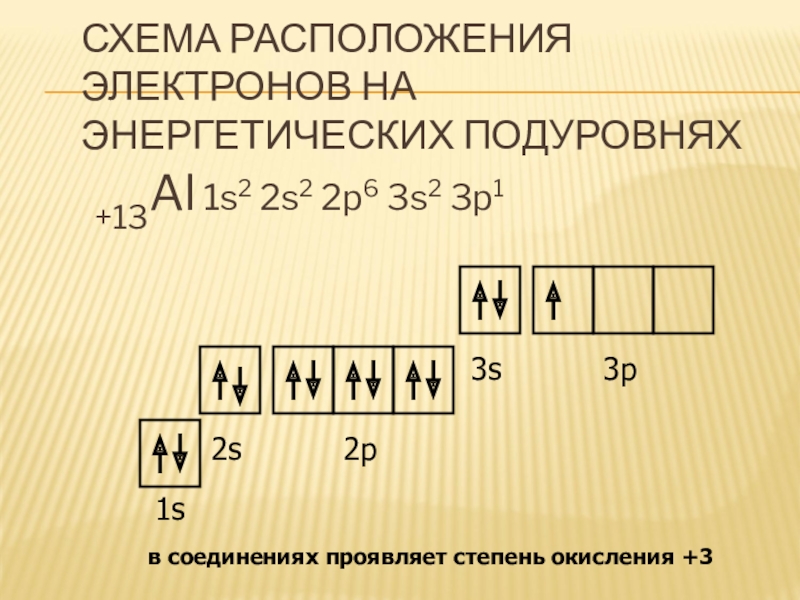
- 8. Схема расположения электронов на энергетических подуровнях+13Al 1s2
- 9. Al – типичный металлСхема образования вещества
- 10. Физические свойства вещества Al – серебристо-белый металл, пластичный,
- 11. Химические свойства вещества Al активный металл восстанавливает
- 12. Алюминий реагирует: 1. 2Al+3O2 =
- 13. Получение веществаАлюминий получают электролизом раствора глинозема в
- 14. Применение Al
- 15. Ряд факторов применения алюминия:Алюминий – самый распространенный
- 16. Оксид алюминия Al2О3:Очень твердый (корунд, рубин) порошок
- 17. Гидроксид алюминия Al(ОН)3:Белый нерастворимый в воде порошок.Проявляет
- 18. Презентацию приготовил Владислав Ларушкин
- 19. Скачать презентанцию
Al13Алюминий (лат. Aluminium) 38226,98153s2 3p1
Слайды и текст этой презентации
Слайд 4Al
13
Алюминий
(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Порядковый номер. Химический элемент III группы главной
подгруппы 3-го периода.
Слайд 7Изотопы алюминия
В природе представлен лишь один стабильный изотоп 27Al. Искусственно
получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий 26Al имеет период
полураспада 720 тысяч лет.Слайд 8Схема расположения электронов на энергетических подуровнях
+13Al 1s2 2s2 2p6 3s2
3p1
1s
2s
2p
3s
3p
в соединениях проявляет степень окисления +3
Слайд 9Al – типичный металл
Схема образования вещества
Al 0-
3ē Al+3
Тип химической связи -металлическая
Тип кристаллической решетки – кубическая
гранецентрированная Слайд 10Физические свойства вещества
Al – серебристо-белый металл, пластичный, легкий, хорошо проводит
тепло и электрический ток, обладает хорошей ковкостью, легко поддаётся обработке,
образует лёгкие и прочные сплавы.=2,7 г/см3
tпл.=6600С
Слайд 11Химические свойства вещества
Al активный металл восстанавливает все элементы, находящиеся
справа от него в электрохимическом ряду напряжения металлов, простые вещества
– неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой Al2 O3Слайд 12Алюминий реагирует:
1. 2Al+3O2 = 2Al2O3 + O –
покрывается пленкой оксида, но в мелкораздроблен-ном виде горит с выделением
большого количества теплоты.2. 2Al + 3Cl2 = 2 AlCl3 (Br2, I3) – на холоду
3. 2Al + 3S = Al2S3 - при нагревании
4. 4Al + 3С = Al4С3 - при нагревании
5. Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и другие, например:
3Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 13Получение вещества
Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6),
электролизом расплава AlCl3 (расходуется около 16 кВт·час на 1 кг
Al)Электролиз: Al2O3 при 9500С в расплаве криолита: На катоде: Al3+ + 3e = Al0
На угольном аноде (расходуется в процессе электролиза):
O2- - 2e = 00;
C + O = CO;
2CO + O2 = 2CO2;
Слайд 15Ряд факторов применения алюминия:
Алюминий – самый распространенный металл земной коры.
Его ресурсы практически неисчерпаемы.
Обладает высокой коррозионной стойкостью и практически не
нуждается в специальной защите.Высокая химическая активность алюминия используется в алюминотермии.
Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроений и способствует расширению его применения в наземном и водном транспорте, а также в строительстве.
Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.
Слайд 16Оксид алюминия Al2О3:
Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий
- 20500С. Не растворяется в воде.
Амфотерный оксид, взаимодействует:
а) с кислотами
Al2O3 + 6H+ = 2Al3+ + 3H2Oб) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O
Слайд 17Гидроксид алюминия Al(ОН)3:
Белый нерастворимый в воде порошок.
Проявляет амфотерные свойства, взаимодействует:
а)
с кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O
б)
со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2OРазлагается при нагревании 2Al (OH)3 = Al2O3 + 3H2O
Образуется:
а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка)
Al3+ + 3OH- = Al (OH)3
б) при взаимодействии алюминатов с кислотами (без избытка)
AlO-2 + H+ + H2O = Al (OH)3