Слайд 1Аналитическая
химия
«Качественный
анализ»
Слайд 2Задачи:
1. Сформировать знания о методах качественного анализа.
2. Выявить различные подходы
к качественному анализу.
3. Познакомить с реакциями, используемыми в качественном анализе
и требованиями к ним.
4. Сформировать навыки по определению открываемого минимума предельного разбавления, предельной концентрации, предельного отношения.
5. Рассмотреть сульфидную классификацию катионов.
6. Рассмотреть кислотно-основную классификацию катионов, групповую характеристику.
7. Рассмотреть классификацию анионов.
Слайд 3План.
1. Классификация методов качественного анализа.
2. Систематический и дробный анализы.
3. Типы
химических реакций, используемых в качественном анализе.
4. Требования к аналитическим реакциям.
5.
Классификация ионов.
Слайд 4Предмет качественного анализа: развитие теоретических основ, усовершенствование существующих, разработка новых,
более совершенных методов определения элементарного состава веществ.
Слайд 5Задачи КА:
определение «качества» веществ или обнаружение отдельных элементов или
ионов, входящих в состав исследуемого соединения.
Слайд 6Методы КА:
Химические
Физические
Физико-химические
Слайд 7По технике выполнения микроанализ может быть:
А) микрокристаллоскопическим:
CaCO3 +H2SO→CaSO4↓+H2O+CO2
Под
микроскопом смотрят игольчатые кристаллы CaSO4. Реакцию проводят на предметном стекле.
Слайд 8Б) капельный метод.
Реакции выполняют с каплями растворов и реагентов,
обладающих высокой чувствительностью.
Реакцию проводят на фарфоровой пластинке, предметном стекле,
часовом стекле или на фильтровальной бумаге.
Слайд 9По агрегатному состоянию объекта и получаемого вещества:
Пирохимический – нагревание исследуемого
вещества в пламени газовой горелки.
А) Образование окрашенных перлов (стекол):
Соли и
оксиды металлов при нагревании растворяют в расплавленном тетрабрате натрия Na2 B4 O7·10H2O. Образуются перлы (стекла) характерной окраски.
Сr – изумрудно-зеленые перлы;
Со – интенсивно синие;
Mg – фиолето-аметистовые;
Fe – желто – бурые;
Ni – красно – бурые;
Слайд 10 Б) Окрашивание пламени. Летучие соли многих металлов при внесении
их в бесцветную часть пламени окрашивают пламя в характерный цвет.
Слайд 12Анализ методом растирания
(Ф.М. Флавицкий 1898 г)
Твердое исследуемое вещество
растирают в фарфоровой ступке с равным количеством твердого реагента.
По
окраске полученного соединения судят о наличии искомого иона.
CоCl2+2NH4SCN→(NH4)2[Cо(SCN)4]+2NH4Cl
роданид синяя соль тетрародано – аммония (II)- кобольтата аммония
CH3COONa+NaHSO4→Na2SO4+CH3COOH
запах уксусной
кислоты
Слайд 132.Систематический и дробный анализы.
Систематический анализ основан на последовательном открытии и
удалении ионов, которых мешают дальнейшему определению.
Для удаления ионов используют
групповые или специфические реактивы.
Слайд 14Сисmемаmическим ходом анализа - называется определенная последовательность выполнения аналитических реакций,
при которой каждый ион обнаруживают после того, как будут обнаружены
и удалены другие ионы, мешающие его обнаружению.
Слайд 15Пример: раствор Ba2++Ca2+
Ca2+ + Na2CO3 =CaCO3↓+2Na+
белый осадок
ионы обнаружить
нельзя, т.к. сходные аналитические признаки
Слайд 16Ba2++Na2CO3=BaCO3↓ +2Na+
белый осадок
Ba2++K2CrO4→BaCrO4+2K+
желтый осадок
отделив Ba2+ от Ca2+ в виде желтого соединения BaCrO4 можно обнаружить Ca2+ действием
Ca2++2K2CrO4→
Слайд 17Дробным анализом - называют обнаружение ионов с помощью специфических реакций
в отдельных порциях анализируемого раствора, производимое в любой последовательности.
Слайд 18Дробный метод анализа.
Основоположником дробного метода анализа, применяемого в современной
аналитической химии, является советский учёный Н. А.Тананаев.
Благодаря
этому методу, отпадает необходимость выделения исследуемых ионов из растворов.
Слайд 19Для обнаружения соответствующих ионов дробным методом необходимо применять специфические реактивы,
позволяющие обнаружить искомый ион в присутствии посторонних ионов.
Слайд 20Маскировкой - называется процесс устранения влияния мешающих ионов, находящихся в
сложной смеси, на обнаружение искомых ионов.
Слайд 21Демаскировкой ионов - называют процесс освобождения ранее замаскированных ионов от
маскирующих реактивов.
Слайд 22Дробный анализ основан на применении специфических реакций, при помощи которых
можно в любой последовательности обнаружить определяемые ионы.
При дробном ходе анализа
для каждого определения берут отдельную пробу:
Слайд 23Пример: K+ + Na+ + NH4+
NaHC4H4O6 + K+→KHC4H4O6↓ + Na+
гидротартрат
белый
натрия кристаллический
анализ
KH2SbO4 + Na+→NаH2SbO4↓ +K+
дигидро- белый
антимонат кристаллический
калия осадок
Слайд 24Групповые- реакции, аналитический эффект которых характерен для определенной группы ионов.
Применяемый реактив – групповой.
Слайд 25Пример, 2-я аналитическая группа катионов (HCl)
AgNO3 + HCl → AgCl↓
+ HNO3
Pb(NO3)2 +2HCl→PbCl2↓ + HNO3
белый творожистый осадок
Hg2(BO3)2 + 2HCl→Hg2Cl2↓+HNO3 NH4++2K2[HgJ4]+4KOH→[OHg2NH2]J↓+8K++H2O
реактив красно-бурый Несслера осадок
Слайд 26Требования к групповому реактиву:
- должен осаждать все анионы группы
-
осадок должен растворяться в кислотах для продолжения анализа
- избыток реагента
не должен мешать дальнейшему анализу.
Слайд 273.Селективные (избирательные) – реакции, которые позволяют в смеси ионов обнаружить
ограниченное количество ионов.
Применяемый реагент – селективный.
Слайд 28Fe3++6NH4SCN→(NH4)3[Fe(SCN)6]+3NH4+ роданид гексороданоферрат – (III)
аммония
аммония, красного цвета
Сo2++4NH4SCN→(NH4)2[Co(SCN)4]+2NH4+
тетрородано (II)кобальт аммония,
ярко-синего цвета
Слайд 294.Специфические – реакции, аналитический эффект которых характерен только для одного
иона. Применяемый реагент – специфический, используется в дробном ходе
to
анализа.NH4Cl + KOH→NH3↑+KCl+H2O
запах аммиака, лакмусовая бумажка синеет.
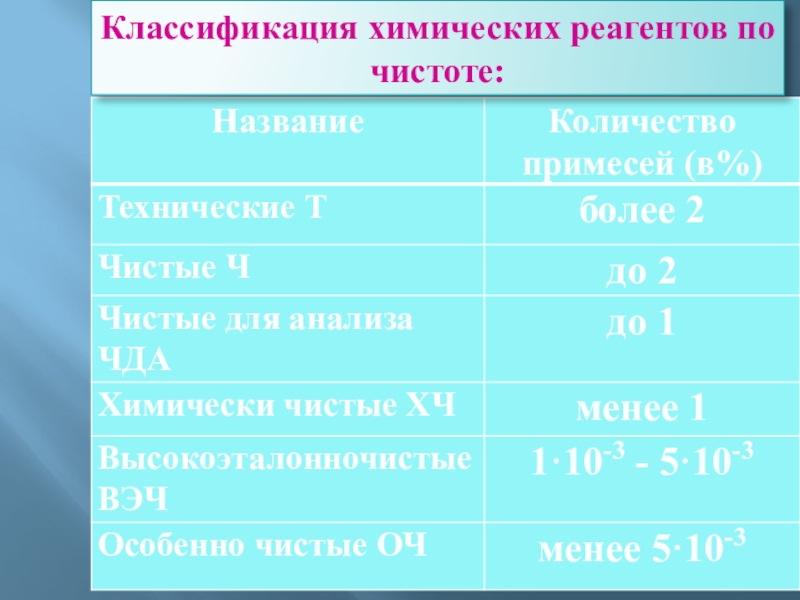
Слайд 30Классификация химических реагентов по чистоте:
Слайд 314.Требования к химическим реакциям, применяемым в аналитической химии:
Реакция должна сопровождаться
аналитическим признаком.
К аналитическим признакам относятся:
А) образование или растворение осадка
с определенными свойствами (цвет, растворимость в определенных растворителях, форма кристаллов.
Слайд 32AgCl – белый творожистый осадок;
MnS – осадок телесного цвета; CaSO4·2H2O
– игольчатые кристаллы.
H2O
Zn3(PO4)2+2NH4OH → [Zn(NH4)2](PO4)2 + 2Zn(OH)2 различная растворимость осадков в NH3
H2O
AlPO4 + NH4OH →
Слайд 33Б) получение при действии окрашенного растворимого соединения.
2Mn(NO3)2 + 5PbO2 +
6HNO3→2HMnO4 +5Pb(NO3)2 + 2 H2O
малиновый раствор
CuCl2 + 4NH3→[Cu(NH3)4]Cl2
дихлорид тетроамин
меди (II)
В) выделение газа с известными свойствами:
Слайд 342.аналитический признак должен определяться визуально или инструментально.
Условия протекания реакций:
Определенное значение
pH среды. Осадки, которые растворимы в кислотах не будут выпадать
при избытке свободной кислоты.
Слайд 35Температура.
Осадки, растворимость которых повышается с увеличением температуры не образуются
в нагретом растворе, их следует получать на холоде.
Концентрация ионов.
Необходима
определенная концентрация ионов, при которой осадки будут выпадать.
Слайд 36Те реакции, для которых необходимы очень малые концентрации определяемого иона
и реагента – высокочувствительные.
Реакции, для протекания которых требуется большая концентрация
определяемого иона и реагента – низкочувствительные.
Чувствительность реакции – это то наименьшее количество вещества или иона, которое можно открыть с помощью данного реагента.
Слайд 37Количественные характеристики чувствительности реакций:
Открываемый минимум (m) – наименьшее количество вещества
(иона), которое при определенных условиях можно открыть действием данного реагента.
Выражают в мкг
Слайд 41Реакция тем чувствительней, чем меньшую концентрацию определяемых ионов она открывает.
Таким
образом, аналитические реакции тем чувствительнее, чем ниже значение открываемого минимума
и выше значение предельного разбавления.
Слайд 42Cu2+ + 3HCl=H[CuCl3]+2H2 m = 1мкг V
пред зеленый
=50000мг
Cu2+ +4NH3=[Cu(NH3)4]2+ m= 0?2 мкг V (чувствительность) пред = 250000 мг
cиний
2 Cu2+ +[Fe(CN6) 3+= Cu2[Fe(CN)6] m =0,02мкг коричневый V пред =2500000мг
Слайд 44можно еще обнаружить ион в данной реакции.
Возможно ли открытие катионов
Mn 2+ в присутствии катионов Cr3+ равна 30 мкг, а
ПО равняется 0,025
(при концентрации Cr3+ равной 20 мкг).
Слайд 46Аналитическая классификация ионов.
В основу классификации ионов в аналитической химии положено
различие в растворимости образуемых ими солей и гидроксидов, позволяющее отделять
(или отличать) одни группы ионов от других.
Слайд 47Существуют разные системы группового разделения катионов: сероводородная, кислотно-основная, аммиачно-фосфатная, тиоацетамидная
и др. Наибольшее распространение получили сульфидная и кислотно-основная классификации.
Сульфидная классификация
основана на различной растворимости в воде сульфидов, хлоридов, карбонатов и гидроксидов.
Слайд 48Недостатки:
- растворимость сульфидов катионов III и II групп близка, поэтому
разделение катионов неполное.
- соосаждение катионов III и IV групп, что
приводит к частичной потере соосаждающихся катионов.
- неточность в определении катионов I группы
- полный анализ требует много времени (25-30ч)
- ядовитость H2S
Слайд 49Таблица 1. Сульфидная классификация катионов
Слайд 50Кислотно-основный метод анализа катионов основан на различной растворимости в воде
хлоридов, сульфатов и гидроксидов, а также растворимости последних в избытке
раствора гидроксида натрия или в водном растворе аммиака.
Соляная и серная кислоты, раствор NаОН и водный раствор аммиака являются групповыми реагентами. В этом методе классификации катионы делят на шесть групп.
Слайд 51Достоинства классификации: используются основные свойства катионов, группы катионов практически полностью
соответствуют группам периодической системы элементов Д.И. Менделеева, быстрота выполнения анализов,
широкое применение систематического и дробного хода анализа.
Слайд 52Недостатки:
включает не все известные элементы, недостаточно отражены свойства гидроксидов
катионов 4 и 5 групп, условия их осаждения.
Слайд 53Таблица 2 . Кислотно-основная классификация катионов
Слайд 54Аналитическая классификация анионов.
Анионы- это отрицательно заряженные ионы, состоящие из отдельных
атомов или групп атомов различных элементов. Эти частицы могут нести
один или несколько отрицательных зарядов. Общепринятой классификации анионов не существует. Наиболее часто применяется классификация, по которой все анионы делятся на три аналитические группы в зависимости от растворимости их бариевых и серебряных солей.
Слайд 55Вопросы для самоподготовки:
1. Классификация методов качественного анализа.
2. Систематический и дробный
анализы.
3. Типы химических реакций, используемых в качественном анализе.
4. Требования к
аналитическим реакциям.
5. Классификация ионов.
Слайд 56План:
1. Катионы 1аналитической группы.
2. Катионы 2 аналитической группы.
3. Применение катионов
1 и 2 аналитических групп в медицине
Слайд 57Общая характеристика группы.
К первой аналитической группе относятся катионы К+,
Na+, NH4+.
Калий и натрий входят в первую группу периодической
системы химических элементов Д.И.Менделеева и обладают ярко выраженными металлическими свойствами. Их ионы имеют законченные восьми электронные оболочки.
Слайд 58Большинство солей калия, натрия, аммония и их гидроксиды хорошо растворимы
в воде. Гидроксиды калия и натрия- сильные щелочи, которые в
водных растворах полностью ионизированы.
Соли калия и натрия, образованные слабыми кислотами, подвергаются гидролизу, и растворы их имеют рН>7.
Их соли, образованные сильными кислотами, не подвергаются гидролизу, их растворы имеют нейтральную реакцию.
Раствор аммиака в воде - слабое основание. Соли, образованные им и сильными кислотами, подвергаются гидролизу, и растворы их имеют рН< 7.
Соли аммония разлагаются при нагревании, поэтому могут быть удалены прокаливанием.
Большинство солей катионов первой аналитической группы хорошо растворимы в воде.
Группового реагента, осаждающего все катионы группы, не имеется.
Слайд 59ЧАСТНЫЕ РЕАКЦИИ КАТИОНА К+
1.Гидротартрат натрия или винная кислота дает с
растворами солей калия белый кристаллический осадок:
KCl+ NaHC4H4O6= KHC4H4O6+ NaCl
Осадок растворяется
при добавлении растворов сильных кислот и щелочей, разбавлении дистиллированной водой и при нагревании.
Слайд 602.Гексанитро- (111) кобальтат натрия дает с катионами К+ желтый осадок
комплексной соли гексанитро – (111) кобальтата калия – натрия
2KCl +
Na3[Co(NO2)6]→2NaCl + K2Na[Co(NO2 )6]↓
Осадок растворим в сильных кислотах. Присутствие щелочей мешает реакции, так как щелочи, разлагая реактив, образуют темно бурый осадок гидроксида кобальта Со(ОН)3.
Слайд 613.Микрокристаллоскопическая реакция. Гексанитро–(11) купрат натрия-свинца с катионами калия образует кубические
кристаллы черного или коричневого цвета:
Na2Pb[Cu(NO2 )6 ]+2KCl = K2
Pb[Cu(NO2 )6 ] ↓ + 2NaCl
Реакцию проводят при рН6- 7.
Этой реакции мешают ионы аммония, т. к. они образуют с реактивом черные кристаллы, как и катионы К+.
4.Окрашивание пламени.
В присутствии катионов К+ бесцветная часть пламени окрасится в бледно-фиолетовый цвет.
Все реакции фармакопейны.
Слайд 62ЧАСТНЫЕ РЕАКЦИИ КАТИОНА Na+
1.Дигидроантимонат калия образует с катионами натрия белый
кристаллический осадок дигидроантимоната натрия:
NaCl+KH2SbO2=NaH2SbO4+KCl
Концентрация раствора натрия должна быть достаточной, поэтому
разбавленные растворы упаривают. Среда раствора должна быть слабощелочной или нейтральной. Кислоты разлагают дигидроантимонат калия с образованием белого аморфного осадка метосурьмяной кислоты:
KH2SbO4+ HCl= H2SbO4+KCl HSbO=HSbO3+ H2O
Реакцию надо вести на холоде.
Слайд 632. Гексагидроксостибиат калия K[Sb(OH)6] образует с ионом Na белый кристаллический
осадок гексагидроксостибиата (V) натрия:
NaCl + K[Sb(OH)6] = Na[Sb(OH)6]↓ + KCl
Обнаружение
иона Na+ проводят в нейтральном или слабощелочном растворе, т.е. кислоты разлагают реагент.
Реакцию проводят на холоде, потирают стенки пробирки стеклянной палочкой.
Слайд 643.Микрокристаллоскопическая реакция.
Раствор уранилацетата UO2(CHCOO)2 с катионами натрия дает правильной тетраэдрической
или октаэдрической формы кристаллы натрийуранилацетата NaCH3COO∙UO2(CH3COO)2.
4.Окрашивание пламени.
NaCl +
UO2(CH3COO)2 + CH3COOH = Na[(UO2)(CH3COO)3] + HCl
В присутствии катионов натрия бесцветная часть пламени окрашивается в желтый цвет.
Все реакции фармакопейны.
Слайд 65ЧАСТНЫЕ РЕАКЦИИ КАТИОНА NH4 .
1.Щелочи разлагают соли аммония с выделением
газообразного аммиака:
NH4Cl+ NaOH= NH3+ H2O+NaCl
Наблюдается выделение газа, который обнаруживается по
запаху. Выделение аммиака можно обнаружить влажной лакмусовой бумажкой, которую держат над пробиркой. Она окрашивается в синий цвет. Опыт проводят при рН>9,в нагретом растворе.
Слайд 66Условия проведения опыта
При выполнении опыта необходимо брать избыток реактива Несслера,
так как осадок растворим в солях аммония.
Открытию катиона NH
мешают катионы Fe3+ , Cr3+ , Co2+ , Ni2+ и др.
В присутствии этих катионов реакцию ведут, добавляя 50% раствор тартрата калия-натрия KNaC4H4O6, который с большинством указанных катионов дает комплексные соединения.
2.Реактив Несслера образует с катионами аммония красно- бурый осадок:
NH4Cl+ 2К2 [HgI4 ] + 4КОН →[OHg2 NH2 ]I + KCI + 7KI + 3H2O
NH + 2 [HgI4 ]2+ + 4OH- → [OHg2 NH2 ]I↓ + 7I- + 3H2O
Реакция очень чувствительна.
Слайд 672.Катионы второй аналитической группы (группа хлороводородной кислоты).
Общая характеристика группы.
Ко второй
группе относятся катионы Ag+, Pb2+ и [Hg2]2+. Эти элемента находятся
в разных группах периодической системы Д. И. Менделеева.
Они имеют либо законченные 18-электронные внешние слои, либо оболочки, содержащие 18+2 электронов в двух наружных слоях, что обусловливает одинаковое отношение их к галогенид-ионам.
Слайд 68Групповой реагент – 2 н. хлороводородная кислота.
Катионы Ag+, Pb2+, [Hg2]2+
при взаимодействии с ней образуют трудно растворимые в воде и
в разбавленных кислотах осадки:
AgNO3 + HCl → AgHl↓ + HNO3
Ag + + Cl - AgCl↓
Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3
Pb2+ + 2Cl - → PbCl2↓
Hg2(NO3)2 + 2HCl → Hg2Cl2↓ + 2HNO3
+ 2Cl - → Hg2Cl2↓
следует избегать избытка и использования концентрированной хлороводородной кислоты, так как могут образоваться растворимые комплексные соединения:
AgCl + 2HCl → H2[AgCl3], PbCl2 + HCl → H[PbCl3]
Растворимость хлоридов различна
Слайд 69Хлорид ртути при взаимодействии с раствором аммиака образует хлорид димеркураммония,
который неустойчив и разлагается на малорастворимый меркурамммоний и металлическую ртуть,
которая придаёт осадку чёрный цвет:
Hg2Cl2 + 2NH4OH → [Hg2NH2]Cl↓ + NH4Cl + 2H2o
Hg2Cl2 + 2NH4OH → [Hg2NH2]Cl↓ + + Cl - + 2H2O
[Hg2NH2]Cl → [NH2Hg]Cl↓ + Hg↓
Это позволяет отделить катион [Hg2]2+ от катиона Ag+. Хлорид серебра хорошо растворим по действие аммиака с образованием комплексной соли:
AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
AgCl + 2NH4OH → [Ag(NH3)2]+ + Cl- + 2H2O
Слайд 701. Частные реакции катионов Ag+.
Гидроксиды калия и натрия КОН и
NaOH образуют с катионом Ag+ бурый осадок оксида серебра Ag2O:
AgNO3
+ KOH → AgOH↓ + KNO3
Ag+ + OH- → AgOH
2Ag OH → Ag2O↓ + H2O
Оксид серебра (I) растворяется в растворе аммиака NH3:
Ag2O + 4NH4OH → 2[Ag(NH3)2]OH + H2O
Слайд 712. Хромат калия K2CrO4 даёт с катионом Ag+ осадок хромата
серебра Ag2CrO4 кирпично-красного цвета:
K2CrO4+2AgNO3→ Ag2CrO4↓ + 2KNO3
→ Ag2CrO4↓
Осадок хромата серебра
растворяется в азотной кислоте и растворе аммиака, но не растворяется в уксусной кислоте.
Условия проведения опыта.
Реакцию следует проводить при рН 6,5-7,5.
В аммиачной и сильнокислой среде осадок не образуется.
Ионы Pb2+, Ba2+ и др., образующие с Cr осадки, мешают проведению реакции.
3. Бромид и йодид калия KBr и KI образуют с катионом Ag+ бледно-жёлтый осадок бромида серебра AgBr и жёлтый осадок йодида AgI:
KBr + AgNO3 → AgBr↓+KNO3
Ag+ + Br - → AgBr↓
KI + AgNO3 → AgI↓ + KNO3
Ag+ + I- → AgI↓
Слайд 724. Тиосульфат натрия Na2S2O3 при взаимодействии с раствором солей серебра
образует белый осадок, который быстро желтеет, затем буреет и переходит
в черный осадок сульфида серебра:
2AgNO3 + Na2S2O3 = Ag2S2O3↓ + 2NaNO3;
Ag2S2O3 + H2O = Ag2S↓ + H2SO4
Реакция ГФ.
5. Реакция «серебрянного зеркала». Фармальдегид с аммиачным раствором нитрата серебра образует осадок металлического серебра. Реакция ГФ
Слайд 731. Частные реакции катиона Pb2+.
Гидроксиды KOH и NaOH образуют с
катионом Pb2+ белый осадок Pb(OH)2, растворимый как в кислотах, так
и в концентрированных растворах гидроксидов:
Pb(NO3)2 + 2NaOH → Pb(OH)2↓ + 2NaNO3
Pb2+ + 2OH- → Pb(OH)2
При действии избытка гидроксида образуется плюмбит натрия:
Pb(OH)2 + 2NaOH → Na2PbO2 + 2H2O
2. Серная кислота и сульфаты осаждают катионы Pb2+ выпадает белый осадок PbSO4.
Pb(NO3)2 +Н2SO4= PbSO4+НNO3
При нагревании сульфатов свинца с растворами гидроксидов образуются плюмбиты:
PbSO4 + 4KOH → K2PbO2 + K2SO4 + 2H2O
PbSO4 + 4OH- → + 2H2O
Сульфат свинца растворяется также в 30% растворе ацетата аммония:
2 PbSO4 + 2CH3COO- → [Pb(CH3COO)2PbSO4] + SO
Кислоты азотная и хлороводородная повышают растворимость сульфата свинца, так как ионы H+ связываются с ионами SO с образованием аниоа HSO
PbSO4 ⇆ Pb2+ + SO HNO3 ⇆ NO H+, H+ + SO ⇆ HSO
Слайд 743. Хромат калия K2CrO4 и дихромат калия K2Cr2O7 образуют с
катионами Pb2+ малорастворимый хромат свинца жёлтого цвета:
Pb2+ + CrO →
PbCrO4
Хромат свинца растворим в гидроксидах, н нерастворим в уксусной кислоте. Реакция ГФ4. Ион I- образует с катионом Pb2+ жёлтый осадок:
Pb(NO3)2 + 2KI → PbI2 + 2KNO3
Pb2+ + 2I- → PbI2+ ↓
Осадок растворяется при нагревании, но при охлаждении вновь образуется в виде блестящих золотистых кристалликов. реакция ГФ
Слайд 75Частные реакции катиона [Hg2]2+
Растворы солей ртути (I) содержат группировку –
Hg – Hg - , при диссоциации образуют сложные катионы
[Hg2]2+,
в которых ртуть имеет степень окисления Hg+1, так как два положительных заряда приходятся в этом ионе на два атома ртути. Все соли ртути ядовиты.
Гидроксиды образуют с катионом [Hg2]2+ чёрный осадок оксида ртути (I):
Hg2(NO3)2 + 2NaOH → Hg2O↓ + 2NaNO3 + H2O
[Hg2]2+ + 2OH- → Hg2O + H2O
Раствор аммиака с катионом [Hg2]2+ образует хлорид димеркуоаммония [Hg2NH2]Cl.
Слайд 762. Хромат калия K2CrO4 даёт с катионами [Hg2]2+ красный осадок
Hg2CrO4, нерастворимый в гидроксидах и в разбавленной уксусной кислоте, но
растворяется в азотной кислоте.
Hg2(NO3)2 + K2CrO4= Hg2CrO4+ KNO3
3. Иодид калия KI образует с растворами солей ртути (I) осадок Hg2I2 грязно-зеленого цвета.
Hg22+ + 2I- → Hg2I2↓
Осадок растворяется в избытке реактива с образованием черного осадка металлической ртути.
Реакция ГФ.
Слайд 77V.Задание на дом.
Тема: Катиона 1 и 2 аналитических групп
Вопросы
для самоподготовки:
1. Частные реакции катиона калия
2. Частные реакции катиона натрия
3.
Частные реакции катиона аммония
4. Частные реакции катиона серебра
5. Частные реакции катиона свинца
6. Частные реакции катиона ртути
7. Действие группового реактива второй аналитической группы
Слайд 78Литература:
Барковский Е.В. Аналитическая химия: Учеб. Пособ. - Мн.: Высш.шк.,2004.
Харитонов Ю.
Я. Аналитическая химия (аналитика) В 2 кн. – М.: Высшая
школа., 2010
Слайд 79Задачи:
1. Сформировать знания о методах качественного анализа.
2. Выявить различные подходы
к качественному анализу.
3. Познакомить с реакциями, используемыми в качественном анализе
и требованиями к ним.
4. Сформировать навыки по определению открываемого минимума предельного разбавления, предельной концентрации, предельного отношения.
5. Рассмотреть сульфидную классификацию катионов.
6. Рассмотреть кислотно-основную классификацию катионов, групповую характеристику.
7. Рассмотреть классификацию анионов.
Слайд 80Ситуационные задачи:
1. Сколько граммов йодида калия содержится в 250 мл
0,5 М раствора этой соли?
2. Сколько граммов йодида калия содержится
в 250 мл 0,5 М раствора этой соли?
3. Какое количество бромида калия надо взять для приготовления 200 мл 0,3 М раствора?
1. Сколько кристаллической соли Na2CO3·10H2O надо взять для приготовления 500 мл 0,5 н. раствора?
2. Сколько миллилитров концентрированной соляной кислоты (38%, d=1,19) нужно взять для приготовления 500 мл 0,3 н. раствора?
3. Сколько миллилитров концентрированной серной кислоты (96%, d=1,84) потребуется для приготовления 2 л 0,01 н. раствора



























![Аналитическая химия Fe3++6NH4SCN→(NH4)3[Fe(SCN)6]+3NH4+ роданид гексороданоферрат – (III)аммония аммония, красного цветаСo2++4NH4SCN→(NH4)2[Co(SCN)4]+2NH4+ Fe3++6NH4SCN→(NH4)3[Fe(SCN)6]+3NH4+ роданид гексороданоферрат – (III)аммония аммония, красного цветаСo2++4NH4SCN→(NH4)2[Co(SCN)4]+2NH4+](/img/tmb/6/592732/b1e8c72886ab11bc29fd5f27d73a6d7b-800x.jpg)












![Аналитическая химия Cu2+ + 3HCl=H[CuCl3]+2H2 m = 1мкг V пред зеленый Cu2+ + 3HCl=H[CuCl3]+2H2 m = 1мкг V пред зеленый](/img/tmb/6/592732/12f710ed71320b1f4be990d6d27decd8-800x.jpg)




















![Аналитическая химия 2. Гексагидроксостибиат калия K[Sb(OH)6] образует с ионом Na белый кристаллический осадок 2. Гексагидроксостибиат калия K[Sb(OH)6] образует с ионом Na белый кристаллический осадок гексагидроксостибиата (V) натрия:NaCl + K[Sb(OH)6] =](/img/tmb/6/592732/971fd4ef34dd355ffaa2a5eaf8ef8efe-800x.jpg)



![Аналитическая химия 2.Катионы второй аналитической группы (группа хлороводородной кислоты).Общая характеристика группы.Ко второй группе 2.Катионы второй аналитической группы (группа хлороводородной кислоты).Общая характеристика группы.Ко второй группе относятся катионы Ag+, Pb2+ и [Hg2]2+.](/img/tmb/6/592732/e4eb9039c7683f6f5f8c91455a745509-800x.jpg)
![Аналитическая химия Групповой реагент – 2 н. хлороводородная кислота.Катионы Ag+, Pb2+, [Hg2]2+ при Групповой реагент – 2 н. хлороводородная кислота.Катионы Ag+, Pb2+, [Hg2]2+ при взаимодействии с ней образуют трудно растворимые](/img/tmb/6/592732/8e2dcffbaf5850bbe256f2a5c2cb0c09-800x.jpg)






![Аналитическая химия Частные реакции катиона [Hg2]2+Растворы солей ртути (I) содержат группировку – Hg Частные реакции катиона [Hg2]2+Растворы солей ртути (I) содержат группировку – Hg – Hg - , при диссоциации](/img/tmb/6/592732/ec4036b5483b66f8b0f5d4981e3b355a-800x.jpg)
![Аналитическая химия 2. Хромат калия K2CrO4 даёт с катионами [Hg2]2+ красный осадок Hg2CrO4, 2. Хромат калия K2CrO4 даёт с катионами [Hg2]2+ красный осадок Hg2CrO4, нерастворимый в гидроксидах и в разбавленной](/img/tmb/6/592732/7b3cbe9b1246a59b2a656370343a3375-800x.jpg)