Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Анионпроводящие твердые электролиты
Содержание
- 1. Анионпроводящие твердые электролиты
- 2. Устройства на основе кислородпроводящих твердых электролитов Потенциометрический
- 3. Анод:Катод:Топливный элемент (fuel cell) – электрохимическое устройство
- 4. Твердые ионные проводники с проводимостью по иону
- 5. Структурный тип флюоритаОбщая формула: MO2, где М
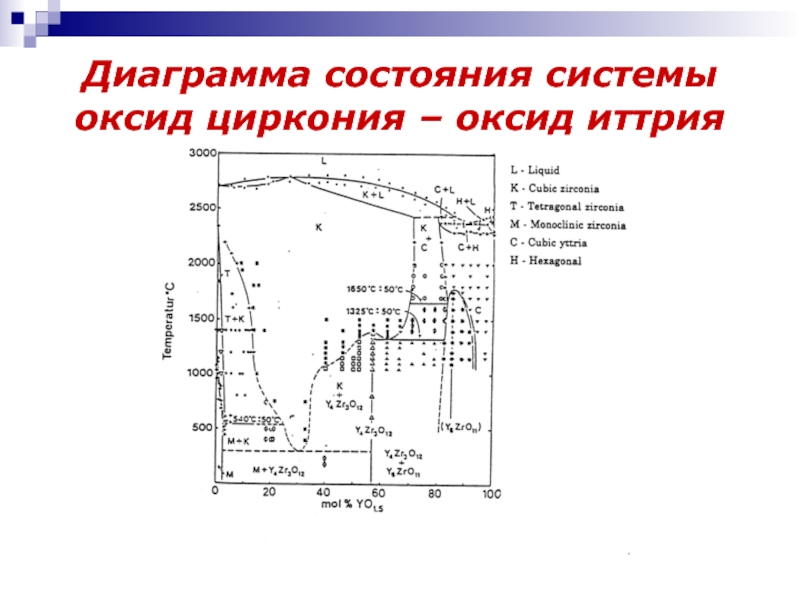
- 6. Диаграмма состояния системы оксид циркония – оксид иттрия
- 7. ДостоинстваНедостаткиВысокая ионная проводимость;Стабильность в окислительной и восстановительной
- 8. r (Ce4+) = 0,94 Ǻ, r (Sm3+)
- 9. Электролиты на основе Bi2O3d-Bi2O3d-Bi2O3 обладает самой высокой
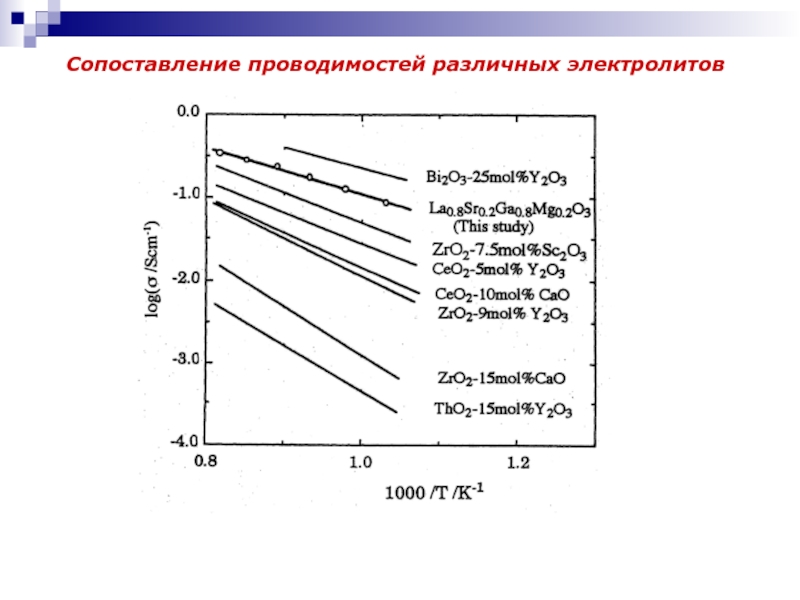
- 10. Сопоставление проводимостей различных электролитов
- 11. Электролиты со структурой пирохлораОбщая формула: А(III)2B(IV)2O6X,
- 12. Структурный тип перовскитаКритерий образования структуры перовскита –
- 13. Структурный тип браунмиллеритаМожет быть получена из структуры
- 14. (Ba0.3Sr0.2La0.5)2In2O5.5 s = 0.12 См/см при 800°CBa2In1.5Ga0.5O5
- 15. Оксиды со структурой фаз Раддлесдена-ПоппераСтруктура срастания из
- 16. Оксиды со структурой фаз АуривиллиусаСтруктура срастания между
- 17. Семейство BIMEVOXBi2V1-xCuxO5.5-3x/2 (BICUVOX)Bi2V1-xNixO5.5-3x/2 (BINIVOX)Bi2V0.9Cu0.1O5.35 (BICUVOX) σ =
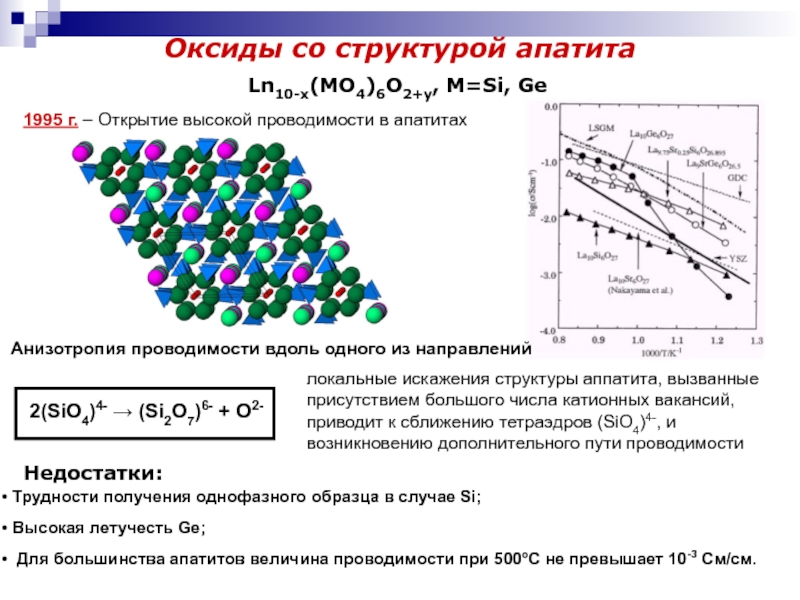
- 18. Оксиды со структурой апатитаLn10-x(MO4)6O2+y, M=Si, Ge Анизотропия
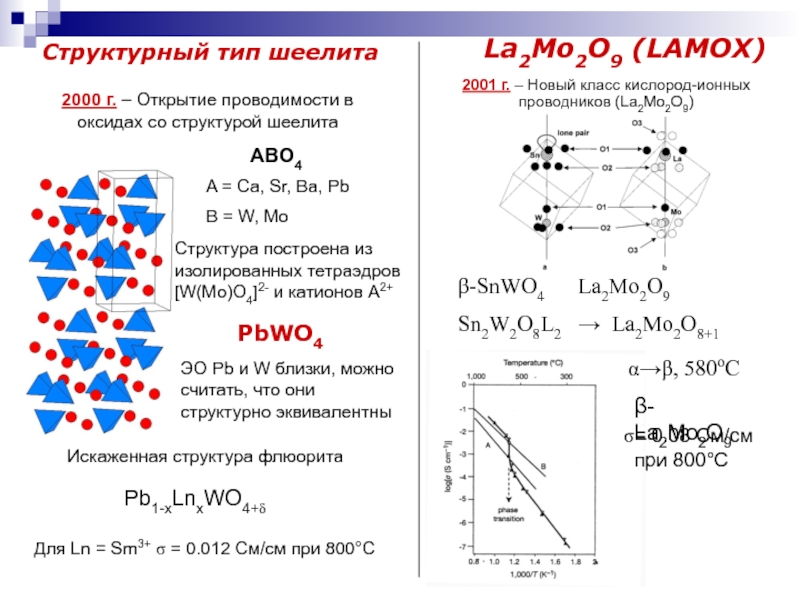
- 19. Структурный тип шеелитаLa2Mo2O9 (LAMOX)ABO4 A = Ca,
- 20. Фторпроводящие твердые электролиты(Ba, Sr, Ca, Pb, Cd)
- 21. Сульфидпроводящие твердые электролитыMeS – ZrS2 или MeS-Ln2S3
- 22. Спасибо за внимание!!!
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Устройства на основе кислородпроводящих твердых электролитов
Потенциометрический датчик кислорода
E=(RT/4F)ln(p1/p11)
Кислородный насос
Электролиз
– разложение воды
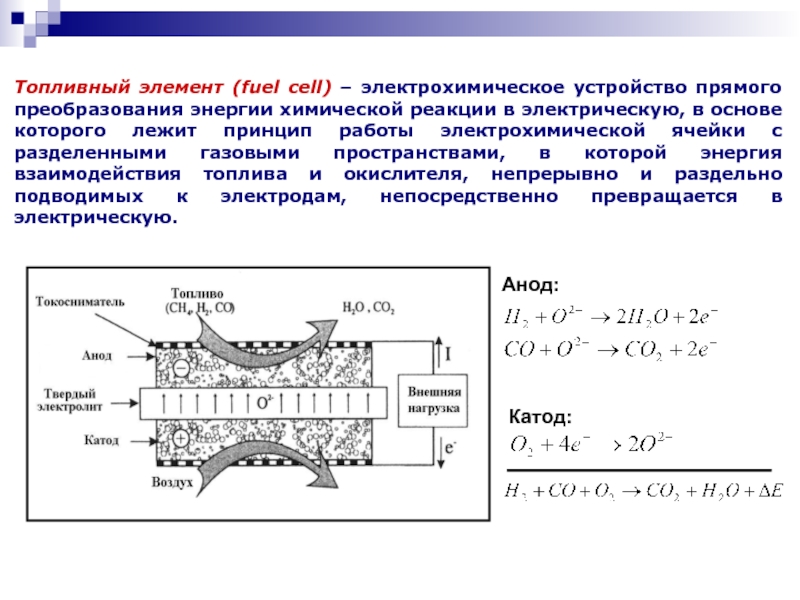
топливный элементСлайд 3Анод:
Катод:
Топливный элемент (fuel cell) – электрохимическое устройство прямого преобразования энергии
химической реакции в электрическую, в основе которого лежит принцип работы
электрохимической ячейки с разделенными газовыми пространствами, в которой энергия взаимодействия топлива и окислителя, непрерывно и раздельно подводимых к электродам, непосредственно превращается в электрическую.Слайд 4Твердые ионные проводники с проводимостью по иону кислорода
Структурные типы
Оксиды со
структурой флюорита (ZrO2, CeO2, Bi2O3)
Оксиды со структурой пирохлора (Gd2Ti2O7)
Оксиды со
структурой перовскита (LSGM)Оксиды со структурой браунмиллерита (Ba2In2O5)
Оксиды со структурой фаз Раддлесдена-Поппера (Sr3Ti2O7)
Оксиды со структурой фаз Ауривиллиуса (BIMEVOX)
Оксиды со структурой шеелита (PbWO4)
Оксиды со структурой La2Mo2O9 (LAMOX)
Оксиды со структурой апатита (Ln10-x((Si, Ge)O4)6O2+y)
Ионные проводники
(электролит для SOFC)
Проводники со смешанной электронно-ионной проводимостью
(электродные материалы)
Слайд 5Структурный тип флюорита
Общая формула: MO2, где М – относительно большой
4-х валентный катион, как Zr4+, Ce4+.
1899 г. - Лампа
Нернста (85% ZrO2 – 15% Y2O3)ZrO2
(monoclinic)
ZrO2
(tetragonal)
ZrO2
(cubic)
1170ºC
2370ºC
r (Zr4+) = 0,84 Ǻ, r (Sc3+) = 0,87 Ǻ,
r(Y3+) = 1,02 Å.
(ZrO2)0.9(Sc2O3)0.1 – 1*10-1 Ом-1см-1 при 800°C
(ZrO2)0.9(Y2O3)0.1 – 3*10-2 Ом-1см-1 при 800°C
Стабилизация высокопроводящей кубической модификации достигается путем допирования различными катионами (РЗЭ, Са).
Слайд 7Достоинства
Недостатки
Высокая ионная проводимость;
Стабильность в окислительной и восстановительной атмосферах;
Относительная доступность.
Низкая механическая
прочность;
Плохая устойчивость к термическому удару;
Кластеризация вакансий при длительной эксплуатации.
Зависимость ионной
проводимости
ZrO2(Y2O3) от концентрации Y2O3 при 300оССлайд 8r (Ce4+) = 0,94 Ǻ, r (Sm3+) = 1,10 Ǻ,
r
(Gd3+) = 1,07 Å.
Ce0.8Sm0.2O1.9 (SDC) s – 2.5·10-1 См/см (1000
ºС )Восстановление Се4+ → Се3+ при
Т > 600ºС и появление электронной составляющей проводимости.
Химическая инертность по отношению к электродам;
Проводимость при 600ºС сравнима с YSZ при 800ºС.
Достоинства:
Недостатки:
Зависимость проводимости Ce1-xMxO2-y
от содержания катиона М (Т=800ºС)
Ионная проводимость твердых электролитов
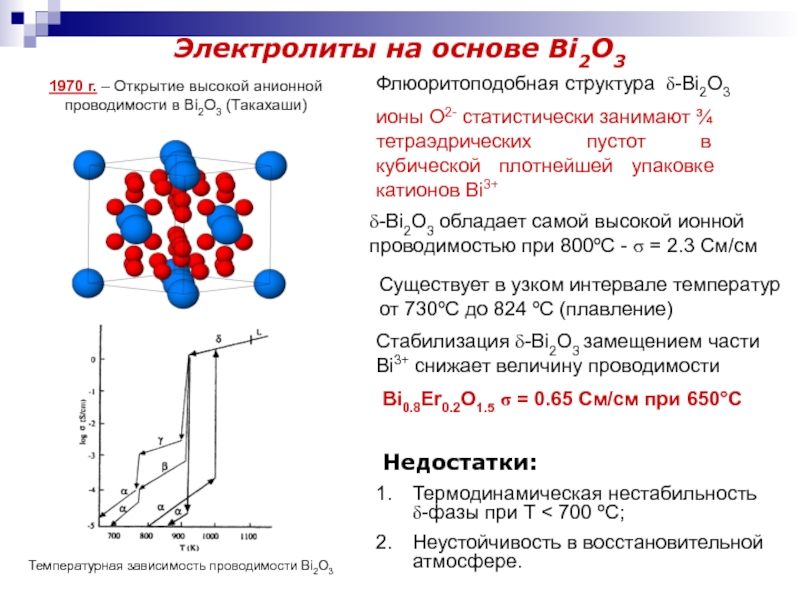
Слайд 9Электролиты на основе Bi2O3
d-Bi2O3
d-Bi2O3 обладает самой высокой ионной проводимостью при
800ºС - s = 2.3 См/см
Флюоритоподобная структура
ионы O2- статистически занимают
¾ тетраэдрических пустот в кубической плотнейшей упаковке катионов Bi3+ Существует в узком интервале температур от 730ºС до 824 ºС (плавление)
Температурная зависимость проводимости Bi2O3
Стабилизация d-Bi2O3 замещением части Bi3+ снижает величину проводимости
Bi0.8Er0.2O1.5 s = 0.65 См/см при 650°С
Недостатки:
Термодинамическая нестабильность d-фазы при Т < 700 ºС;
Неустойчивость в восстановительной атмосфере.
1970 г. – Открытие высокой анионной проводимости в Bi2O3 (Такахаши)
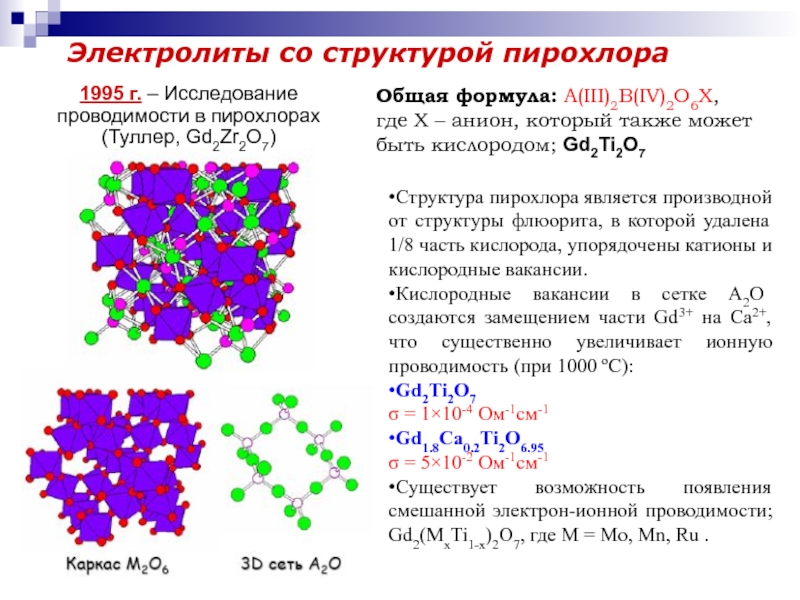
Слайд 11Электролиты со структурой пирохлора
Общая формула: А(III)2B(IV)2O6X,
где X – анион,
который также может быть кислородом; Gd2Ti2O7
•Структура пирохлора является производной
от структуры флюорита, в которой удалена 1/8 часть кислорода, упорядочены катионы и кислородные вакансии.•Кислородные вакансии в сетке A2O создаются замещением части Gd3+ на Ca2+, что существенно увеличивает ионную проводимость (при 1000 ºC):
•Gd2Ti2O7
σ = 1×10-4 Ом-1см-1
•Gd1.8Ca0.2Ti2O6.95
σ = 5×10-2 Ом-1см-1
•Существует возможность появления смешанной электрон-ионной проводимости; Gd2(MxTi1-x)2O7, где М = Мо, Мn, Ru .
1995 г. – Исследование проводимости в пирохлорах (Туллер, Gd2Zr2O7)
Слайд 12Структурный тип перовскита
Критерий образования структуры перовскита – фактор Гольдшмидта
t =
(RA + RO)/2(RB + RO)
(t ≈ 0.8 – 1.0)
Критерии
высокой кислород-ионной проводимостив перовкитоподобных оксидах:
La0.9Sr0.1Mg0.2Ga0.8O2.85 s = 0.1 См/см (750ºС)
Сложность получения однофазного материала – нестабильность работы ТЭ
Недостатки:
Проводимость открыта в 1971 г. Такахаши (Япония)
Общая формула: ABO3, где А – большой ион, как La3+ или Sr2+;
В – маленький ион как Ga3+ или Ti4+.
Низкое значение энергии связи В-катион-кислород
Открытая структура (большой свободный объем, т.е. разница между объемом элементарной ячейки и суммой объемов ионов)
Диаметр полости между двумя В катионами и А-катионом (“бутылочное горлышко”) должен быть наибольшим для обеспечения миграции О2- ионов (rкрит≤ 1.1 Ǻ)
Поляризуемость В-катиона (т.е. легкость изменения В-катионом координационного числа)
Слайд 13Структурный тип браунмиллерита
Может быть получена из структуры перовскита путем удаления
1/6 части кислорода и упорядочения возникающих анионных вакансий
Чередующиеся слои октаэдров
ВО6 и тетраэдров ВО4.абраун ≈ 2апер,
bбраун ≈ 4апер,
сбраун ≈ 2апер
Замещение части катионов возможно как в А, так и в В подрешетках, а также совместное замещение для стабилизации кубической разупорядоченной структуры.
Общая формула: A2BB’O5
(производные от минерала Ca2FeAlO5) – Ba2In2O5
Ba2In2O5
ромб.
BaInO2,5
куб.
930°C
10-3 См/см
10-1 См/см
Переход порядок - беспорядок
1990 г. – Обнаружение кислород-ионной проводимости в оксидах со структурой браунмиллерита (Гуденаф, Ba2In2O5)
Слайд 14(Ba0.3Sr0.2La0.5)2In2O5.5 s = 0.12 См/см при 800°C
Ba2In1.5Ga0.5O5
s = 5*10-3 См/см при 700°C
Достоинства:
Высокая
ионная проводимость, для ряда соединений, сравнимая с YSZ;Устойчивость в восстановительной атмосфере.
Недостатки:
Высокая стоимость In2O3;
Чувствительность к СО2 с образованием карбоната бария и деградацией электролита;
Неустойчивость во влажной атмосфере.
При замене части In на Zr происходит абсорбция воды в структуре. Молекулы воды занимают позиции кислородных вакансий. В результате это вещество становится протонным проводником.
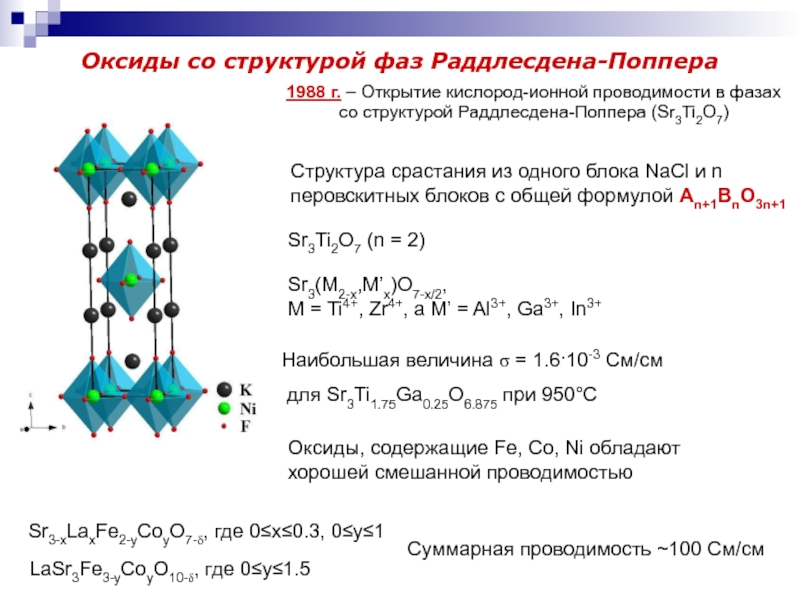
Слайд 15Оксиды со структурой фаз Раддлесдена-Поппера
Структура срастания из одного блока NaCl
и n перовскитных блоков с общей формулой An+1BnO3n+1
Sr3Ti2O7 (n
= 2)Sr3(M2-x,M’x)O7-x/2,
M = Ti4+, Zr4+, а M’ = Al3+, Ga3+, In3+
Наибольшая величина s = 1.6·10-3 Cм/см
для Sr3Ti1.75Ga0.25O6.875 при 950°C
Оксиды, содержащие Fe, Co, Ni обладают хорошей смешанной проводимостью
Sr3-xLaxFe2-yCoyO7-d, где 0≤х≤0.3, 0≤у≤1
LaSr3Fe3-yCoyO10-d, где 0≤у≤1.5
Суммарная проводимость 100 См/см
1988 г. – Открытие кислород-ионной проводимости в фазах со структурой Раддлесдена-Поппера (Sr3Ti2O7)
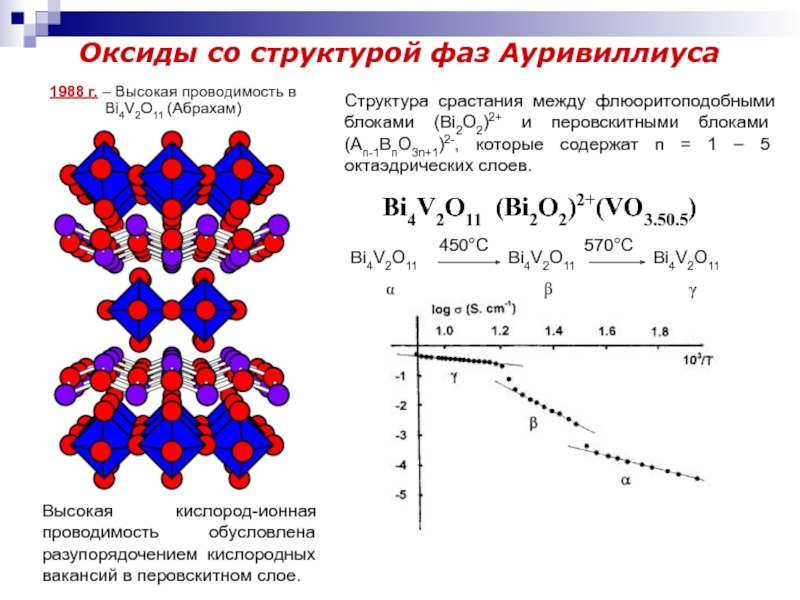
Слайд 16Оксиды со структурой фаз Ауривиллиуса
Структура срастания между флюоритоподобными блоками (Bi2O2)2+
и перовскитными блоками (An-1BnO3n+1)2-, которые содержат n = 1 –
5 октаэдрических слоев.Bi4V2O11 (Bi2O2)2+(VO3.50.5)
Bi4V2O11
a
Bi4V2O11
b
Bi4V2O11
g
450°C
570°C
Высокая кислород-ионная проводимость обусловлена разупорядочением кислородных вакансий в перовскитном слое.
1988 г. – Высокая проводимость в Bi4V2O11 (Абрахам)
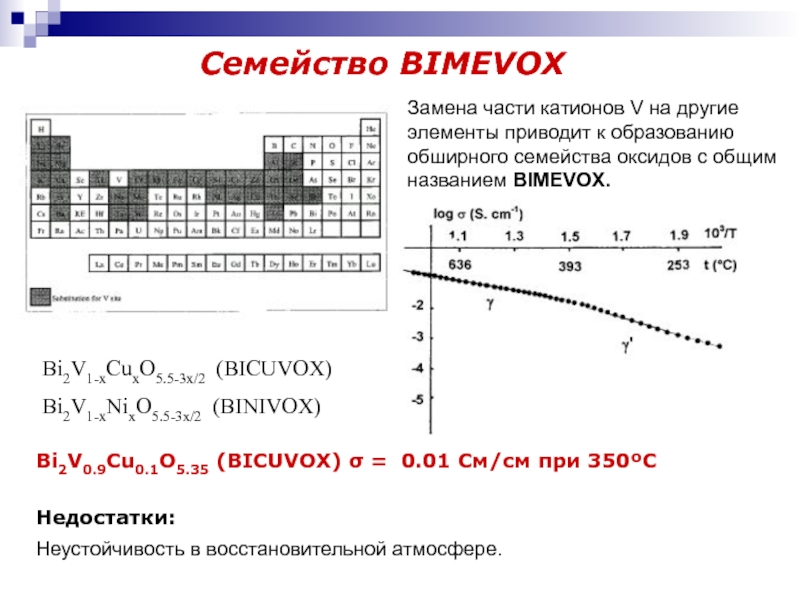
Слайд 17Семейство BIMEVOX
Bi2V1-xCuxO5.5-3x/2 (BICUVOX)
Bi2V1-xNixO5.5-3x/2 (BINIVOX)
Bi2V0.9Cu0.1O5.35 (BICUVOX) σ = 0.01 См/см при
350ºC
Неустойчивость в восстановительной атмосфере.
Недостатки:
Замена части катионов V на другие элементы
приводит к образованию обширного семейства оксидов с общим названием BIMEVOX.Слайд 18Оксиды со структурой апатита
Ln10-x(MO4)6O2+y, M=Si, Ge
Анизотропия проводимости вдоль одного
из направлений
Для большинства апатитов величина проводимости при 500°C не
превышает 10-3 См/см. локальные искажения структуры аппатита, вызванные присутствием большого числа катионных вакансий, приводит к сближению тетраэдров (SiO4)4-, и возникновению дополнительного пути проводимости
Трудности получения однофазного образца в случае Si;
Высокая летучесть Ge;
Недостатки:
1995 г. – Открытие высокой проводимости в апатитах
Слайд 19Структурный тип шеелита
La2Mo2O9 (LAMOX)
ABO4
A = Ca, Sr, Ba, Pb
B
= W, Mo
Структура построена из изолированных тетраэдров [W(Mo)O4]2- и
катионов A2+ PbWO4
ЭО Pb и W близки, можно считать, что они структурно эквивалентны
Искаженная структура флюорита
Pb1-xLnxWO4+d
Для Ln = Sm3+ s = 0.012 См/см при 800°C
-SnWO4 La2Mo2O9
Sn2W2O8L2 La2Mo2O8+1
, 580oC
- La2Mo2O9
= 0.08 См/см
при 800°C
2000 г. – Открытие проводимости в оксидах со структурой шеелита
2001 г. – Новый класс кислород-ионных проводников (La2Mo2O9)
Слайд 20Фторпроводящие твердые электролиты
(Ba, Sr, Ca, Pb, Cd) F2 – MF3
(M = La-Lu, Y)
YbF3 YbCa + 2FFx +
Fi’СaF2
Электропроводность монокристаллов:
1 – CaF2; 2,3 – CaF2-NaF (0.003 и 0.03 мол. %); 4 – CaF2-YbF3 (5*10-4 мол.%)
(Ba, Sr, Ca, Pb, Cd) F2 – MF (M = Na, K, Rb)
Слайд 21Сульфидпроводящие твердые электролиты
MeS – ZrS2 или MeS-Ln2S3 (Me = Be,
Mg, Ca, Sr, Ba; Ln - лантаноиды)
Ln2S3 2LnLnx
+ 3SSx + VMe“ + VS MeLn2S4
Ln2S3 2LnLnx + 3SSx + VMe‘ + VS
MeLn2S4
Ln2S3 2LnLnx + 3SSx + VMe“ + VS + h
MeLn2S4
Ln2S3 2LnLnx + 3SSx + VMe’ + VS + e’
MeLn2S4
Электрофизические свойства фаз
на основе тиолантанатов