Слайд 1 АО «Медицинский Университет Астана»
Кафедра: интернатуры внутренних
болезней
СРС
«Миелодиспластический синдром. Этиология,
патогенез, клинико-диагностические и дифференциально-диагностические критерии. Лечение.»
Выполнила: Цепелева Т.
Группа: 785 ВБ
Проверила: Рахимбекова Г.А.
Астана 2018г
Слайд 2Введение
1. Этиология
2. Патогенез
3. Клиника
4. Диагностика
5. Лечение
Список литературы
Содержание
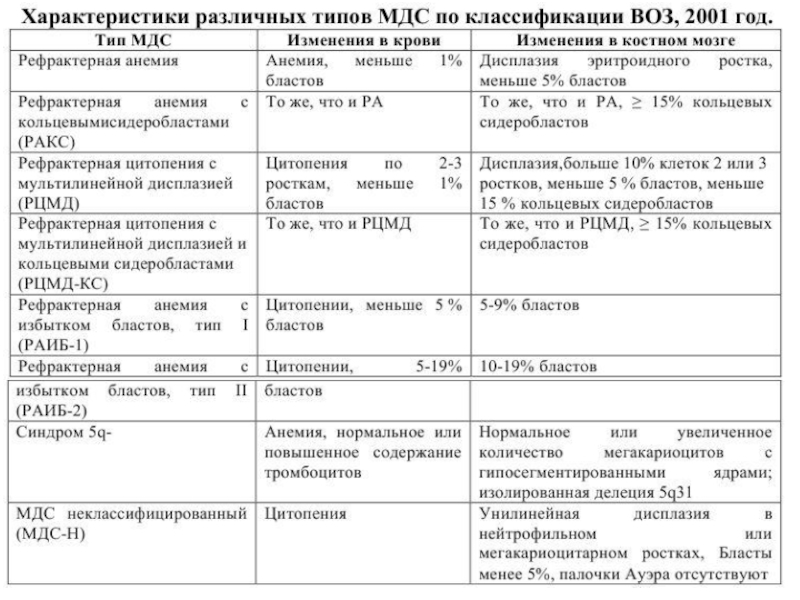
Слайд 3Миелодиспластический синдром – группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении
в периферической крови, дисплазии в костном мозге и риском трансформации
в острый лейкоз.
МДС — заболевание преимущественно пожилых людей. Без учета возраста заболеваемость составляет 3–5 на 100 000 населения в год, у лиц старше 70 лет — 20 на 100 000.
5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз происходит в 30 % случаев.
Введение
Слайд 4В 80-90 % случаев этиология МДС неизвестна.
Факторы риска, приводящие к
развитию МДС:
Контакт с токсинами (бензин, органические растворители, в частности бензол,
пестициды)
Радиация
Курение
Врождённые и наследственные заболевания
Пожилой возраст
Предшествующая химиотерапия онкологического заболевания или после ТКМ
Длительное проведение иммуносупрессивной терапии
Наличие врожденных и наследственных заболеваний (нейрофиброматоз, синдром Дауна, анемия Фанкони)
1. Этиология
Слайд 5Препаратами, которые способны повреждать геном и вызывать последующее развитие МДС,
являются:
алкилирующие агенты (циклофосфан), которые в результате относительной избирательности в отношении
опухолевых клеток проникают также в здоровые клетки различных тканей и органов, подавляя их деление;
ингибиторы топоизомеразы, катализирующие спирализацию и деспирализацию ДНК и оказывающие противоопухолевое действие (топотекан, иринотекан и др.);
антрациклины, которые являются противоопухолевыми антибиотиками (доксорубицин и др.);
подофиллотоксины, которые являются противоопухолевыми препаратами растительного происхождения (этопозид).
Слайд 6Основой патогенеза МДС является происходящая под воздействием повреждающих факторов мутация
полипотентной стволовой клетки крови. Благодаря возникшим генетическим аномалиям и феномену
гиперметилирования ДНК потомки мутировавшей клетки, обладающие биологическим преимуществом, колонизируют костный мозг путем вытеснения нормальных гемопоэтических клеток.
К особенностям мутации стволовых клеток при миелодиспластическом синдроме относится частичное сохранение потомками мутировавшей клетки способности созревать до зрелых клеток крови. При этом процесс созревания недостаточно эффективен, поэтому в периферической крови количество зрелых клеток уменьшается. Наблюдается также снижение функциональной активности таких клеток.
Гиперклеточность костного мозга в сочетании с периферической цитопенией связана с ускоренным апоптозом аномально пролиферирующих (делящихся) клеток костного мозга.
2. Патогенез
Слайд 7Неопластические клетки, образовавшиеся в результате мутации, могут мутировать вторично. В
ряде случаев вследствие вторичных мутаций в костном мозге развиваются клоны
гемопоэтических клеток, в большей степени потерявшие способность к созреванию, чем при первичной мутации. При этом в костном мозге увеличивается количество бластов.
Когда количество бластов превышает 30%, миелодиспластический синдром трансформируется в острый лейкоз. В данной ситуации острый лейкоз является закономерным продолжением течения имеющегося заболевания, а не развитием нового заболевания (аналогично бластному кризу при хроническом миелолейкозе).
Таким образом в результате патологических процессов зрелые клетки крови отличаются опухолевым происхождением, их количество снижено, а функции ослаблены.
Слайд 10Кариотип:
• Хороший: нормальный, -Y, del 5q, del 20q;
• Плохой: более 3х аномалий или аномалии 7 хромосомы
• Средний: все другие
Регулярные гемотрансфузии –переливание минимум 1 дозы эритроцитарной массы каждые 8 недель в течение 4 месяцев.
Слайд 11 Жалобы на:
слабость;
потливость;
утомляемость;
субфебрилитет;
познабливание;
снижение
массы тела;
геморрагические высыпания в виде петехий и экхимозов
на коже;
эпистаксис (носовые кровотечения);
меноррагии;
повышенная кровоточивость.
3. Клиника
Слайд 12Анамнез: следует обратить внимание на:
длительно сохраняющуюся слабость;
быструю утомляемость;
частые инфекционные заболевания;
повышенную кровоточивость;
появление геморрагических высыпаний на коже
и слизистыхоболочках.
Физикальное обследование :
бледность кожных покровов;
геморрагические высыпания – петехии, экхимозы;
одышка;
тахикардия;
увеличение селезенки.
Слайд 13Диагностические критерии постановки диагноза:
Минимальные диагностические критерии МДС
включают обязательные диагностические условия (цитир. по NCCN, 2.2015):
• стабильная
цитопения не менее 6 месяцев, (за исключением случаев, когда цитопения сопровождается специфическим кариотипом или дисплазией двух ростков кроветворения — в этих случаях длительность стабильной цитопении должна составлять не менее 2 месяцев);
• исключение других заболеваний, которые могут стать причиной развития дисплазии или/и цитопении.
В дополнение к этим двум диагностическим условиям для установления диагноза МДС необходимо соответствие хотя бы одному из трех основных критериев:
• дисплазия (≥ 10 % клеток одного или более из трех основных ростков кроветворения в костном мозге);
• содержание бластов в костном мозге 5-19 %;
• специфический кариотип, например, делеция (5q-), делеция (20q-), +8 или −7/делеция (7q-).
4. Диагностика
Слайд 14Лабораторные исследования:
ОАК: макроцитарная, гиперхромная анемия, нейтропения, тромбоцитопения, моноцитоз
БАК: определение
уровня железа, фолиевой кислоты, эритропоэтина, ЛДГ и АСТ, АЛТ, щелочной
фосфатазы, мочевины
Исследование мазка крови: признаки дисплазии, деформированные эритроциты, агарнулярные нейтрофилы, бластные клетки.
Слайд 15Морфологическое исследование: морфологические признаки дисплазии элементов различных ростков кроветворения являются
определяющим фактором в распознавании МДС. Наиболее типичными для диагностики МДС
являются следующие диспластические проявления:
• Присутсвие гипо- или гипергранулированных нейтрофилов и вытекающий отсюда дефицит активности перокидазы на всех стадиях созревания клеток миелопоэза;
• пельгероидность клеток нейтрофильного и эозинофильного ряда;
• наличие более 15% кольцевых сидеробластов;
• PAS – положительный материал в мегалобластоидных клетках;
• микромегакариоциты с одним пикнотическим ядром или гигантские мегакариоциты с множеством раздельными ядрами округлой формы.
Слайд 16Иммунофенотипирование: При иммунофенотипических исследованиях не обнаружено каких-либо специфических маркеров
МДС. Данное исследование при МДС проводиться для исключения пароксизмальной ночной
гемоглобинурии (при МДС в 10-15% случаях ПНГ-клон – положителен), а также ИФТ позволяет более точно подсчитать количество бластов.
Стандартное цитогенетическое исследование: специфический кариотип, например, делеция (5q-), делеция(20q-), +8 или −7/делеция (7q-).
Молекулярно-генетическое исследование: для МДС исследовании методом FISH харатерны - (-7/7q-; EGR1(5q); 20q; -Y)
Слайд 17Гистологическое исследование: характерно нарушение костно-мозговой топографии всех ростков кроветворения. Гистологически
выделяются два варианта:
МДС с повышенной клеточностью КМ/Гиперцеллюлярный
КМ: отмечается некоторое усиление эритропоэза с увеличением количества незрелых клеток эритробластическогоряда, в основном проэритробластов. Незрелые клетки эритробластического ряда образуют островки, содержащие не менее 10 клеток. Эти небольшие очаги эритропоэза сочетаются с относительно равномерно расределенными в срезах клетками гранулоцитарного ряда. Увеличивается количество мегалобластоидных клеток.
МДС с пониженной клеточностью КМ/Гипоцеллюлярный КМ: В мегакариоцитарном ростке- скопления микромегакариоцитов, нарушение синусоидальной ориентации и паратрабекулярной локализации диспластических
и пикнотичных мегакариоцитов. Для миелоидного ростка характерным признаком является патологическая локализация незрелых клеток – ALIP (abnormal localization of immature precursors). Со стороны эритропоэза выявляются участки с блоком созревания, располагающиеся как в интра-, так и в паратрабекулярных областях.
Слайд 18Инструментальные исследования:
УЗИ органов брюшной полости: увеличение размеров селезенки.
КТ
грудного сегмента: инфильтративные изменения легочной ткани.
ЭКГ: нарушение проводимости импульсов в
сердечной мышце.
ЭхоКГ: признаки сердечной недостаточности (ФВ <60%), снижение сократимости, диастолическая дисфункция, легочная гипертензия, пороки и регургитации клапанов.
Слайд 19Дифференциальная диагностика МДС проводится с:
•Мегалобластными анемиями (заболевания, характеризующиеся изменениями
морфологии клеток костного мозга вследствие нарушения синтеза ДНК. Более 90
% — В-12 и фолиево-дефицитные анемии). После начала терапии витамином В-12 или фолиевой кислотой в анализе крови выявляется ретикулярный криз на 5-7 сутки и повышение показателей красной крови, что нехарактерно для больных рефрактерной анемией. Изменения кариотипа клеток костного мозга не встречаются при мегалобластных анемиях.
•Апластическая анемия может быть врожденной, приобретенной и идиопатической. Врожденная апластическая анемия — анемия Фанкони сочетается с другими генетическими аномалиями (кожная пигментация, гипоплазия почек, микроцефалия), приобретенная связана с действием химических и физических агентов, инфекциями, нарушениями обмена веществ. Для апластической анемии нехарактерны изменение кариотипа, гиперклеточный костный мозг.
•Анемии при хроническом гепатите характерно выявление маркеров вирусных инфекций, гепатоспленомегалия, клиническая картина хр. гепатита, изменения биохимических показателей крови (метаболизма билирубина, функции печени).
ДИАГНОЗ И ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ

Слайд 20Показания для экстренной госпитализации:
• впервые выявленный миелодиспластический синдром
• геморрагический
и анемический синдромы с выраженными клиническими проявлениями
• фебрильная нейтропения
Показания
для плановой госпитализации:
• Проведение иммуносупрессивной терапии АТГ
• Проведение химиотерапии
• Аллогенная трансплантация гемопоэтических стволовых клеток
5. Лечение
Слайд 21Цели лечения:
• достижение полного или частичного ответа
• снижение зависимости
от трансфузий и регресс перегрузки железом, в случаях, когда не
удается получить ответ
Немедикаментозное лечение:
Режим: общеохранительный.
Диета: Стол №15. Нейтропеническим пациентам не рекомендуется соблюдать определенную диету
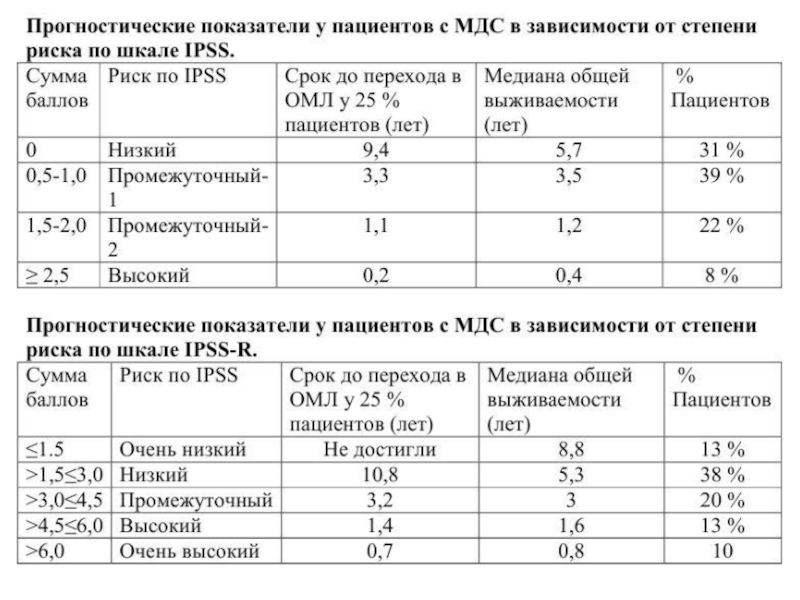
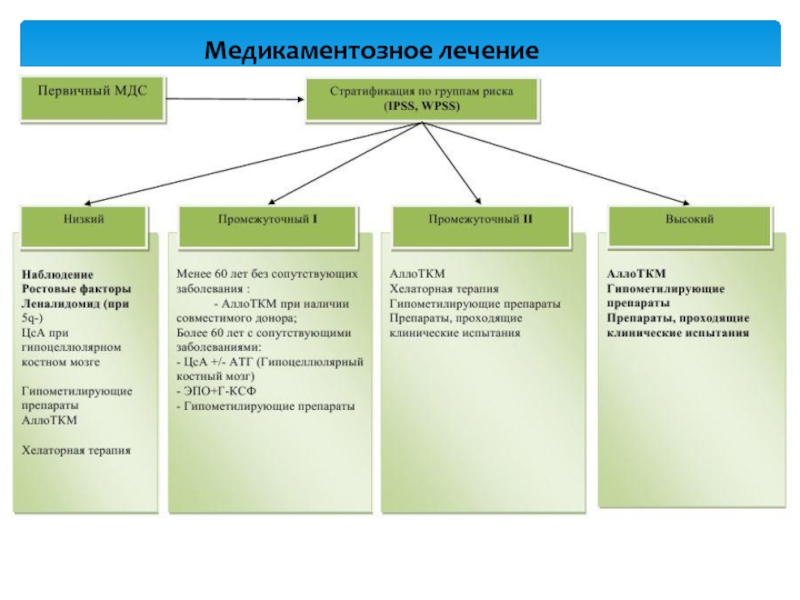
Слайд 22Согласно рекомендациям NCCN (2.2015) выбор режима терапии основывается на прогностической
категории пациента (IPSS, IPSS-R, WPSS). На основании стратификации пациентов по
группам риска, выделяются две основные терапевтические группы:
• Терапевтическая группа «низкого риска»:
IPSS: Низкий, Промежуточный -1
IPSS-R: Очень низкий, Низкий, Промежуточный
WPSS: Низкий, Очень низкий, Промежуточный
• Терапевтическая группа «высокого риска»:
IPSS: Промежуточный-2, Высокий;
IPSS-R: Промежуточный, Высокий, Очень высокий;
WPSS: Высокий, Очень высокий.
Слайд 24 Метод является единственным радикальным способом лечения больных с миелодиспластическим
синдромом. Полную ремиссию после аллоТКМ достигают 60-70% больных с МДС,
однако, как правило, ремиссии непродолжительные.
Пациентам из группы «низкого риска» ТКМ показана в случае отсутствия ответа на проводимую терапию и сохранении зависимости от трансфузий (переливание минимум 1 дозы эритроцитарной массы чаще чем каждые 8 недель в течение 4 месяцев).
Пациентам из группы «высокого риска» аллоТКМ рекомендуется проводить сразу после достижения полного или частичного ответа на проводимую терапию.
Аллогенная трансплантация костного мозга при МДС
Иммуносупрессивная
терапия
МДС может развиваться одновременно с некоторыми нарушениями иммунной системы. У пациентов с МДС часто наблюдаются нарушения в иммунной системе: аутоантитела, дисглобулинемия, аутореактивные клоны Т-клеток, дисбаланс между различными популяциями Т-клеток, NK-клеточные нарушения, увеличение популяции Т-регуляторов (CD4+25+; FoxP3+), увеличение продукции ИЛ-17 Т-клетками провоспалительный, проапоптотический цитокин). Иммунная дисрегуляция может предшествовать или предрасполагать к развитию клональных гематологических заболеваний.
При гипопластическом (гипопролиферативном) варианте МДС по аналогии с апластической анемией используется иммуносупрессивная терапия. Основными показаниями к использованию ИСТ является подтверждение гипоплазии кроветворения данными гистологического исследования костного мозга, низкий или промежуточный I риск по IPSS.
Слайд 26Основные препараты ИСТ при МДС:
Циклоспорин;
Иммуноглобулин антитимоцитарный.
Терапия Циклоспорином:
1) 3-5
мг/кг/ день в 2 приема per os;
2) Оптимальная концентрация
циклоспорина в крови до 300 нг/мл;
3) Эффект у больных с гипоплазией костного мозга поликлональными скоплениями лимфоидных элементов в КМ, с нормальным кариотипом: 53- 83%.
Иммуноглобулин антитимоцитарный:
Применяется в виде внутривенных капельных инфузий, как правило, в дозе 10-20-40 мг/кг массы тела в 500-1000 мл изотонического раствора натрия хлорида в течение 3-18 ч на протяжении 5 суток. При невысокой активности иммунокомпетентных клеток крови и костного мозга возможно применение АТГ в дозах 5-10 мг/кг.
Слайд 27 Применение Леналидомида в лечении больных с МДС 5q-
. Рекомендуемая начальная доза составляет 25 мг 1 раз в
день в 1–21-й дни повторных 28-дневных циклов.
Из группы ингибиторов гиперметиллирования для пожилых пациентов с низким и промежуточным -1 рисками (по шкале IPSS) предпочтительно использование Децитабина. Режимы дозирования: 20мг/м2 в/в 1р/д х 5дней; 10мг/м2 п/к х 5дней; 10мг/м2 в/в 1р/д х 10дней.
Слайд 28 Для пациентов группы высокого риска (по шкале IPSS),
и пациентам старше 75 лет, более предпочтителен Азацитидин. Рекомендуемая начальная
доза независимо от гематологических показателей составляет 75 мг/м2 п/к или в/в, в течение 7 дней ежедневно. Для предотвращения тошноты и рвоты следует проводить премедикацию. Последующие циклы терапии следует проводить каждые 4 недели. Дозу можно увеличить до 100 мг/м2 при отсутствии терапевтического эффекта после первых 2 циклов терапии и при отсутствии проявлений токсичности (кроме тошноты и рвоты). Рекомендуется проведение 4-6 циклов терапии.
У пациентов пожилого возраста или пациентам с тяжелой сопутствующей патологией показано применение химиотерапии по схеме «малые дозы цитазара» (Ara-C). Цитарабин назначают по 10 мг/м2 (не более 20 мг) 2 раза в день п/к 14-28 дней.
Слайд 30Эритропоэтин.
Терапия ЭПО назначается по следующим показаниям: гемоглобин
эндогенный ЭПО
по IPSS.
Начальная терапия (стадия коррекции). Начальная доза составляет 40 МЕ/кг массы тела 3 раза в неделю в/в (высшая доза не должна превышать 720 МЕ/кг массы тела в неделю). Поддерживающая терапия. Для поддержания гематокрита на уровне 30-35% дозу вначале следует уменьшить вполовину от дозы в предыдущей инъекции. Впоследствии поддерживающую дозу подбирают индивидуально, с интервалом в одну или две недели.
С целью уменьшения количества введений и повышения качества жизни могут быть использованы ЭПО с продленным действием по 300 мкг п/к 1 раз в 3 недели.
Слайд 31Лечение тромбоцитопении
Используются препараты-стимуляторы тромбопоэза:
• Ромиплостим AMG 531 (TPO-R peptibody);
•
Эльтромбопаг (TPO-R агонист-GSK);
• Лонифарниб, Типифарниб.
Ромиплостим – способствует дифференцировке
мегакариоцитов и тромбоцитов тем же путем, что и эндогенный тромбопоэтин. Он является аналогом тромбопоэтина, приводит к повышению продукции тромбоцитов. Вводят подкожно. Начальная доза - 1 мкг/кг реальной массы тела, еженедельно, до стабилизации числа тромбоцитов на уровне 50 x 109/л и более в течение не менее 4 недель без коррекции дозы.
Слайд 32Хелаторная терапия
Метод хелатирования был разработан в 1950-х гг.
для лечения отравления тяжелыми металлами - свинцом, железом, ртутью и
медью. Метод используется для лечения больных с МДС при перегрузке железом. Стандартное показание для начала хелаторной терапии – повышение уровня ферритина более 1000 мкг/л.
Дефероксамин - средняя суточная доза - 20-40 мг/кг. Средняя начальная доза –500 мг. Терапия считается успешной, если концентрации ферритина в сыворотке крови близки к нормальным значениям (менее 300 мкг/л).
Деферазирокс - первоначально рекомендуемая доза 20 мг, прием 1 раз в день внутрь.
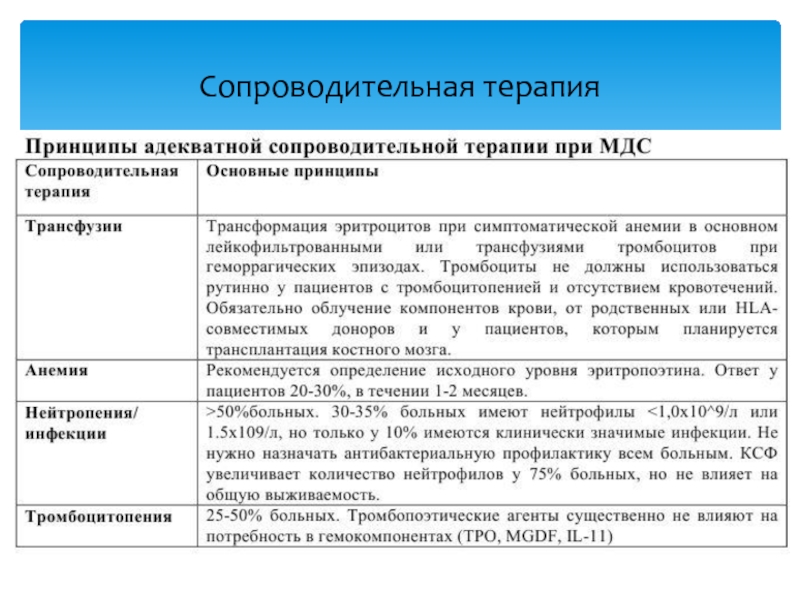
Слайд 33Эритроцитарная масса/взвесь
Уровень гемоглобина не нужно повышать, пока обычные резервы
и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде.
Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, denovo депрессией или элевацией ST);
Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов.
При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
Возраст (лет) Триггерный уровень Hb (г/л)
<25 35-45
25-50 40-50
50-70 55
>70 60
Гемокомпонентная терапия:
Слайд 34Концентрат тромбоцитов
При снижении уровня тромбоцитов менее 30х10/9/л проводится
трансфузия аферезных тромбоцитов вирусинактивированных, желательно облученных, с целью поддержания их
уровня не ниже 30-50 х 10/9/л в особенности в первые 10 дней курса.
При наличии высокого риска геморрагических осложнений (возраст старше 60 лет, повышение уровня креатинина более 140 мкмоль/л) необходимо поддерживать уровень тромбоцитов более 50 х10/9/л.
Свежезамороженная плазма
Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур.
Слайд 35Индикаторы эффективности лечения
Слайд 371. Протокол № 6 от «9» июля 2015 года Клинический
протокол диагностики и лечения МДС у взрослых МЗРК
2. Волкова С.А.,
Н.Н. Боровков Основы клинической гематологии, 2013г
3. https://liqmed.ru/disease/mielodisplasticheskij-sindrom/
4. http://sosudinfo.ru/krov/mielodisplasticheskij-sindrom/
5. http://sindrom.info/mielodisplasticheskij/
Список литературы