Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АРОМАТИКА
Содержание
- 1. АРОМАТИКА
- 2. АРЕНЫАроматические соединения, или арены, — большая группа
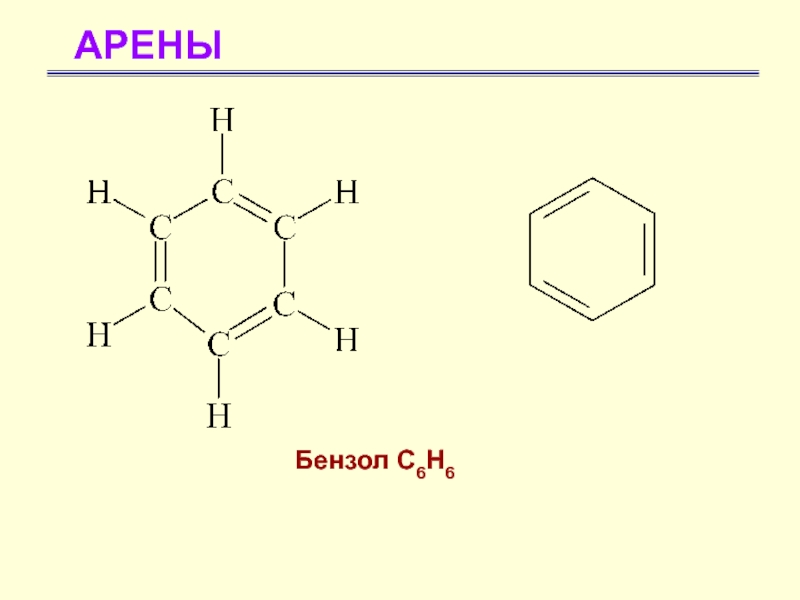
- 3. АРЕНЫБензол С6Н6
- 4. АРЕНЫВ современной химической литературе понятие “соединение ароматического
- 5. АРЕНЫСравнение химических свойств циклогексена и бензола
- 6. АРЕНЫБензол не вступает в реакции присоединения, в
- 7. АРЕНЫВывод об устойчивости ароматической системы следует из
- 8. АРЕНЫОднако экспериментальная теплота гидрирования одного моля бензола
- 9. АРЕНЫВ практике наиболее употребимы формула Полинга, выражающая
- 10. АРЕНЫСтроение молекулы бензола Фридрих Август Кекуле7 сентября 1829 г. – 13 июля 1896 г.
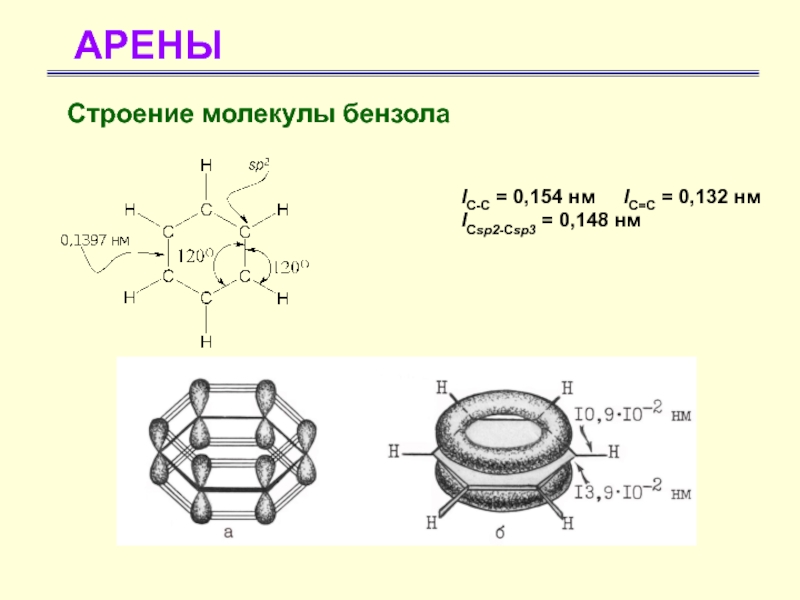
- 11. АРЕНЫСтроение молекулы бензола lС-С = 0,154 нм
- 12. АРЕНЫ«Ароматичность» – совокупность особых свойств бензола Э.Хюккель
- 13. АРЕНЫ«Ароматичность» – совокупность особых свойств бензола Эрих Хюккель1896-1980
- 14. АРЕНЫ«Ароматичность» – совокупность особых свойств бензола Ароматический
- 15. АРЕНЫНоменклатура и изомериястирол(винилбензол толуол(метилбензол) этилбензол
- 16. АРЕНЫНоменклатура и изомериякумол(изопропилбензол) анизол(метоксибензол) мезителен(1,3,5-триметилбензол)
- 17. АРЕНЫНоменклатура и изомерияфенил бензил бензилиден
- 18. АРЕНЫо-ксилол(1,2-диметилбензол) м-ксилол(1,3-диметилбензол) п-ксилол(1,4-диметилбензол) Номенклатура и изомерия
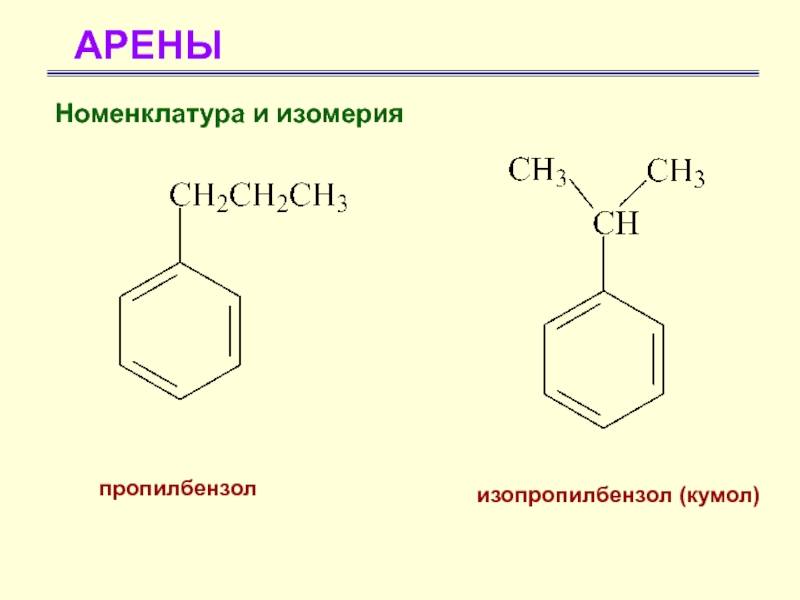
- 19. АРЕНЫпропилбензолизопропилбензол (кумол) Номенклатура и изомерия
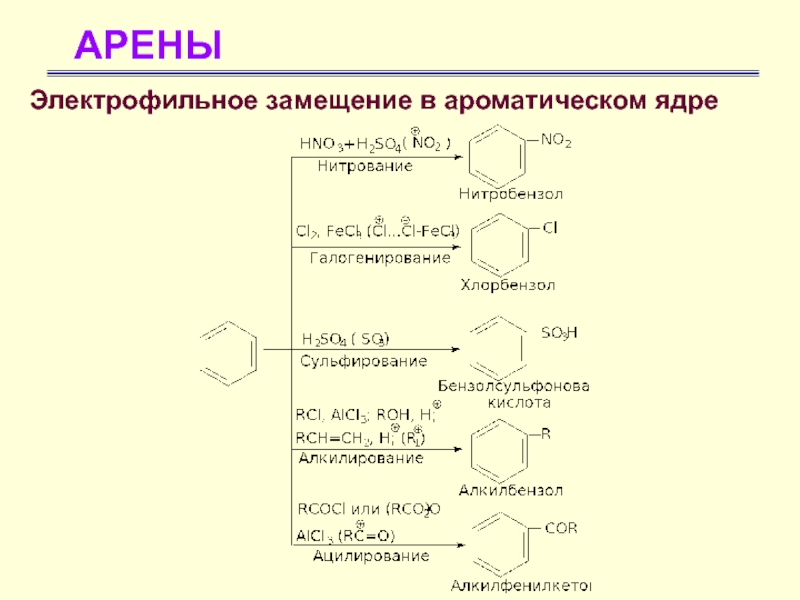
- 20. АРЕНЫХимические свойства аренов Электрофильное замещение в ароматическом
- 21. АРЕНЫЭлектрофильное замещение в ароматическом ядре
- 22. АРЕНЫЭлектрофильное замещение в ароматическом ядре Реакции электрофильного замещения в ароматическом ряду представляют собой двухстадийный процесс присоединения-отщепления
- 23. АРЕНЫЭлектрофильное замещение в ароматическом ядре Положительно заряженный
- 24. АРЕНЫЭлектрофильное замещение в ароматическом ядре За счет
- 25. АРЕНЫЭлектрофильное замещение в ароматическом ядре Строение карбокатиона
- 26. АРЕНЫЭлектрофильное замещение в ароматическом ядре Первая стадия
- 27. АРЕНЫЭлектрофильное замещение в ароматическом ядре Это направление
- 28. АРЕНЫГалогенирование При галогенировании электрофил образуется в реакции
- 29. АРЕНЫГалогенирование Прямое фторирование является исключительно активным процессом
- 30. АРЕНЫНитрование Нитрование проводится нитрующей смесью - смесью
- 31. АРЕНЫВ реакции сульфирования в качестве сульфирующих реагентов
- 32. АРЕНЫСульфирование Механизм сульфирования может быть представлен следующим
- 33. АРЕНЫСульфирование Поскольку последняя является сильной кислотой, то она сильно диссоциирована (стадия 4)
- 34. АРЕНЫСульфирование Практическое значение имеет обратимость реакции сульфирования:
- 35. АРЕНЫАлкилированиеАлкилирование — введение алкильной группы в молекулу органического соединения (например, в бензольное кольцо).Реакция Фриделя—Крафтса
- 36. АРЕНЫАлкилированиеКрафтс (Crafts) Джеймс Мейсон (8.3.1839 — 20.6.1917, США)Фридель (Friedel) Шарль (12.3.1832 — 20.4.1899, Франция)
- 37. АРЕНЫАлкилированиеАлкилирование по Фриделю - Крафтсу состоит в
- 38. АРЕНЫАлкилированиеВ более сложных первичных и вторичных галогеналканах
- 39. АРЕНЫАлкилированиеПри применении алкенов как алкилирующих агентов в
- 40. АРЕНЫАлкилированиеРеакцию алкилирования трудно остановить на стадии монозамещения
- 41. АРЕНЫАлкилированиеНедостатки реакции алкилирования1. Изомеризация алкилирующего агента.
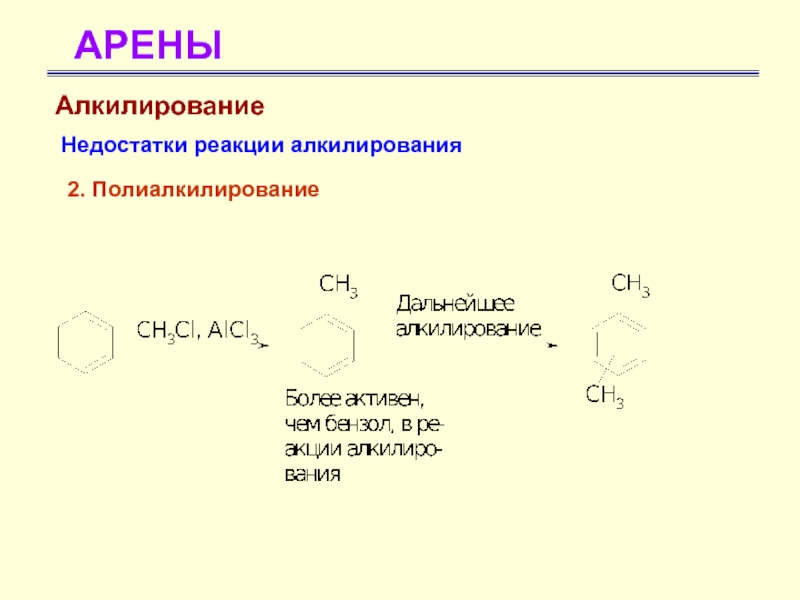
- 42. АРЕНЫАлкилированиеНедостатки реакции алкилирования2. Полиалкилирование
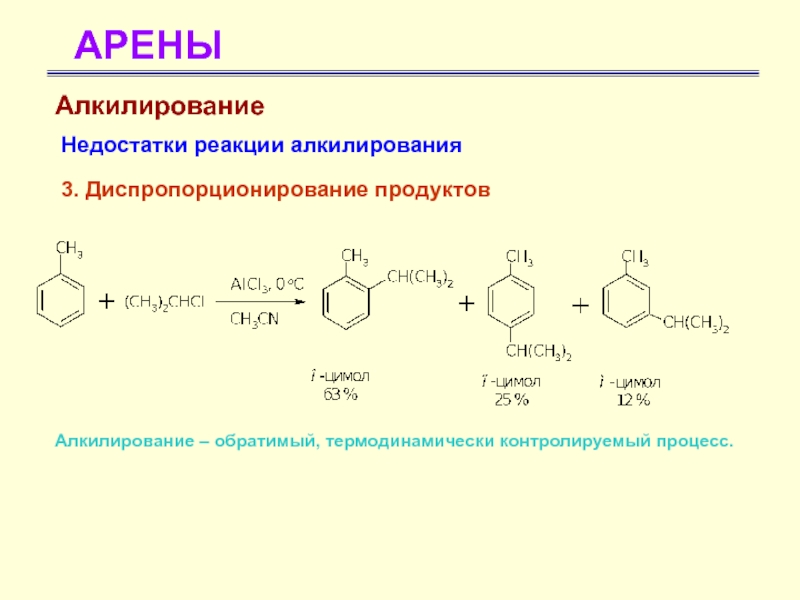
- 43. АРЕНЫАлкилированиеНедостатки реакции алкилирования3. Диспропорционирование продуктов Алкилирование – обратимый, термодинамически контролируемый процесс.
- 44. АРЕНЫАлкилированиеОграничения алкилирования по Фриделю-Крафтсу связанные с группами,
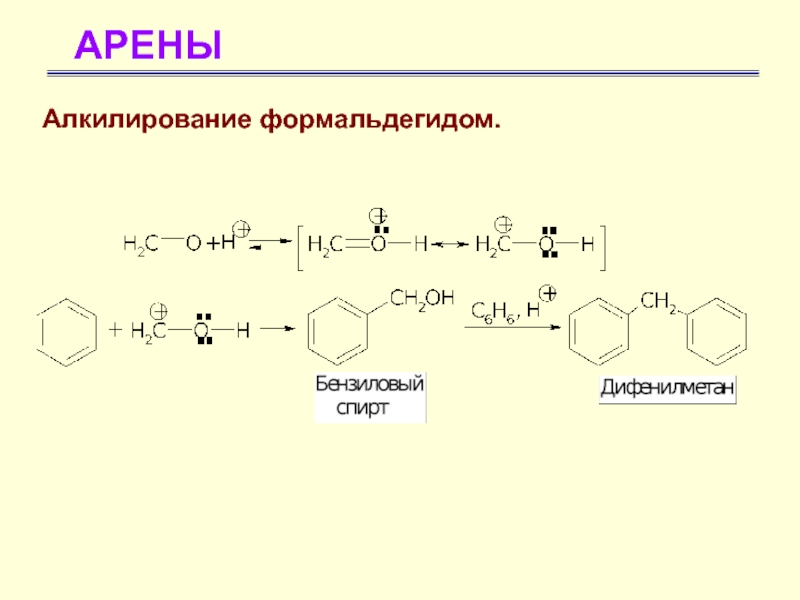
- 45. АРЕНЫАлкилирование формальдегидом.
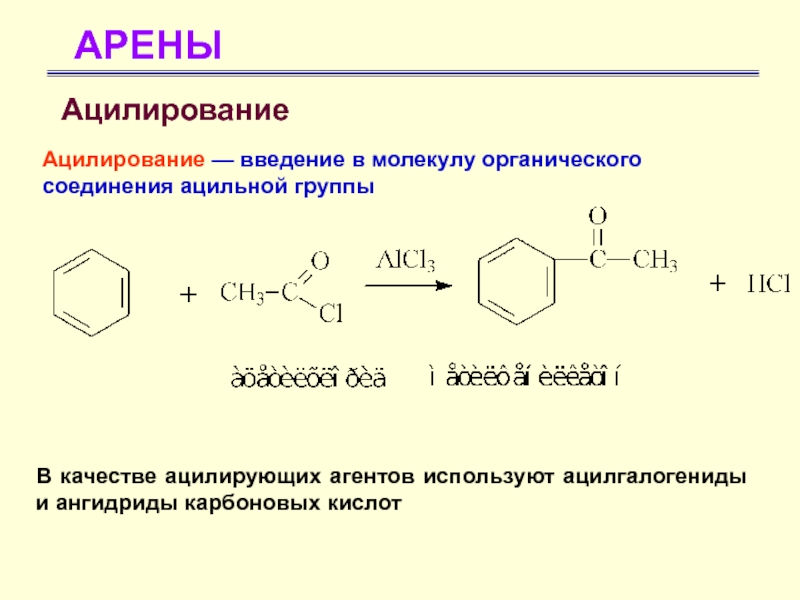
- 46. АРЕНЫАцилирование Ацилирование — введение в молекулу органического
- 47. АРЕНЫАцилирование В качестве ацилирующих агентов используют ацилгалогениды
- 48. АРЕНЫАцилирование В реакции алкилирования и ацилирования не
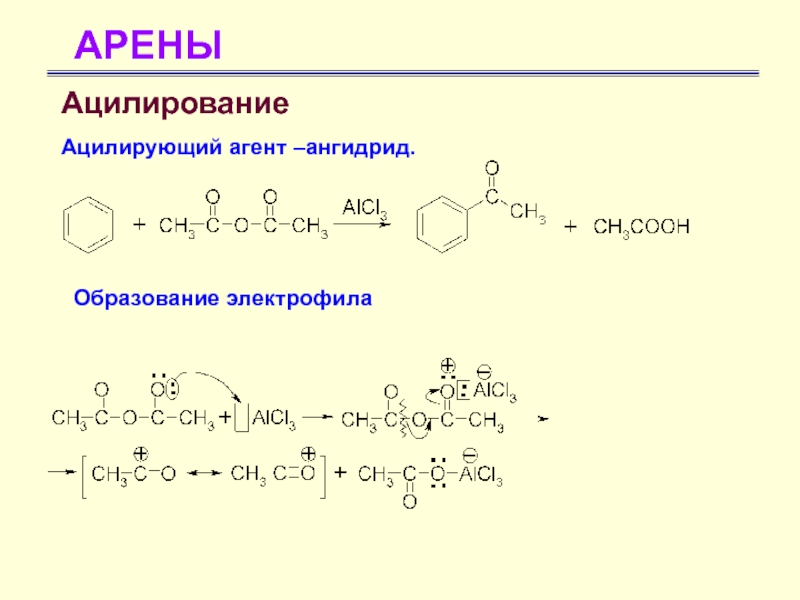
- 49. АРЕНЫАцилирование Ацилирующий агент –ангидрид.Образование электрофила
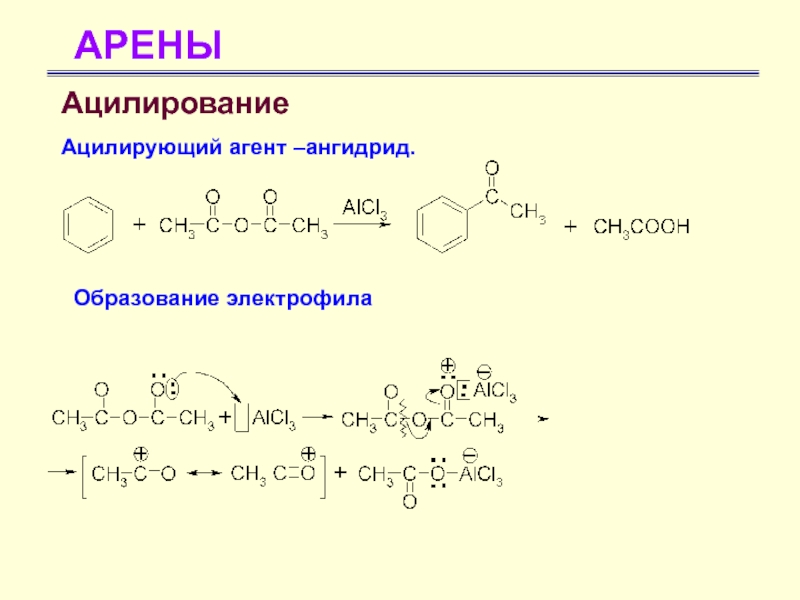
- 50. АРЕНЫАцилирование Ацилирующий агент –ангидрид.Образование электрофила
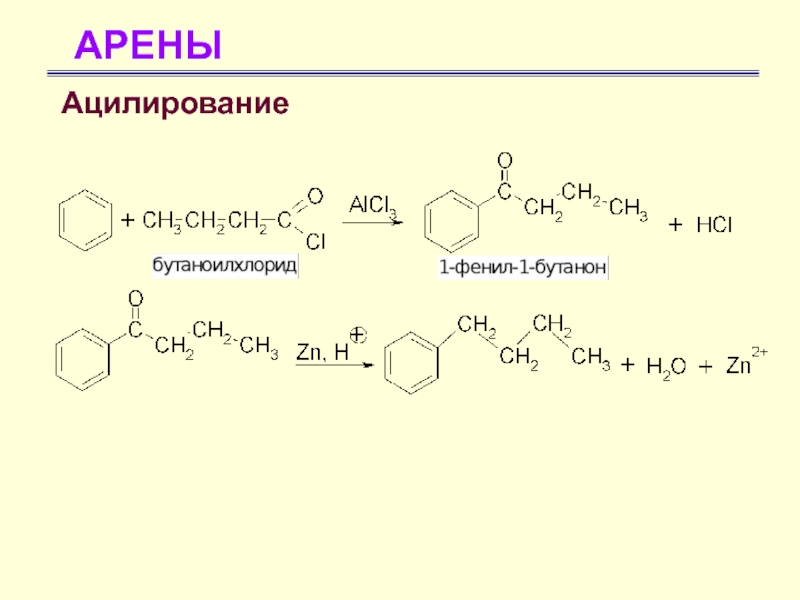
- 51. АРЕНЫАцилирование Внутримолекулярное ацилирование
- 52. АРЕНЫАцилирование Преимущества ацилирования по Фриделю-Крафтсу:1. При ацилировании
- 53. АРЕНЫАцилирование
- 54. АРЕНЫХлорметилирование
- 55. АРЕНЫФормилирование (реакция Гаттермана-Коха)Ацилирующий агент
- 56. АРЕНЫСвободнорадикальное замещение в боковой цепи аренов Для
- 57. АРЕНЫСвободнорадикальное замещение в боковой цепи аренов Механизм SR
- 58. АРЕНЫСвободнорадикальное замещение в боковой цепи аренов Избирательность
- 59. АРЕНЫСвободнорадикальное замещение в боковой цепи аренов
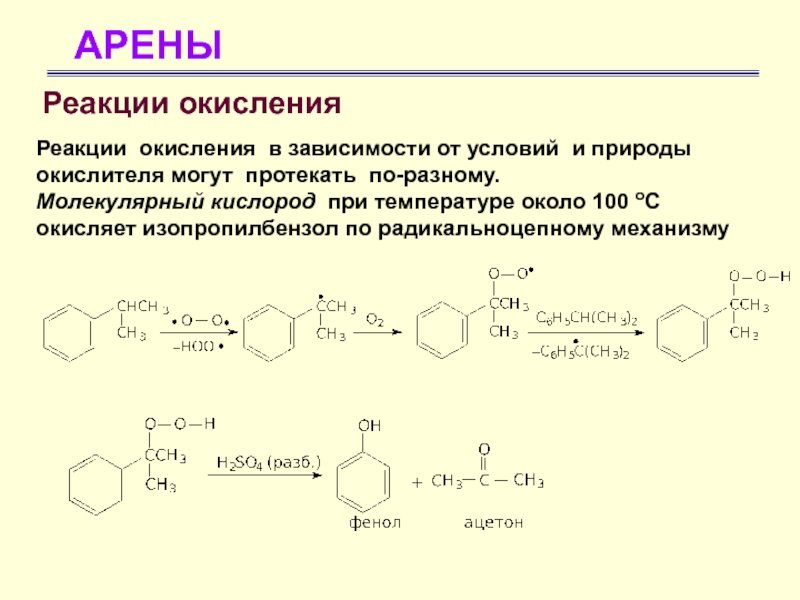
- 60. АРЕНЫРеакции окисления Реакции окисления в зависимости от
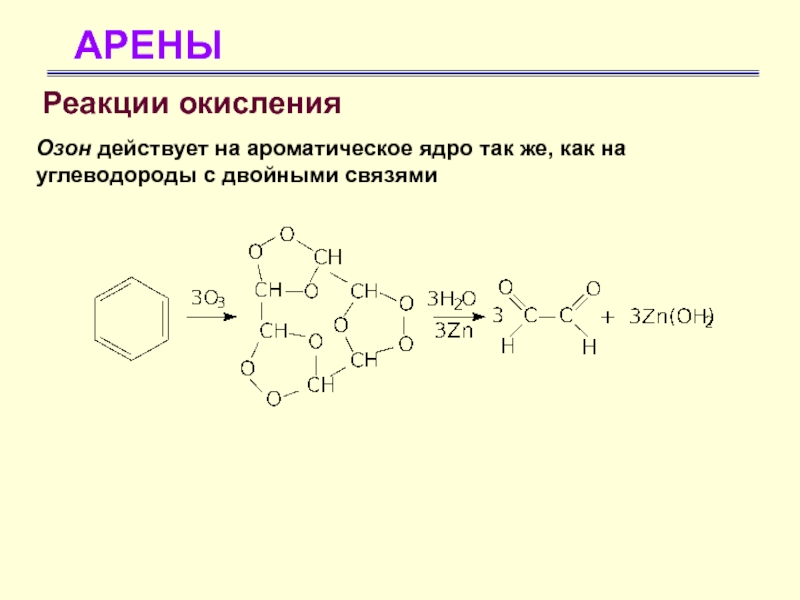
- 61. АРЕНЫРеакции окисления Озон действует на ароматическое ядро так же, как на углеводороды с двойными связями
- 62. АРЕНЫРеакции окисления Сильные неорганические окислители (KMnO4, K2Cr2O7
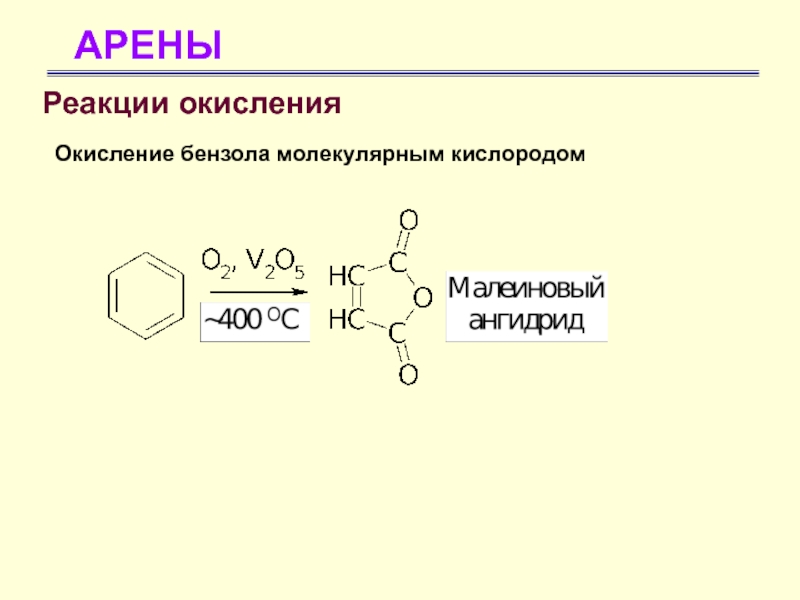
- 63. АРЕНЫРеакции окисления Окисление бензола молекулярным кислородом
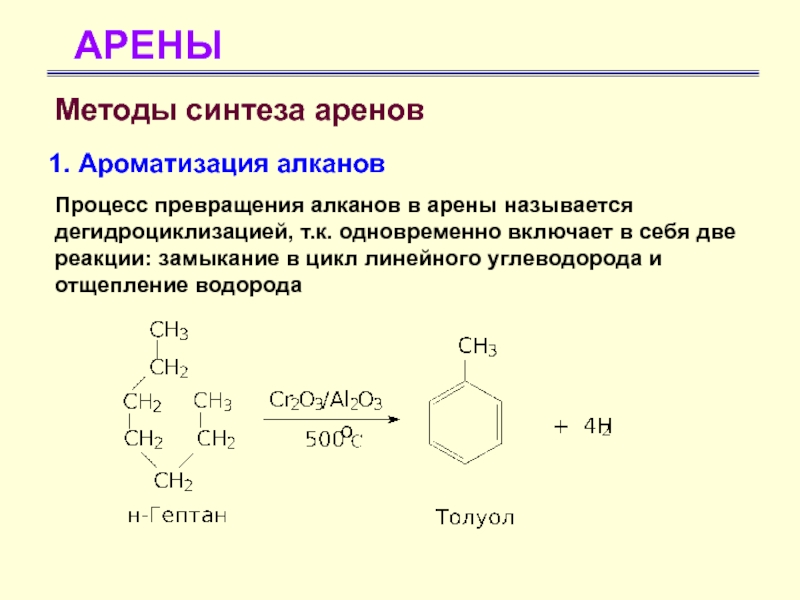
- 64. АРЕНЫМетоды синтеза аренов 1. Ароматизация алкановПроцесс превращения
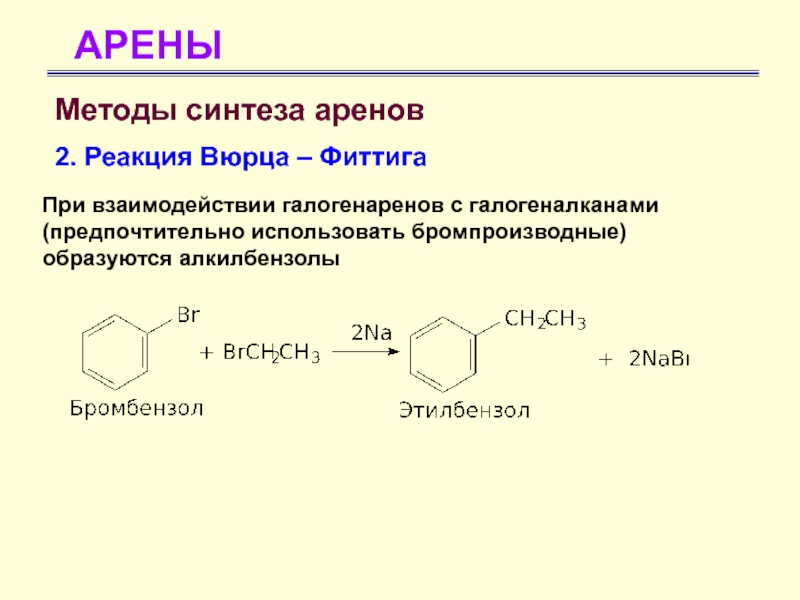
- 65. АРЕНЫМетоды синтеза аренов 2. Реакция Вюрца –
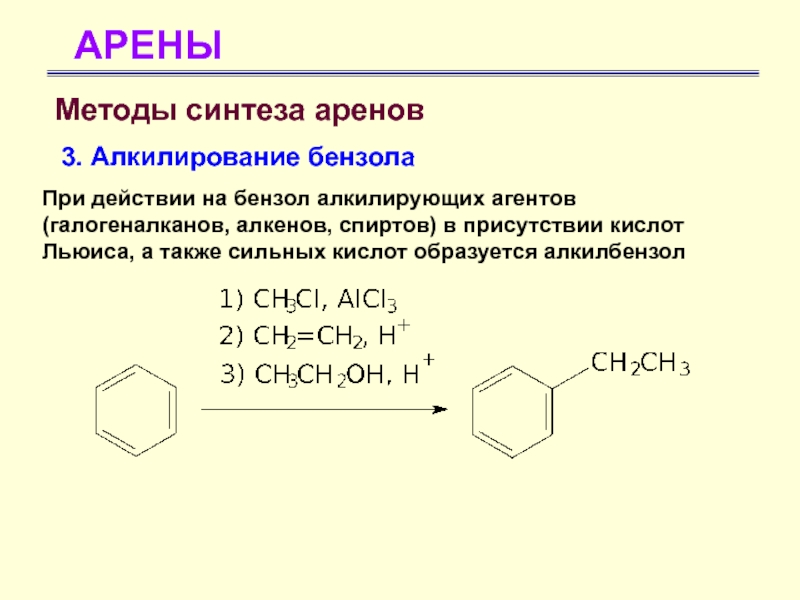
- 66. АРЕНЫМетоды синтеза аренов 3. Алкилирование бензола При
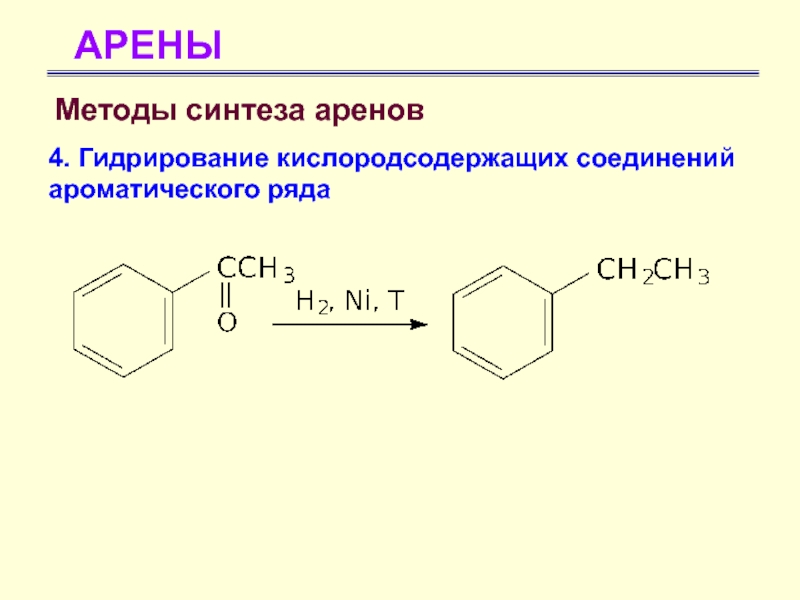
- 67. АРЕНЫМетоды синтеза аренов 4. Гидрирование кислородсодержащих соединений ароматического ряда
- 68. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2АРЕНЫ
Ароматические соединения, или арены, — большая группа соединений карбоциклического ряда,
Слайд 4АРЕНЫ
В современной химической литературе понятие “соединение ароматического ряда” означает сходство
химических свойств соединения со свойствами бензола и не связаны с
запахом соединений.В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением и можно ожидать, что для него характерна тенденция вступать в типичные для алкенов реакции присоединения. Однако в условиях, в которых алкен быстро вступает в реакции присоединения, бензол не реагирует или реагирует медленно
Слайд 6АРЕНЫ
Бензол не вступает в реакции присоединения, в которых разрушилась бы
π-электронная система бензольного кольца. Такая устойчивость называется кинетической. Она связана
со значительной величиной энергии активации. Вместе с тем бензол достаточно легко вступает в реакции замещения. Образующиеся при этом продукты сохраняют специфическую структуру бензолаСлайд 7АРЕНЫ
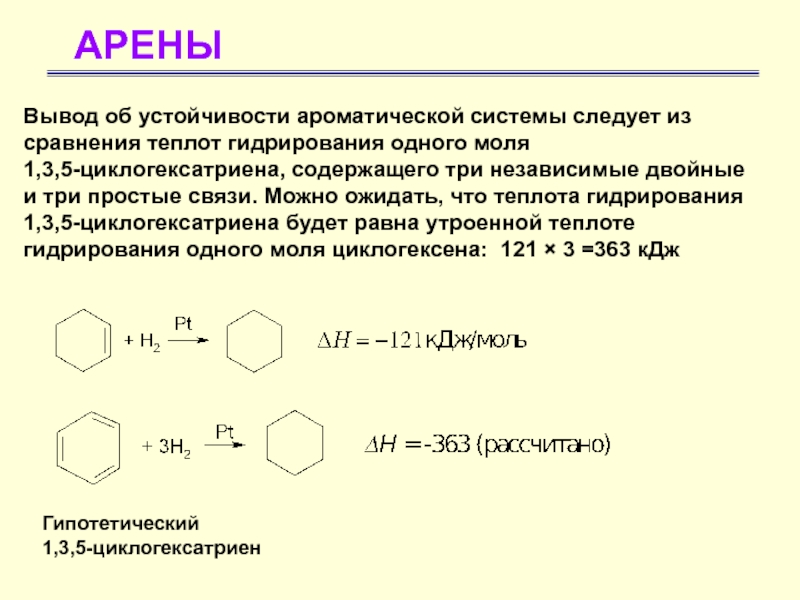
Вывод об устойчивости ароматической системы следует из сравнения теплот гидрирования
одного моля
1,3,5-циклогексатриена, содержащего три независимые двойные и три простые
связи. Можно ожидать, что теплота гидрирования 1,3,5-циклогексатриена будет равна утроенной теплоте гидрирования одного моля циклогексена: 121 × 3 =363 кДж Гипотетический
1,3,5-циклогексатриен
Слайд 8АРЕНЫ
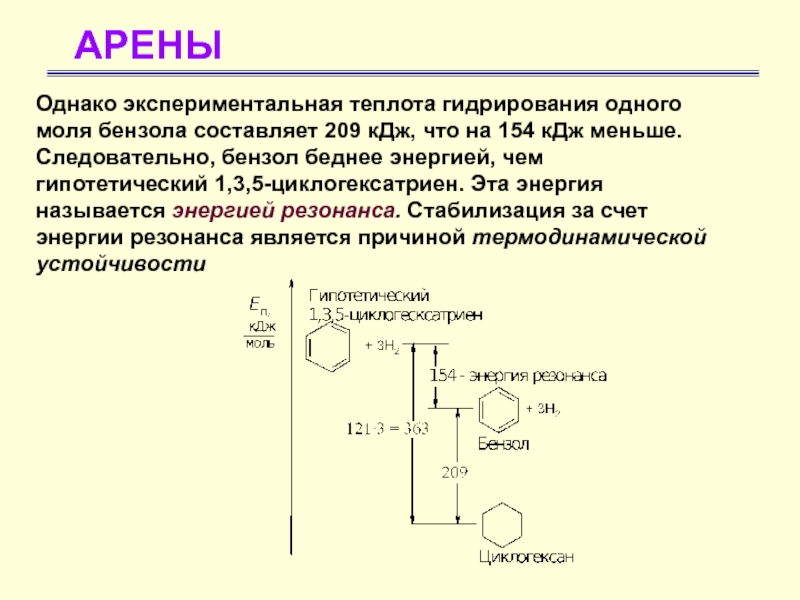
Однако экспериментальная теплота гидрирования одного моля бензола составляет 209 кДж,
что на 154 кДж меньше. Следовательно, бензол беднее энергией, чем
гипотетический 1,3,5-циклогексатриен. Эта энергия называется энергией резонанса. Стабилизация за счет энергии резонанса является причиной термодинамической устойчивостиСлайд 9АРЕНЫ
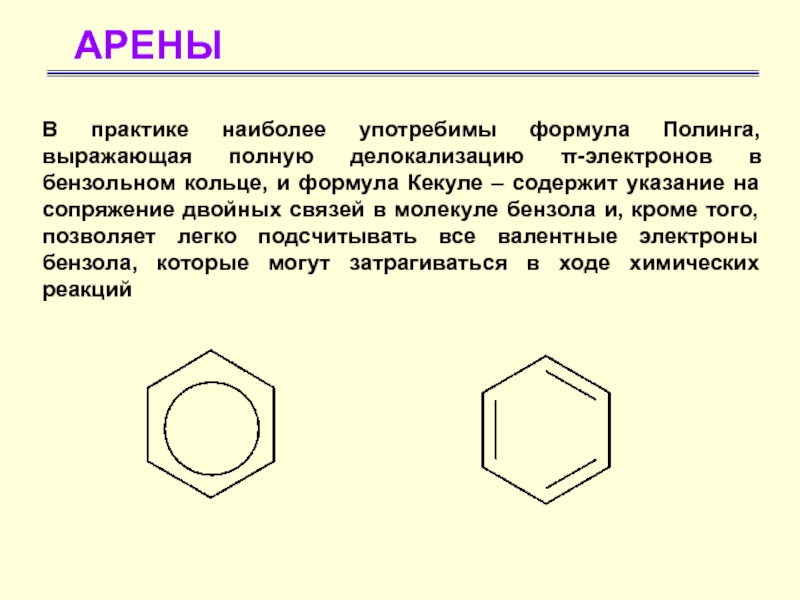
В практике наиболее употребимы формула Полинга, выражающая полную делокализацию π-электронов
в бензольном кольце, и формула Кекуле – содержит указание на
сопряжение двойных связей в молекуле бензола и, кроме того, позволяет легко подсчитывать все валентные электроны бензола, которые могут затрагиваться в ходе химических реакций
Слайд 12АРЕНЫ
«Ароматичность» – совокупность особых
свойств бензола
Э.Хюккель вывел правило (1931)
Правило
Хюккеля: плоские моноциклические соединения, содержащие замкнутую сопряженную систему (4n +
2) π-электронов, где n = 1, 2, 3 … (т.е. соединения, содержащие 2, 6, 10, 14 π-электронов в цикле), являются ароматическимиСлайд 14АРЕНЫ
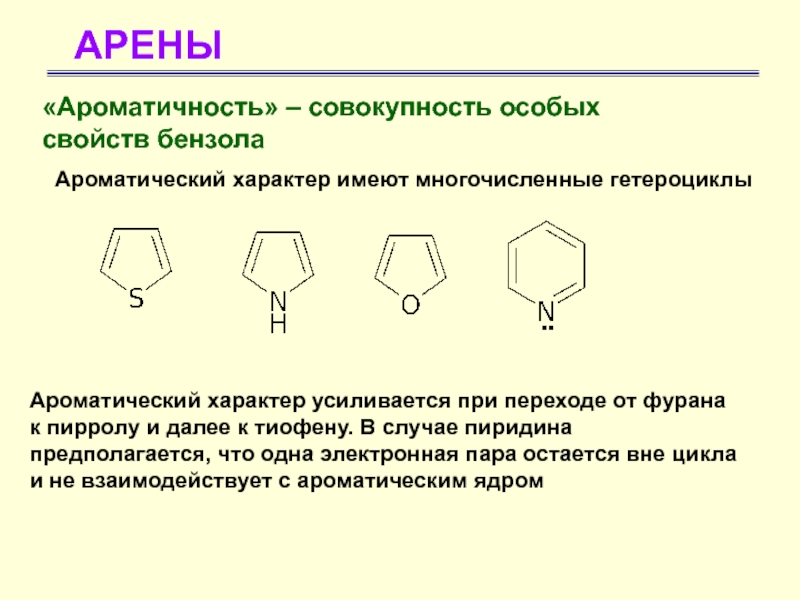
«Ароматичность» – совокупность особых
свойств бензола
Ароматический характер имеют многочисленные
гетероциклы
Ароматический характер усиливается при переходе от фурана к пирролу и
далее к тиофену. В случае пиридина предполагается, что одна электронная пара остается вне цикла и не взаимодействует с ароматическим ядром Слайд 16АРЕНЫ
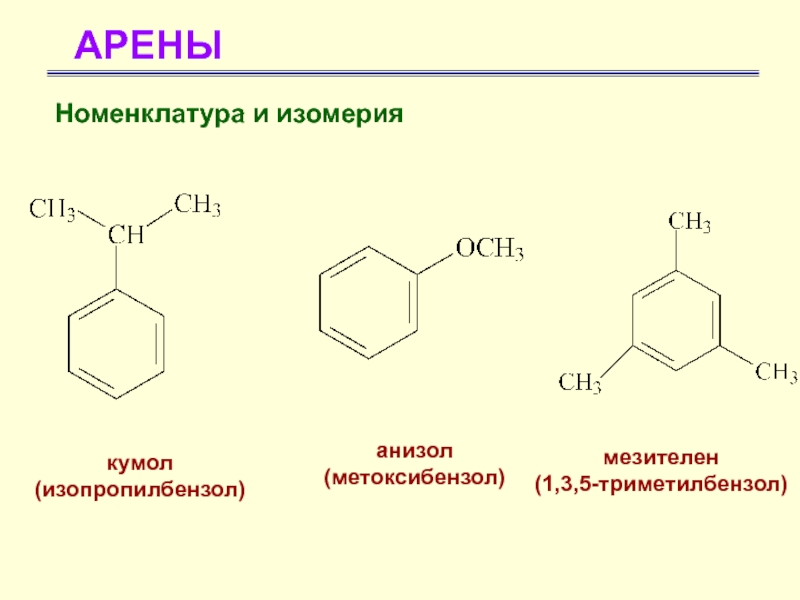
Номенклатура и изомерия
кумол
(изопропилбензол)
анизол
(метоксибензол)
мезителен
(1,3,5-триметилбензол)
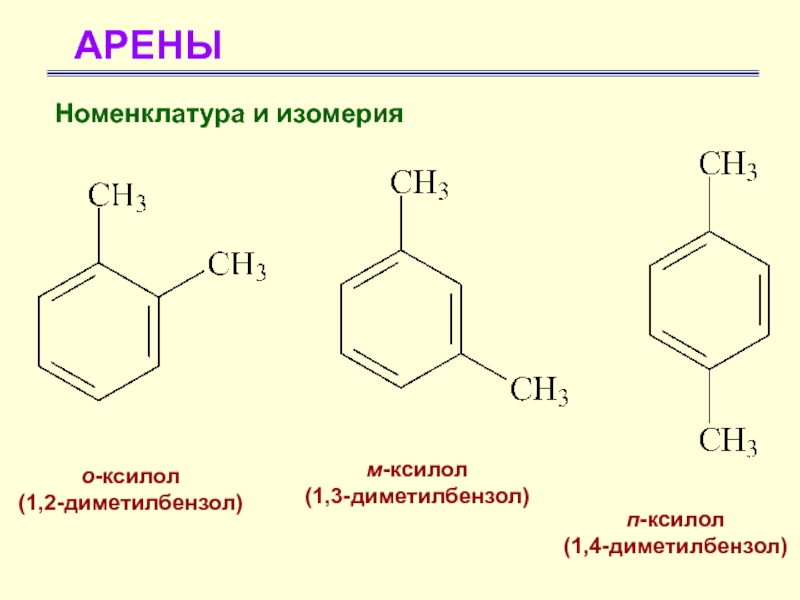
Слайд 18АРЕНЫ
о-ксилол
(1,2-диметилбензол)
м-ксилол
(1,3-диметилбензол)
п-ксилол
(1,4-диметилбензол)
Номенклатура и изомерия
Слайд 20АРЕНЫ
Химические свойства аренов
Электрофильное замещение в ароматическом ядре
Для бензола
характерны реакции замещения атома водорода ароматического ядра, в которых сохраняется
устойчивая шести π-электронная ароматическая системаМеханизм SEAr
Слайд 22АРЕНЫ
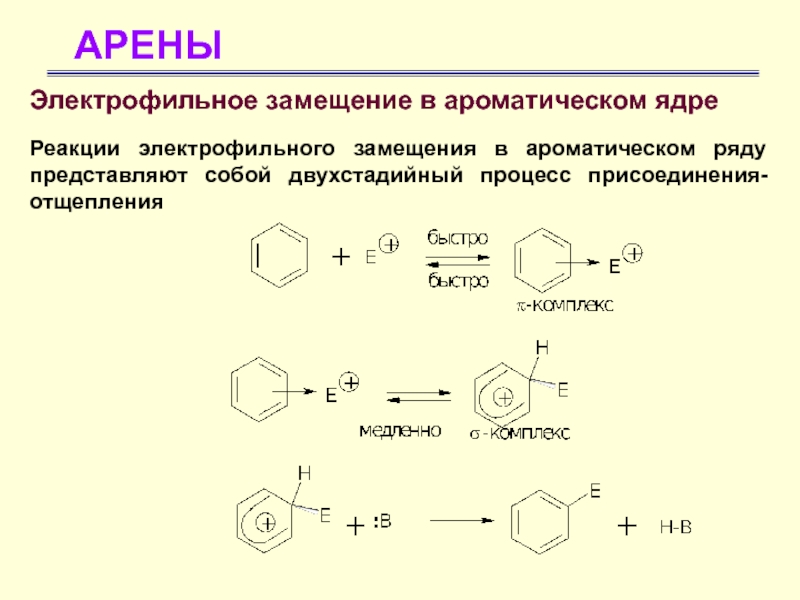
Электрофильное замещение в ароматическом ядре
Реакции электрофильного замещения в ароматическом
ряду представляют собой двухстадийный процесс присоединения-отщепления
Слайд 23АРЕНЫ
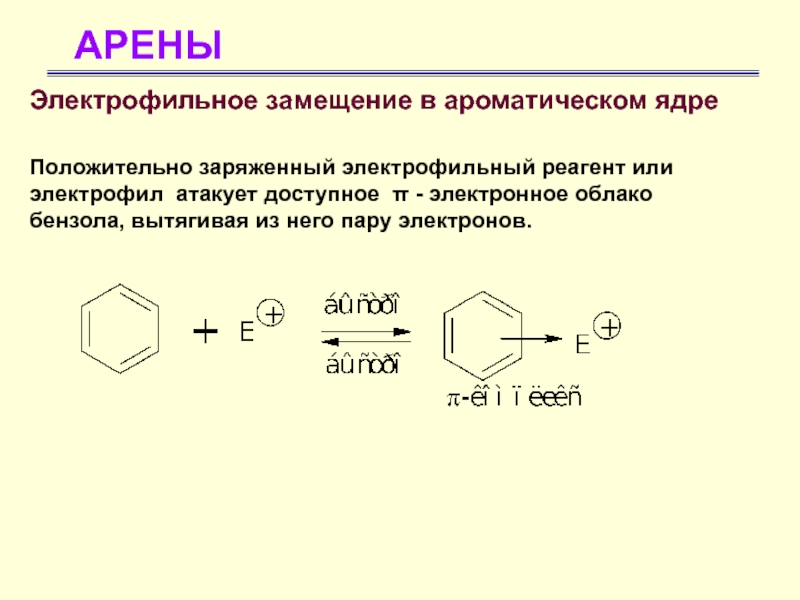
Электрофильное замещение в ароматическом ядре
Положительно заряженный электрофильный реагент или
электрофил атакует доступное π - электронное облако бензола, вытягивая из
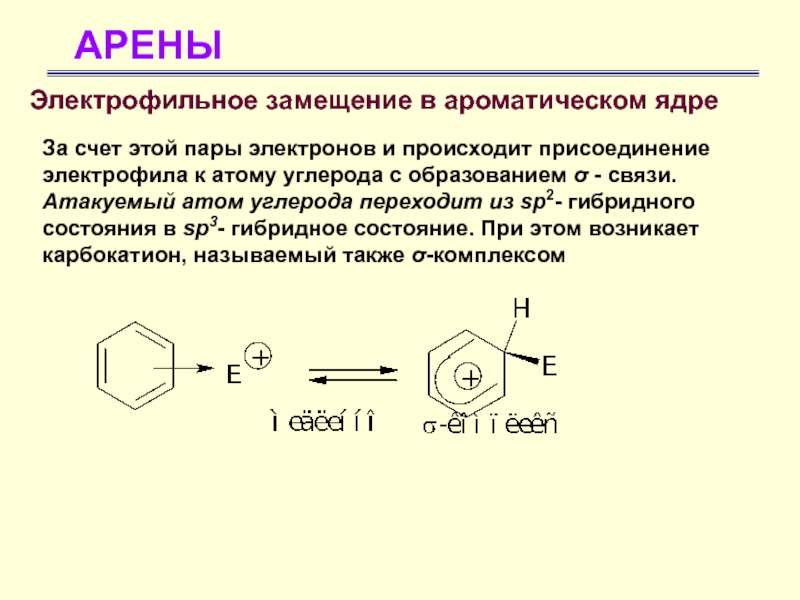
него пару электронов.Слайд 24АРЕНЫ
Электрофильное замещение в ароматическом ядре
За счет этой пары электронов
и происходит присоединение электрофила к атому углерода с образованием σ
- связи. Атакуемый атом углерода переходит из sp2- гибридного состояния в sp3- гибридное состояние. При этом возникает карбокатион, называемый также σ-комплексомСлайд 25АРЕНЫ
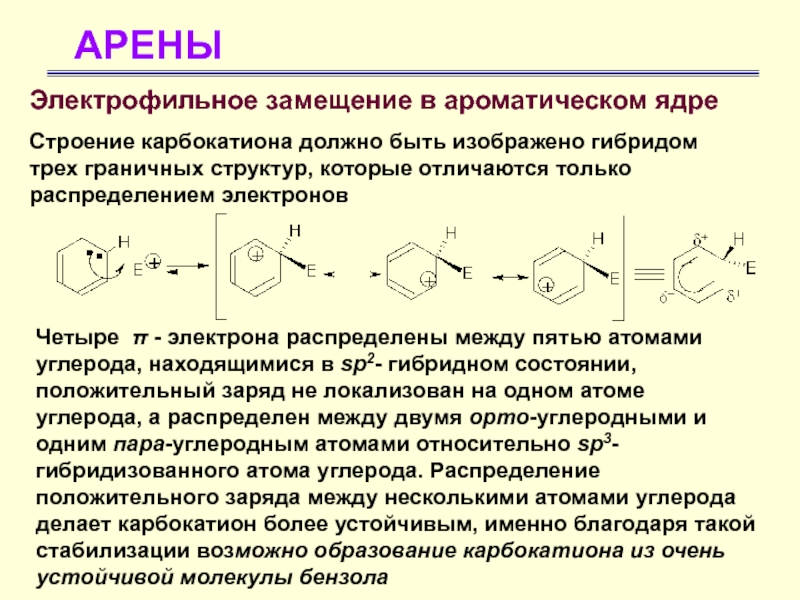
Электрофильное замещение в ароматическом ядре
Строение карбокатиона должно быть изображено
гибридом трех граничных структур, которые отличаются только распределением электронов
Четыре
π - электрона распределены между пятью атомами углерода, находящимися в sp2- гибридном состоянии, положительный заряд не локализован на одном атоме углерода, а распределен между двумя орто-углеродными и одним пара-углеродным атомами относительно sp3- гибридизованного атома углерода. Распределение положительного заряда между несколькими атомами углерода делает карбокатион более устойчивым, именно благодаря такой стабилизации возможно образование карбокатиона из очень устойчивой молекулы бензола Слайд 26АРЕНЫ
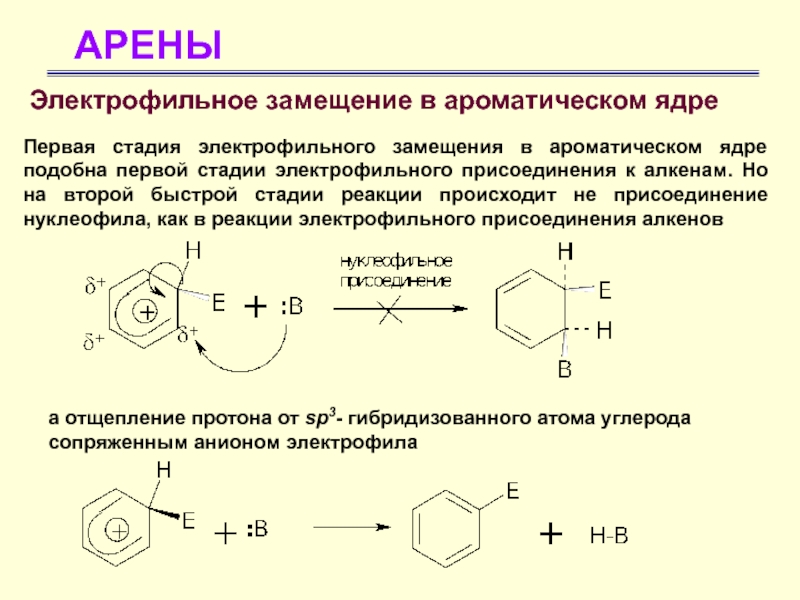
Электрофильное замещение в ароматическом ядре
Первая стадия электрофильного замещения в
ароматическом ядре подобна первой стадии электрофильного присоединения к алкенам. Но
на второй быстрой стадии реакции происходит не присоединение нуклеофила, как в реакции электрофильного присоединения алкенова отщепление протона от sp3- гибридизованного атома углерода сопряженным анионом электрофила
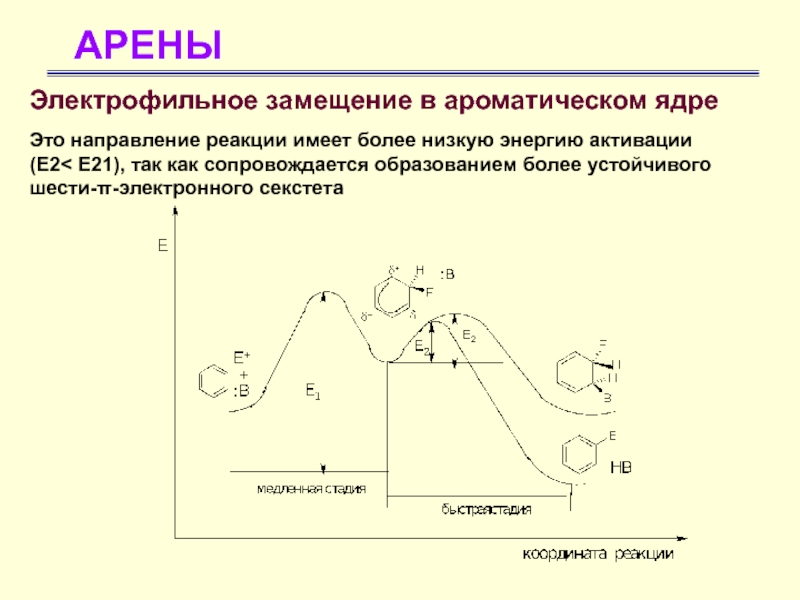
Слайд 27АРЕНЫ
Электрофильное замещение в ароматическом ядре
Это направление реакции имеет более
низкую энергию активации
(Е2< Е21), так как сопровождается образованием более
устойчивого шести-π-электронного секстета
Слайд 28АРЕНЫ
Галогенирование
При галогенировании электрофил образуется в реакции галогена с катализатором
- кислотой Льюиса (AlCl3, FeCl3 и др)
Комплексообразование с кислотой Льиса
ведет к появлению частиного или целого положительного заряда на одном из атомов в молекуле хлора Слайд 29АРЕНЫ
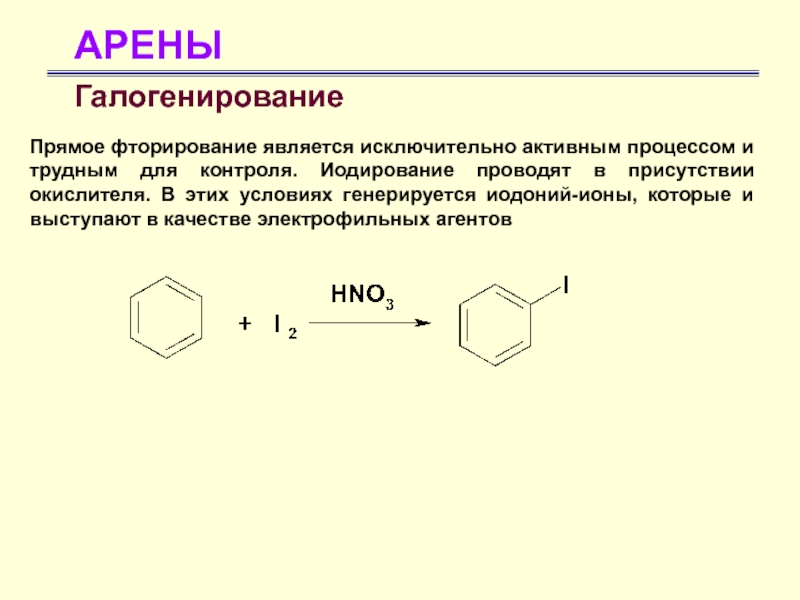
Галогенирование
Прямое фторирование является исключительно активным процессом и трудным для
контроля. Иодирование проводят в присутствии окислителя. В этих условиях генерируется
иодоний-ионы, которые и выступают в качестве электрофильных агентов
Слайд 30АРЕНЫ
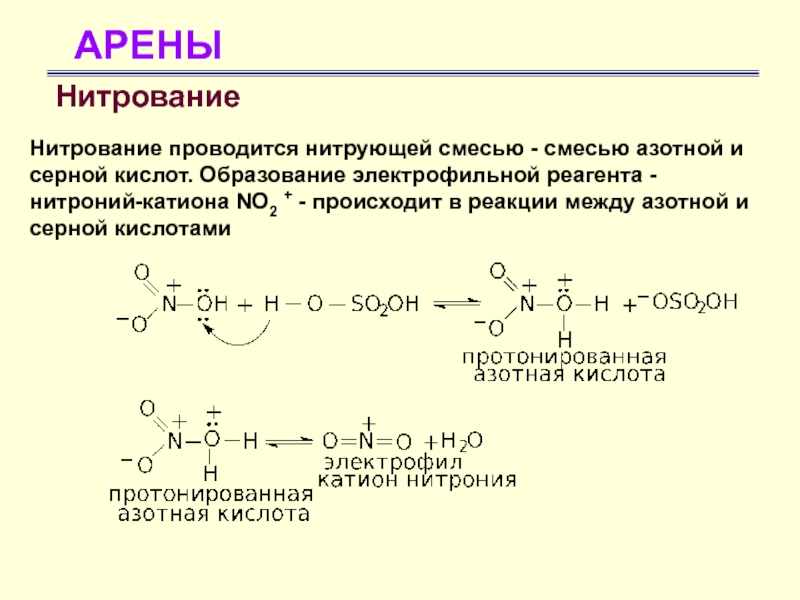
Нитрование
Нитрование проводится нитрующей смесью - смесью азотной и серной
кислот. Образование электрофильной реагента - нитроний-катиона NO2 + - происходит
в реакции между азотной и серной кислотамиСлайд 31АРЕНЫ
В реакции сульфирования в качестве сульфирующих реагентов чаще всего применяют
концентрированную серную кислоту, олеум (дымящая серная кислота – раствор SO3
в H2SO4), свободный триоксид серы SO3, а также хлорсульфоновую кислоту HSO3ClСульфирование
Атаку ароматического субстрата осуществляет атом серы, поскольку он сильно положительно поляризован, т.е. электронодефицитен
Слайд 32АРЕНЫ
Сульфирование
Механизм сульфирования может быть представлен следующим образом
Электрофильный агент присоединяется
к бензольному кольцу, давая промежуточный карбониевый ион. На стадии (3)
происходит отрыв иона водорода от резонансно-стабилизированного продукта с образованием аниона бензолсульфокислотыСлайд 33АРЕНЫ
Сульфирование
Поскольку последняя является сильной кислотой, то она сильно диссоциирована
(стадия 4)
Слайд 34АРЕНЫ
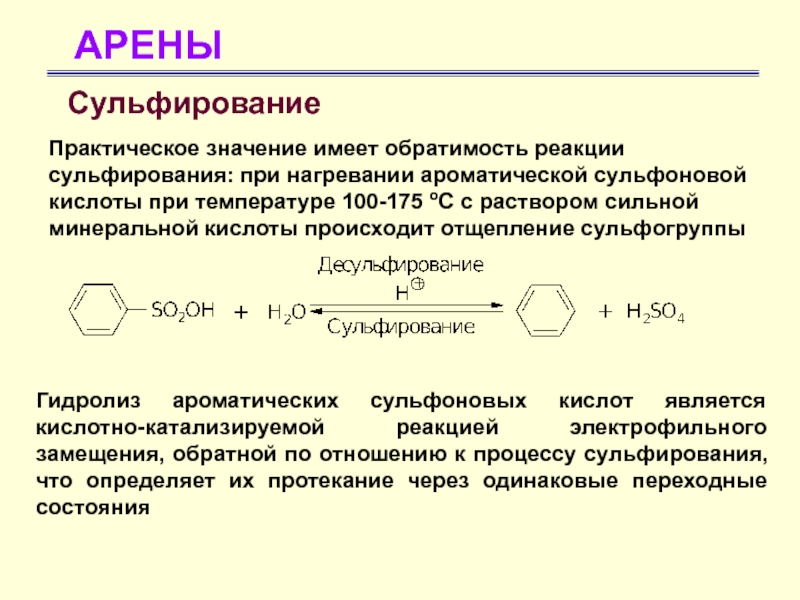
Сульфирование
Практическое значение имеет обратимость реакции сульфирования: при нагревании ароматической
сульфоновой кислоты при температуре 100-175 оС с раствором сильной минеральной
кислоты происходит отщепление сульфогруппыГидролиз ароматических сульфоновых кислот является кислотно-катализируемой реакцией электрофильного замещения, обратной по отношению к процессу сульфирования, что определяет их протекание через одинаковые переходные состояния
Слайд 35АРЕНЫ
Алкилирование
Алкилирование — введение алкильной группы в молекулу органического соединения (например,
в бензольное кольцо).
Реакция Фриделя—Крафтса
Слайд 36АРЕНЫ
Алкилирование
Крафтс (Crafts) Джеймс Мейсон
(8.3.1839 — 20.6.1917, США)
Фридель (Friedel) Шарль
(12.3.1832 — 20.4.1899, Франция)
Слайд 37АРЕНЫ
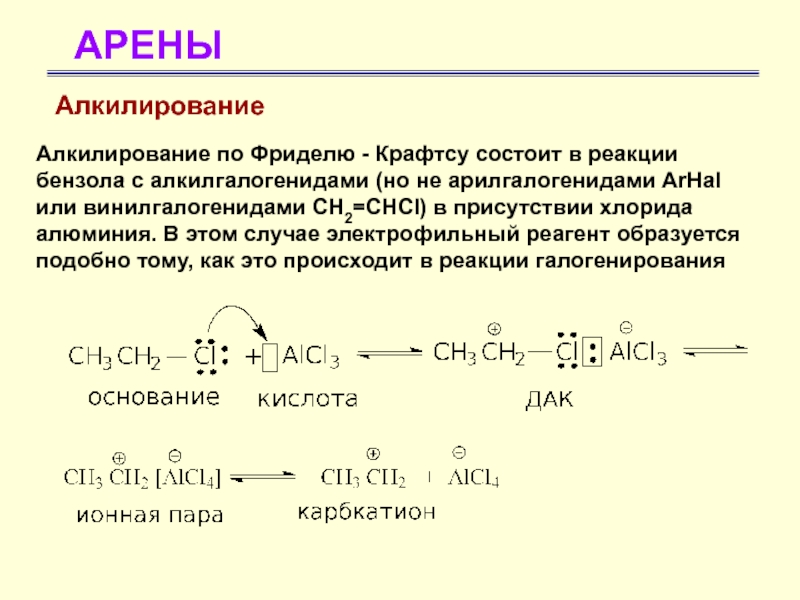
Алкилирование
Алкилирование по Фриделю - Крафтсу состоит в реакции бензола с
алкилгалогенидами (но не арилгалогенидами ArHal или винилгалогенидами CH2=CHCl) в присутствии
хлорида алюминия. В этом случае электрофильный реагент образуется подобно тому, как это происходит в реакции галогенированияСлайд 38АРЕНЫ
Алкилирование
В более сложных первичных и вторичных галогеналканах первоначально образующийся карбокатион
перегруппировывается в более устойчивый за счет миграции гидридиона или алкиланиона
Слайд 39АРЕНЫ
Алкилирование
При применении алкенов как алкилирующих агентов в качестве катализатора применяют
смеси HCl + AlCl3 и HF + BF3
Алкилирование спиртами
проводят в присутствии сильных минеральных кислот (H2SO4, H3PO4) или BF3Слайд 40АРЕНЫ
Алкилирование
Реакцию алкилирования трудно остановить на стадии монозамещения вследствие того, что
введение одного алкильного заместителя приводит к активированию ядра по отношению
к дальнейшему алкилированию. Поэтому для получения моноалкилбензолов необходимо использовать большой избыток бензола
Слайд 43АРЕНЫ
Алкилирование
Недостатки реакции алкилирования
3. Диспропорционирование продуктов
Алкилирование – обратимый, термодинамически контролируемый
процесс.
Слайд 44АРЕНЫ
Алкилирование
Ограничения алкилирования по Фриделю-Крафтсу связанные с группами,
которые уже имеются
в ароматическом кольце:
соединения, содержащие только электроноакцепторные группы
(-NO2, -COOH,
-CHO, -CN) не алкилируются;2) ароматические соединения с группами –NH2, -NHR, -NR2, -OH
не вступают в реакции алкилирования по Фриделю-Крафтсу из-за
связывания кислоты Льюиса основными группами с образованием
межмолекулярного ДАК.
Слайд 46АРЕНЫ
Ацилирование
Ацилирование — введение в молекулу органического соединения ацильной группы
В
качестве ацилирующих агентов используют ацилгалогениды и ангидриды карбоновых кислот
Слайд 47АРЕНЫ
Ацилирование
В качестве ацилирующих агентов используют ацилгалогениды и ангидриды карбоновых
кислот
В реакцию ацилирования необходимо вводить эквимолекулярное количество катализатора, так как
хлорид алюминия выводится из реакционной среды, давая устойчивое соединение с образующимся продуктом Слайд 48АРЕНЫ
Ацилирование
В реакции алкилирования и ацилирования не вступают соединения, содержащие
только электроноакцепторные группы (-NO2, -COOH, -CN).
Ароматические кольца с группами
(-NH2, -NHR, -NR2) не вступают в реакцию Фриделя-Крафтса из-за связывания кислоты Льюиса с основаниями Слайд 52АРЕНЫ
Ацилирование
Преимущества ацилирования по Фриделю-Крафтсу:
1. При ацилировании вводится только одна
ацильная группа, поскольку ароматические кетоны не вступают в дальнейшую реакцию
ацилирования (так же, как и другие арены, содержащие сильные электроноакцепторные группы).2. Еще одним преимуществом этой реакции является отсутствие перегруппировок в ацилирующем агенте.
3. Кроме того, для ацилирования не характерны реакции
диспропорционирования продуктов.
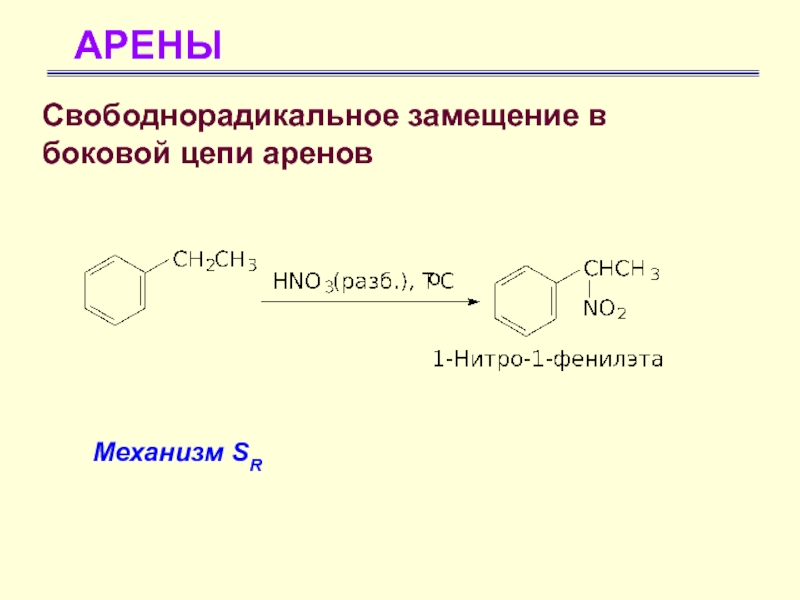
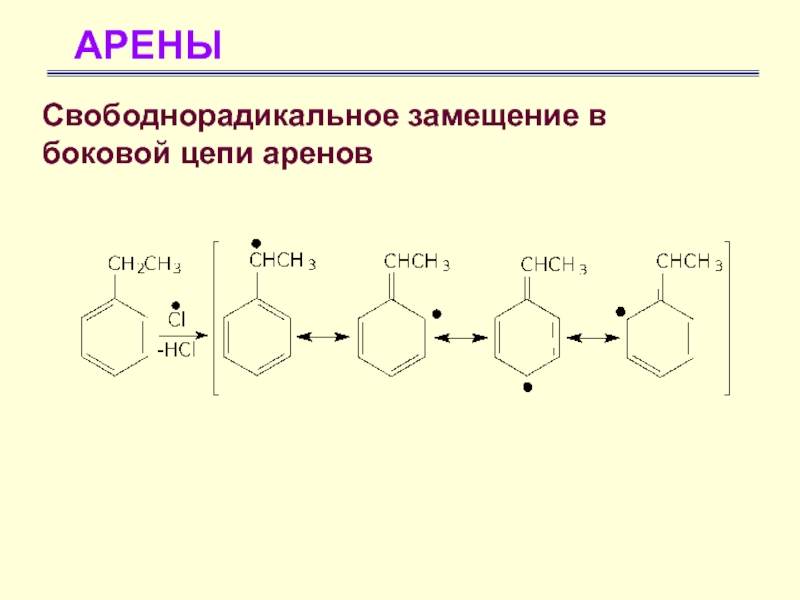
Слайд 56АРЕНЫ
Свободнорадикальное замещение в
боковой цепи аренов
Для бензола не характерно
свободнорадикальное замещение, так как он не содержит sp3-гибридного углерода. Реакции
свободнорадикального замещения аренов: галогенирование, нитрование происходят в боковой цепи (алкильной группе)Механизм SR