Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АТОМ РЕЗЕРФОРДА -БОРА
Содержание
- 1. АТОМ РЕЗЕРФОРДА -БОРА
- 2. Атомная физика - это наука об электронном
- 3. Школа древнегреческих атомистовДемокрит(ок.460-ок.370 до н.э.)Левкипп(V в.
- 4. ? Легенда о яблоке
- 5. «… остаётся признать неизбежно Существованье того,
- 6. Закономерности в атомных спектрах.хИтак, что же такое
- 7. Линейчатые спектры испускания и поглощения света.
- 8. Линейчатые спектры испускания и поглощения света.
- 9. Линейчатые спектры испускания и поглощения света. Спектральные серии.Формула Бальмера (первоначальный вид):
- 10. Бальмер установил, что длины волн серии в
- 11. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий:
- 12. Обобщенная формула Бальмера где k = 1, 2,
- 13. Атом сложная система, имеющая сложный спектрВидимая областьИнфракрасная обл.Ультрафиолетовая обл.
- 14. Были предложены различные модели строения атома. 1
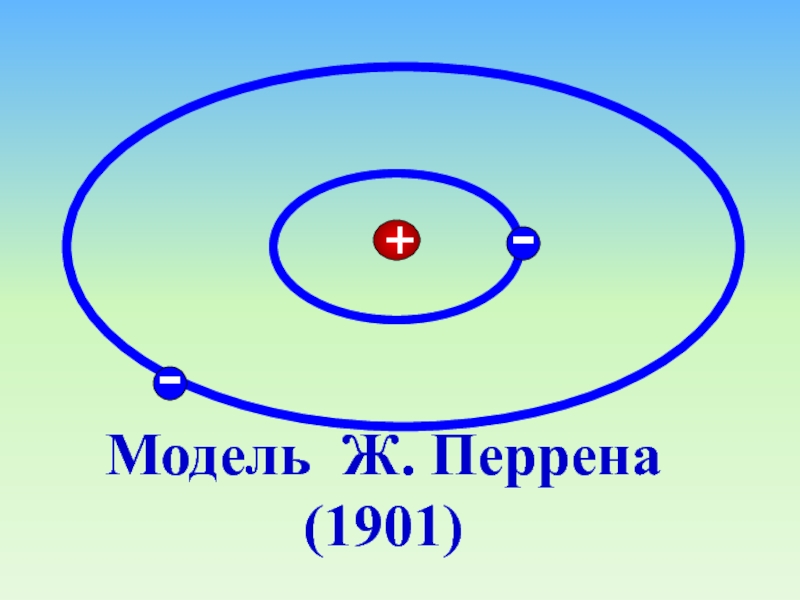
- 15. Модель Ж. Перрена (1901)
- 16. Следующий шаг - «сатурноподобная» модель Нагаоке. Здесь
- 17. х В 1903 году Дж. Дж. Томсон, предложил
- 18. Джозеф-Джон Томсон (1856-1940) - английский физик, Нобелевская
- 19. Какая из моделей верна?
- 20. Эрнест Резерфорд (1871 - 1937). Лауреат Нобелевской
- 21. Схема опыта Резерфорда по рассеянию α-частиц.
- 22. Большинство α-частиц рассеивалось на углы
- 23. Рассеяние a-частиц золотой фольгойЕдинственным правдоподобным объяснением рассеяния
- 24. Малая вероятность отклонения на большие углы свидетельствует
- 25. Слайд 25
- 26. Слайд 26
- 27. Резерфорд потом вспоминал: "это было самым невероятным
- 28. 10-15м Радиус ядра R
- 29. Однако, планетарная модель
- 30. К великому сожалению Резерфорда, статья была
- 31. Планетарная модель атома противоречит электродинамике Максвелла!!!
- 32. Согласно теории Максвелла, ускоренно движущийся заряд излучает электромагнитные волны.
- 33. При движении по окружности имеется центростремительное ускорение.
- 34. Нестабильный атом?!Падать на ядро!
- 35. Попыткой спасения планетарной модели атома стали постулаты Н. Бора
- 36. хЭлементарная теория Бора. БОР Нильс Хендрик Давид
- 37. 1. Атом следует описывать как «пирамиду» стационарных
- 38. Слайд 38
- 39. 2. При переходах между стационарными состояниями атом
- 40. ЕnEm > En Поглощение энергии
- 41. ЕnEm > En Излучение энергии
- 42. Резерфорд в письме Бору сразу же указал
- 43. Немного цитат ☺«Если это правильно, то это
- 44. Немного цитат ☺«Законы квантования в своей теперешней
- 45. Теория Бора
- 46. 1. Электроны движутся только по определенным (стационарным)
- 47. 2. Излучение или поглощение энергии в виде
- 48. х Уравнение движения
- 49. Радиус первой орбиты водородного атома называют Боровским
- 50. Внутренняя энергия атома слагается из кинетической
- 51. В основном состоянии (n=1) полная энергия электрона
- 52. хВидимая областьИнфракрасная обл.Ультрафиолетовая обл.Основное состояние
- 53. При переходе электрона в атоме водорода из
- 54. Лабораторная работа №4 Определение постоянной Ридберга и энергетических уровней атома водорода
- 55. Экспериментальная установка для исследования спектра атома водорода.
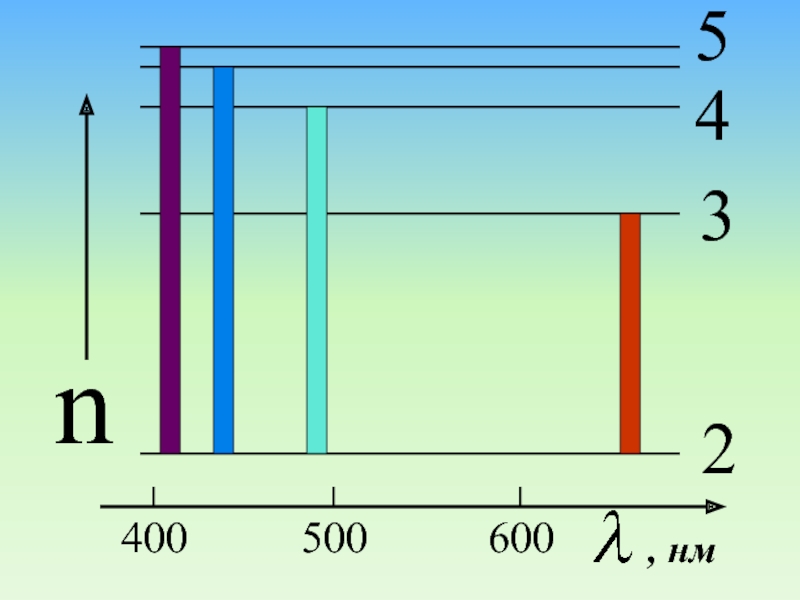
- 56. 400500600n2 345, нм
- 57. В каких пределах должна лежать энергия бомбардирующих
- 58. Решение (продолжение). При столкновении бомбардирующий электрон не может
- 59. Слайд 59
- 60. Бор продемонстрировал объяснительную силу своей модели и
- 61. Серьезным успехом теории Бора явилось: вычисление постоянной
- 62. Лабораторная работа №17 Опыт Франка и Герца
- 63. хОпыт Франка и Герца. Существование дискретных
- 64. В трубке, заполненной парами ртути при давлении
- 65. х Зависимость тока через гальванометр (Г) от разности
- 66. Такой ход кривой объясняется тем, что вследствие
- 67. При U < 4,86
- 68. Атомы ртути, получившие при соударении с электронами
- 69. Таким образом, опыты Франка и Герца экспериментально
- 70. х Однако наряду с успехами в теории Бора
- 71. х Стало ясно, что теория Бора является лишь
- 72. Дальнейшее развитие квантовой механики привело к отказу от механической картины движения электрона в поле ядра.
- 73. КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ«Волна – частица»
- 74. Луи-де-Бройль
- 75. Иллюстрация идеи де Бройля о возникновении стоячих волн на стационарной орбите для случая n = 4.
- 76. Принцип дополнительности Н.БораВсем микрообъектам присущи и волновые,
- 77. ВернерГейзенбергМатричная механикаСоотношение неопределенностей
- 78. Соотношение неопределенностей В.ГейзенбергаМикрочастицы в принципе не имеют
- 79. ЭрвинШредингерВолновая механикаВолновое уравнение электрона – уравнение Шредингера
- 80. Распределение вероятности обнаружения электрона в атоме водорода
- 81. Классическая механика – описание частиц путем задания
- 82. Возбуждённое состояние, n=3Некоторые из возможных форм электронного
- 83. 1874 г. - Стони, из чисел Фарадея и
- 84. АТОМУ БОРА 100 ЛЕТ 2013
- 85. Что там внутри атома водорода?
- 86. На рисунке показан основной результат - данные
- 87. Слайд 87
- 88. ЛЕКЦИЯ ЗАКОНЧЕНА БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- 89. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Тема
Атом водорода по теории Бора.
1. Закономерности в атомных спектрах.
2. Ядерная
модель атомов.
Слайд 2Атомная физика - это наука об электронном строении вещества. Она
призвана объяснить его макроскопические свойства на базе микроскопического подхода.
Слайд 3
Школа древнегреческих атомистов
Демокрит
(ок.460-ок.370 до н.э.)
Левкипп
(V в. до н.э.)
Идея атомизма
(Ατομος –
«неделимый»):
Нет ничего кроме атомов и пустоты
Число атомов и их форм
бесконечноИз ничего не происходит ничего
Ничто не совершается случайно, но по необходимости.
Различие между вещами происходит от различия их атомов
Слайд 5«… остаётся признать неизбежно Существованье того, что совсем неделимо, являясь
По существу наименьшим.»
Тит
Лукреций Кар
(ок.99-55 до н.э.)
автор книги
«О природе вещей»
Слайд 6Закономерности в атомных спектрах.
х
Итак, что же такое атом?
Изолированные атомы
в виде разреженного газа или паров металлов испускают спектр, состоящий
из отдельных спектральных линий (линейчатый спектр). Изучение атомных спектров послужило ключом к познанию строения атомов.Прежде всего было замечено, что линии в спектрах расположены не беспорядочно, а сериями. Расстояние между линиями в серии закономерно уменьшается по мере перехода от длинных волн к коротким.
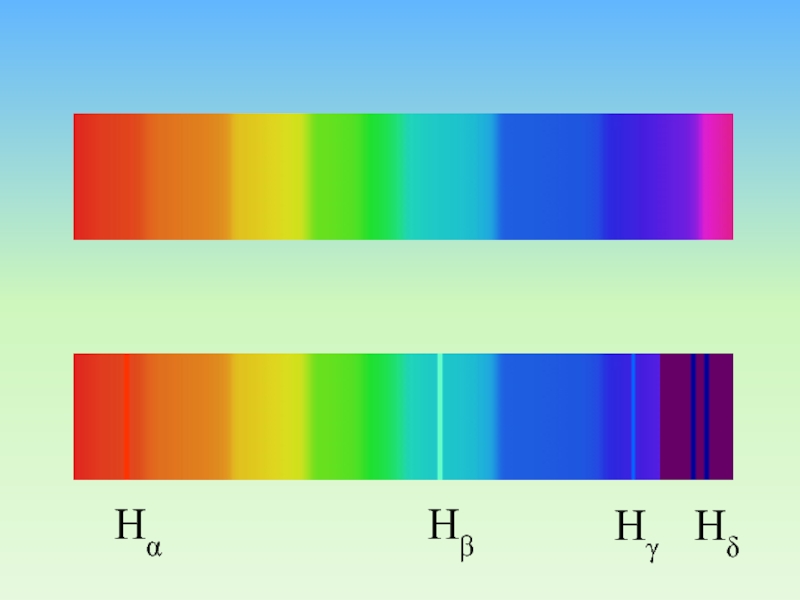
Слайд 7Линейчатые спектры испускания и поглощения света.
Спектральные серии
Линейчатые спектры дают
все вещества в газообразном
атомарном состоянии. Изолированные атомы излучают строго определенные
длины волн.Линейчатые спектры в видимой области: Спектр поглощения и спектр излучения.
Слайд 8Линейчатые спектры испускания и поглощения света.
Спектральные серии
Обнаружил закономерность в
спектральных линиях атома водорода, показав в 1885 г., что длины
волн линий видимой части спектра атома водорода связаны между собой простой зависимостью (формула Бальмера), которая дает возможность определить длины волн всех линий этой водородной серии (серия Бальмера). Это открытие послужило толчком для обнаружения других серий в спектре атома водорода – серий Лаймана, Пашена, Брэкетта и Пфунда. Был пионером в изучении структуры атома.Иоганн Бальмер
Бальмер (Balmer) Иоганн Якоб (1825–1898). Швейцарский физик и математик. Родился в Лозанне. Учился в Базеле, Карлсруэ, Берлине.
В 1849 получил степень доктора в Базельском университете.
С 1859 преподавал в средней школе, а в 1865–90 – в Базельском университете.
Слайд 9Линейчатые спектры испускания и поглощения света.
Спектральные серии.
Формула Бальмера
(первоначальный
вид):
Слайд 10 Бальмер установил, что длины волн серии в видимой части спектра
водорода могут быть представлены формулой (формула Бальмера):
х
λ0 = const,
n = 3, 4, 5,…В физике постоянной Ридберга называют и другую величину равную R = R′·2πс.
R = 2,07·1016c-1
R′ = 1,09·107 м-1 – постоянная Ридберга, n = 3,4,5,…
или
Слайд 13 Атом сложная система, имеющая сложный спектр
Видимая область
Инфракрасная обл.
Ультрафиолетовая обл.
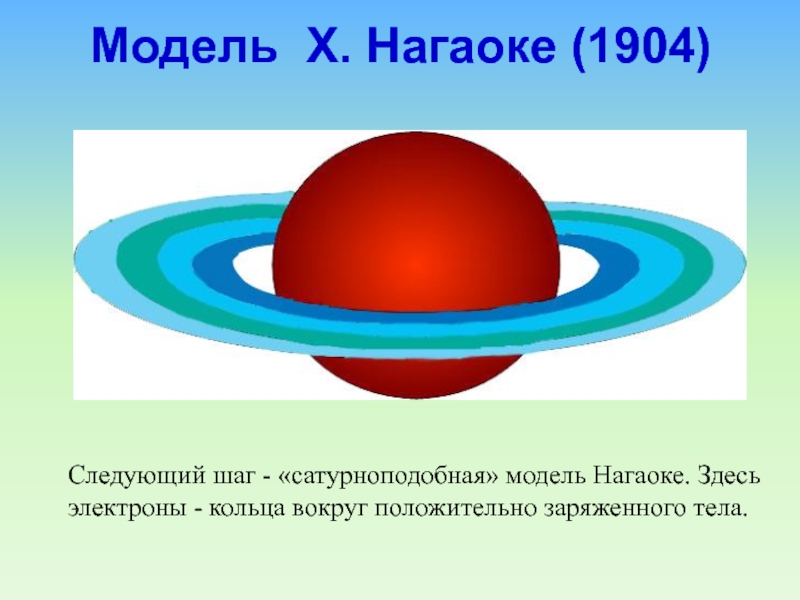
Слайд 16Следующий шаг - «сатурноподобная» модель Нагаоке. Здесь электроны - кольца
вокруг положительно заряженного тела.
Модель Х. Нагаоке (1904)
Слайд 17
х
В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера,
равномерно заполненная положительным электричеством, внутри которой находятся электроны. Суммарный заряд
сферы равен заряду электронов. Атом в целом нейтрален. Теория такого атома давала, что спектр должен быть сложным, но никоим образом не линейчатым, что противоречило экспериментам.Слайд 18Джозеф-Джон Томсон (1856-1940) - английский физик, Нобелевская премия 1906 г.
по физике за работы, которые привели к открытию электрона. В
1884-1919 гг. Томсон - профессор Кембриджского университета и руководитель Кавендишской лаборатории. С 1918 г. и до конца жизни - ректор Тринити-колледжа. Предложил модель строения атома.Атом Томсона
Слайд 20Эрнест Резерфорд (1871 - 1937).
Лауреат Нобелевской премии по химии 1908г.
«За
проведенные им исследования в области распада элементов в химии радиоактивных
веществ».Открыл альфа- и бета-излучение.
Открыл и объяснил радиоактивное превращение химических элементов, создал теорию радиоактивного распада.
Предложил и экспериментально обосновал планетарную модель атома.
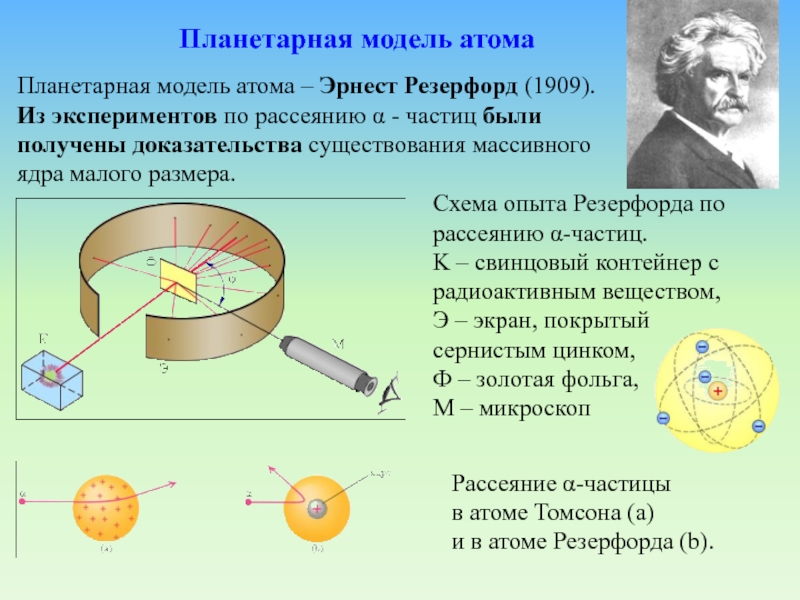
Планетарная модель атома - Эрнест Резерфорд
Слайд 21Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер
с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф
– золотая фольга, M – микроскопПланетарная модель атома – Эрнест Резерфорд (1909).
Из экспериментов по рассеянию α - частиц были получены доказательства существования массивного ядра малого размера.
Планетарная модель атома
Рассеяние α-частицы
в атоме Томсона (a)
и в атоме Резерфорда (b).
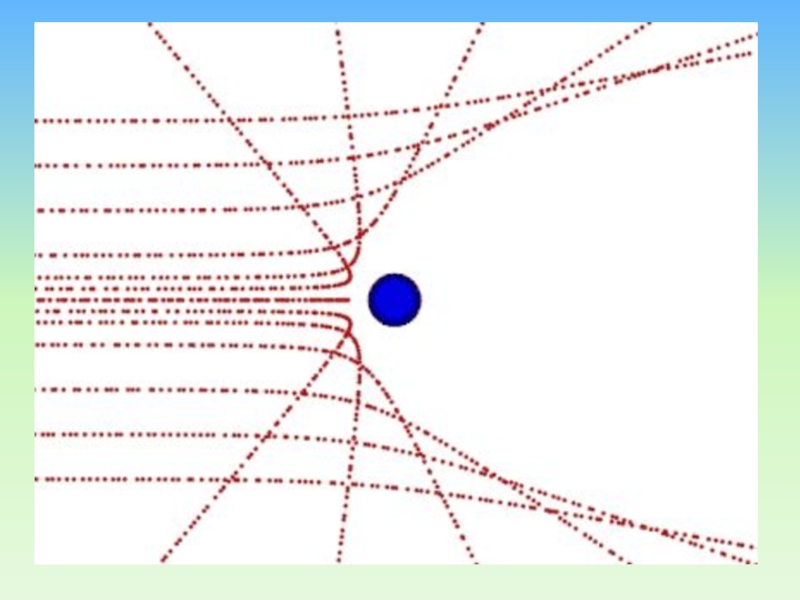
Слайд 22 Большинство α-частиц рассеивалось на углы порядка 3°
Отдельные α-частицы отклонялись на большие углы, до 150º
(одна из α-частиц)Такое отклонение возможно лишь при взаимодействии практически точечного положительного заряда – ядра атома – с близко пролетающей α-частицей.
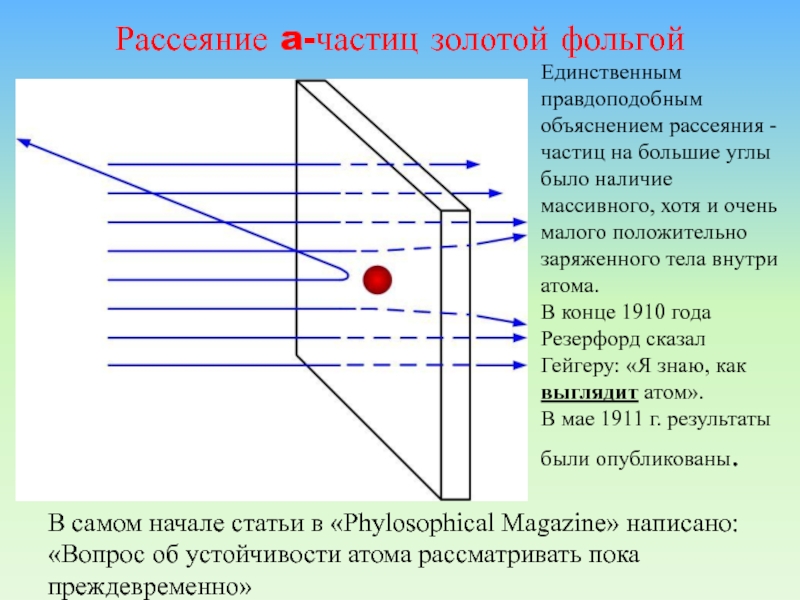
Слайд 23Рассеяние a-частиц золотой фольгой
Единственным правдоподобным объяснением рассеяния -частиц на большие
углы было наличие массивного, хотя и очень малого положительно заряженного
тела внутри атома.В конце 1910 года
Резерфорд сказал Гейгеру: «Я знаю, как выглядит атом».
В мае 1911 г. результаты были опубликованы.
В самом начале статьи в «Phylosophical Magazine» написано: «Вопрос об устойчивости атома рассматривать пока преждевременно»
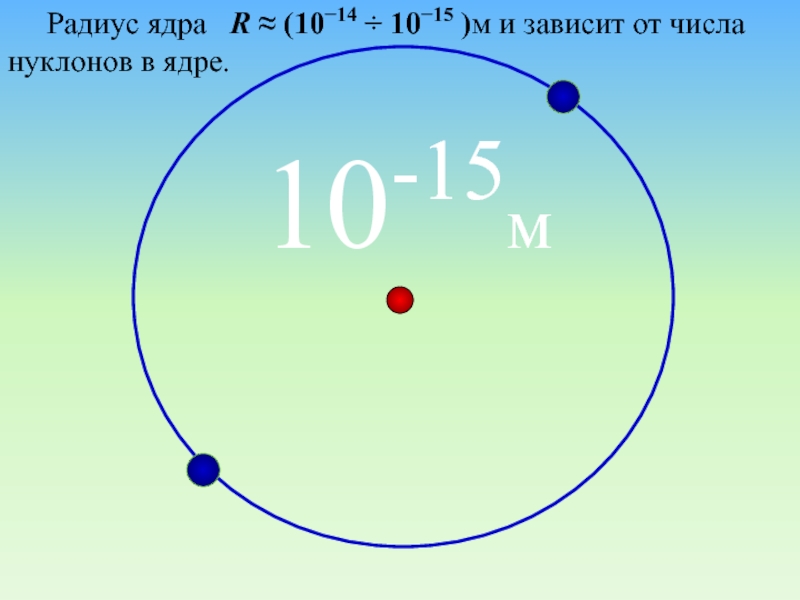
Слайд 24Малая вероятность отклонения на большие углы свидетельствует о малых размерах
ядра:
99,95% массы атома сосредоточено в ядре.
Слайд 27Резерфорд потом вспоминал: "это было самым невероятным событием моей жизни.
Это было почти столь же невероятно, как если бы выстрелили
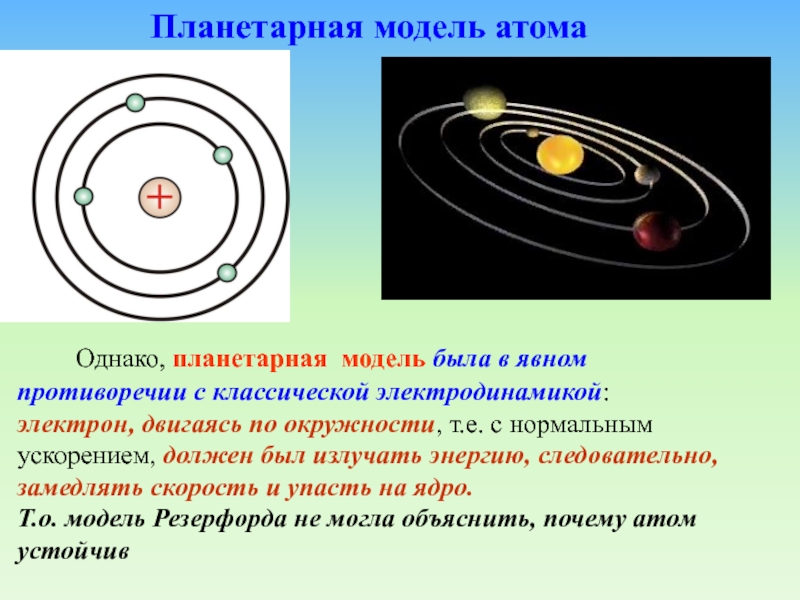
15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился к вам и нанес вам удар".Слайд 29 Однако, планетарная модель была в явном
противоречии с классической электродинамикой: электрон, двигаясь по окружности, т.е. с
нормальным ускорением, должен был излучать энергию, следовательно, замедлять скорость и упасть на ядро.Т.о. модель Резерфорда не могла объяснить, почему атом устойчив
Планетарная модель атома
Слайд 30 К великому сожалению Резерфорда, статья была встречена молчанием. Резерфорд,
конечно понимал почему. Его атом был недолговечен. Электрон, вращаясь вокруг
ядра, должен излучать электромагнитные волны и терять вследствие этого энергию. При этом скорость его должна была бы замедлиться, и он должен был бы упасть на ядро! Однако опыт свидетельствует, что практически все атомы в природе устойчивы.Слайд 33При движении по окружности имеется центростремительное ускорение. Поэтому электрон должен
терять энергию на электромагнитное излучение и падать на ядро!
Слайд 36
х
Элементарная теория Бора.
БОР Нильс Хендрик Давид (1885–1962) – выдающийся
датский физик-теоретик, один из создателей современной физики.
Сформулировал идею о
дискретностиэнергетических состояний атомов, в свете новых идей построил атомную модель, открыв условия устойчивости атомов, и объяснил большой круг явлений. Создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам. Бор много сделал для развития ядерной физики. Он – автор теории составного ядра, один из создателей капельной модели ядра и теории деления атомного ядра.
Слайд 371. Атом следует описывать как «пирамиду» стационарных энергетических состояний. Пребывая
в одном из стационарных состояний, атом не излучает энергию.
Слайд 392. При переходах между стационарными состояниями атом поглощает или излучает
квант энергии. При поглощении энергии атом переходит в более энергетическое
состояние.Слайд 42Резерфорд в письме Бору сразу же указал на главную трудность
новой теории. «Как электрон устанавливает частоту, с которой он должен
колебаться при переходе из одного стационарного состояния в другое? Видимо, Вы будете вынуждены предположить, что электрон заранее „знает", где остановиться».Реакция научного мира оказалась быстрой и бурной, сторонники и противники новой теории сталкивались в многочисленных дискуссиях. Макс Фон Лауэ сказал по поводу гипотезы Бора:
«Это вздор! Уравнения Максвелла действительны во всех обстоятельствах, и электрон должен излучать непрерывно».
Недовольство физиков старого поколения выразил лорд Джон Уильям Рэлей:
«Не берусь утверждать, что открытия так не делаются. Быть может, и делаются. Но меня такое не устраивает».
Через некоторое время всё же стало ясно: работы Бора изменили физику и задали направление её развития на весь XX век.
Слайд 43Немного цитат ☺
«Если это правильно, то это означает конец физики
как науки» (А. Эйнштейн, 1913 г.).
«Я убежден, что это учение является роковым
для здорового развития науки» (А. Шустер, 1913 г.).«Атом существует вечно, мы это бесспорно знаем. Но понимаем ли мы это? Нет, не понимаем. Наше непонимание мы прикрываем непонятными же квантовыми условиями. Процесс лучеиспускания — это акт возрождения разрушенного атома. Механизм его нам непонятен. Свое непонимание мы вновь прикрываем непонятным квантовым условием, второй гипотезой Бора... Весь этот метод Бора основан на квантовании — совершенно слепом, мало логическом процессе мысли, на формальной, если можно так выразиться, интуиции» (Д. С. Рождественский, 1919 г.).
«Теория квантов подобна другим победам в науке: месяцами вы улыбаетесь им, а затем годами плачете» (Г. Крамерс, 1920 г.).
Слайд 44Немного цитат ☺
«Законы квантования в своей теперешней формулировке носят до
некоторой степени теологический характер, для натуралиста совершенно неприемлемый, так что
многие ученые по справедливости возмущаются этими Bauern-Regeln (крестьянскими законами)» (П. Эпштейн, 1922 г.).«Мы неизмеримо далеки от такого описания атомного механизма, которое позволило бы проследить, например, все движения электрона в атоме или понять роль стационарных состояний... Теорию квантов можно сравнить с лекарством, излечивающим болезнь, но убивающим больного». (Г. Крамерс, X. Гольст, 1923 г.)
«Все это очень красиво и крайне важно, но, к сожалению, не очень понятно. Мы не понимаем ни гипотезы Планка об осцилляторах, ни запрета нестационарных орбит, и мы не понимаем, как же, в конце концов, образуется свет согласно теории Бора. Не подлежит сомнению, что механику квантов, механику дискретного, еще предстоит создать» (Г.А. Лоренц, 1923 г.).
«Физика теперь снова зашла в тупик, во всяком случае для меня она слишком трудна, и я предпочел бы быть комиком в кино или кем-нибудь вроде этого и не слышать ничего о физике!» (В. Паули, 21 мая 1925 г.).
Слайд 46
1. Электроны движутся только по определенным (стационарным) орбитам. При этом
не происходит излучения энергии.
Постулаты Бора
n = 1, 2, 3,… главное
квантовое число.
me vr = nħ
Условие для стационарных орбит:
из всех орбит электрона возможны только те, для которых момент импульса электрона, равен целому кратному постоянной Планка:
Слайд 47
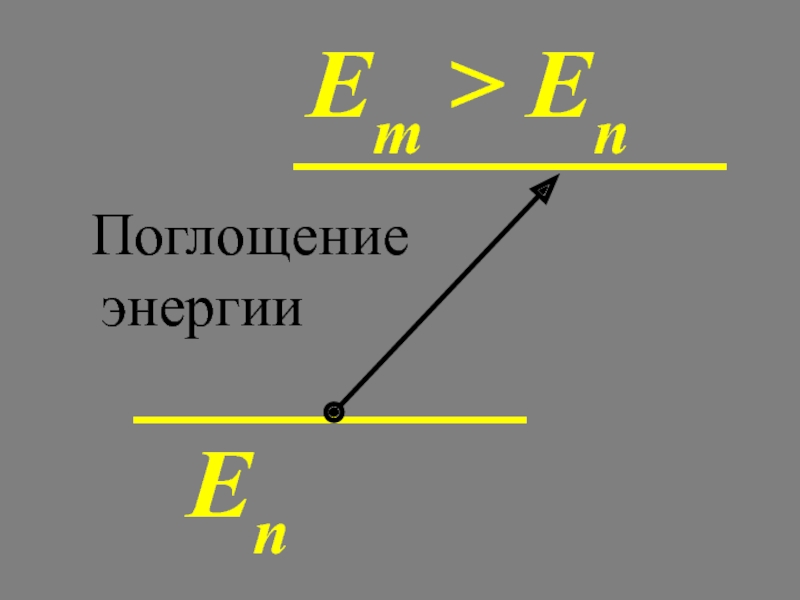
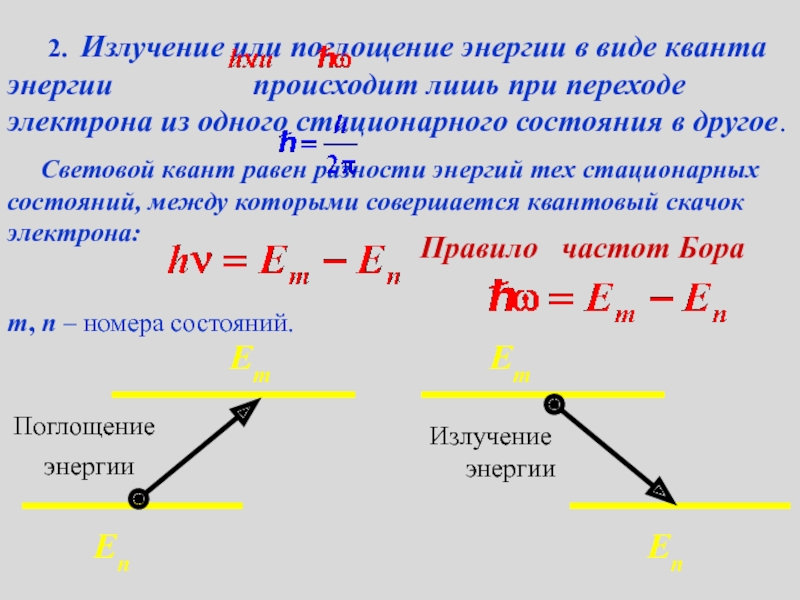
2. Излучение или поглощение энергии в виде кванта энергии
происходит лишь при
переходе электрона из одного стационарного состояния в другое.Световой квант равен разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона:
m, n – номера состояний.
Правило частот Бора
Поглощение энергии
Еn
Em
Излучение энергии
Слайд 48
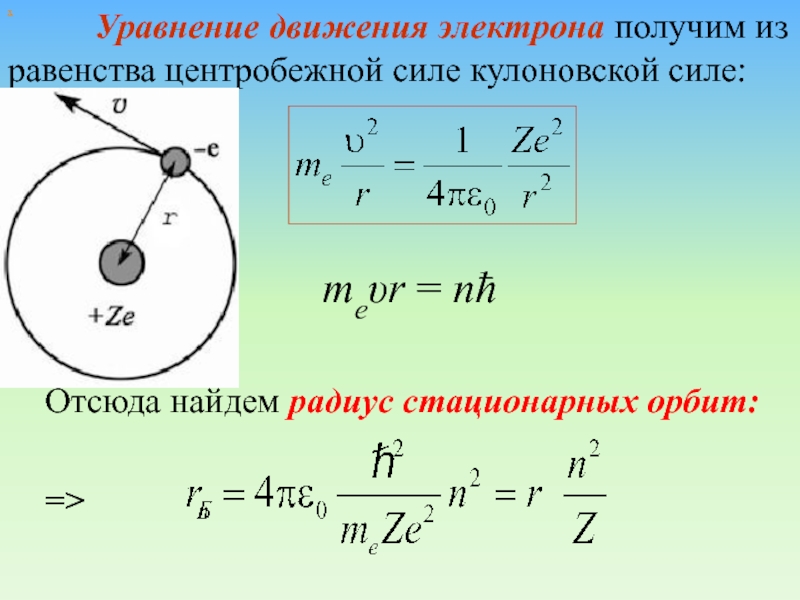
х
Уравнение движения электрона получим из
равенства центробежной силе кулоновской силе:
=>
Отсюда найдем радиус стационарных орбит:
meυr =
nħ Слайд 49 Радиус первой орбиты водородного атома называют Боровским радиусом:
При n
=1, Z = 1 для водорода имеем:
х
= 0,529·10–10
м. Å=
Слайд 50 Внутренняя энергия атома слагается из кинетической энергии электрона и
потенциальной энергией взаимодействия электрона с ядром:
Видно, что:
энергия электрона может принимать
толькодискретные значения,
т.к.n = 1, 2, 3,…
Отсюда
или
Слайд 51В основном состоянии (n=1) полная энергия электрона в атоме минимальна
и равна
где
Энергию произвольного состояния с любым номером n
удобно выражать через энергию основного состояния: Слайд 53 При переходе электрона в атоме водорода из состояния n в
состояние k излучается фотон с энергией :
х
и частота излучения,
Мы получили обобщенную формулу Бальмера, которая хорошо согласуется с экспериментом, где постоянная Ридберга
или
или
Слайд 54Лабораторная работа №4 Определение постоянной Ридберга и энергетических уровней атома
водорода
Слайд 55Экспериментальная установка для исследования спектра атома водорода. 1 – спектральная трубка;
2 – источник высокого напряжения; 3 – дифракционная решетка; 4
– измерительная шкала.Слайд 57В каких пределах должна лежать энергия бомбардирующих электронов, чтобы при
возбуждении атомов водорода ударами этих электронов спектр водорода имел только
одну спектральную линию?Решение.
Для того, чтобы было возможно наблюдать только одну спектральную линию, энергия электрона в атоме должна возрасти на величину, равную разности энергий второго и первого квантовых уровней.
Слайд 58Решение (продолжение).
При столкновении бомбардирующий электрон не может передать энергию, большую,
чем кинетическая энергия этого электрона, поэтому.
В то же время
электрон атома не должен получить энергию, достаточную для перехода на уровень номер 3. Ответ: энергия бомбардирующих электронов должна лежать пределах
Слайд 60Бор продемонстрировал объяснительную силу своей модели и другим способом. В конце
XIX века гарвардский астроном Эдвард Чарльз ПикерингБор продемонстрировал объяснительную силу своей
модели и другим способом. В конце XIX века гарвардский астроном Эдвард Чарльз Пикеринг (Edward Charles PickeringБор продемонстрировал объяснительную силу своей модели и другим способом. В конце XIX века гарвардский астроном Эдвард Чарльз Пикеринг (Edward Charles Pickering) обнаружил в излучении звезды Дзета КормыБор продемонстрировал объяснительную силу своей модели и другим способом. В конце XIX века гарвардский астроном Эдвард Чарльз Пикеринг (Edward Charles Pickering) обнаружил в излучении звезды Дзета Кормы спектральную серию, которая по структуре напоминала линии водорода, но не описывалась формулой Ридберга. В 1912 году те же линии промерил в лаборатории лондонский физик Альфред ФаулерБор продемонстрировал объяснительную силу своей модели и другим способом. В конце XIX века гарвардский астроном Эдвард Чарльз Пикеринг (Edward Charles Pickering) обнаружил в излучении звезды Дзета Кормы спектральную серию, которая по структуре напоминала линии водорода, но не описывалась формулой Ридберга. В 1912 году те же линии промерил в лаборатории лондонский физик Альфред Фаулер (Alfred Fowler). Бор понял, что эти линии принадлежат атому гелия, лишенному одного электрона, то есть одноэлектронному иону этого газа. Тогда в формуле для частот излучения надо положить, что заряд ядра вдвое больше заряда электрона, отчего все частоты умножаются на 4 по сравнению с аналогичными частотами водорода. Это объяснение оказалось стопроцентно вернымСлайд 61 Серьезным успехом теории Бора явилось:
вычисление постоянной Ридберга для водородоподобных
систем и
объяснение структуры их линейчатых спектров.
Бору удалось объяснить
линии спектра ионизованного гелия.Ион гелия (Z=2)
Слайд 63
х
Опыт Франка и Герца.
Существование дискретных энергетических уровней атома
и доказательство правильности теории Бора подтверждается опытом Франка и Герца.
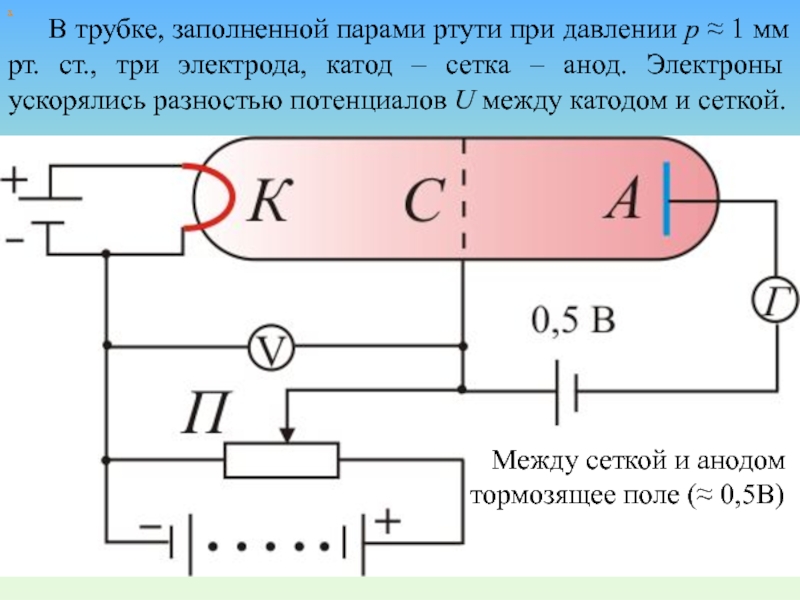
Немецкие ученые Джеймс Франк и Густав Герц, за экспериментальные исследования дискретности энергетического уровня получили Нобелевскую премию в 1925 г. Слайд 64 В трубке, заполненной парами ртути при давлении р ≈ 1
мм рт. ст., три электрода, катод – сетка – анод.
Электроны ускорялись разностью потенциалов U между катодом и сеткой.х
Между сеткой и анодом тормозящее поле (≈ 0,5В)
Слайд 65
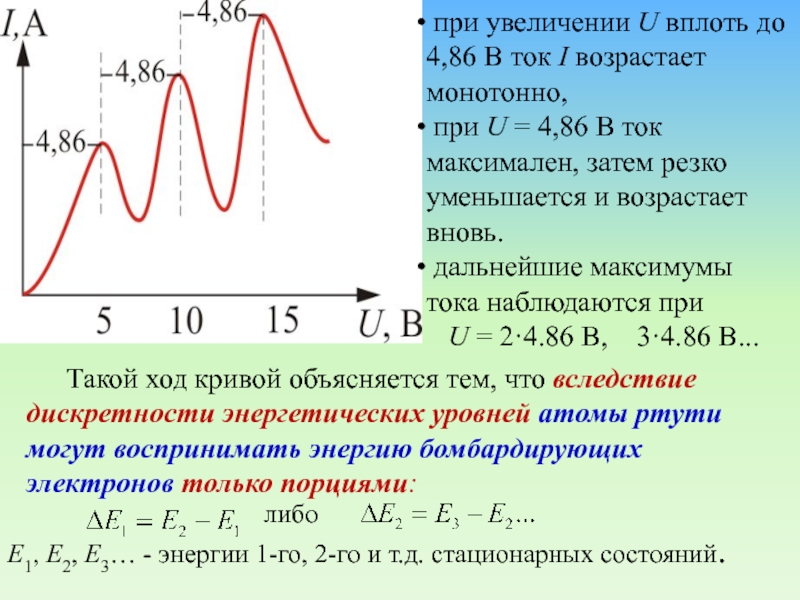
х
Зависимость тока через гальванометр (Г) от разности потенциалов между катодом
и сеткой (U):
U = 4,86 – соответствует 1-му
потенциалу возбуждения Слайд 66
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней
атомы ртути могут воспринимать энергию бомбардирующих электронов только порциями:
либо
Е1, Е2,
Е3… - энергии 1-го, 2-го и т.д. стационарных состояний. при увеличении U вплоть до 4,86 В ток I возрастает монотонно,
при U = 4,86 В ток максимален, затем резко уменьшается и возрастает вновь.
дальнейшие максимумы тока наблюдаются при
U = 2·4.86 B, 3·4.86 B...
Слайд 67 При U < 4,86 В
энергия
электронов меньше ΔЕ1;
соударения между электронами и атомами ртути
носят упругий характер. При U = 4,86 В
энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути энергию ΔЕ1 и продолжает двигаться с меньшей скоростью;
число электронов, достигающих А, резко уменьшается и ток падает
атом ртути переходит в возбужденное состояние.
При U, кратном 4,86 В
электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения, теряя при этом полностью свою энергию.
анодный ток каждый раз резко уменьшается.
Слайд 68 Атомы ртути, получившие при соударении с электронами энергию ΔЕ1 и
перешедшие в возбужденное состояние, спустя время ~ 10-8 с должны
вернуться в основное состояние, излучая, согласно второму постулату Бора фотон с частотой (правило частот):-что соответствует
ультрафиолетовому
излучению.
При этом длина волны светового кванта:
Опыт действительно обнаруживает ультрафиолетовую линию с
Слайд 69 Таким образом, опыты Франка и Герца экспериментально подтвердили не только
первый, но и второй постулат Бора.
Эти опыты сыграли огромное
значение в развитии атомной физики. Слайд 70
х
Однако наряду с успехами в теории Бора с самого начала
обнаружились существенные недостатки.
Главнейшее – внутренняя противоречивость теории: механическое соединение
классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий.
Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров гелия (He) (два электрона на орбите, и уже теория Бора не справляется).
Слайд 71
х
Стало ясно, что теория Бора является лишь переходным этапом на
пути создания более общей и правильной теории. Такой теорией и
являлась квантовая (волновая) механика.Слайд 72Дальнейшее развитие квантовой механики привело к отказу от механической картины
движения электрона в поле ядра.
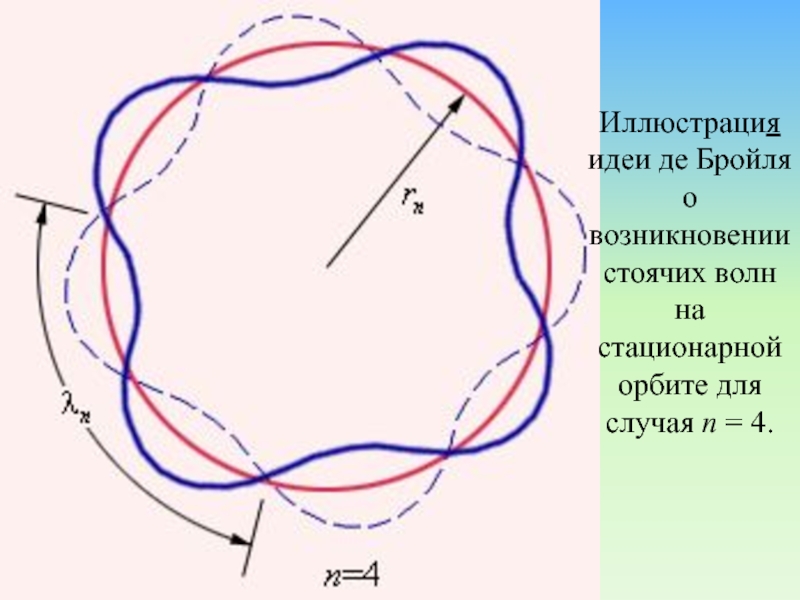
Слайд 75Иллюстрация идеи де Бройля о возникновении стоячих волн на стационарной орбите
для случая n = 4.
Слайд 76Принцип дополнительности Н.Бора
Всем микрообъектам присущи и волновые, и корпускулярные свойства,
однако, они не являются ни волной, ни частицей в классическом
понимании.Разные свойства микрообъектов не проявляются одновременно, они дополняют друг друга, только их совокупность характеризует микрообъект полностью.
Слайд 78Соотношение неопределенностей В.Гейзенберга
Микрочастицы в принципе не имеют одновременно точного значения
координаты и соответствующей проекции импульса.
Является проявлением двойственной корпускулярно-волновой
природы материальных микрообъектов. Позволяет оценить, в какой мере можно применять к микрочастицам понятия классической механики.
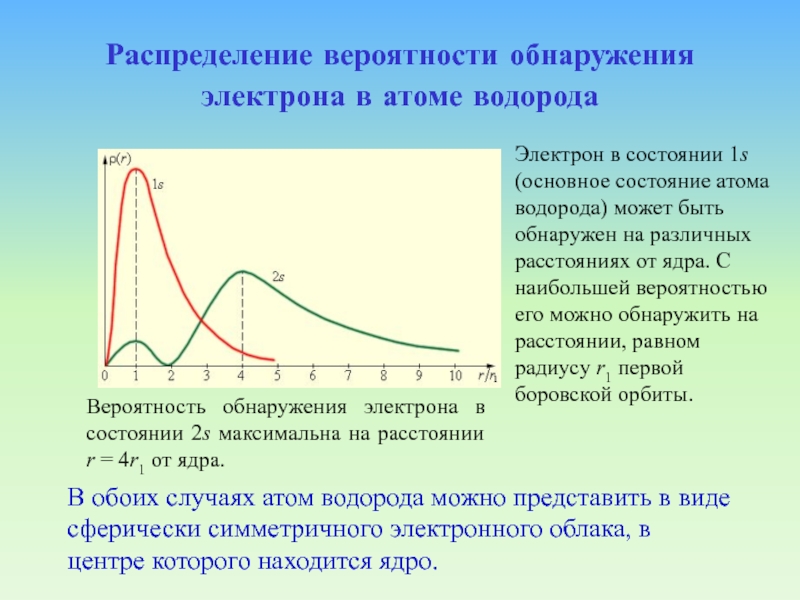
Слайд 80Распределение вероятности обнаружения электрона в атоме водорода
В обоих случаях
атом водорода можно представить в виде сферически симметричного электронного облака,
в центре которого находится ядро.Электрон в состоянии 1s (основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу r1 первой боровской орбиты.
Вероятность обнаружения электрона в состоянии 2s максимальна на расстоянии r = 4r1 от ядра.
Слайд 81Классическая механика – описание частиц путем задания их положения в
пространстве (координат) и скоростей и зависимости этих величин от времени
Квантовая (волновая) механика – законы носят принципиально вероятностный характер
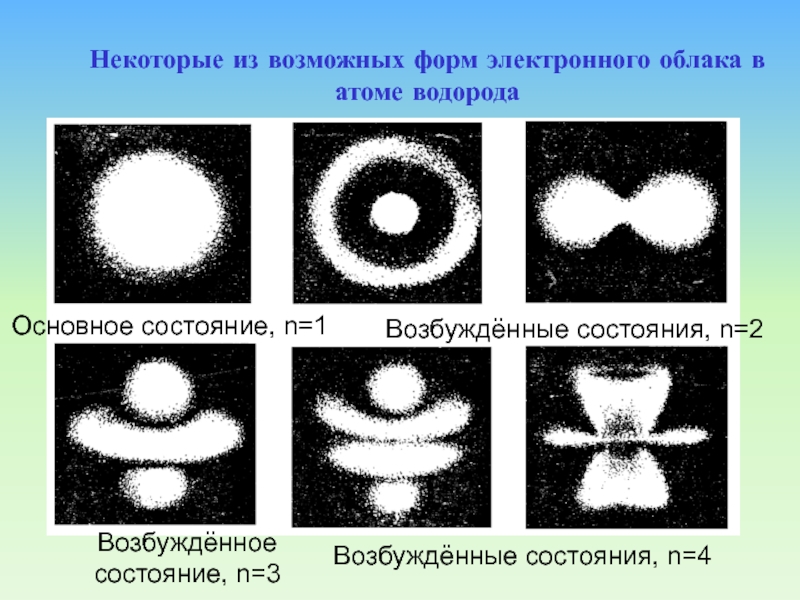
Слайд 82Возбуждённое состояние, n=3
Некоторые из возможных форм электронного облака в атоме
водорода
Основное состояние, n=1
Возбуждённые состояния, n=2
Возбуждённые состояния, n=4
Слайд 831874 г. - Стони, из чисел Фарадея и Авогадро, определил величину
элементарного заряда e и в 1891 г. ввёл термин "электрон";
1888 г.
- исследование Столетовым фотоэффекта; 1895 г. - открытие рентгеновских лучей;
1896-97 гг. - Томсон измерил отношение e/me элементарного заряда к массе электрона me;
1900 г. - Планк создал квантовую теорию излучения абсолютно чёрного тела и ввёл постоянную h;
1902 г. - Томсон предложил модель атома с электронами, вкрапленными в размазанный положительный заряд ("пудинг с изюмом");
1905 г. - Эйнштейн объяснил явление фотоэффекта;
1906-1911 гг. - Резерфорд измерил размеры атомного ядра;
1913 г. - планетарная модель атома по Бору;
1925-27 гг.- созданы основы квантовой механики (Гайзенберг, Борн, Йордан, Дирак, Паули, Шрёдингер).