Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Атомная физика
Содержание
- 1. Атомная физика
- 2. АтомАтом состоит из атомного ядра и электронов.
- 3. Модель атома по Томсону
- 4. Опыты Резерфорда Планетарная модельАтомное ядро заряжено
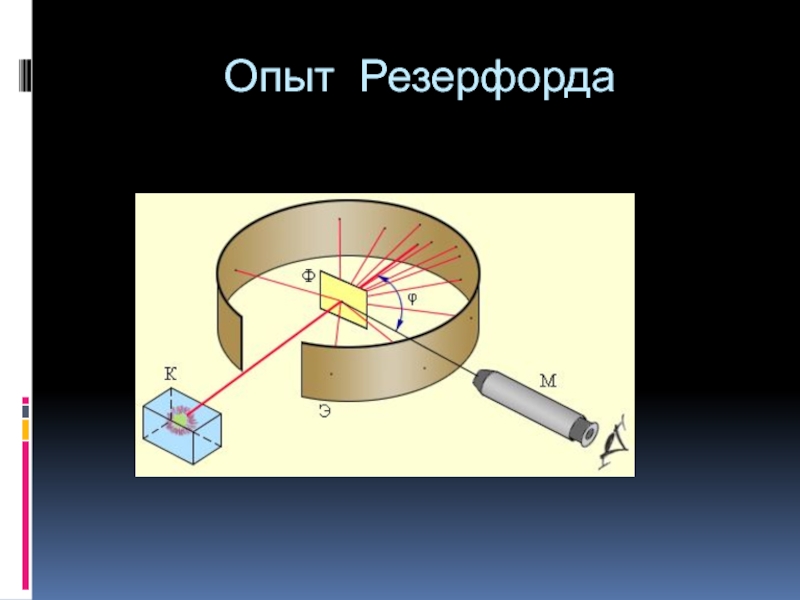
- 5. Опыт Резерфорда
- 6. Опыт Резерфорда
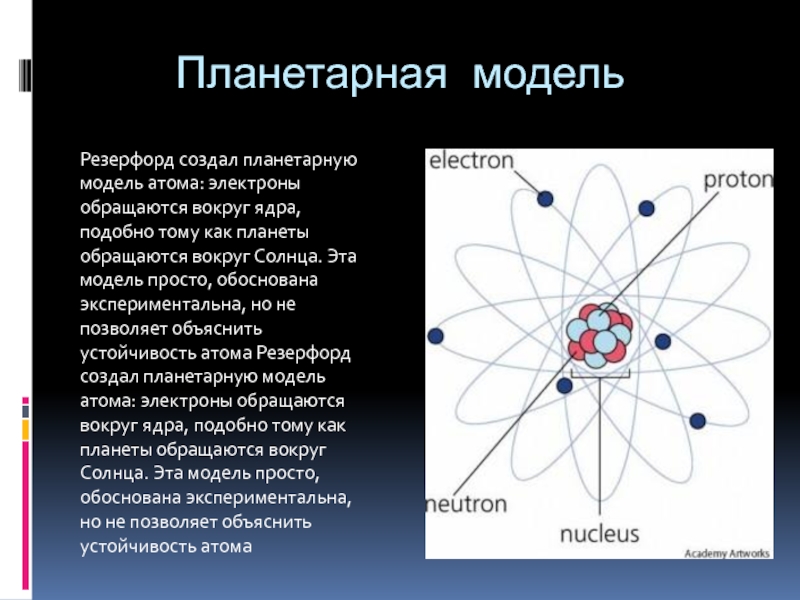
- 7. Планетарная модельРезерфорд создал планетарную модель атома: электроны
- 8. Современная модель атома водорода
- 9. Формула связи частиц в атоме
- 10. Квантовые постулаты бора. Модель атома водорода по
- 11. Постулаты БораСледующий шаг в развитии представлений об
- 12. Модель постулаты Бора
- 13. Трудности теории Бора. Квантовая механика.Теория Бора является
- 14. Скачать презентанцию
АтомАтом состоит из атомного ядра и электронов. Электрон – это частица, заряд которой отрицателен и равен по модулю элементарному заряду e = 1,6·10 –19 Кл, а масса m e = 9,1·10
Слайды и текст этой презентации
Слайд 4Опыты Резерфорда
Планетарная модель
Атомное ядро заряжено положительно. Его диаметр не
превышает 10 –14 –10 –15 м, а заряд q равен
произведению элементарного заряда на порядковый номер атома Z: q = Z·e. Явление радиоактивности, а также опыты Резерфорда показали, что атомное ядро состоит из протонов и нейтронов, удерживаемых вместе ядерными силами. Протоны и нейтроны носят общее название нуклонов.Слайд 7Планетарная модель
Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра,
подобно тому как планеты обращаются вокруг Солнца. Эта модель просто,
обоснована экспериментальна, но не позволяет объяснить устойчивость атома Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому как планеты обращаются вокруг Солнца. Эта модель просто, обоснована экспериментальна, но не позволяет объяснить устойчивость атомаСлайд 10Квантовые постулаты бора. Модель атома водорода по бору.
Планетарная модель
атома, предложенная Резерфордом, – это попытка применения классических представлений о
движении тел к явлениям атомных масштабов. Эта попытка оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волнСлайд 11Постулаты Бора
Следующий шаг в развитии представлений об устройстве атома сделал
в 1913 году выдающийся датский физик Нильс Бор. Проанализировав всю
совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний: hνnm = En – Em, где h – постоянная Планка