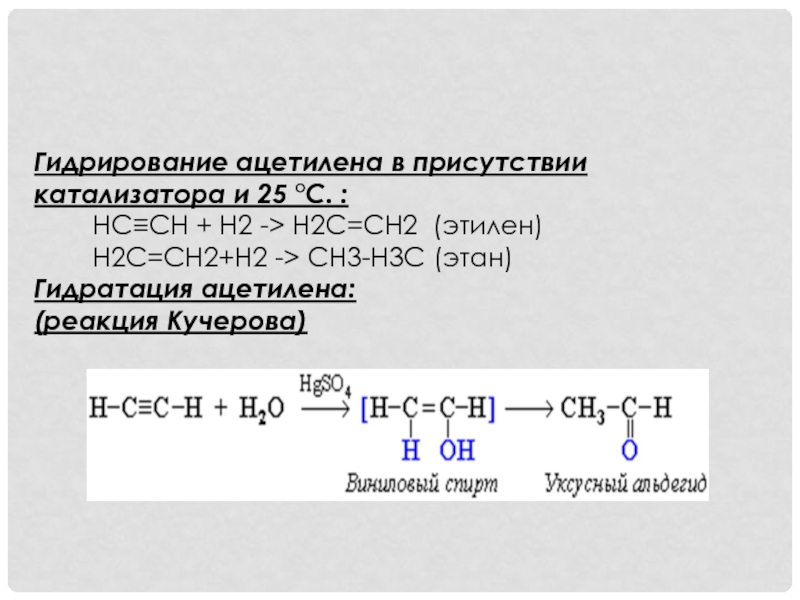
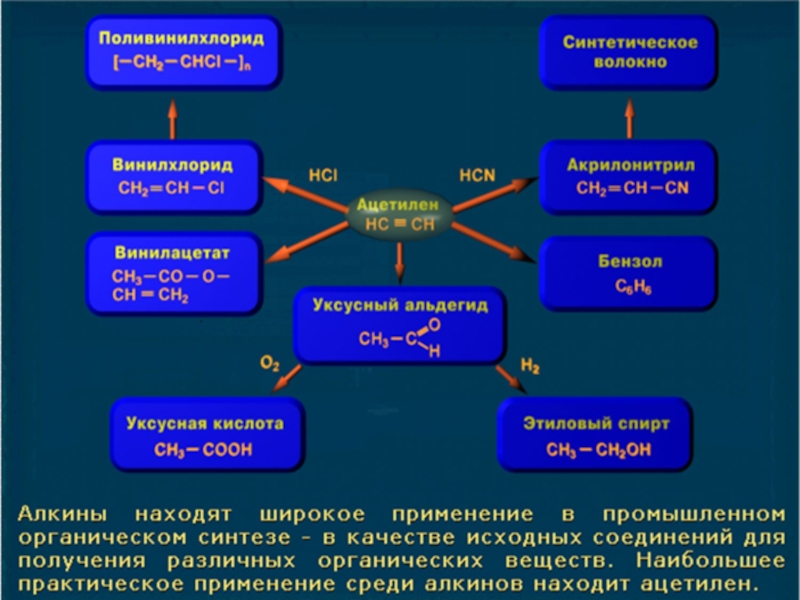
Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и
трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Ацетилен используют: для сварки и резки металлов, источник очень яркого, белого света в автономных светильниках, в производстве взрывчатых веществ, для получения уксусной кислоты, этилового спирта, растворителей, пластмасс, каучука для получения технического углерода в ракетных двигателях.

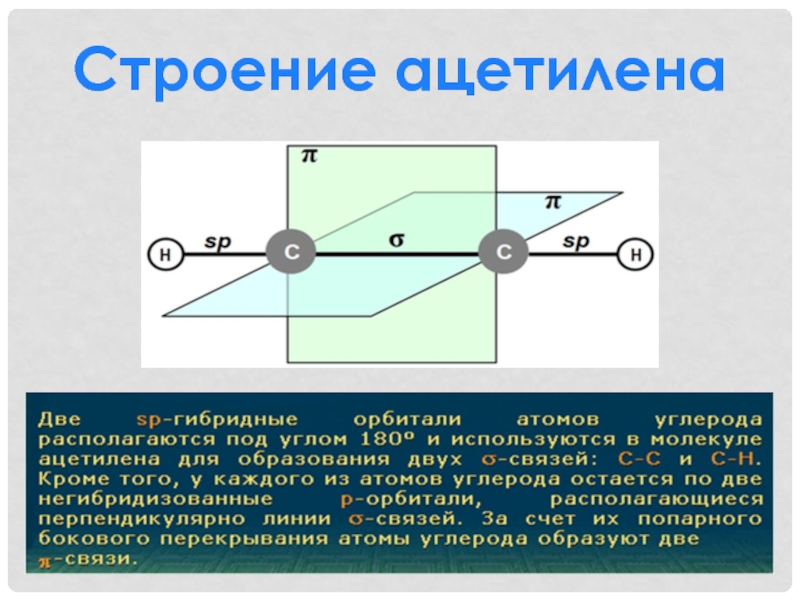

![Ацетилен Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:— Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:— гидрированиеСH≡CH +H2O→ [CH2=CH-OH] → CH3-CH=O (H2SO4](/img/thumbs/8eda771c71089b4d5de53b9d8c381e08-800x.jpg)