Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биогеохимический круговорот азота
Содержание
- 1. Биогеохимический круговорот азота
- 2. Пулы азота:В почве и воде:органический N, NH4+ (NH3), NO2-, NO3-В атмосфере:N2NH3N2ОNONO2NO3-
- 3. Энергетические характеристики основных реакций круговорота азота
- 4. Распределение азота в различных резервуарах Земли(Tamm, 1991)
- 5. Активация азота в биосфере:Биологическая фиксация:фиксация свободноживущими м/осимбиотическаяассоциативная Промышленная:производство удобренийпроизводство иных продуктов химиипромышленные выбросывыбросы транспортаПриродные поступления (молнии)
- 6. Круговорот азота в биосфере(баланс)
- 7. Динамика численности населения Мира и России за
- 8. http://yandex.ru/images/search?img_url=http%3A%2F%2F900igr.net%2Fdatas%2Fgeografija%2FPrirodnye-resursy%2F0010-010-Zemelnye-resursy-mira.jpg&uinfoИзменение площади пахотных земель в Мире за последние 50 лет (млн. га)
- 9. http://yandex.ru/images/search?img_url=http%3A%2F%2F900igr.net%2Fdatas%2Fgeografija%2FPrirodnye-resursy%2F0010-010-Zemelnye-resursy-mira.jpg&uinfoДинамика площади пашни в Мире в расчёте на 1 чел. 0.15прогноз0.400.300.200.10га/человека
- 10. Население и удельная площадь пашни на 1
- 11. Потребность в Nуд. рассчитывается исходя из равного
- 12. Удобрения
- 13. Урожайность пшеницы в России и некоторых странах*
- 14. Расход N, Р, К в кг/га на формирование урожая пшеницы с соответствующим количеством побочной продукции
- 15. Сравнительная обеспеченность минеральными удобрениями пахотных угодий России и некоторых стран
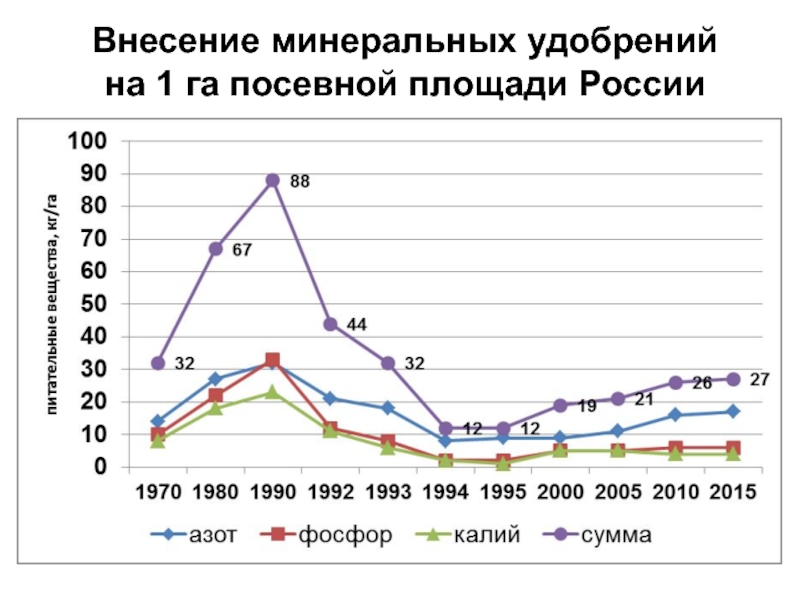
- 16. Внесение минеральных удобрений на 1 га посевной площади России
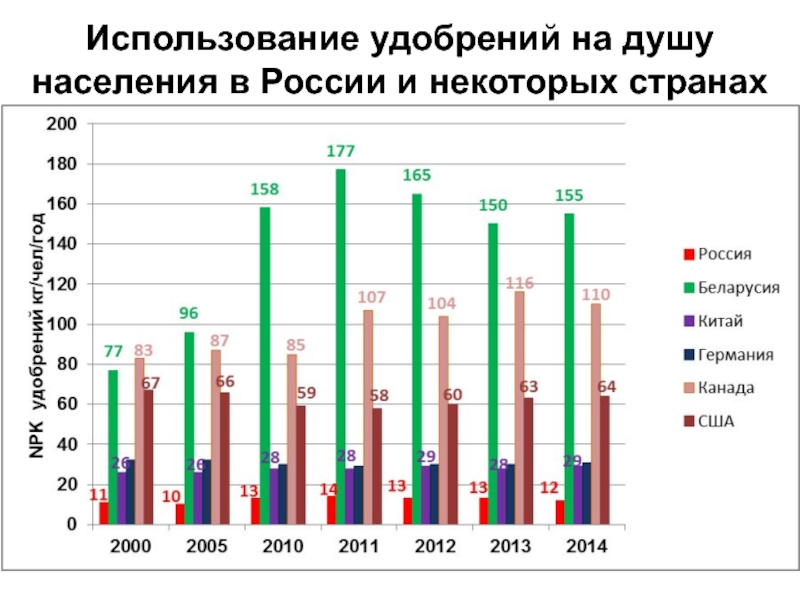
- 17. Использование удобрений на душу населения в России и некоторых странах
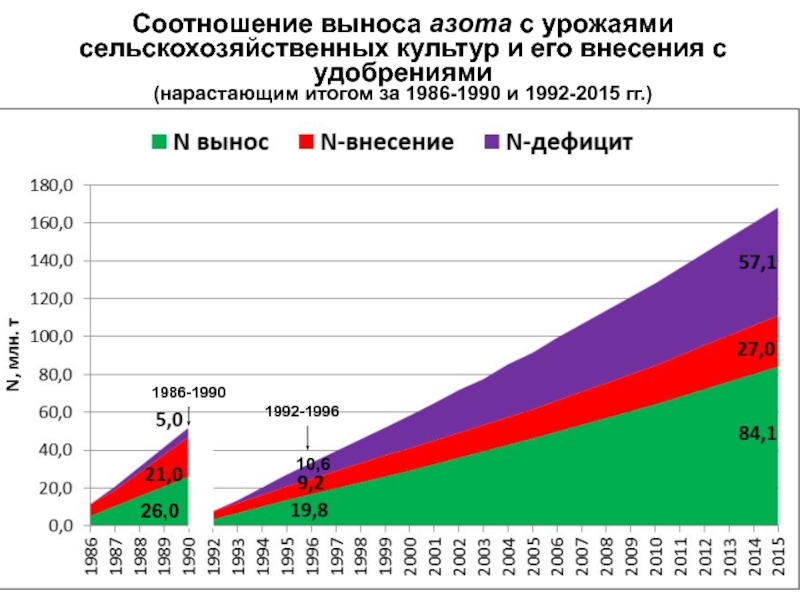
- 18. Соотношение выноса азота с урожаями сельскохозяйственных культур
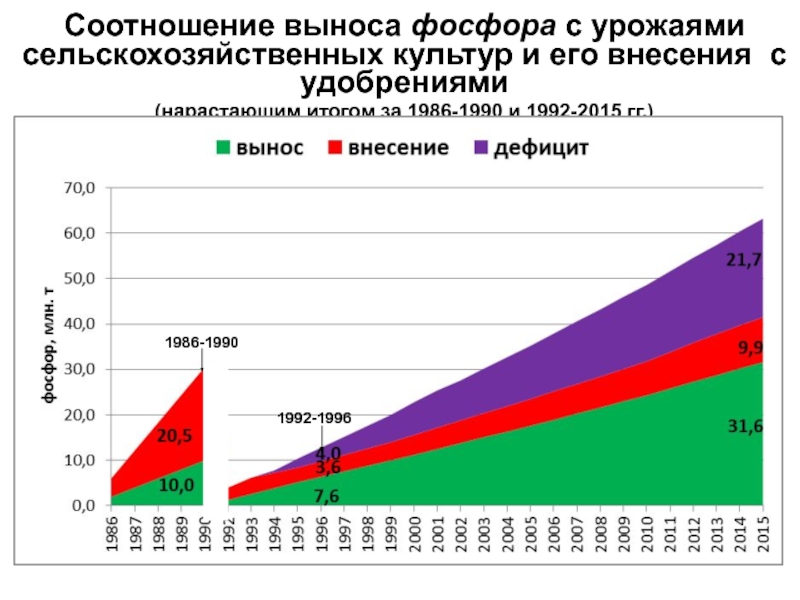
- 19. Соотношение выноса фосфора с урожаями сельскохозяйственных культур
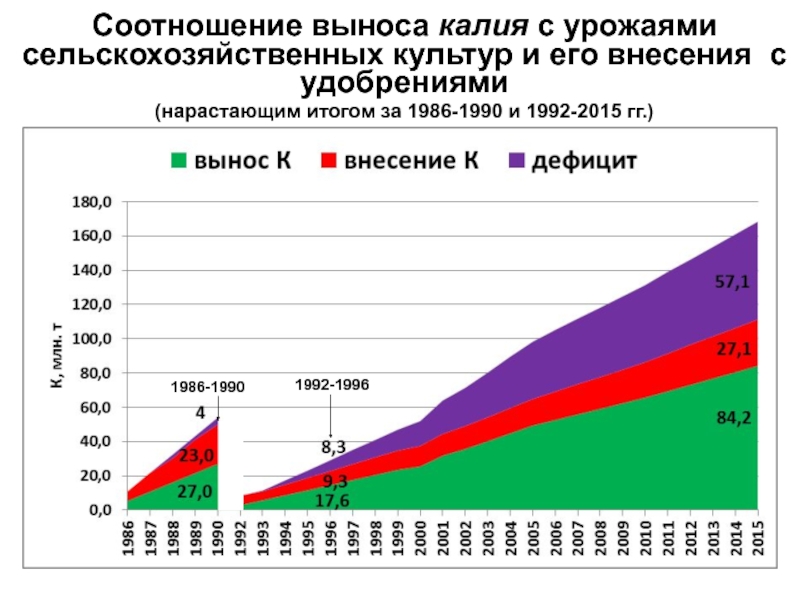
- 20. Соотношение выноса калия с урожаями сельскохозяйственных культур
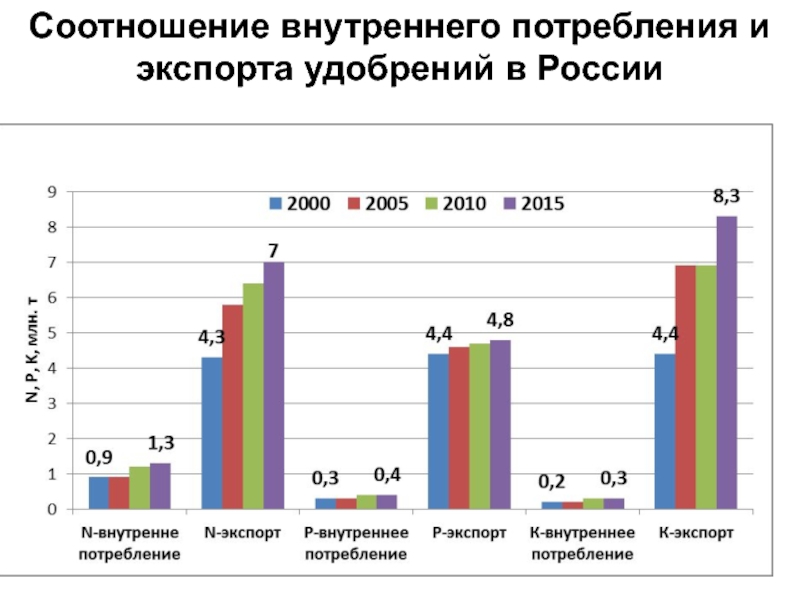
- 21. Соотношение внутреннего потребления и экспорта удобрений в России
- 22. Активированный азот, млн. т/годБиологическая фиксация азотаСжигание ископаемого
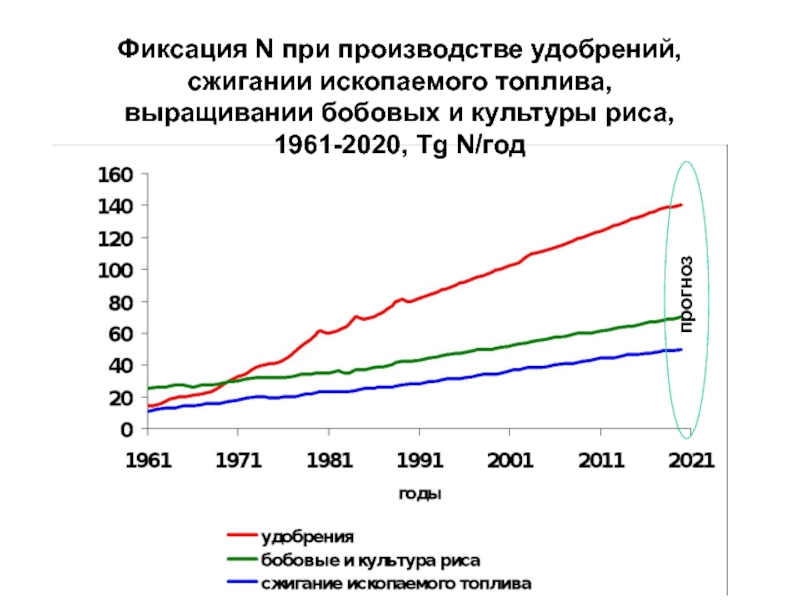
- 23. Фиксация N при производстве удобрений,сжигании ископаемого топлива,выращивании бобовых и культуры риса,1961-2020, Tg N/год прогноз
- 24. Экологические последствия интенсивного вовлечения техногенного азота в круговорот
- 25. Потоки азота при сжигании ископаемого топливаВыбросы: NOx, NH3Последствия:Фотохимический смогКислотные атмосферные осадкиРазрушение озонового слояПарниковый эффект
- 26. Выбросы NOxМобильные источники:легковые автомобили 6-7 млн.т/годтяжелые
- 27. Нитраты (NO3-)Нитраты (NO3-) - не
- 28. Метгемоглобинемия или синдром «синего ребенка»У детей младше
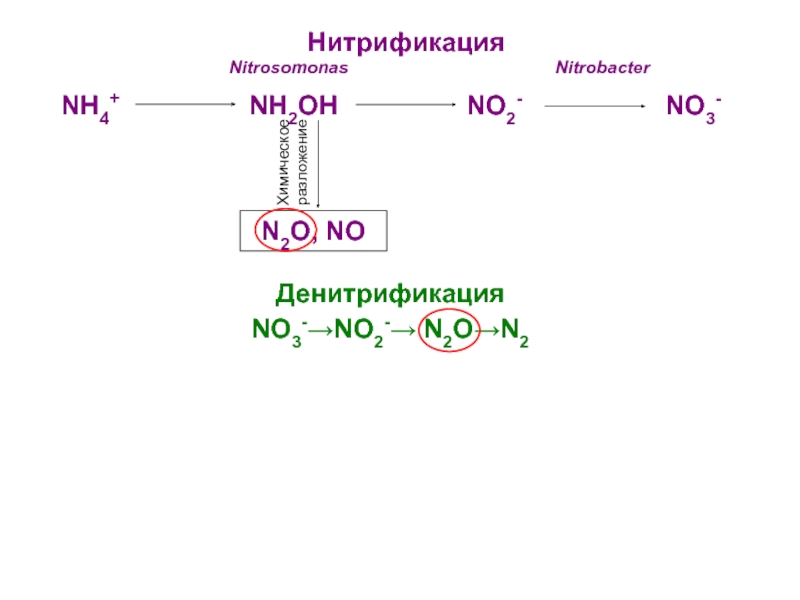
- 29. Нитрификация
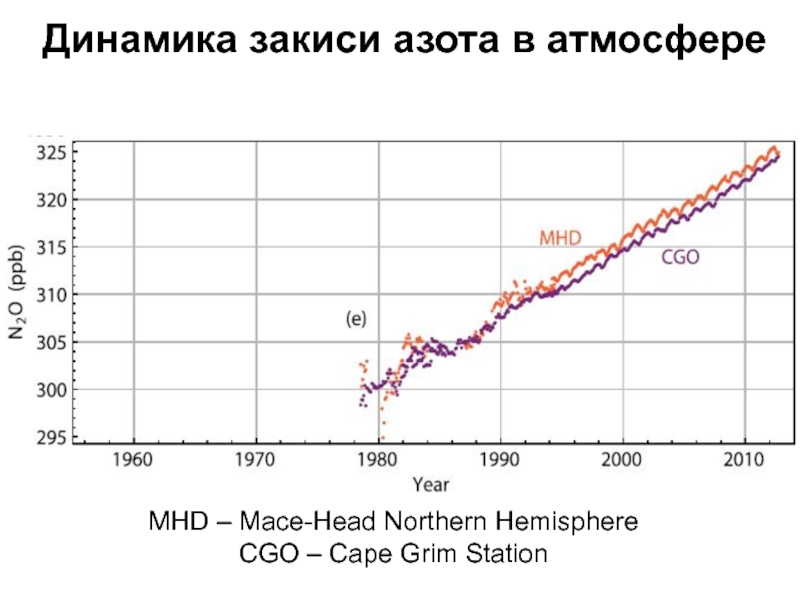
- 30. Динамика закиси азота в атмосфереMHD – Mace-Head Northern HemisphereCGO – Cape Grim Station
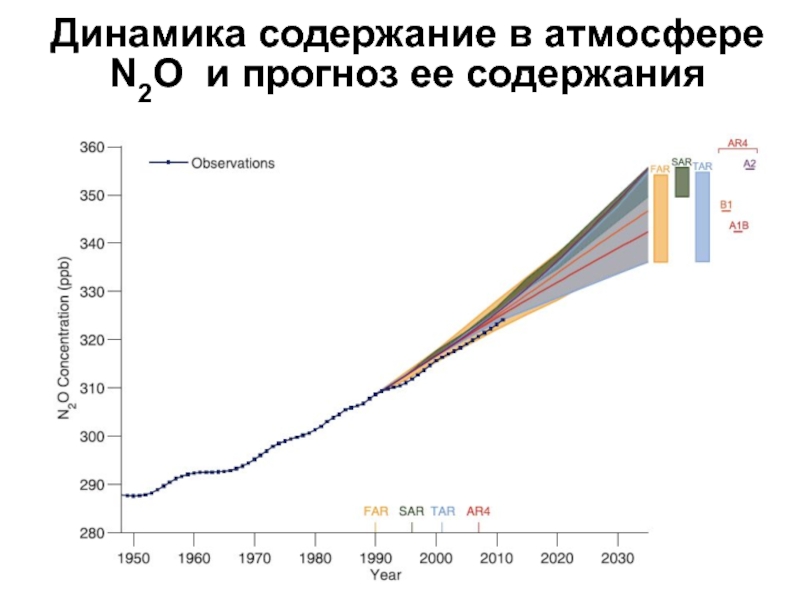
- 31. Динамика содержание в атмосфере N2O и прогноз ее содержания
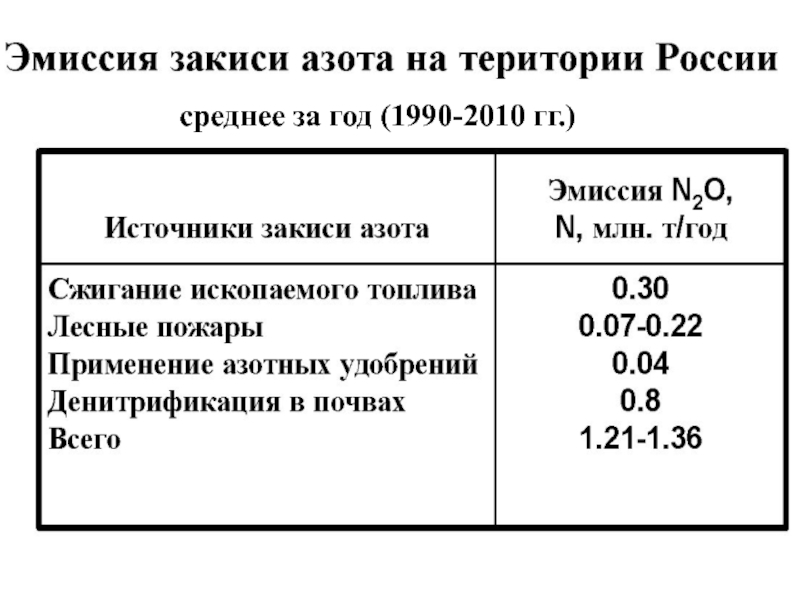
- 32. среднее за год (1990-2010 гг.)
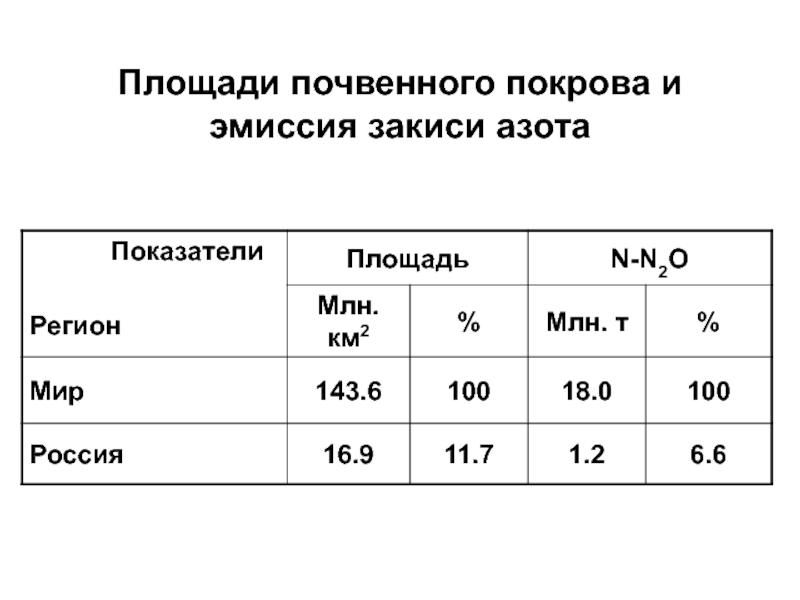
- 33. Площади почвенного покрова и эмиссия закиси азота
- 34. Разрушение озонаNO каталитически разрушает озон:NO+О3 NO2+O2N2O+О NO+O2Нетто:O+О32O2
- 35. Имеются ли в будущем альтернативы применению удобрений?
- 36. Биогеохимический круговорот фосфора
- 37. Рассмотренные нами круговороты азота и углерода относятся
- 38. Р – один из важнейших биофильных элементов.Без
- 39. Позвоночные животные, их мышцы содержат 0.2% Р,
- 40. Путь вовлечения фосфора в круговорот начинается с
- 41. Фосфорные удобрения – представляют собой конечный продукт
- 42. В масштабе времени цивилизаций (1000 лет) основной
- 43. Органические соединения фосфора в почве имеют очень
- 44. ПУЛЫ И ПОТОКИ фосфора В СОВРЕМЕННОМ ПРЕДСТАВЛЕНИИ
- 45. Для нормального функционирования организма взрослого человека необходимо
- 46. ФОСФОР В СЕЛЬСКОМ ХОЗЯЙСТВЕСредние урожаи зерна выносят
- 47. Слайд 47
- 48. Впервые коммерческое производство Р-удобр. началось в 1847
- 49. СУДЬБА Р-УДОБРЕНИЙ В ПОЧВЕВ сравнении с N-удобр.,
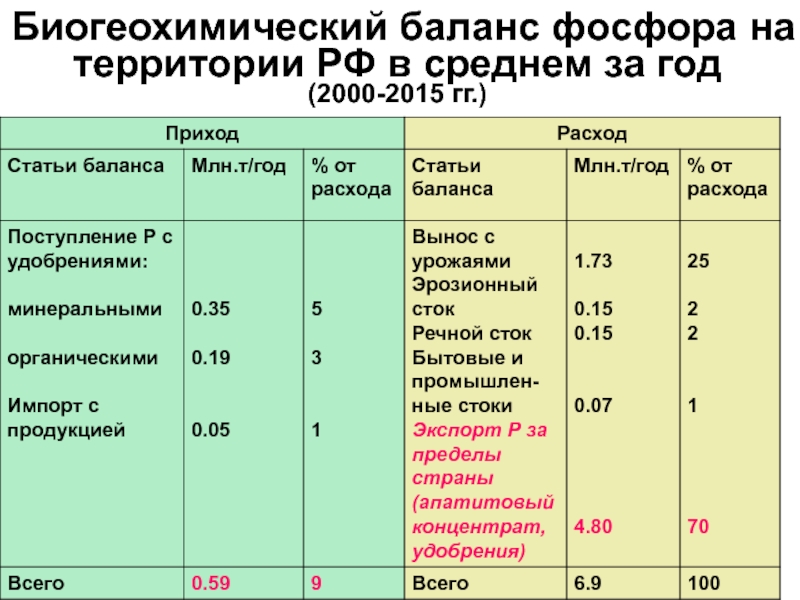
- 50. Биогеохимический баланс фосфора на территории РФ в среднем за год (2000-2015 гг.)
- 51. ПРОБЛЕМА ФОСФОРА В ВОДАХявляется следствием экстраординарной чувствительности
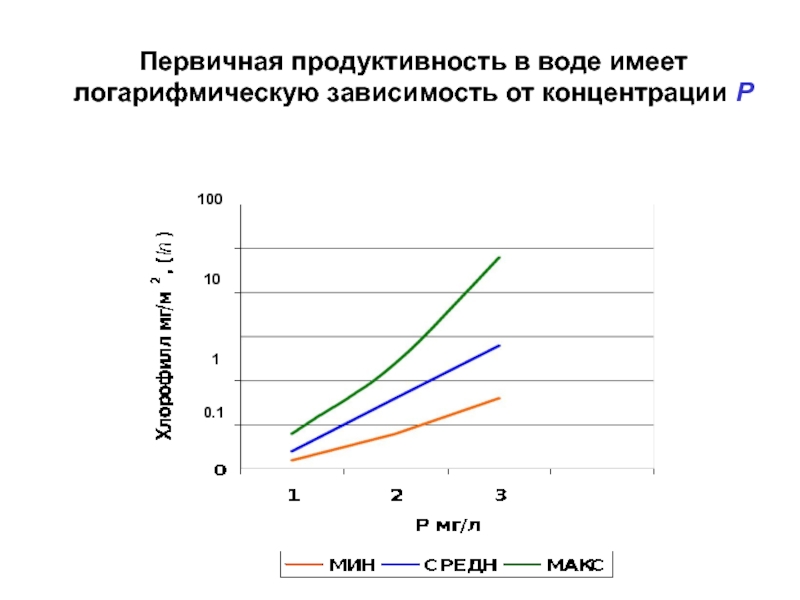
- 52. Первичная продуктивность в воде имеет логарифмическую зависимость
- 53. Выраженное беспокойство по поводу увеличивающейся эвтрофикации относится
- 54. ЭТАПЫ ЭВТРОФИКАЦИИМедленное увеличение эвтрофикации с момента появления
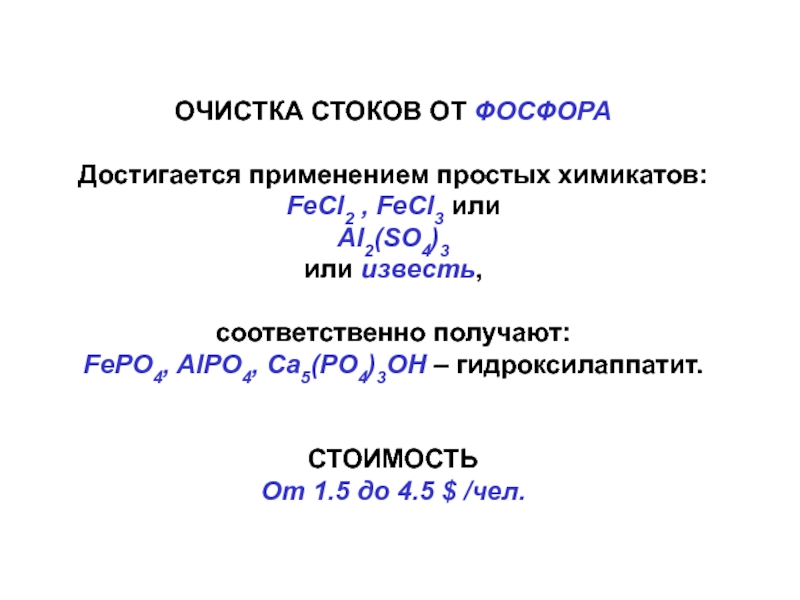
- 55. ОЧИСТКА СТОКОВ ОТ ФОСФОРАДостигается применением простых химикатов:
- 56. Биогеохимический круговорот серы
- 57. Глобальный биогеохимический цикл серы – целый комплекс
- 58. Все серосодержащие газы хорошо растворимы в воде
- 59. Большинство сульфатов широко распространено в природе:CaSO4 –
- 60. Серосодержащие соединения с металлами меняются в зависимости
- 61. ОБРАЗОВАНИЕ И РАЗЛОЖЕНИЕS-СОДЕРЖАЩИХ СОЕДИНЕНИЙ В БИОЛОГИЧЕСКИХ ПРОЦЕССАХСера
- 62. Другая группа живых организмов (животные и некоторые
- 63. ПОТОК СЕРЫ ЗА СЧЕТ ВЫВЕТРИВАНИЯ ПОРОД, ОБУСЛОВЛЕННОГО
- 64. Содержание S в топливах (%%):Уголь – 1-14(уголь
- 65. ЭМИССИЯ СЕРЫ В МЕТАЛЛУРГИЧЕСКИХ ПРОИЗВОДСТВАХСульфиды присутствуют во
- 66. КИСЛОТНЫЕ ДОЖДИВ незагрязненных районах рН осадков 5.7
- 67. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Активация азота в биосфере:
Биологическая фиксация:
фиксация свободноживущими м/о
симбиотическая
ассоциативная
Промышленная:
производство удобрений
производство иных
продуктов химии
промышленные выбросы
выбросы транспорта
Природные поступления (молнии)
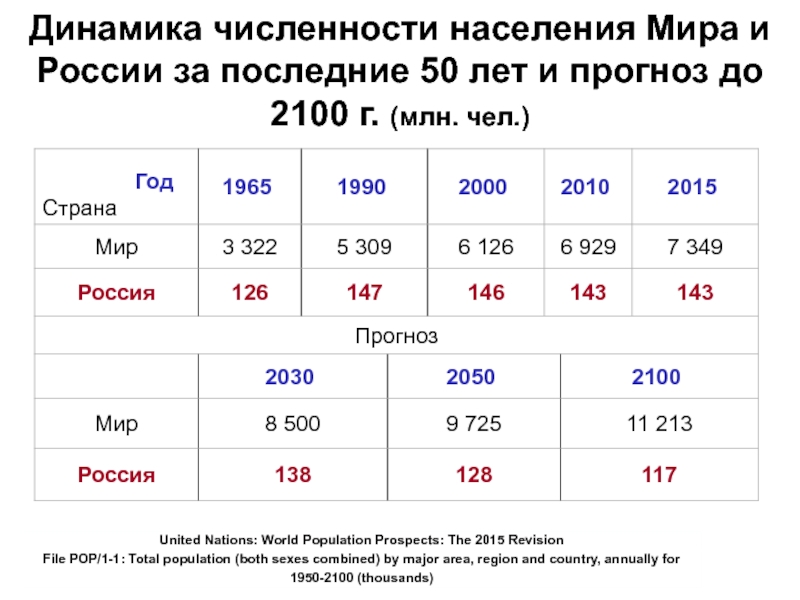
Слайд 7Динамика численности населения Мира и России за последние 50 лет
и прогноз до 2100 г. (млн. чел.)
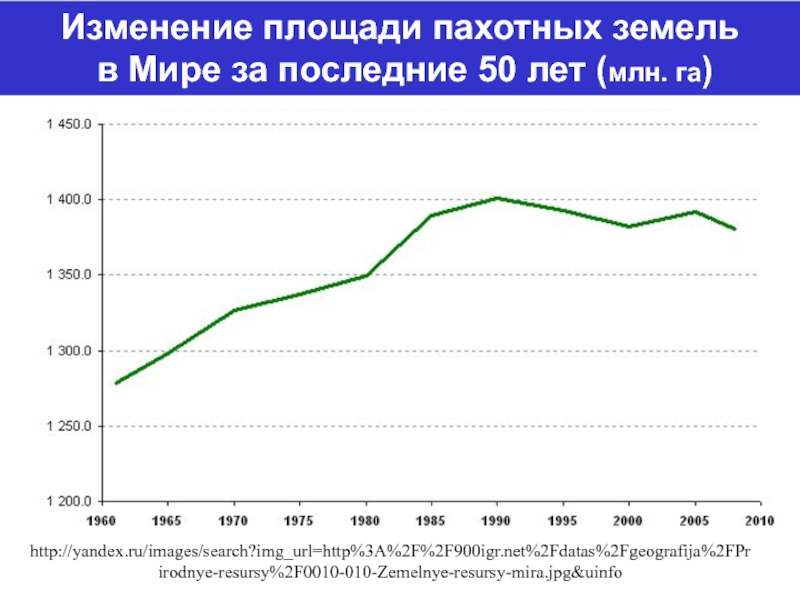
Слайд 8http://yandex.ru/images/search?img_url=http%3A%2F%2F900igr.net%2Fdatas%2Fgeografija%2FPrirodnye-resursy%2F0010-010-Zemelnye-resursy-mira.jpg&uinfo
Изменение площади пахотных земель
в Мире за последние 50 лет
(млн. га)
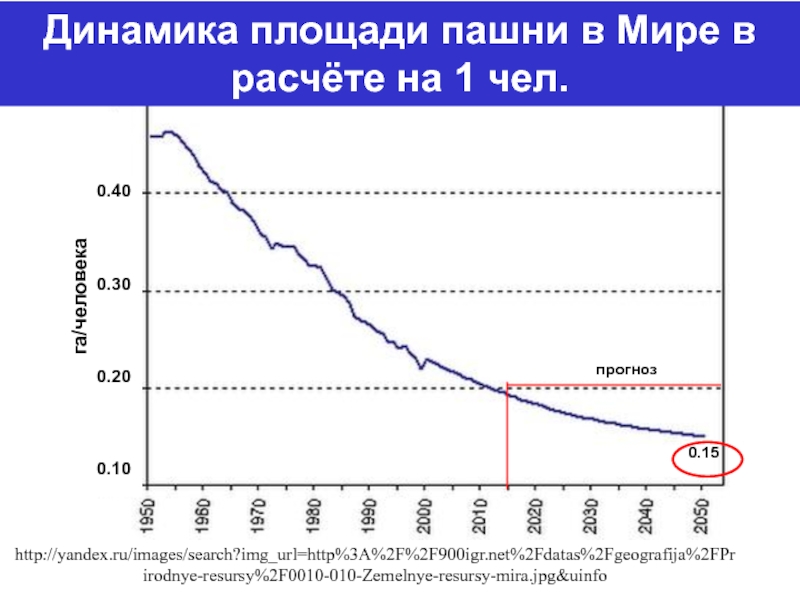
Слайд 9http://yandex.ru/images/search?img_url=http%3A%2F%2F900igr.net%2Fdatas%2Fgeografija%2FPrirodnye-resursy%2F0010-010-Zemelnye-resursy-mira.jpg&uinfo
Динамика площади пашни в Мире в расчёте на 1 чел.
0.15
прогноз
0.40
0.30
0.20
0.10
га/человека
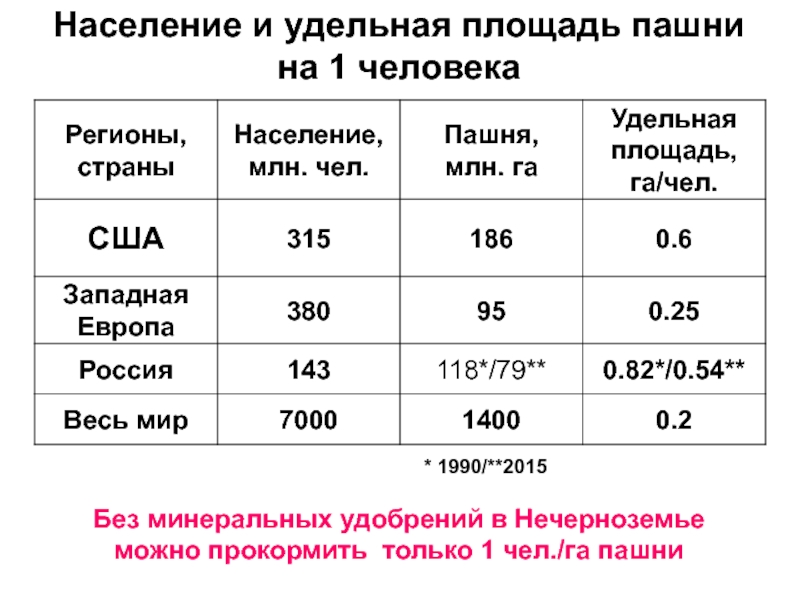
Слайд 10Население и удельная площадь пашни
на 1 человека
* 1990/**2015
Без минеральных
удобрений в Нечерноземье можно прокормить только 1 чел./га пашни
Слайд 11Потребность в Nуд. рассчитывается исходя из равного количества потребляемого протеина
(животного и растительного)
50% и 15% - коэффициенты усвоения,
соответственно.Потребность населения в протеине
60-70 г/чел./день или 4 кг N/чел./год
Nуд. – потребность = 17 кг N/чел./год
Для населения 140 млн. человек – 2,4 млн.т N уд.
Каждый гектар пашни России должен получать
не менее 60 кг N/год
Потребность в азоте
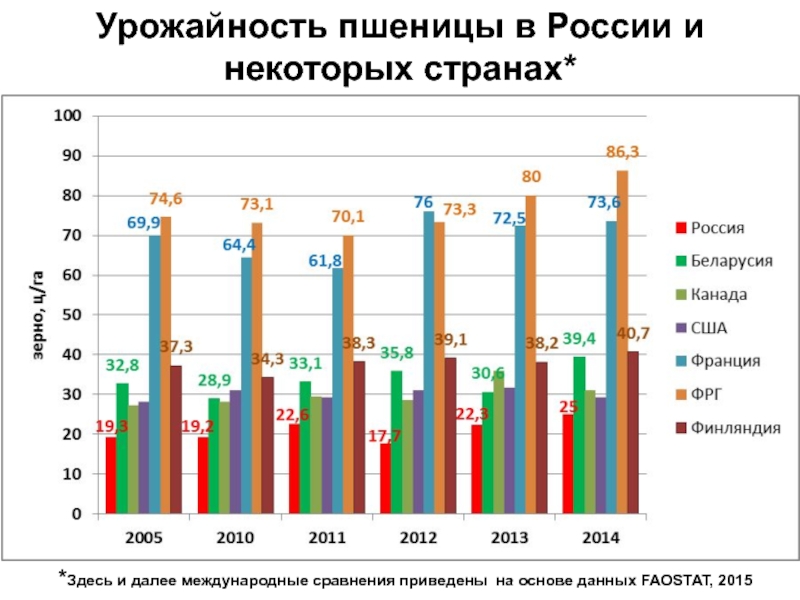
Слайд 13Урожайность пшеницы в России и некоторых странах*
*Здесь и далее
международные сравнения приведены на основе данных FAOSTAT, 2015
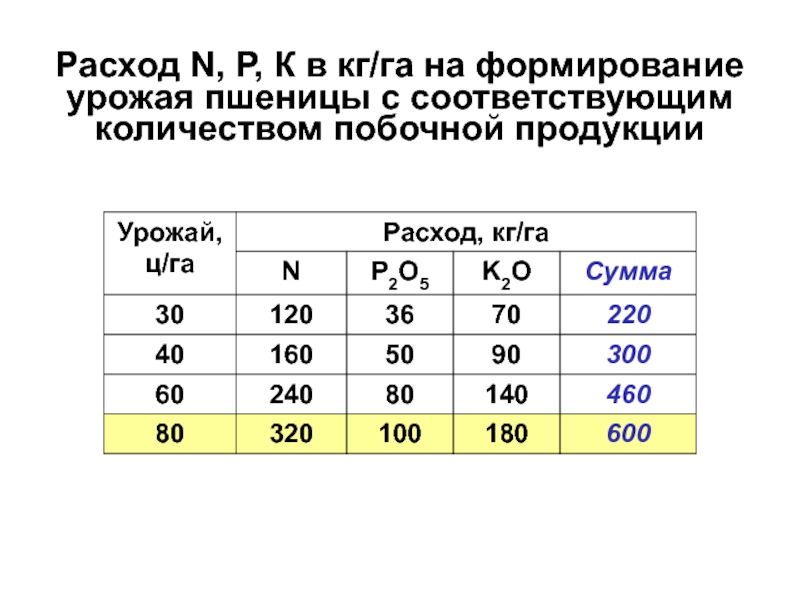
Слайд 14Расход N, Р, К в кг/га на формирование урожая пшеницы
с соответствующим количеством побочной продукции
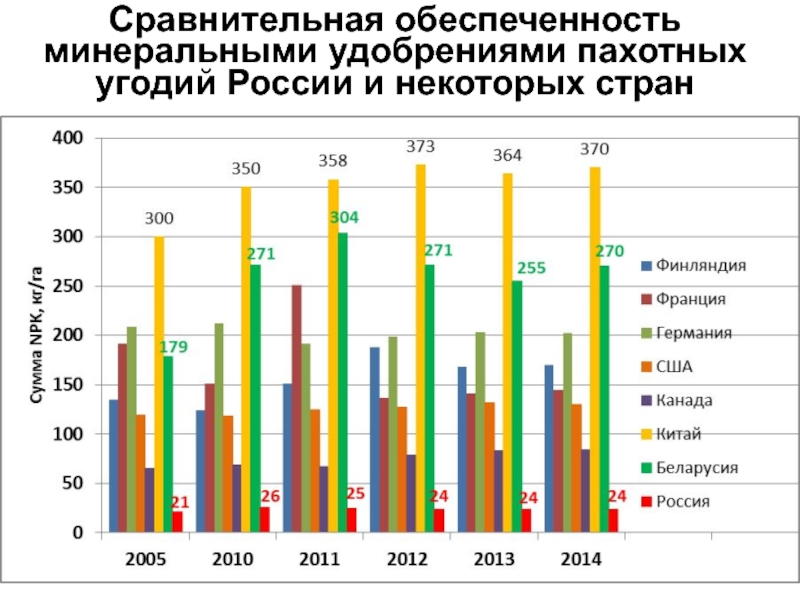
Слайд 15Сравнительная обеспеченность минеральными удобрениями пахотных угодий России и некоторых стран
Слайд 18Соотношение выноса азота с урожаями сельскохозяйственных культур и его внесения
с удобрениями
(нарастающим итогом за 1986-1990 и 1992-2015 гг.)26,0
10,6
1986-1990
1992-1996
Слайд 19Соотношение выноса фосфора с урожаями сельскохозяйственных культур и его внесения
с удобрениями
(нарастающим итогом за 1986-1990 и 1992-2015 гг.)1986-1990
1992-1996
Слайд 20Соотношение выноса калия с урожаями сельскохозяйственных культур и его внесения
с удобрениями
(нарастающим итогом за 1986-1990 и 1992-2015 гг.)1992-1996
1986-1990
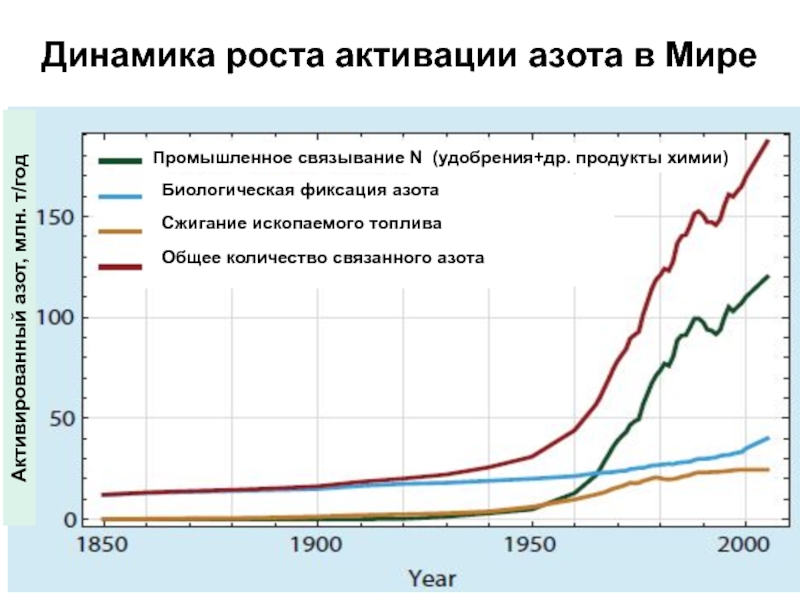
Слайд 22Активированный азот, млн. т/год
Биологическая фиксация азота
Сжигание ископаемого топлива
Общее количество связанного
азота
Динамика роста активации азота в Мире
Промышленное связывание N (удобрения+др.
продукты химии) Слайд 23Фиксация N при производстве удобрений,
сжигании ископаемого топлива,
выращивании бобовых и культуры
риса,
1961-2020, Tg N/год
прогноз
Слайд 25Потоки азота
при сжигании ископаемого топлива
Выбросы: NOx, NH3
Последствия:
Фотохимический смог
Кислотные атмосферные
осадки
Разрушение озонового слоя
Парниковый эффект
Слайд 26Выбросы NOx
Мобильные источники:
легковые автомобили 6-7 млн.т/год
тяжелые автомобили и авиация
2-3 млн.т/год
Химическая промышленность
(без удобрений) и производство
цемента 2-3
млн.т./годСжигание древесины
и растительных остатков 5 млн.т/год
Слайд 27
Нитраты (NO3-)
Нитраты (NO3-) - не токсичны!
Нитриты (NO2-) консерванты
против ботулизма
NO3- - используется для лечения мочекаменной болезни, болезней
сердца Растворяет почечные камни фосфатной природы.
Дозировка до 9г NaNO3 или NH4NO3 в сутки - без каких-либо осложнений.
Слайд 28Метгемоглобинемия или синдром «синего ребенка»
У детей младше 1 года в
желудке
NO3- NO2-
Оксигемоглобин, содержит (Fe+++) в окисной форме
переходит в
метгемоглобин (Fe++) в закисной формеВ результате снижается способность переносить О2
Слайд 29Нитрификация
Nitrosomonas
NitrobacterNH4+ NH2OH NO2- NO3-
Химическое разложение
N2O, NO
Денитрификация
NO3-NO2- N2ON2
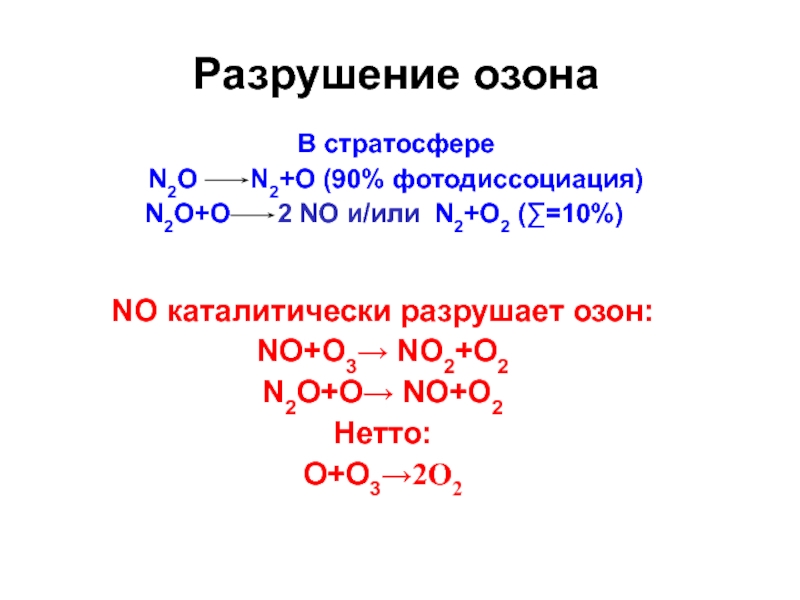
Слайд 34Разрушение озона
NO каталитически разрушает озон:
NO+О3 NO2+O2
N2O+О NO+O2
Нетто:
O+О32O2
В стратосфере
N2O
N2+О (90% фотодиссоциация)
N2O+O 2 NO и/или N2+О2 (∑=10%) Слайд 37Рассмотренные нами круговороты азота и углерода относятся к круговороту газообразных
веществ и являются более совершенными, т.е. способные к саморегуляции.
В противоположность
C, N и S фосфор не улетучивается(хотя РН3 –фосфин – летучее соединение, но его биосферные потоки не имеют сколько-нибудь значительных атмосферных связей с другими средами).
Круговорот фосфора относится к осадочному типу, менее совершенному и менее саморегулируемому
Слайд 38Р – один из важнейших биофильных элементов.
Без его участия не
могут синтезироваться
ни углеводы, ни белки.
Р входит в состав АТФ
и АДФ, носителей энергии.Фитомассса леса бореального пояса содержит:
C – 45-50%, N – 0.3-0.5% P – 0.02-0.03%.
Слайд 39Позвоночные животные, их мышцы содержат 0.2% Р, но самое большое
содержание Р в скелете.
В костях взрослого человека
Са3(РО4)2 составляет ≈60%,
в зубах – 70%Скелет средних размеров взрослого человека содержит
3.5 кг Са5(РО4)3ОН или 650 г чистого Р.
Мы едим каждый день 1.5 г Р в основном в пище животного происхождения
и выбрасываем ≈98% Р в виде NaNH4HPO4, который удаляется со сточными водами
Слайд 40Путь вовлечения фосфора в круговорот начинается с растворения Р-содержащей горной
породы Са5(РО4)3F (фторапатит).
В промышленности – кислотная переработка фосфатного сырья –
один из самых распространенных способов вовлечения фосфора в современный биогеохимический круговорот.Слайд 41Фосфорные удобрения – представляют собой конечный продукт переработки фосфатного сырья.
Н3РО4 – производные:
одно-, ди-, и трехзамещенные соли.
Производят также и
триполифосфат Na5P3O10, используемый в основном для производства детергентов. Внедрение в природный цикл Р синтетических воднорастворимых Р-соединений началось с середины 19-го века, когда в Англии впервые было начато производство суперфосфата из костей.
Слайд 42В масштабе времени цивилизаций (1000 лет) основной цикл Р представляет
собой однонаправленные потоки, с суши в океан.
Возврат - очень
малый (гуано, рыба).В геологическом масштабе времени первичные неорганические Р-потоки движутся ступенчато, с медленным распространением по морскому дну фосфорсодержащих осадков, имеющих в большей части эрозионное происхождение.
Р-содержащие соединения могут возвращаться на сушу только после тектонических подъемов после 107-109 лет.
Слайд 43Органические соединения фосфора в почве имеют очень короткое время оборота,
порядка 0.1-1.0 год.
После минерализации Р опять может очень быстро
включаться в биологический круговорот.Аналогично короткий биологический круговорот фосфора имеет место и в водной среде. Обмен может осуществляться также между осадками и водной биотой.
Человек изменяет скорость и направленность круговорота Р. Добыча полезных ископаемых также как и сведение лесов и лугов, распашка земель усиливает поток Р сторону моря.
Возврат Р из моря на сушу в виде гуано птиц
До середины 19 века гуано было единственным Р-удобрением, которое собирали на птичьих базарах
Гуано – уже не имеет практического значения
Слайд 44ПУЛЫ И ПОТОКИ фосфора В СОВРЕМЕННОМ ПРЕДСТАВЛЕНИИ
Около 9/10 всех
разведанных запасов Р-сырья находится в осадочных породах морского происхождения.
Остальное (1/10)
– в изверженных породах (апатиты). США и Мароко – являются одними из основных производителей фосфатного сырья.
Месторождения в России (Хибинские аппатиты, Егорьевские фосфориты и др.)
Разведанные резервы Р-сырья оцениваются не менее, чем в 20 Рg, общие запасы оцениваются в 90 Pg.
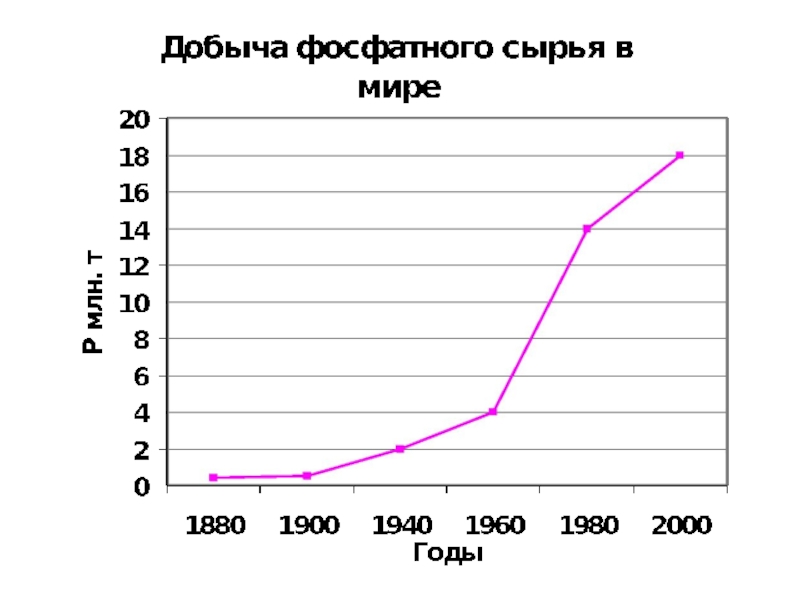
Ежегодная добыча фосфатного сырья ≈ 150 Tg или
20 Tg Р, 80% этого сырья идет на удобрение
Слайд 45Для нормального функционирования организма взрослого человека необходимо каждый день поступление
с пищей (в основном животного происхождения) 1.5 г Р или
550 г Р/год. Из этого количества из организма выбрасывается ≈98% Р в виде NaNH4HPO4, который необратимо теряется со сточными водами.Для удовлетворения общей годовой потребности населения (143 млн. чел.) в пищевом фосфоре в продуктах питания должно содержаться не менее 75 тыс. т Р. С учетом коэффициентов усвоения с/х культурами Р удобрений и коэффициентов перевода с/х продукции в продукты питания потребность в фосфатных удобрениях составляет не менее
1.5 млн. т Р2О5/год или 20 кг Р2О5/га/год/.
Потребность в фосфоре
Слайд 46ФОСФОР В СЕЛЬСКОМ ХОЗЯЙСТВЕ
Средние урожаи зерна выносят 15-35 кг Р/га.
Овощные и плодовые – 5-15 кг Р/га.
Общее содержание Р в
сельскохозяйственной продукции мира – 11 ̶ 12 Тg/год.Единственный источник поступления Р в почвы – удобрения.
Мировая потребность в Р-удобрениях – 18 Тg/год
при коэффициенте утилизации фосфора не менее 65%.
До начала применения Р-удобрений, производимых из фосфатного сырья, внедрение человека в фосфатный цикл было очень ограничено.
Рециклирование Р при применении местных удобрений (навоз, компосты, зола) возможно не более 20% от общей потребности.
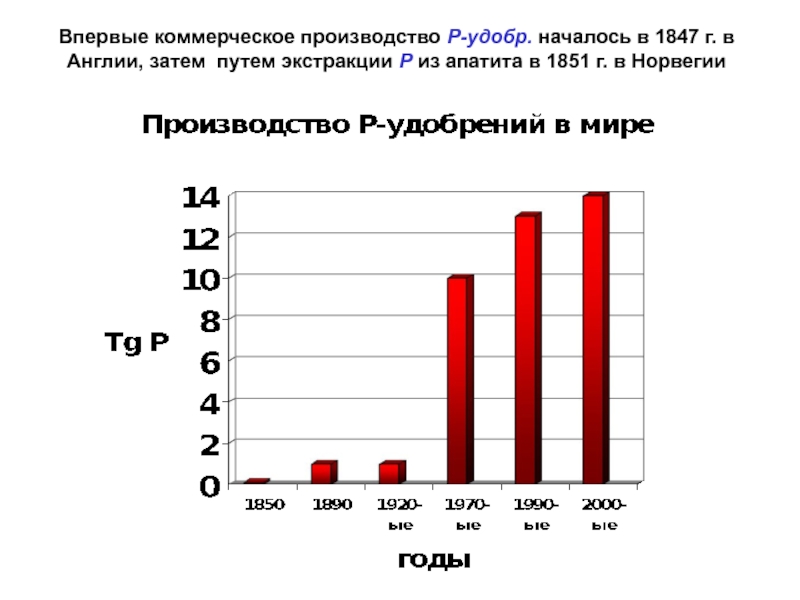
Слайд 48Впервые коммерческое производство Р-удобр. началось в 1847 г. в Англии,
затем путем экстракции Р из апатита в 1851 г. в
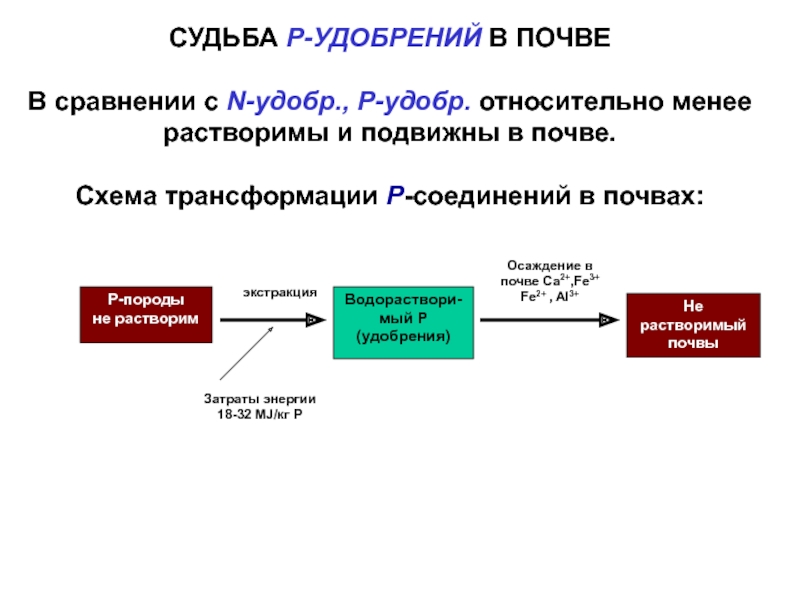
НорвегииСлайд 49СУДЬБА Р-УДОБРЕНИЙ В ПОЧВЕ
В сравнении с N-удобр., Р-удобр. относительно менее
растворимы и подвижны в почве.
Схема трансформации Р-соединений в почвах:
экстракция
Р-породы
не
растворимЗатраты энергии
18-32 MJ/кг Р
Водораствори-мый Р
(удобрения)
Не растворимый
почвы
Осаждение в
почве Ca2+,Fe3+ Fe2+ , Al3+
Слайд 51ПРОБЛЕМА ФОСФОРА В ВОДАХ
является следствием экстраординарной чувствительности фитопланктона к фосфору.
Для
поддержания нормальной жизни в водах необходимо благоприятное соотношение
C:N:P =
106:16:1Фосфор в большинстве случаев является главным лимитирующим элементом в эвтрофикации водоемов.
Повышение концентрации Р в воде неизбежно ведет к сложной перестройке всех взаимоотношений в среде, ведет к мобилизации других питательных элементов.
Слайд 52Первичная продуктивность в воде имеет логарифмическую зависимость от концентрации Р
100
10
1
0.1
Слайд 53Выраженное беспокойство по поводу увеличивающейся эвтрофикации относится
к 60-ым годам
прошлого века.
Главным вкладчиком являются фосфорные удобрения.
Полагают, что около
2-3% от вносимого количества Р с удобрениями подвергается вымыванию. Такое же количество Р или больше теряется с эрозионным стоком (жидким и твердым).
Применение детергентов на основе полифасфатов
Слайд 54ЭТАПЫ ЭВТРОФИКАЦИИ
Медленное увеличение эвтрофикации с момента появления промышленных Р-удобрений и
активизации бытовых сбросов, т.е. с 1840-50 годов в Европе.
В Северной
Америке это совпало в 1940-х годах с началом производства фосфатных детергентов и быстрым наращиванием применения Р-удобрений.Связан с экспоненциальным увеличением производства фосфорных удобрений с 1970-х годов.
Слайд 55ОЧИСТКА СТОКОВ ОТ ФОСФОРА
Достигается применением простых химикатов:
FeCl2 , FeCl3
или
Al2(SO4)3
или известь,
соответственно получают:
FePO4, AlPO4, Ca5(PO4)3OH – гидроксилаппатит.
СТОИМОСТЬ
От
1.5 до 4.5 $ /чел. Слайд 57Глобальный биогеохимический цикл серы – целый комплекс химических и биохимических
реакций, в которых сера участвует в различных формах с разными
физико-химическими свойствами и агрегатными состояниямиГазообразные формы серы:
H2S (сероводород), SO2 (двуокись серы),
SO3 (триокись серы)
Серосодержащие газы образуются как в природе, так и в промышленном производстве
Слайд 58Все серосодержащие газы хорошо растворимы в воде и образуют растворы
с ярко выраженными кислотными свойствами
В атмосфере H2S быстро окисляется до
SO2, который очень реакционен и вступает в реакции окисления, гидратации:SO2 + 2H2S 3S + 2H2O
2SO2 + O2 2SO3
SO3 хорошо растворим в воде с образованием H2SO4, которая ведет себя очень агрессивно, способствуя выветриванию минералов и коррозии металлов.
Слайд 59Большинство сульфатов широко распространено в природе:
CaSO4 – ангидрит; CaSO4H2O –
гипс
Окисленная сера выводится из цикла преимущественно в кальциевых соединениях.
Отложения
ангидрита и гипса – самые громадные резервуары серы.Сульфиды образуются из водных растворов H2S. Большинство сульфидов металлов (за исключением щелочных и щелочеземельных) очень плохо растворимы в воде.
Слайд 60Серосодержащие соединения с металлами меняются в зависимости от окислительно-восстановительных условий:
анаэробные аэробные
сульфиды сульфатыОкисленные формы, сульфаты металлов, более растворимы и могут вымываться, а сульфиды – плохо растворимы, иммобилизуют металлы.
Из всех сульфидов наибольшее распространение имеет сульфид железа – FeS2 или пирит, широко встречаемый в природе.
Наряду с элементарной серой пирит используется для производства серной кислоты.
Слайд 61ОБРАЗОВАНИЕ И РАЗЛОЖЕНИЕ
S-СОДЕРЖАЩИХ СОЕДИНЕНИЙ В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ
Сера входит в состав
многих аминокислот и является одним из главных биофильных элементов.
Подавляющее большинство
растений и микроорганизмов используют реакцию восстановления при ассимиляции сульфатов.Сера затем включается в серосодержащие аминокислоты: цистин, цистеин и метионин.
Слайд 62Другая группа живых организмов (животные и некоторые микроорганизмы) утилизируют серу
для своего метаболизма и роста только в виде серосодержащих аминокислот.
Некоторые
микроорганизмы не ограничиваются только использованием серы из сульфатов, а могут использовать ее из сульфитов и сульфидов.После отмирания биомассы, сера минерализуется с высвобождением либо сульфатов (аэробное разложение) либо сульфидов (анаэробное)
Слайд 63ПОТОК СЕРЫ ЗА СЧЕТ ВЫВЕТРИВАНИЯ ПОРОД, ОБУСЛОВЛЕННОГО ХОЗЯЙСТВЕННОЙ ДЕЯТЕЛЬНОСТЬЮ ЧЕЛОВЕКА
Механическое
выветривание.
Руды и основные породы, которые извлекаются на поверхность Земли с
содержанием серы 0.1% и выше составляют 20103 Tg/год или 20 Tg S/год.
Выветривание, связанное с добычей и сжиганием топлива
Во время сжигания органическая и пиритная сера окисляется до SO2 (94%) или SO3 (4%)
Слайд 64Содержание S в топливах (%%):
Уголь – 1-14
(уголь из Рура, Донбаса
содержит 8-14% S)
Общий пул S в каменном угле оценивается в
20103Tg при общих запасах каменного угля 1300103Tg.В настоящее время выделение S при сжигании угля 60-70 Tg/год
Нефть
Содержит 0.1 – 3% S
Газ
Содержит 0.1-40% S
Эмиссия S при сжигании нефти и газа 20-25 TgS/год
Слайд 65ЭМИССИЯ СЕРЫ В МЕТАЛЛУРГИЧЕСКИХ ПРОИЗВОДСТВАХ
Сульфиды присутствуют во всех рудах нежелезных
металлов.
В некоторых пиритах S 45%.
При выплавке меди, цинка, никеля,
свинца и др. металлов сульфиды окисляются до SO2 и выделяются в атмосферуВыделение S в металлургических производствах составляет 10-29% от количества, выделяемого при сжигании угля, что составляет 10-20 TgS/год
Слайд 66КИСЛОТНЫЕ ДОЖДИ
В незагрязненных районах рН осадков 5.7 при 25оС
В районах с карбонатными почвами, попадание пыли в атмосферу вызывает
подщелачивание осадков.В прединдустриальную эпоху рН осадков везде был выше 5,0
В Антарктиде, в снеговом-ледовом профиле пробы имеют рН 6.30
В настоящее время, в индустриальных районах кислотность осадков повысилась в 5-30 раз по сравнению с незагрязненными районами
рН осадков в странах Западной и Центральной Европы, а также Восточное побережье США и Ю.В. Канады 4.0-4.5