Слайд 1БИОИНЖЕНЕРИЯ №3
Тема нашей сегодняшней лекции – это поведение брома при
атаке его молекулами хрома. Это в простонародье известно, как «закон
Майкельсона-Шварца». Всем хорошо известно, что Майкельсон был крупным российским учёным, но мало кто знает, что Майкельсон работал со Шварцем. Шварц был репрессирован в тридцать седьмом году и, практически, расстрелян. До того, как он был расстрелян, он был помещён в Волго-Балт.
И тогда, в одном из писем, писем из лагеря своей жене, он писал о том, что в процессе рытья ямы он обнаружил странную вещь. Яма, наполненная бромом, может хлорироваться только четырьмя молекулами углерода.
Представьте себе молекулу углекислого плюмбума. Молекула ведёт себя при атаке её атома приблизительно так. Атом ведёт себя пассивно, он не воспринимает воздействия энергетических потоков сознания на молекулу и старается воспротивиться восприятию луча со стороны земной коры. Кора поддаёт снизу. И когда молекула начинает вращаться, мы берём хлорированный бром и смешиваем его с плюмбумом-четыре-эс-два-аш. Посмотрите, что происходит. Вы видите? Видите? И он был потрясен тоже! Ничего подобного ни один человек ещё не видел. И этот закон назывался «законом Майкельсона», потому что Шварц был забыт. Обратите внимание – хром, вот видите, хром? Хром, при возможности возникновения его в промежуточном состоянии, он начинает выделять энергетику, равную нулю.

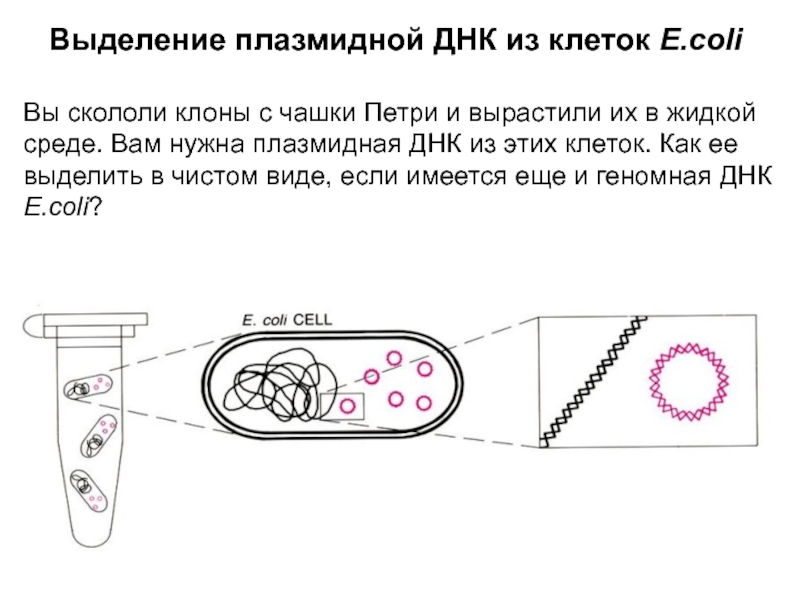
Слайд 2Выделение плазмидной ДНК из клеток E.coli
Вы скололи клоны с чашки
Петри и вырастили их в жидкой среде. Вам нужна плазмидная
ДНК из этих клеток. Как ее выделить в чистом виде, если имеется еще и геномная ДНК E.coli?
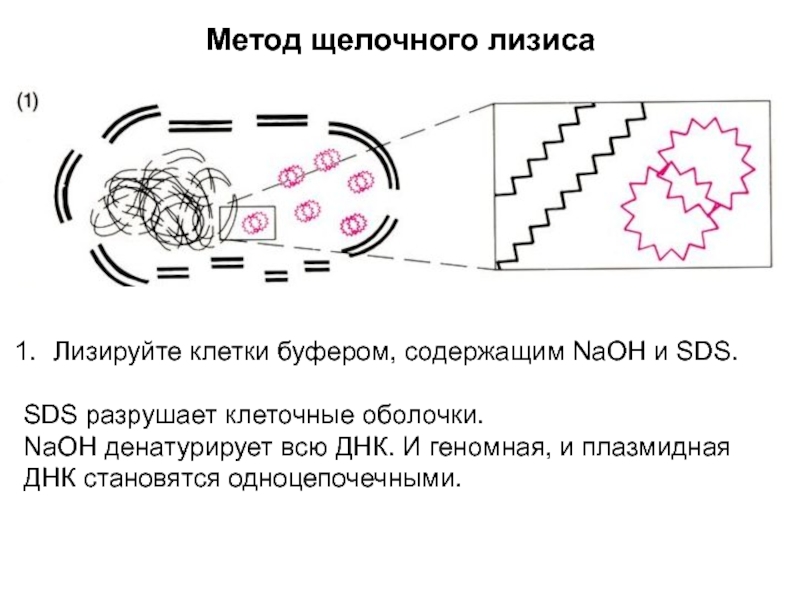
Слайд 3Метод щелочного лизиса
Лизируйте клетки буфером, содержащим NaOH и SDS.
SDS разрушает
клеточные оболочки.
NaOH денатурирует всю ДНК. И геномная, и плазмидная ДНК
становятся одноцепочечными.
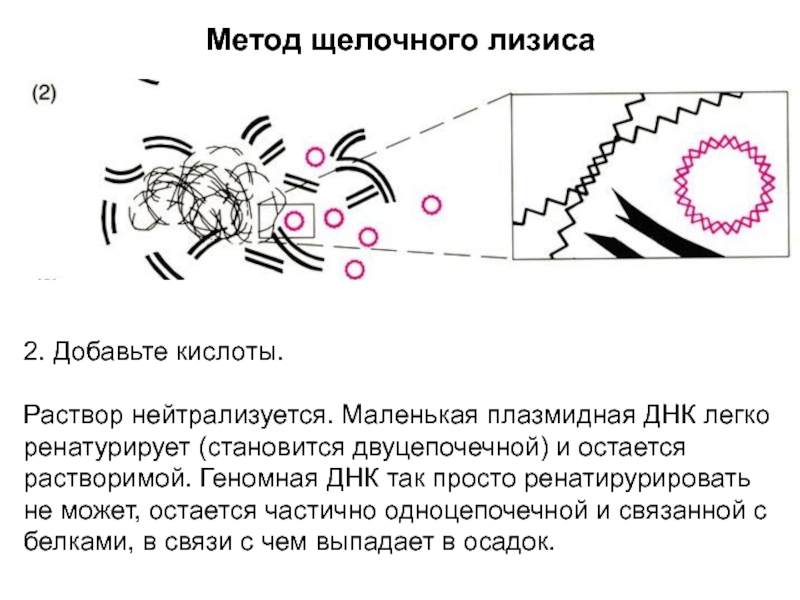
Слайд 4Метод щелочного лизиса
2. Добавьте кислоты.
Раствор нейтрализуется. Маленькая плазмидная ДНК легко
ренатурирует (становится двуцепочечной) и остается растворимой. Геномная ДНК так просто
ренатирурировать не может, остается частично одноцепочечной и связанной с белками, в связи с чем выпадает в осадок.
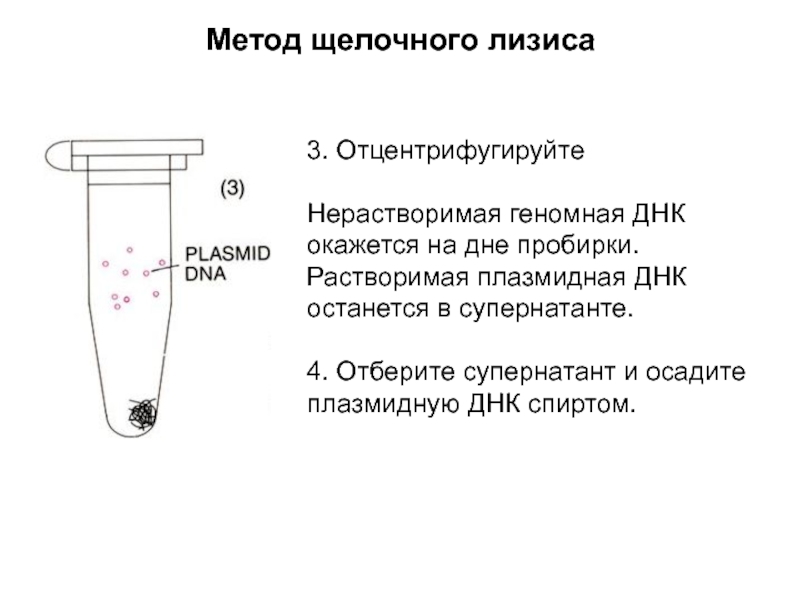
Слайд 5Метод щелочного лизиса
3. Отцентрифугируйте
Нерастворимая геномная ДНК окажется на дне пробирки.
Растворимая плазмидная ДНК останется в супернатанте.
4. Отберите супернатант и осадите
плазмидную ДНК спиртом.
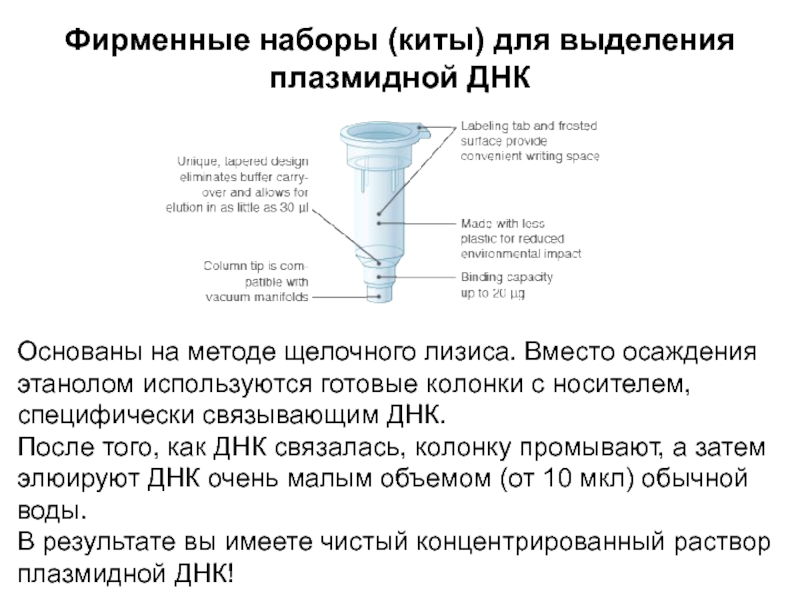
Слайд 6Фирменные наборы (киты) для выделения плазмидной ДНК
Основаны на методе щелочного
лизиса. Вместо осаждения этанолом используются готовые колонки с носителем, специфически
связывающим ДНК.
После того, как ДНК связалась, колонку промывают, а затем элюируют ДНК очень малым объемом (от 10 мкл) обычной воды.
В результате вы имеете чистый концентрированный раствор плазмидной ДНК!
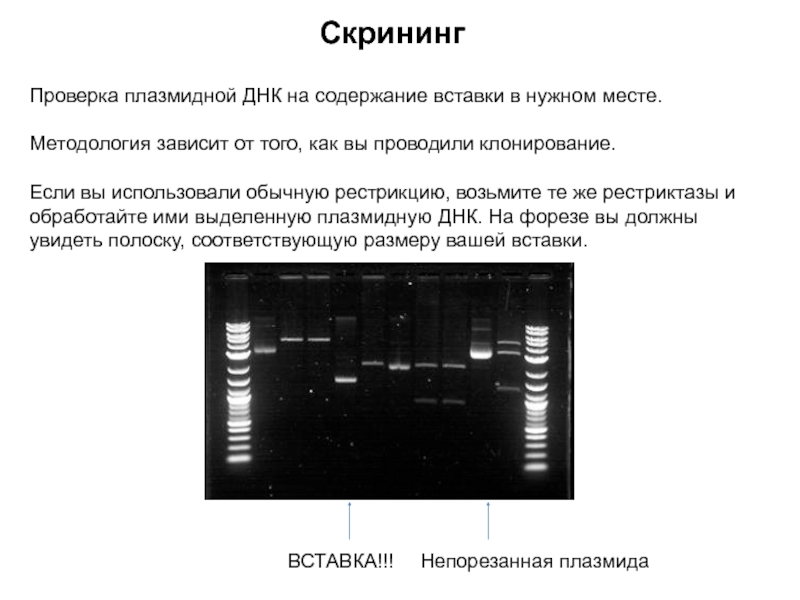
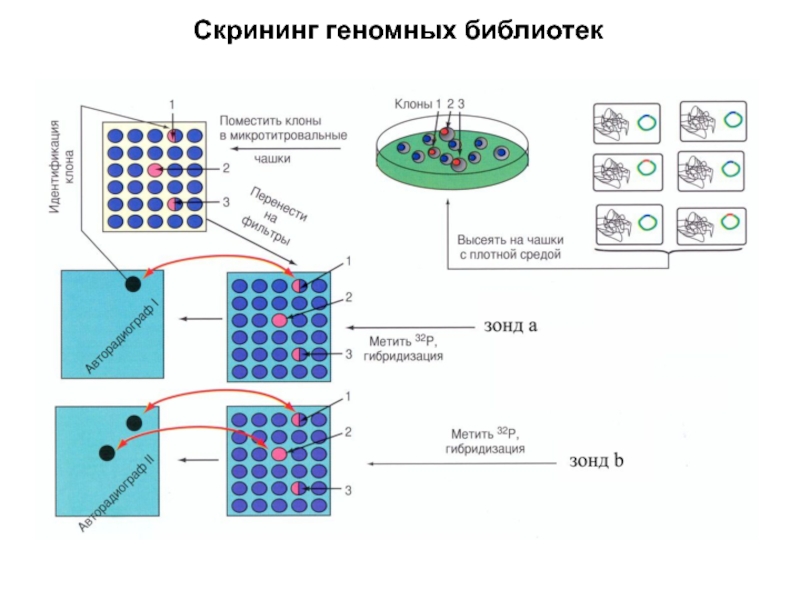
Слайд 7Скрининг
Проверка плазмидной ДНК на содержание вставки в нужном месте.
Методология зависит
от того, как вы проводили клонирование.
Если вы использовали обычную рестрикцию,
возьмите те же рестриктазы и обработайте ими выделенную плазмидную ДНК. На форезе вы должны увидеть полоску, соответствующую размеру вашей вставки.
Непорезанная плазмида
ВСТАВКА!!!
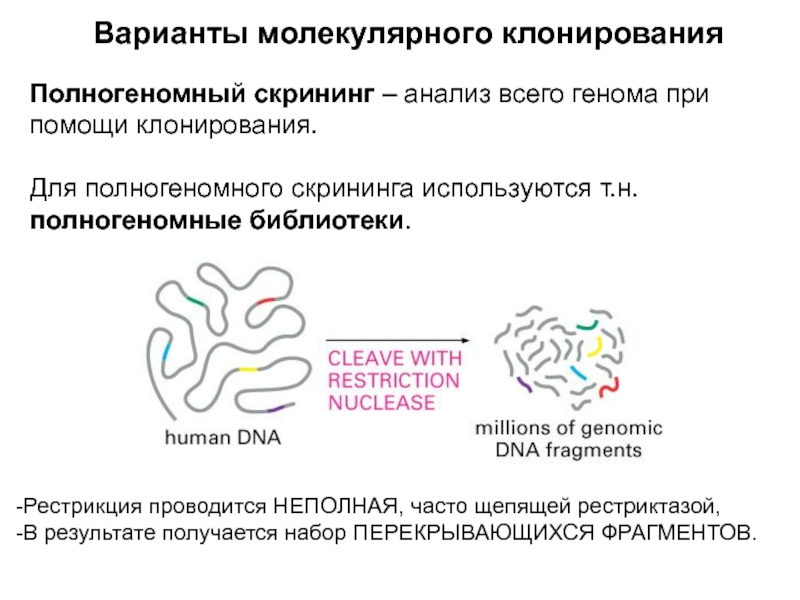
Слайд 8Варианты молекулярного клонирования
Полногеномный скрининг – анализ всего генома при помощи
клонирования.
Для полногеномного скрининга используются т.н. полногеномные библиотеки.
Рестрикция проводится НЕПОЛНАЯ, часто
щепящей рестриктазой,
В результате получается набор ПЕРЕКРЫВАЮЩИХСЯ ФРАГМЕНТОВ.
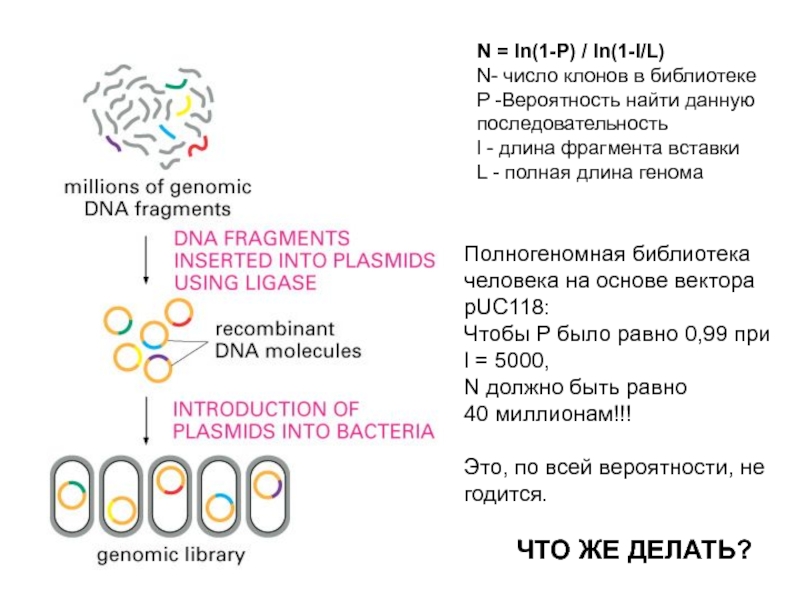
Слайд 9N = ln(1-P) / ln(1-l/L)
N- число клонов в библиотеке
P -Вероятность
найти данную
последовательность
l - длина фрагмента вставки
L - полная длина генома
Полногеномная
библиотека человека на основе вектора pUC118:
Чтобы Р было равно 0,99 при
l = 5000,
N должно быть равно
40 миллионам!!!
Это, по всей вероятности, не годится.
ЧТО ЖЕ ДЕЛАТЬ?
Слайд 10Да очень просто: нужно увеличить размер вставки!
Сделать его 100 тысяч,
да и дело с концом!
А вот и нет!
Плазмида неэффективно
реплицируется в клетке из-за принятия неканонических структур,
2. Рост клеток замедляется из-за повышения вероятности кодирования токсичных продуктов,
3. Неканонические структуры, принимаемые плазмидной ДНК, часто распознаются бактериальными системами как нежелательные и удаляются.
При вставке в обычный вектор фрагмента длиннее 10 т.п.н. возникают проблемы:
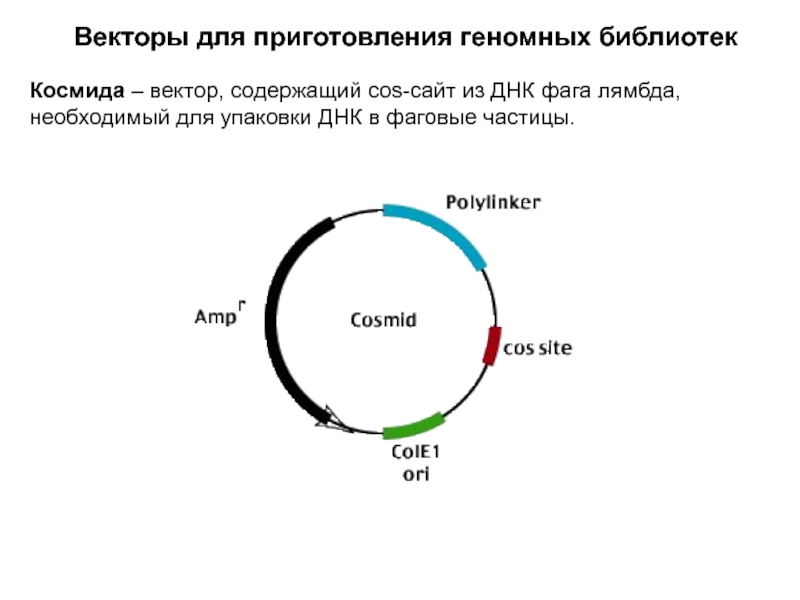
Слайд 11Векторы для приготовления геномных библиотек
Космида – вектор, содержащий cos-сайт из
ДНК фага лямбда, необходимый для упаковки ДНК в фаговые частицы.
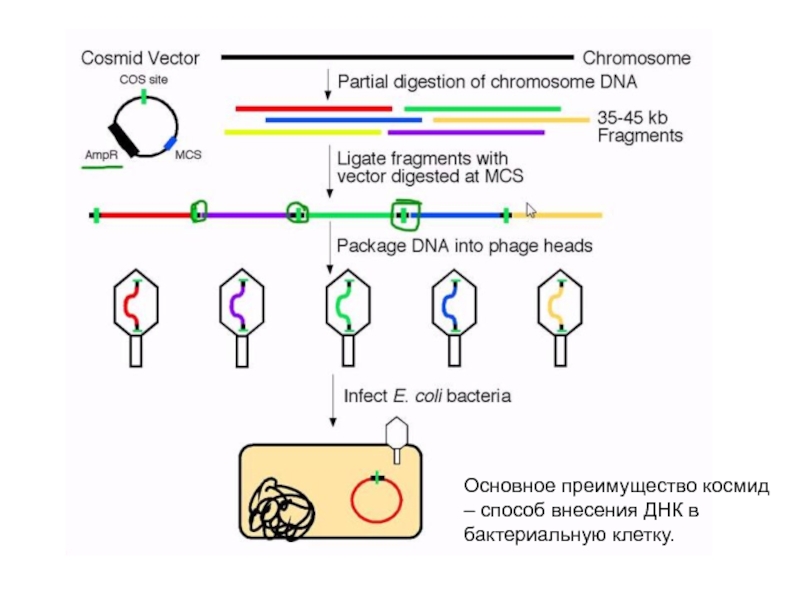
Слайд 12Основное преимущество космид – способ внесения ДНК в бактериальную клетку.
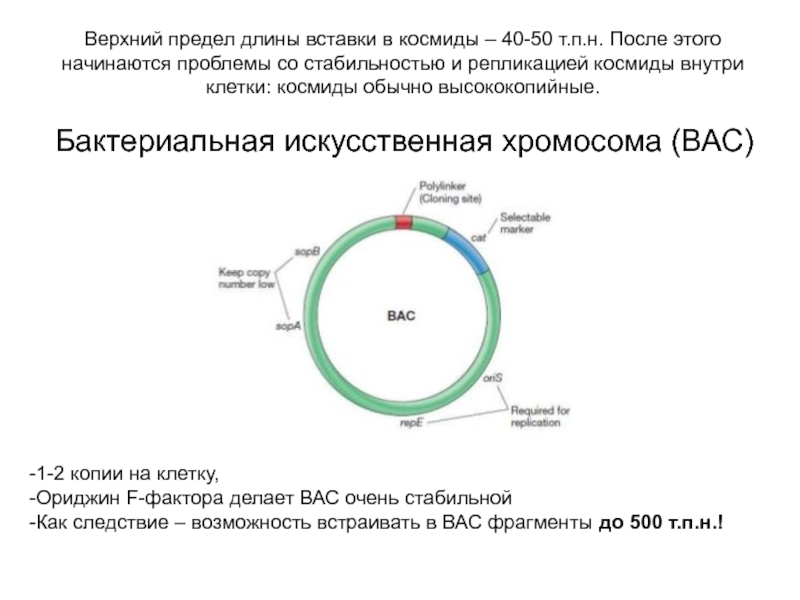
Слайд 13Верхний предел длины вставки в космиды – 40-50 т.п.н. После
этого начинаются проблемы со стабильностью и репликацией космиды внутри клетки:
космиды обычно высококопийные.
Бактериальная искусственная хромосома (ВАС)
1-2 копии на клетку,
Ориджин F-фактора делает ВАС очень стабильной
Как следствие – возможность встраивать в ВАС фрагменты до 500 т.п.н.!
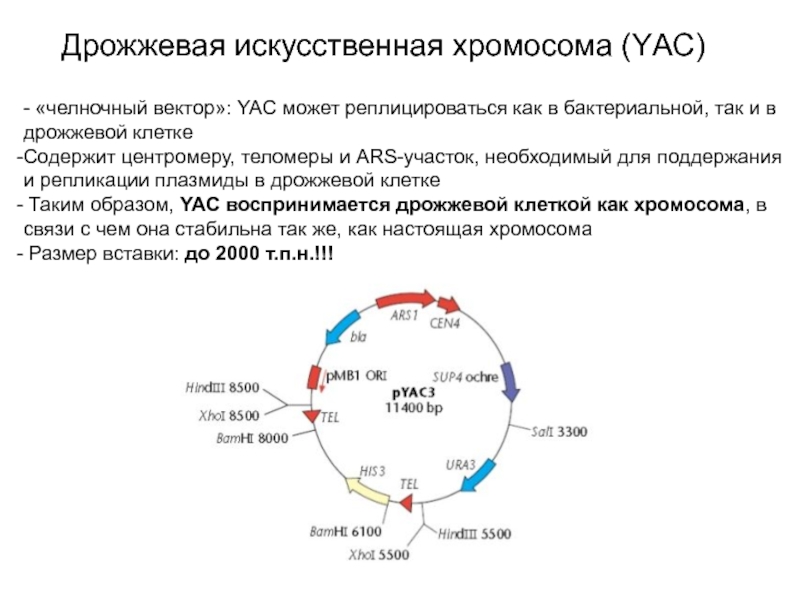
Слайд 14Дрожжевая искусственная хромосома (YАС)
- «челночный вектор»: YAC может реплицироваться как
в бактериальной, так и в дрожжевой клетке
Содержит центромеру, теломеры и
ARS-участок, необходимый для поддержания и репликации плазмиды в дрожжевой клетке
Таким образом, YAC воспринимается дрожжевой клеткой как хромосома, в связи с чем она стабильна так же, как настоящая хромосома
Размер вставки: до 2000 т.п.н.!!!
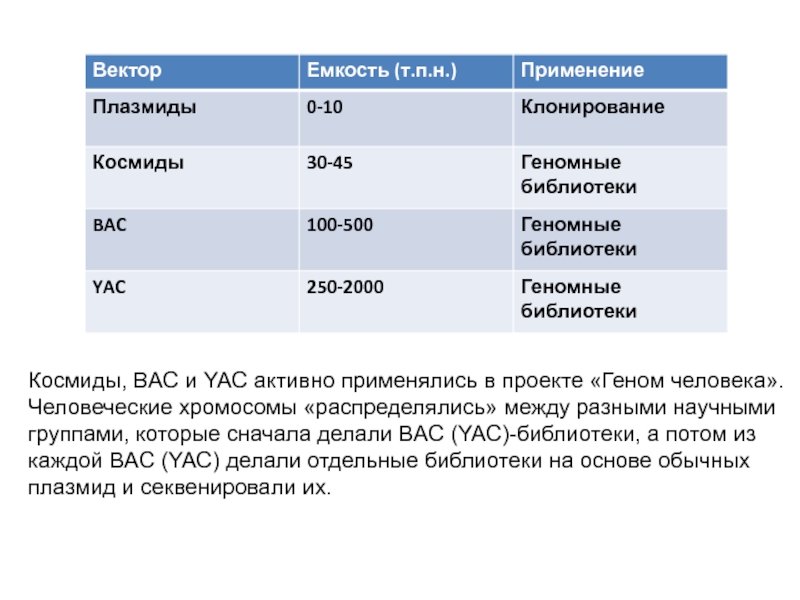
Слайд 15Космиды, BAC и YAC активно применялись в проекте «Геном человека».
Человеческие
хромосомы «распределялись» между разными научными группами, которые сначала делали BAC
(YAC)-библиотеки, а потом из каждой BAC (YAC) делали отдельные библиотеки на основе обычных плазмид и секвенировали их.
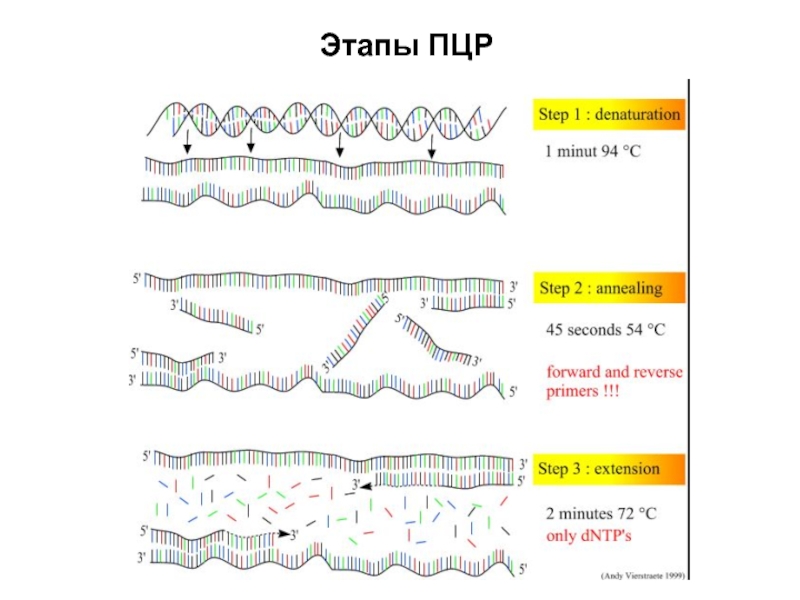
Слайд 17Полимеразная цепная реакция (ПЦР)
Впервые проведена Кэри Маллисом в 1983 году.
В
1993 году он получил Нобелевскую премию.
Даже удивительно, что никто не
додумался до ПЦР раньше. Все ее этапы по отдельности уже использовались в генной инженерии. Маллис же просто сообразил, как совместить их так, чтобы результатом реакции было экспоненциальное увеличение количества нужной ДНК.
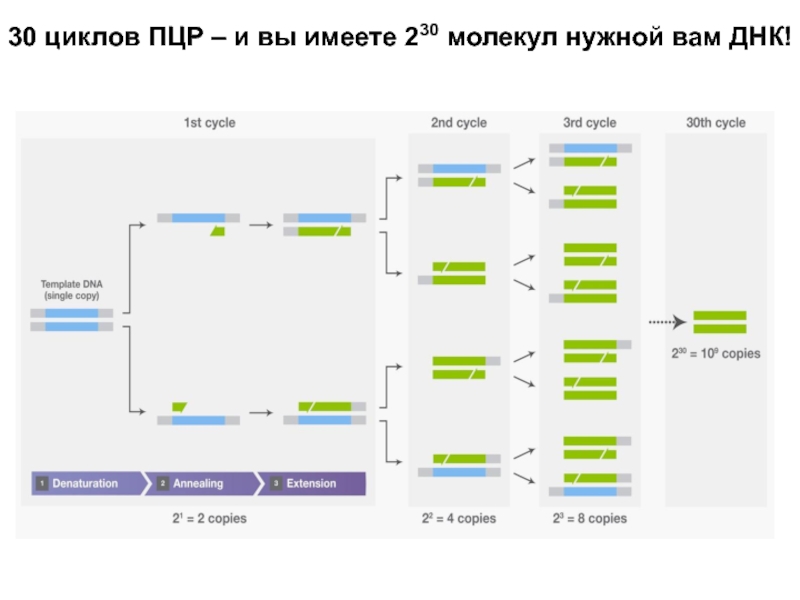
Слайд 1930 циклов ПЦР – и вы имеете 230 молекул нужной
вам ДНК!
Слайд 20ПЦР в 80-е годы: метод трех кастрюль
Слайд 21ПЦР сегодня: программируемые амплификаторы