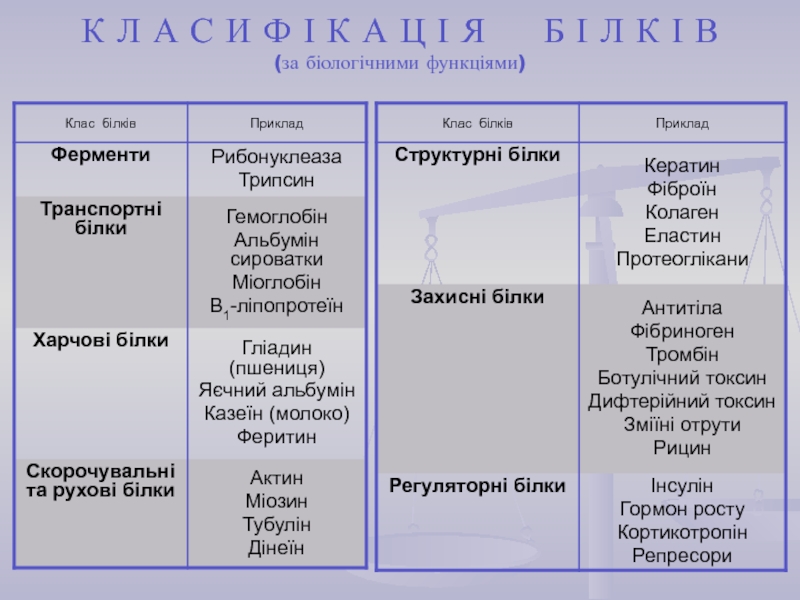
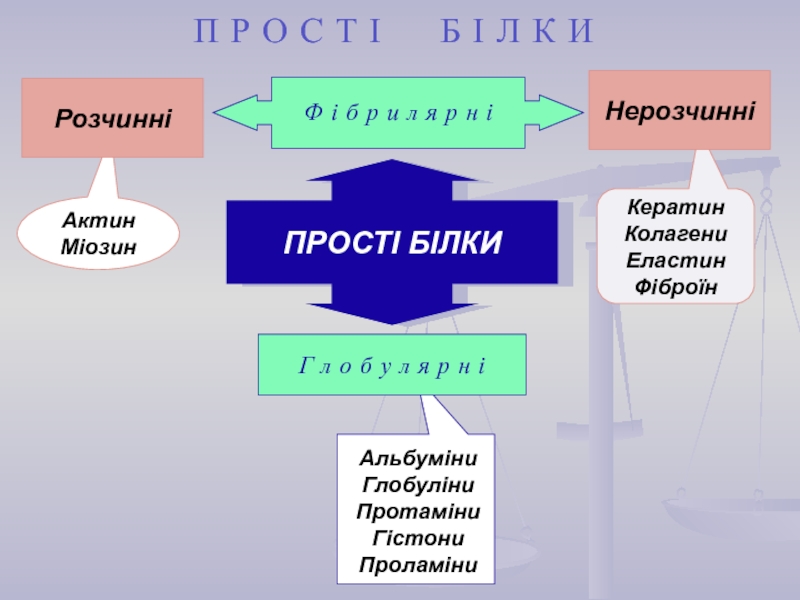
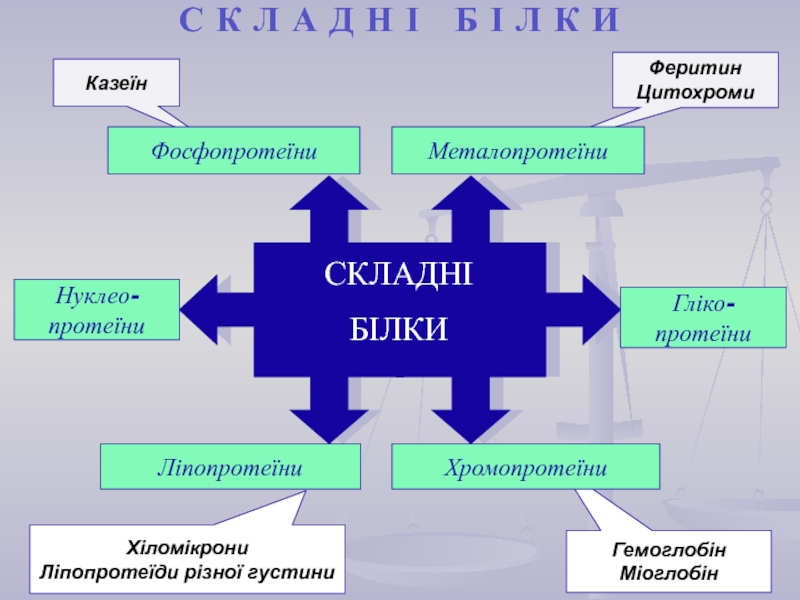
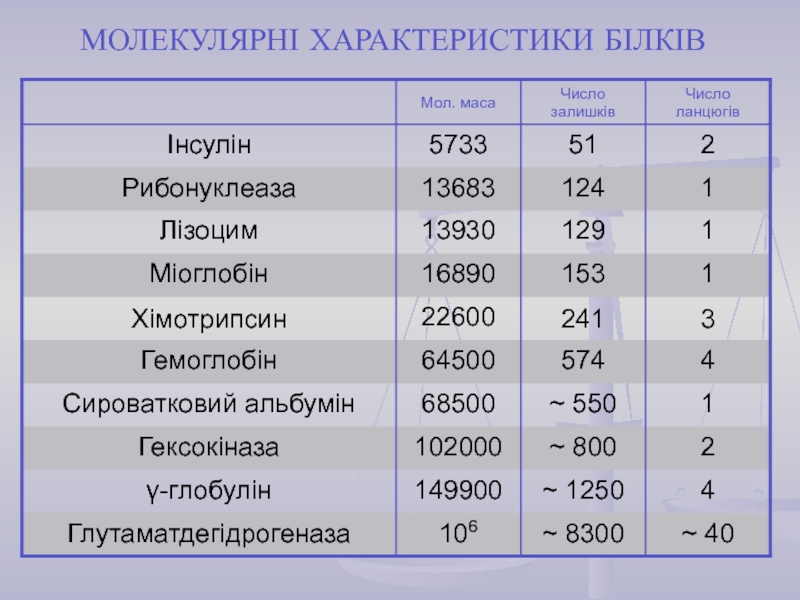
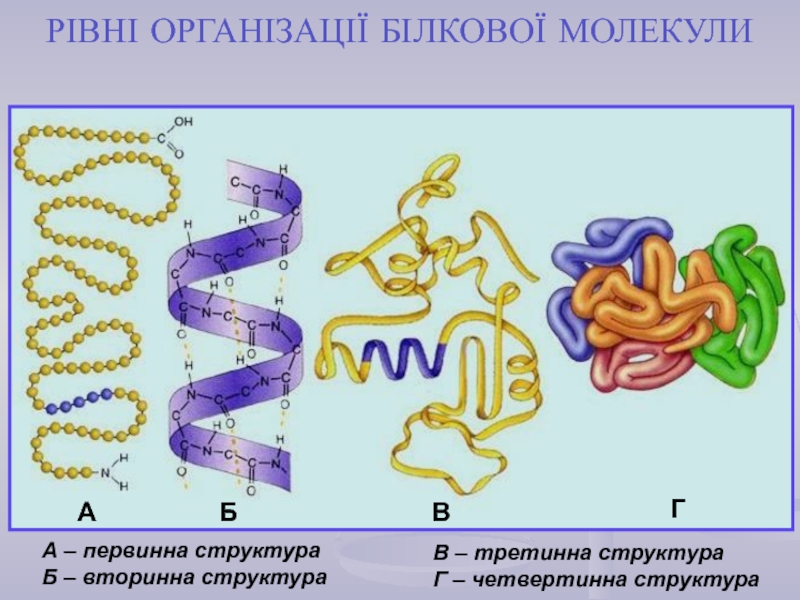
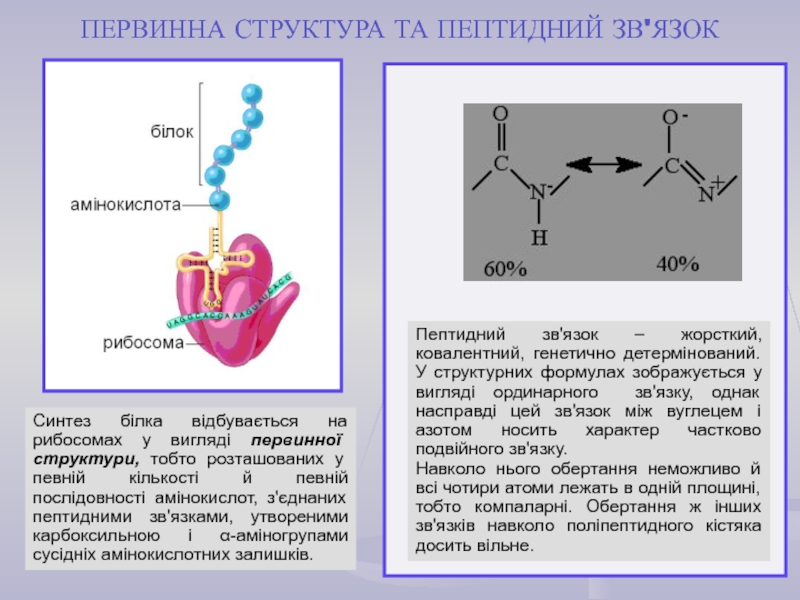
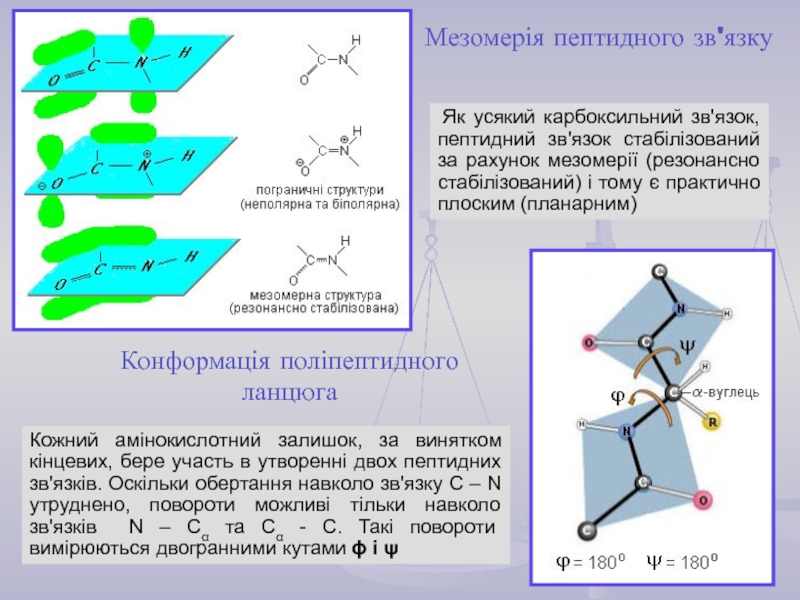
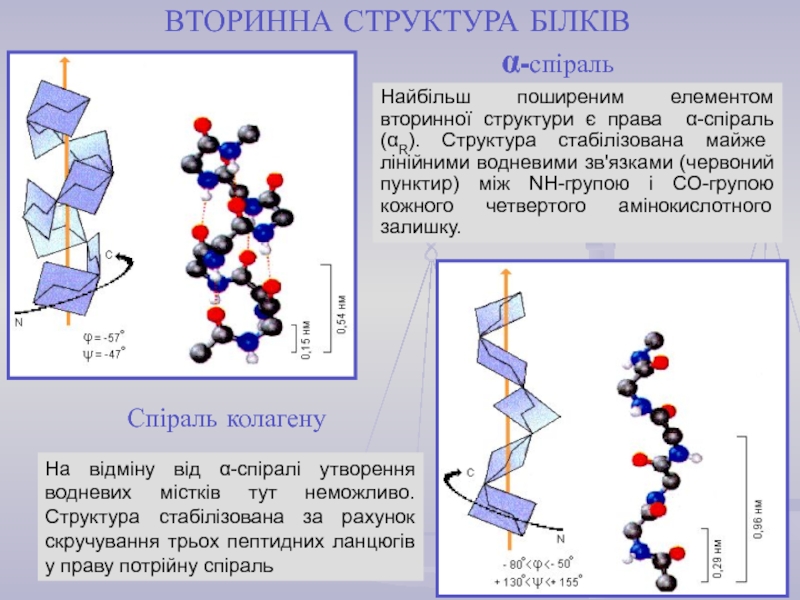
найважливіший) – природні органічні високомолекулярні сполуки, які у вигляді мономерних
ланок містять залишки протеїногенних амінокислот, сполучених пептидним зв'язком. Білки є досить важливими у біологічному відношенні та досить складними за структурою сполуками. Вони зустрічаються в усіх живих організмах і є основою їх життєдіяльності.Кожний білок характеризується специфічною амінокислотною послідовністю й індивідуальною просторовою структурою (конформацією). На частку білків доводиться не менш 50% сухої маси органічних сполук тваринної клітини, і в організмі людини налічується до 5 млн. різних видів білків. Функціонування білка лежить в основі найважливіших процесів життєдіяльності організму.
Б І Л К И