Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Частина 1 Презентація на тему:
Содержание
- 1. Частина 1 Презентація на тему:
- 2. Штучні речовиниШтучні речовини – речовини, яких не
- 3. ГумаГу́ма — продукт вулканізації композицій на основі
- 4. ПластмасиПласти́чна ма́са (пластмаса) — штучно створені матеріали на основі синтетичних або природних полімерів.
- 5. Складно полічити, скільки речей на цьому світі
- 6. Природні РЕЧОВИНИ
- 7. Природні речовиниПриродні речовини – логічно, речовини, які
- 8. Таблиця МєндєлєєваПеріоди́чна систе́ма елеме́нтів — класифікація хімічних
- 9. Органічні речовиниОргані́чні речови́ни — речовини, що виникли
- 10. Частина 2 Презентація на тему: Унікальні властивості води
- 11. ВодаВода́— хімічна речовина у вигляді прозорої, безбарвної
- 12. Властивості води Вода одночасно і проста,
- 13. Деякі фізичні і хімічні властивості водиВода —
- 14. Воду називають універсальним розчинником. Вона розчиняє майже
- 15. Молекули води зчіплюються водневими зв’язками між собою.
- 16. Молекули води здатні, так би мовити, «підійматися»
- 17. При переході від рідкого до твердого стану
- 18. Падаюча крапля дощу розчиняє різні гази, які
- 19. Поверхневий натяг води визначається силами зчеплення молекул
- 20. Дякую за увагу!(навіть за її відсутність)Презентацію виконала
- 21. Скачать презентанцию
Штучні речовиниШтучні речовини – речовини, яких не знайдеш у природі (хоча зараз будь-хто може сказати, що у природі гори всього цього сміття), наприклад гума, пластмаса, силікон та багато інших.
Слайды и текст этой презентации
Слайд 3Гума
Гу́ма — продукт вулканізації композицій на основі каучуку; матеріал, необхідний
для виробництва різноманітних виробів — від автомобільних шин до хірургічних
рукавичок. Головна перевага гуми — її еластичність. Вона може розтягуватися й гнутися, а потім приймати початкову форму.Ка́учук (матеріал з якого виготовляють гуму) — еластичний матеріал, який отримують при коагуляції латексу каучуконосних рослин, головним чином бразильської гевеї, що росте в тропічних країнах
Слайд 4Пластмаси
Пласти́чна ма́са (пластмаса) — штучно створені матеріали на основі синтетичних
або природних полімерів.
Слайд 5Складно полічити, скільки речей на цьому світі виготовлені зі штучних
речовин, якщо подивитися навколо, то, окрім дерев’яних речей, мабуть, все:
навушники, більшість одягу та ліків, телефони, іграшки, канцтовари, навіть їжа – все містить якусь хімію.Слайд 7Природні речовини
Природні речовини – логічно, речовини, які можна запросто, або
й навпаки знайти в природі: звичайнісіньке дерево, не такі вже
й звичайні золото, срібло, мідь та ін. метали, той же каучук, кисень, врешті-решт, вода, пісок, та багато інших речовин. Зокрема і тих, що є в табличці Мєндєлєєва.Слайд 8Таблиця Мєндєлєєва
Періоди́чна систе́ма елеме́нтів — класифікація хімічних елементів, розроблена на
основі періодичного закону.
Дмитро́ Іва́нович Менделє́єв — великий російський хімік, один
з авторів періодичної таблиці хімічних елементів. У 1882 році Лондонське королівське товариство присудило золоті медалі Деві з формулюванням «За відкриття періодичних співвідношень атомних ваг» спільно Менделєєву й німецькому хіміку Лотару Юліусу Маєру.Слайд 9Органічні речовини
Органі́чні речови́ни — речовини, що виникли прямо або непрямо
з живої речовини або продуктів їх життєдіяльності; присутні в атмосфері,
поверхневих і підземних водах, осадах, ґрунтах і гірських породах. Складаються із органічних сполук.Слайд 11Вода
Вода́— хімічна речовина у вигляді прозорої, безбарвної рідини без запаху
і смаку, (в нормальних умовах). У природі існує у трьох
агрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара).Слайд 12Властивості води
Вода одночасно і проста, і складна. Молекула
води складається з трьох атомів — двох атомів
водню та одного атому кисню. Водночас, вода має такі особливості будови, які зумовлюють ряд її незвичайних, майже магічних властивостей.Слайд 13Деякі фізичні і хімічні властивості води
Вода — єдина речовина на
Землі, яка зустрічається у трьох агрегатних станах: твердому, рідкому та
газоподібному. За нормальних умов, температура замерзання чистої води дорівнює 0 градусів Цельсія, а кипіння - відповідно 100 градусів Цельсія, що покладено в основу температурної шкали Цельсія. В залежності від атмосферного тиску, наприклад, на висоті, де тиск нижчий, температура кипіння води теж знижується. Розчинення різних речовин у воді знижує її температуру замерзання. Це добре знають люди, які посипають узимку вулиці сіллю для запобігання утворенню льоду.Слайд 14Воду називають універсальним розчинником. Вона розчиняє майже всі тверді та
газоподібні сполуки значно краще, ніж будь-який інший розчинник. Практично немає
такої речовини, присутність якої не виявлено у воді.Слайд 15Молекули води зчіплюються водневими зв’язками між собою. Подібним же чином
вони здатні «прилипати» до різних матеріалів, таких як скло, вата,
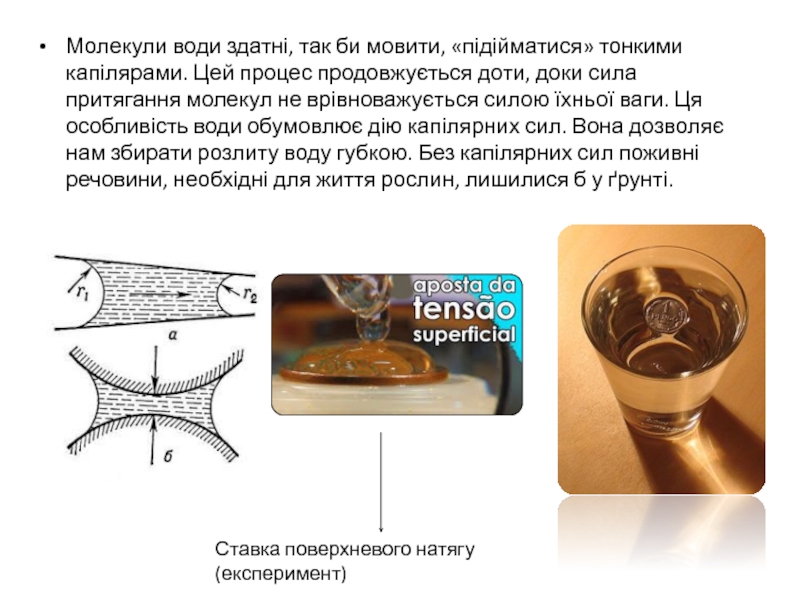
поверхневий шар рослин або ґрунту. Ця властивість називається адгезією.Слайд 16Молекули води здатні, так би мовити, «підійматися» тонкими капілярами. Цей
процес продовжується доти, доки сила притягання молекул не врівноважується силою
їхньої ваги. Ця особливість води обумовлює дію капілярних сил. Вона дозволяє нам збирати розлиту воду губкою. Без капілярних сил поживні речовини, необхідні для життя рослин, лишилися б у ґрунті.Ставка поверхневого натягу (експеримент)
Слайд 17При переході від рідкого до твердого стану густина і вага
майже всіх речовин збільшується. На відміну від них, вода збільшує
свій об’єм і стає легшою при замерзанні. Ця властивість має велике значення для збереження життя у водних об’єктах узимку. Лід утворюється на поверхні водойми і захищає її від повного промерзання.Слайд 18Падаюча крапля дощу розчиняє різні гази, які знаходяться в атмосфері.
Таким чином, дощ може змінити фізичні та хімічні властивості ґрунту
або води річок та озер.Вода здатна зберігати велику кількість теплової енергії. Океани, моря і озера - це гігантські накопичувачі тепла. Така особливість води істотно впливає на клімат районів, близьких до великих водних об’єктів, перш за все морів та океанів. Завдяки цій властивості вода широко використовується як теплоносій в техніці і побуті для охолодження або підігріву.