Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
C:\TEMP\Rar$DI01.671\master.jpg Качественные реакции в неорганической химии
Содержание
- 1. C:\TEMP\Rar$DI01.671\master.jpg Качественные реакции в неорганической химии
- 2. Качественный анализ — совокупность химических, физико-химических и
- 3. В качественном
- 4. Качественные реакции на катионыЩЕЛОЧНЫЕ МЕТАЛЛЫ
- 5. Качественные реакции на катионы щелочных металлов
- 6. Катионы
- 7. ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫКстати, к щелочно-земельным относятся кальций,
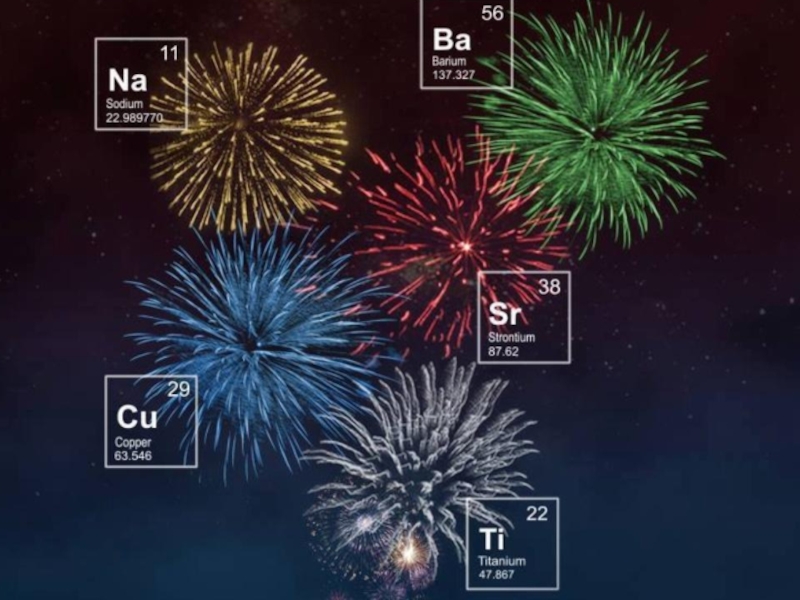
- 8. Катионы щелочно-земельных металловCa2+ - кирпично-красный.Sr2+ - карминово-красный.Ba2+ - желтовато-зеленый.Ra2+ - темно-красный.Окрашивание пламени
- 9. Химия на празднике
- 10. Слайд 10
- 11. Катионы щелочно-земельных металлов можно выявить двумя способами:
- 12. Катионы алюминия Al3+, хрома (III) Cr3+, цинка
- 13. Катионы меди Cu2+ Одной из
- 14. Катион аммония NH4+ При взаимодействии солей
- 15. Катионы свинца (II) Pb2+,
- 16. Катионы железа Fe2+ Данные катионы также образуют
- 17. Катионы железа Fe3+
- 18. Так же ион Fe2+ может быть обнаружен
- 19. Катионы водорода Н+Изменение окраски индикаторовПомните, что нерастворимые кислоты не меняют окраску индикаторов!
- 20. Слайд 20
- 21. Качественные реакции на АНионы
- 22. Качественная реакция на анион ОН-Изменение цвета индикатора:
- 23. Качественные реакции на
- 24. Качественная реакция на
- 25. Сульфат-анион обычно осаждают катионом бария, либо свинца:Ba2+
- 26. Силикат-анион легко осаждается из раствора в виде
- 27. Из сульфидов растворимы сульфиды только щелочных металлов
- 28. Некоторые сульфиды при взаимодействии с кислотами-неокислителями образуют
- 29. При добавлении к раствору карбоната сильных кислот
- 30. Качественная реакция на сульфит-анион SO32-При добавлении к
- 31. (раствор подкисляют обычно разбавленной H2SO4): 3Cu +
- 32. ЗАДАЧА
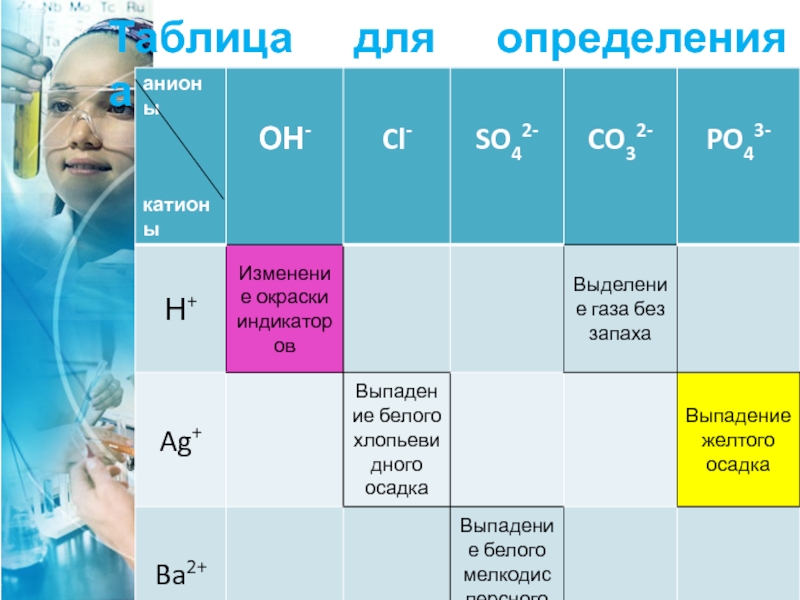
- 33. Таблица для определения анионов
- 34. Качественные реакции на простые и сложные вещества
- 35. ГАЗЫКислород Яркое загорание тлеющей лучинки в
- 36. Озон Взаимодействие озона с растворами иодидов
- 37. Углекислый газ CO2 Тушение горящей лучинки в
- 38. Азот Тушение горящей лучинки в
- 39. АммиакПосинение влажной лакмусовой бумажки при поднесении
- 40. СПАСИБО ЗА ВНИМАНИЕ!
- 41. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых
Слайд 3 В качественном анализе используют легко
выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение
окрашивания, выделение или растворение осадка, образование газа и др.Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы.
Основоположником качественного
анализа считается Р.Бойль.
Слайд 5Качественные реакции
на катионы щелочных металлов
– окрашивание пламени
Li+ –
карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Слайд 6 Катионы Li+
Катионы Li+ можно
отличить от катионов других щелочных металлов с помощью химической реакции.
При сливании раствора соли лития с фосфатами образуется нерастворимый в воде, но растворимый в конц. азотной кислоте, фосфат лития:
3Li+ + PO43- = Li3PO4↓
Li3PO4 + 3HNO3 = 3LiNO3 + H3PO4
У других щелочных металлов все соли растворимы
Слайд 7ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ
МЕТАЛЛЫ
Кстати, к щелочно-земельным относятся кальций, стронций, барий и
радий.
Бериллий и магний нельзя отнести к этой группе.
Слайд 8Катионы щелочно-земельных металлов
Ca2+ - кирпично-красный.
Sr2+ - карминово-красный.
Ba2+ - желтовато-зеленый.
Ra2+ -
темно-красный.
Окрашивание пламени
Слайд 11Катионы щелочно-земельных металлов можно выявить двумя способами: по окраске пламени,
а также реакциями в растворе.
Катионы этих металлов имеют
общую особенность: их карбонаты и сульфаты нерастворимы. Катион Ca2+ предпочитают выявлять
карбонат-анионом CO32-:
Ca2+ + CO32- = CaCO3↓
Который легко растворяется в азотной кислоте с выделением углекислого газа:
2H+ + CO32- = H2O + CO2↑
Катионы Ba2+, Sr2+ и Ra2+ предпочитают выявлять сульфат-анионом с образованием сульфатов, нерастворимых в кислотах:
Sr2+ + SO42- = SrSO4↓ Ba2+ + SO42- = BaSO4↓
Слайд 12Катионы алюминия Al3+, хрома (III) Cr3+, цинка Zn2+
Данные
катионы объединены образованием нерастворимых оснований, легко переводимых в растворимые комплексные
соединения. Групповой реагент – щелочь или раствор аммиака.Al3+ + 3OH- = Al(OH)3↓ + 3OH- = [Al(OH)6]3-
Cr3+ + 3OH- = Cr(OH)3↓ + 3OH- = [Cr(OH)6]3-
Zn2+ + 2OH- = Zn(OH)2↓ + 2OH- = [Zn(OH)4]2-
*Ион Mg+2 можно отличить от данных ионов отсутствием эффекта растворения при добавлении избытка щелочи к осадку Mg(OH)2
Слайд 13Катионы меди Cu2+
Одной из особенностей этих катионов является
образование с молекулами аммиака комплексных солей –
аммиакатов: Cu2+ + 4NH3 = [Cu(NH3)4]2+Аммиакаты окрашивают растворы в яркие цвета. Аммиакат меди окрашивает раствор в ярко-синий цвет.
При добавлении раствора щелочи к растворам солей меди образуется осадок голубого цвета гидроксида меди (II):
Cu2+ + 2ОH- = Cu(OH)2↓
Слайд 14Катион аммония NH4+
При взаимодействии солей аммония со щелочами
при нагревании ощущается резкий запах аммиака:
NH4+
+ OH- t → NH3↑ + H2OПри поднесении влажной лакмусовой бумажки к пробирке она окрасится в синий цвет.
Слайд 15 Катионы свинца (II) Pb2+, серебра (I) Ag+
Эта группу катионов объединяет одна общая особенность: они образуют нерастворимые хлориды. Но катионы свинца и серебра можно выявить и другими галогенидами.
Pb2+ + 2I- = PbI2↓ (осадок ярко желтого цвета)
Ag+ + Cl- = AgCl↓ (белый творожистый осадок)
Ag+ + Br- = AgBr↓ (желтовато-белый осадок)
Ag+ + I- = AgI↓ (желтый осадок )
*Также катионы Pb2+ , Ag+ и Сu2+образют осадки черного цвета с сульфид ионом:
2Ag+ + S2- = Ag2S↓ (осадок черного цвета)
Слайд 16Катионы железа Fe2+
Данные катионы также образуют
нерастворимые основания.
Иону Fe2+
отвечает
гидроксид железа (II) Fe(OH)2
- осадок зеленоватого цвета.
Катиону
Fe3+ отвечает гидроксид железа (III) Fe(OH)3 бурого цвета. Fe2+ + 2OH- = Fe(OH)2↓ ,
но будучи соединением двухвалентного железа, на воздухе неустойчиво и постепенно переходит в гидроксид железа (III): 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Слайд 17Катионы железа Fe3+
Fe3+ + 3OH- = Fe(OH)3↓
(осадок бурого цвета)Еще одной качественной реакцией на Fe3+ является взаимодействие с роданид-анионом SCN-
При этом образуется роданид
железа (III) Fe(CNS)3, окрашивающий раствор в темно-красный цвет:
Fe3+ + 3CNS- = Fe(CNS)3.
Слайд 18Так же ион Fe2+ может
быть обнаружен
гексациано-ферратом (III) калия
(красная кровяная
соль) - K3[Fe(CN)6].
Реакция сопровождается
выпадением синего осадка:
К++
Fe2+ + [Fe(CN)6]3-= KFe[Fe(CN)6] (турнбулева синь)А ион Fe3+ может быть обнаружен гексациано-ферратом (II) калия
(желтая кровяная соль) ,K4[Fe(CN)6].
Реакция сопровождается выпадение синего осадка: К+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6] (берлинская лазурь)
Слайд 19Катионы водорода Н+
Изменение окраски индикаторов
Помните, что нерастворимые кислоты
не меняют
окраску индикаторов!
Слайд 20
Качественная задача
Получите практическое задание у учителя ,
разработайте план распознавания предложенных веществ
и выполните его на практике.
Представьте свой вариант решения классу
Слайд 22Качественная реакция
на анион ОН-
Изменение цвета индикатора: универсальный индикатор и
лакмус посинеют, метиловый оранжевый – пожелтеет, фенолфталеин станет малиновым.
Слайд 23Качественные реакции на
хлорид- Cl-
Ag+ +
Cl-→AgCl↓(белый творожистый осадок)
бромид- Br-
Ag+ + Br-→AgBr↓
(желтоватый осадок)
иодид- I-
Ag+ + I-→AgI↓
(желтый осадок)
Слайд 24Качественная реакция на
фосфат PO43-
При добавлении к
раствору фосфата раствора соли серебра выпадает желтый осадок фосфата серебра Ag3PO4:3Ag+ + PO43- = Ag3PO4↓
(желтый осадок)
Слайд 25
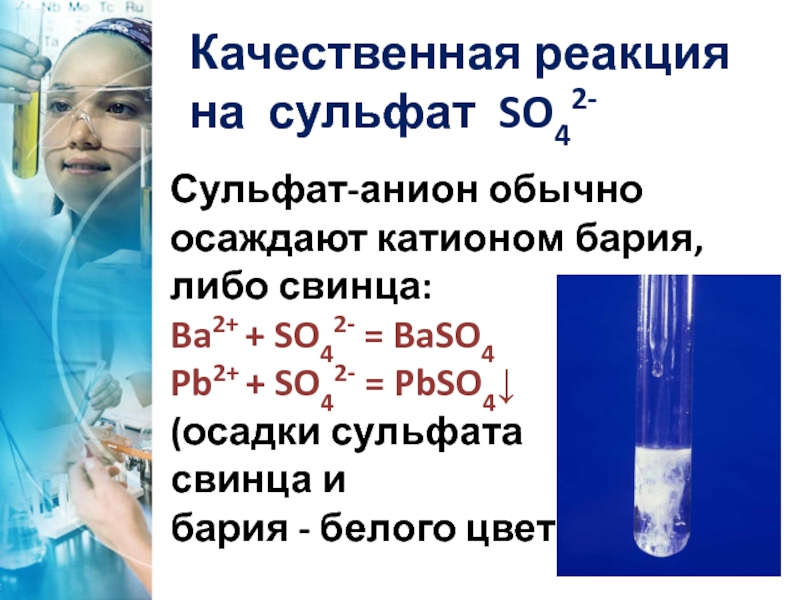
Сульфат-анион обычно осаждают катионом бария, либо свинца:
Ba2+ + SO42- =
BaSO4
Pb2+ + SO42- = PbSO4↓
(осадки сульфата
свинца и
бария - белого
цвета)Качественная реакция на сульфат SO42-
Слайд 26
Силикат-анион легко осаждается из раствора в виде стекловидной массы при
добавлении сильных кислот:
SiO32- + 2H+ = H2SiO3↓ (SiO2*nH2O)
Качественная реакция на
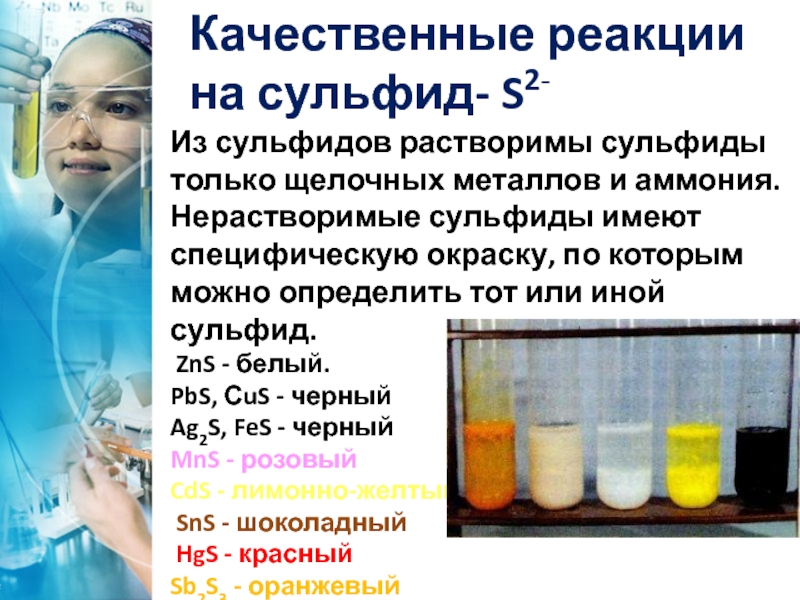
силикат- SiO32-Слайд 27Из сульфидов растворимы сульфиды только щелочных металлов и аммония. Нерастворимые
сульфиды имеют специфическую окраску, по которым можно определить тот или
иной сульфид.ZnS - белый.
PbS, СuS - черный
Ag2S, FeS - черный
MnS - розовый
CdS - лимонно-желтый
SnS - шоколадный
HgS - красный
Sb2S3 - оранжевый осадкиSb2S3,MnS,ZnS,CdS,FeS
Качественные реакции
на сульфид- S2-
Слайд 28Некоторые сульфиды при взаимодействии с кислотами-неокислителями образуют токсичный газ сероводород
H2S с неприятным запахом (тухлых яиц):
Na2S + 2HBr = 2NaBr
+ H2S↑S2- + 2H+ = H2S↑
Также сульфид-анион можно выявить, приливая раствор сульфида к бромной воде:
S2- + Br2 = S↓ + 2Br- (образующаяся сера выпадает в осадок).
Слайд 29
При добавлении к раствору карбоната сильных кислот образуется углекислый газ-
CO2, (газ без запаха, гасящий горящую лучинку, c гидроксидом кальция
дает осадок белого цвета) :CO32- + 2H+ = CO2↑ + H2O
Качественная реакция на карбонат-анион CO32-
Слайд 30Качественная реакция на сульфит-анион SO32-
При добавлении к раствору сульфита сильных
кислот образуется сернистый газ- SO2, (газ c резким неприятным запахом)
:SO32- + 2H+ = SO2↑ + H2O
Слайд 31
(раствор подкисляют обычно разбавленной H2SO4): 3Cu + 2NO3- + 8H+
= 3Cu2+ + 2NO↑ + 4H2O
Оксид азота (II) на воздухе
окисляется до оксида азота (IV) (бурый газ)Качественная реакция на нитрат NO3-
Нитраты в растворе не проявляют окислительных способностей.
Но при подкислении раствора
способны окислить, к примеру, медь
Слайд 35ГАЗЫ
Кислород
Яркое загорание тлеющей лучинки в атмосфере кислорода
Водород
Лающий хлопок при поднесении горящей лучинки к источнику водорода
Слайд 36Озон
Взаимодействие озона с растворами иодидов с выпадением кристаллического
иода I2 в осадок:
2KI + O3 +
H2O = 2KOH + I2↓ + O2↑Озон обесцвечивает красящие вещества
В отличии от озона кислород в данную реакцию не вступает
Слайд 37Углекислый газ CO2
Тушение горящей лучинки в атмосфере углекислого
газа.
При пропускании газа в раствор гидроксида кальция Ca(OH)2
выпадает осадок CaCO3.CO2 + Ca(OH)2→CaCO3 + H2
Дальнейшее пропускание приведет к растворению осадка:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Слайд 38 Азот
Тушение горящей лучинки в атмосфере азота.
При пропускании газа в раствор Ca(OH)2 осадок не выпадает,
в отличии от углекислого газа CO2Угарный газ, оксид углерода (II)
Помутнение раствора при пропускании угарного газа в раствор хлорида палладия (II):
PdCl2 + CO + H2O = CO2↑ + 2HCl + Pd↓
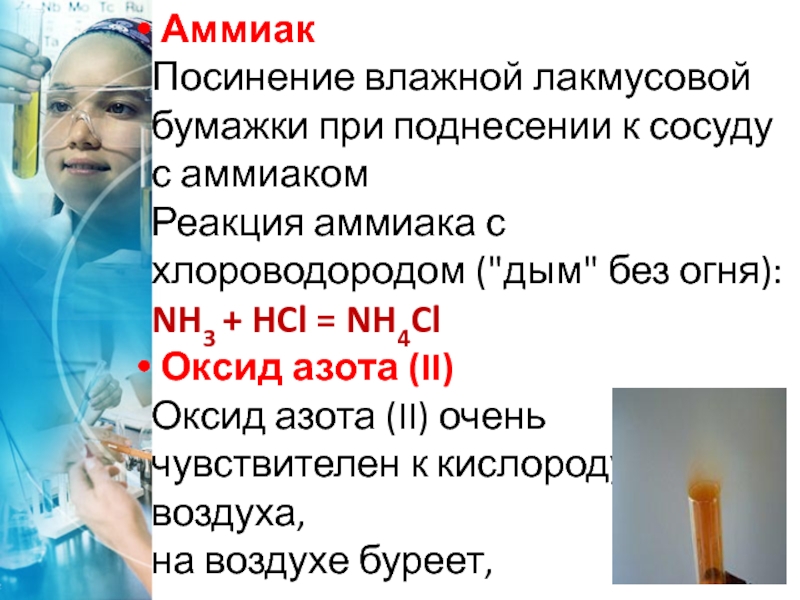
Слайд 39 Аммиак
Посинение влажной лакмусовой бумажки при поднесении к сосуду с
аммиаком
Реакция аммиака с хлороводородом ("дым" без огня): NH3 +
HCl = NH4ClОксид азота (II)
Оксид азота (II) очень чувствителен к кислороду воздуха,
на воздухе буреет,
окисляясь до оксида
азота (IV):2NO + O2 = 2NO2
















![C:\TEMP\Rar$DI01.671\master.jpg
Качественные реакции
в неорганической химии Так же ион Fe2+ может быть обнаружен гексациано-ферратом (III) калия (красная Так же ион Fe2+ может быть обнаружен гексациано-ферратом (III) калия (красная кровяная соль) - K3[Fe(CN)6]. Реакция сопровождается](/img/thumbs/f5464fb1ba3fb93a8b0efb70ec232f50-800x.jpg)