Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физические основы термодинамики
Содержание
- 1. Физические основы термодинамики
- 2. План лекции:1. Значение и задачи физической химии.2.
- 3. Физическая химия – наука изучающая взаимосвязь химических
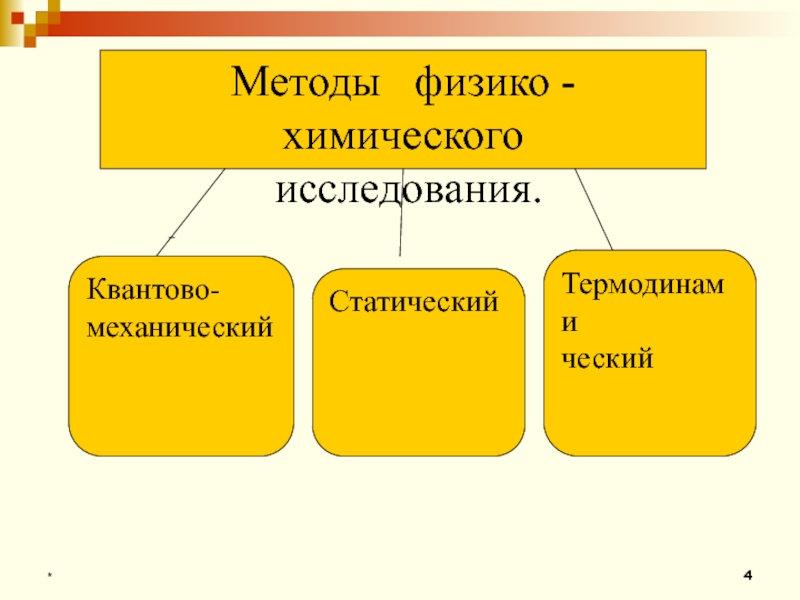
- 4. *Методы физико - химического исследования.Квантово-механическийТермодинамическийСтатический
- 5. Разделы физической химии:Строение веществаХимическая термодинамикаФазовые равновесияРастворыЭлектрохимияКинетика и катализФизикохимия поверхностных явлений*
- 6. История физической химии.*XVIII в. становление науки «физическая
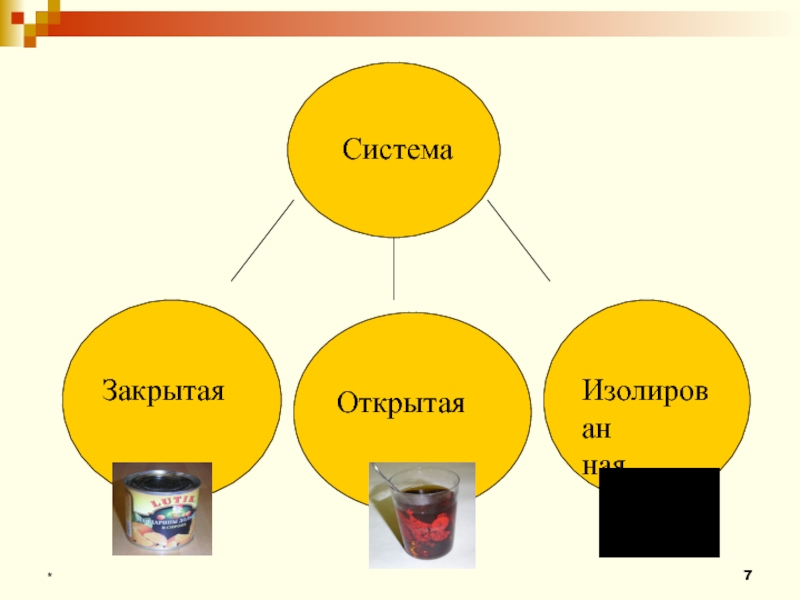
- 7. * СистемаЗакрытаяОткрытаяИзолированная
- 8. Газовые системы:1. Смеси газов -однородные по
- 9. Свойства газовых систем:1. масса2. обьем3.температура4. давление5. плотность*
- 10. ТемператураМера средней кинетической энергии молекул некоего тела.Передача движения молекул одного тела молекулами другого.*
- 11. Состояние газа:PVTT = f (P,V). !!! Нулевой
- 12. Если два тела, нагретые до разных температур
- 13. Виды энергии:*
- 14. Законы поведения идеальных газов:Закон Бойля (P1,V1 =
- 15. Абсолютная температура – нижний предел температуры -273С
- 16. ТеплоемкостьТеплоемкость газов: количество тепла которое необходимо для
- 17. Для газов удобно пользоваться молярной теплоемкостью сμ
- 18. *Реальные (неидеальные газы)
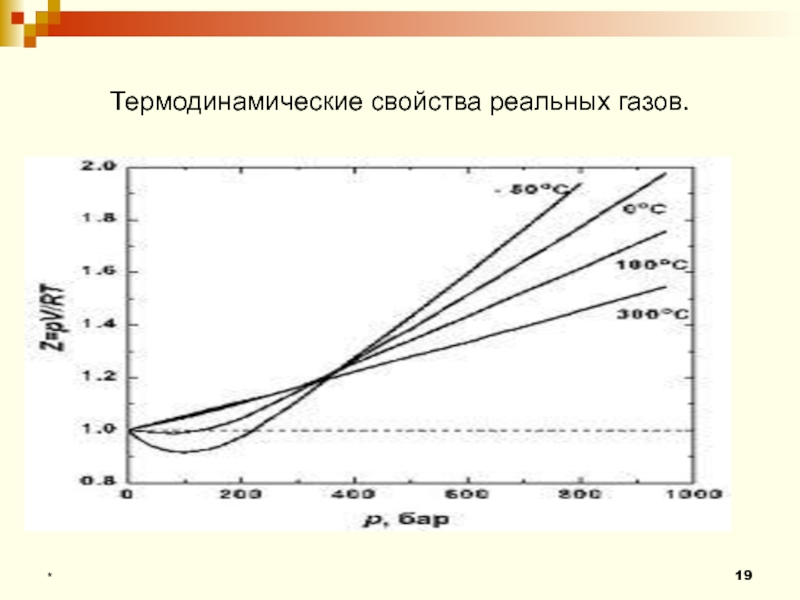
- 19. Термодинамические свойства реальных газов.*
- 20. Законы термодинамики; свободная энергия.Термодинамика – наука о превращении теплоты.*
- 21. 3. Установление критериев равновесного состояния термодинамических систем.Задачи
- 22. Понятия термодинамикиЭнергия – способность производить работу.Термодинамические системы
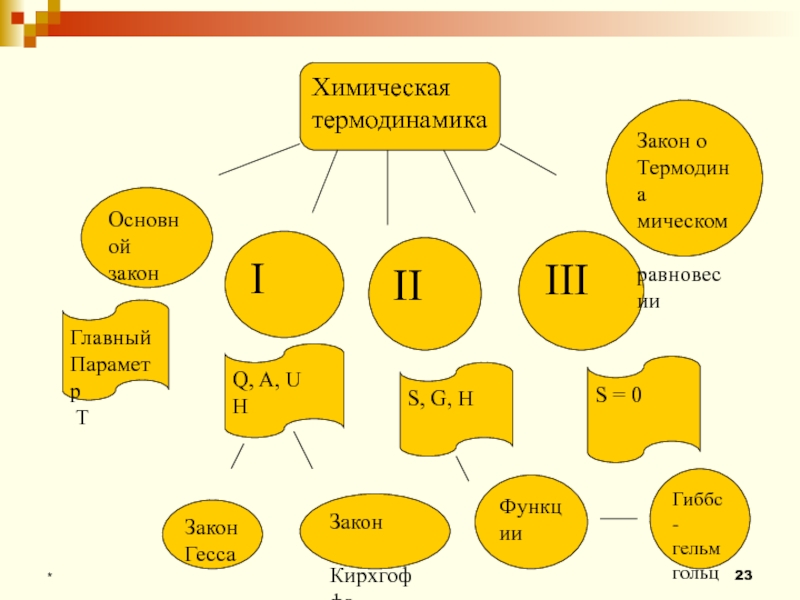
- 23. *Химическая термодинамикаОсновной законIIIIIIЗакон оТермодинамическом равновесииГлавный Параметр ТQ, A, UHS, G, HS = 0ФункцииГиббс-гельмгольцЗакон ГессаЗакон Кирхгоффа
- 24. Два постулата термодинамики:1. Любая изолированная система с
- 25. Энергия, связанная с внутренними движениями частиц системы
- 26. Внутренняя энергия (U) – однозначная функция состояния
- 27. Если нагревать газ при постоянном давлении (СР)
- 28. Изменение со временем одного из параметров системы или нескольких, следует что в системе протекает процесс. *
- 29. Термодинамические функции:E – внутренняя энергияH - энтальпияS
- 30. 1. H = E + PV2. A
- 31. Тепловые процессы:Экзотермический процессЭндотермический процесс
- 32. Факторы ΔН, ΔU: 1) Природа реакции2)
- 33. Факторы ΔН, ΔU: Агрегатное состояние и аллотропные
- 34. Факторы ΔН, ΔU: Т и р Стандартные условия:p = 105 Па ≈ 1 атм
- 35. Стандартная энтальпия образованияΔfH0298 (X) – это стандартное
- 36. Стандартная энтальпия сгоранияΔbH0298 (X) – это энтальпия
- 37. Стандартные энтальпии фазовых переходов:Стандартная энтальпия сублимации ΔsH0298
- 38. Стандартная энтальпия химической связи:– это изменение энтальпии
- 39. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ СИСТЕМЫ (ТПСС)2. Функции
- 40. P1V1T1P2V2T2I*ABII**C∆P = P2 – P1∆V = V2 – V1∆Т = Т2 – Т1
- 41. Состояние термодинамической системы:*Равновесные Параметры системы не зависят от времениНеравновесные Параметры системы зависят от времени
- 42. Pe (externus)-наружныйPi (internus)-внутренний Pe = Pi 100
- 43. Термодинамически необратимые процессы PePi1. Равновесие Pe =
- 44. → СО2 + Н2О + азотистые продукты
- 45. Тело АТело ВТ1Т2Т1 > Т2 ТЕПЛОТА
- 46. Тело АТело BТ1Т2Т1 > Т2РАБОТА
- 47. Первый закон термодинамикиКоличество энергии, которое выделяется или
- 48. Р.Майер (1842 г.), Д. Джоуль (1842
- 49. Применение первого закона (Q = ∆U
- 50. 2. Изобарные процессы. р =const,
- 51. 3. Изотермические процессы. Т = const, ∆Т
- 52. ТЕРМОХИМИЯ - Тепловой эффект реакции -
- 53. Термохимические уравнения: Термохимическая форма записи:
- 54. Закон Гесса (1840 г.)ΙΙ. а) С +
- 55. С6Н12О6(тв) + 6 О2(г) →6 СО2(г)
- 56. Стандартная энтальпия сгорания (∆Носг.) – 2 . ∆Нореакции = ∑∆Носг.исх.в-в. - ∑∆Носг.прод.
- 57. 1234134255и т.д.Статистическое толкование энтропии (S)Людвиг Больцман термодинамическая вероятность (W)ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
- 58. S = k· lnW W- термодинамическая
- 59. N2O2I система:Т N2 = Т O2P
- 60. N2 + O2N2 + O2II система W2 S2 = k lnW2
- 61. W2 > W1 => S2 > S1∆S
- 62. ∆Sматематическое выражение второго закона термодинамики. [S]– [
- 63. Объединенное уравнение первого и второго законов термодинамики.I.
- 64. Аобщ. = р·∆V + Аполезн.T·∆S =
- 65. 1. А>0, ∆G
- 66. Анализ:∆G = ∆Н - Т∆S1) если ∆Н0,
- 67. Расчет свободной энергии Гиббса при стандартных
- 68. Расчет ∆Gреакции в реальных условиях. А
- 69. Термодинамика химического равновесия. хА + уВmC + nDV1V2V1 = V2 химическое равновесие.Равновесные концентрации -
- 70. Кх.р. = Чем > Кх.р., тем
- 71. Уравнение изотермы химической реакции. А + В
- 72. Анализ: ∆G = RT (ln R,
- 73. Уравнение изобары химической реак-и р=const; ∆р=0А
- 74. Анализ:1. экзотермические реакции: ∆Н Т2>Т1 и
- 75. б) понижаем Т => Т2< Т1
- 76. Томсон: невозможен круговой процесс, единственным результатом которого
- 77. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Физические основы термодинамики
Кафедра биологической химии с курсами фармацевтической и токсикологической
химии
Слайд 2План лекции:
1. Значение и задачи физической химии.
2. Методы физико-химических исследований
3.
Краткая история физ.химии
4. Системы
5. Газовые системы
6. Законы термодинамики
7. Энтальпия, энтропия,
свободная энергия.*
Слайд 3
Физическая химия – наука изучающая взаимосвязь химических процессов и физических
явлений, которые их сопровождают, устанавливает закономерности между химическим составом, строением
веществ и их свойствами, исследует скорость химических процессов и их энергетику.*
Слайд 5Разделы физической химии:
Строение вещества
Химическая термодинамика
Фазовые равновесия
Растворы
Электрохимия
Кинетика и катализ
Физикохимия поверхностных явлений
*
Слайд 6История физической химии.
*
XVIII в. становление науки «физическая химия». М.В. Ломоносов
ввел понятие «физическая химия».
Бекетов Н.Н. 1865г первые лекции.
Меншуткин Н.А. 1887г
теория кинетики химических реакций.Гульдберг К, Вааге П. 1887г закон действия масс.
Гиббс Дж, теория термодинамического равновесия 1873-1878.
Развитие квантовой механики.
Слайд 8 Газовые системы:
1. Смеси газов -однородные по составу, истинные растворы,
представляющие собой одну «фазу».
2. При одной и той же температуре
и одном и том же давлении равные объемы газов содержат равное число молей.*
Слайд 10Температура
Мера средней кинетической энергии молекул некоего тела.
Передача движения молекул одного
тела молекулами другого.
*
Слайд 11Состояние газа:
P
V
T
T = f (P,V). !!! Нулевой закон (начало) термодинамики:
две системы находящиеся в тепловом равновесии с третьей, находятся в
тепловом равновесии друг с другом.*
Слайд 12Если два тела, нагретые до разных температур приведены в контакт
друг с другом и остаются в таком состоянии до равновесия:
f(P1,V1)
= f(P2,V2) ≈ T1 =T2*
Слайд 14Законы поведения идеальных газов:
Закон Бойля (P1,V1 = P2,V2)
Закон Шарля(Гей-Люссака):при охлаждении
газа при постоянном давлении на каждый градус Цельсия его обьем
уменьшается на 1/273 того обьема, который он занимает при 0 градусов.*
Слайд 15Абсолютная температура – нижний предел температуры -273С (абсолютный нуль температуры).
Шкала кельвина.
T = t+273
При н.у. уравнение Менделеева-Клапейрона.
При не н.у. P0V0/T0
= PV/T*
Слайд 16Теплоемкость
Теплоемкость газов: количество тепла которое необходимо для повышения температуры на
1С.
Удельная теплоемкость (С) количество теплоты, необходимое для нагревания единицы массы
вещества на один градус.[с] = Дж/кг·К.
*
Размерность теплоемкости: [C] = Дж/К.
Слайд 17 Для газов удобно пользоваться молярной теплоемкостью сμ − количество теплоты,
необходимое для нагревания 1 моля газа на 1 градус:
сμ =
с· μ Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость в этом случае обозначается СV.
Слайд 213. Установление критериев равновесного состояния термодинамических систем.
Задачи химической термодинамики:
1 Установление
энергетических эффектов химических и физико-химических процессов.
2. Установление критериев самопроизвольного протекания
физических и физико-химических процессов. Слайд 22Понятия термодинамики
Энергия – способность производить работу.
Термодинамические системы – макроскопические объекты,
отделенные от окружающего пространства реальной или мысленной поверхностью.
*
Слайд 23*
Химическая
термодинамика
Основной
закон
I
II
III
Закон о
Термодина
мическом
равновесии
Главный
Параметр
Т
Q, A, U
H
S, G,
H
S = 0
Функции
Гиббс-
гельмгольц
Закон
Гесса
Закон
Кирхгоффа
Слайд 24Два постулата термодинамики:
1. Любая изолированная система с течением времени приходит
в равновесное состояние и самопроизвольно не может выйти из него.
2.
Системы находятся в тепловом равновесии.*
Слайд 25 Энергия, связанная с внутренними движениями частиц системы и их взаимодействиями
между собой, называется внутренней.
Внутренняя энергия
Величина внутренней энергии складывается из кинетической
энергии хаотического движения молекул и потенциальной энергии их взаимного расположения:U = Eкин + Евз
Для идеального газа, состоящего из N молекул:
Слайд 26 Внутренняя энергия (U) – однозначная функция состояния термодинамической системы: изменение
внутренней энергии ΔU при переходе системы из состояния 1 в
состояние 2 не зависит от вида процесса перехода и равно: ΔU = U2 – U1. Бесконечно малое изменение внутренней энергии dU для идеального газа:
dU > 0, если внутренняя энергия системы увеличивается.
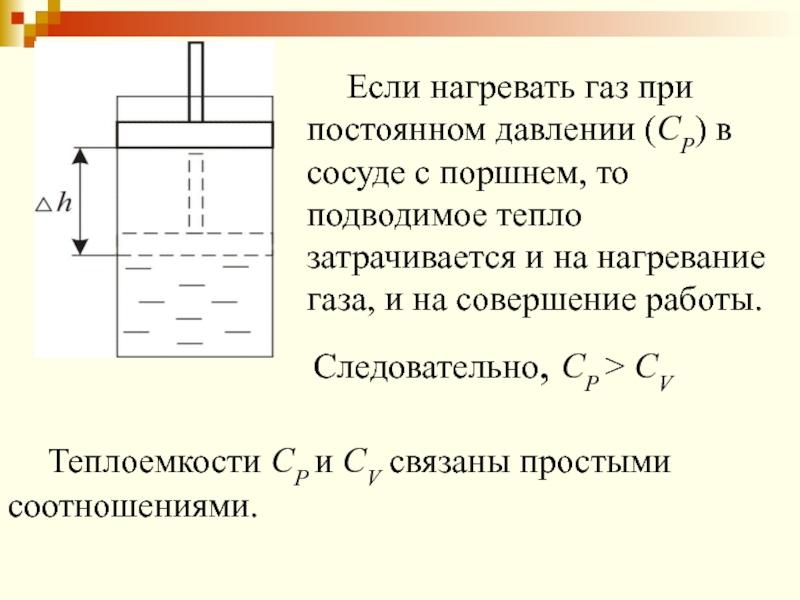
Слайд 27 Если нагревать газ при постоянном давлении (СР) в сосуде с
поршнем, то подводимое тепло затрачивается и на нагревание газа, и
на совершение работы.Следовательно, СР > СV
Теплоемкости СР и СV связаны простыми соотношениями.
Слайд 28
Изменение со временем одного из параметров системы или нескольких, следует
что в системе протекает процесс.
*
Слайд 29Термодинамические функции:
E – внутренняя энергия
H - энтальпия
S - энтропия
G –
свободная энергия Гиббса
A - работа
Q - теплота
*
Слайд 301. H = E + PV
2. A = E –
TS
3. G = H – TS
4. dE = TdS –
PdV5. dH = TdS + VdP
6. dA = - SdT – PdV
7. dG = -SdT +VdP
*
Слайд 32 Факторы ΔН, ΔU:
1) Природа реакции
2) Количество вещества
кДж/моль!
С8Н18 +
25/2 О2 = 8СО2 + 9Н2О + 5460 кДж
2С8Н18 +
25О2 = 16СО2 + 18Н2О + 5460⋅2 кДжСлайд 33Факторы ΔН, ΔU:
Агрегатное состояние и аллотропные модификации
Н2Ож → Н2Ог
– 44 кДж/моль
Сграфит → Салмаз – 2,3 кДж/моль
Сграфит + О2
г = СО2 г + 393,5 кДж/мольСалмаз + О2 г = СО2 г + 395,8 кДж/моль
Слайд 34Факторы ΔН, ΔU:
Т и р
Стандартные условия:
p = 105 Па ≈ 1 атм
Т =
298 К
Для стандартных условий и стандартного состояния:
ΔH0298, ΔU0298
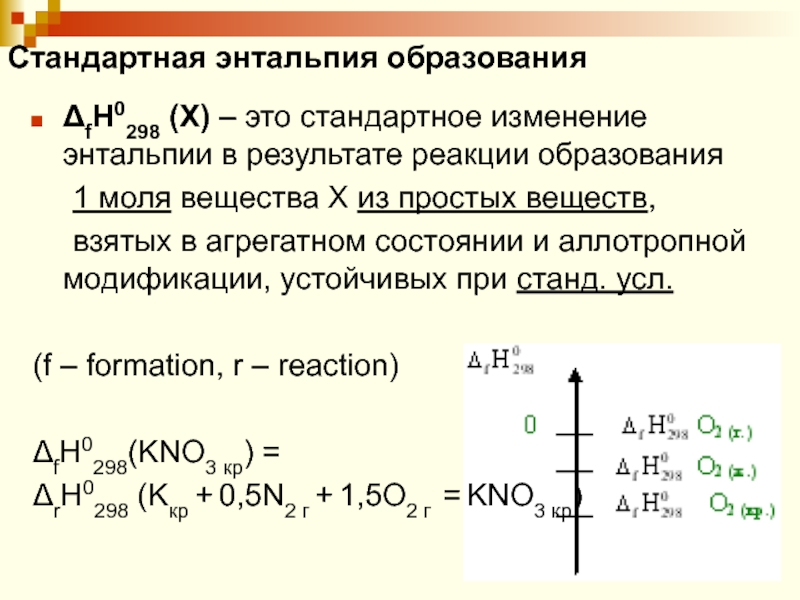
Слайд 35Стандартная энтальпия образования
ΔfH0298 (X) – это стандартное изменение энтальпии в
результате реакции образования
1 моля вещества X из простых веществ,
взятых
в агрегатном состоянии и аллотропной модификации, устойчивых при станд. усл.(f – formation, r – reaction)
ΔfH0298(KNO3 кр) =
ΔrН0298 (Kкр + 0,5N2 г + 1,5O2 г = KNO3 кр)
Слайд 36Стандартная энтальпия сгорания
ΔbH0298 (X) – это энтальпия реакции сгорания 1
моля вещества Х в кислороде с образованием:
оксидов элементов, до которых
сгорает соответствующее простое вещество, или простых веществ, если они более устойчивы в данных условиях, чем оксиды.
(b – burning)
NH3,г + 1,5 O2,г = 0,5 N2,г + 1,5 H2Oж;
СS2,ж + 3О2,г = СО2,г + 2SO2,г.
Слайд 37Стандартные энтальпии фазовых переходов:
Стандартная энтальпия сублимации ΔsH0298 (X)
Стандартная энтальпия
испарения ΔvH0298 (X)
Стандартная энтальпия плавления ΔmH0298 (X)
- это
стандартное изменение энтальпии при переходе 1 моля вещества из одного состояния в другое.(s – sublimation, v – vaporization, m – melting)
Слайд 38Стандартная энтальпия химической связи:
– это изменение энтальпии в реакции образования
1 моля газообразных двухатомных частиц из атомов, находящихся в газообразном
состоянии на бесконечном удалении.Hг + Clг = HClг; Сг + Hг = CHг.
Всегда < 0!
Энергия связи – это энергия, которая выделяется при образовании 1 моля связей.
Слайд 39ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ СИСТЕМЫ (ТПСС)
2. Функции состояния :
внутренняя энергия (U),
U = Eкин. + Eпотенц.В СИ : Дж.
Вне СИ – калория.
1 кал – 4,18 Дж.
- энтальпия,- энтропия,- свободная энергия Гиббса
∆U = U2 кон. – U1 нач.
1. Основные – Т, р, V, m, ρ, η и т.д.
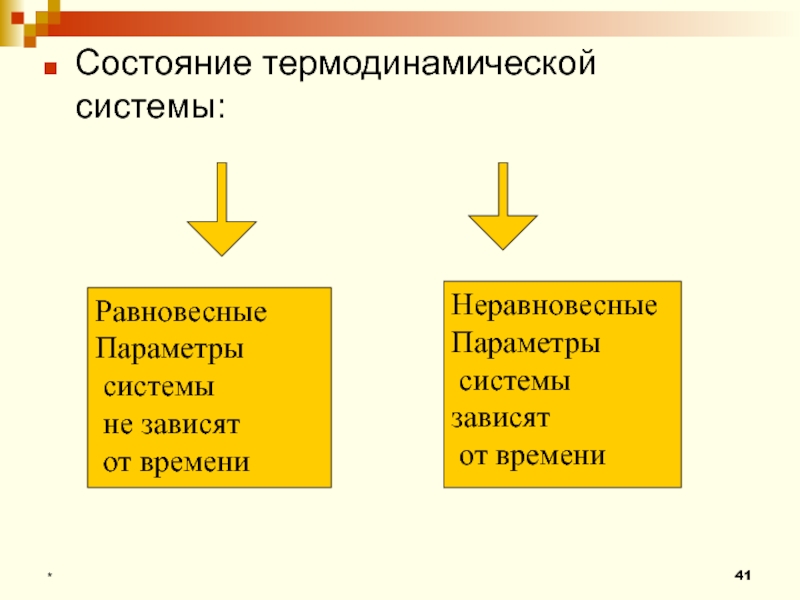
Слайд 41Состояние термодинамической системы:
*
Равновесные
Параметры
системы
не зависят
от времени
Неравновесные
Параметры
системы зависят
от времени
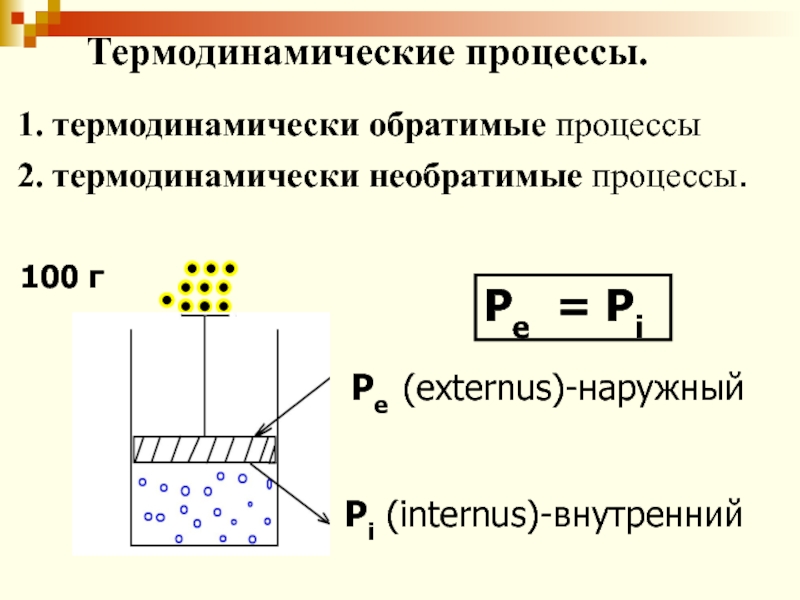
Слайд 42
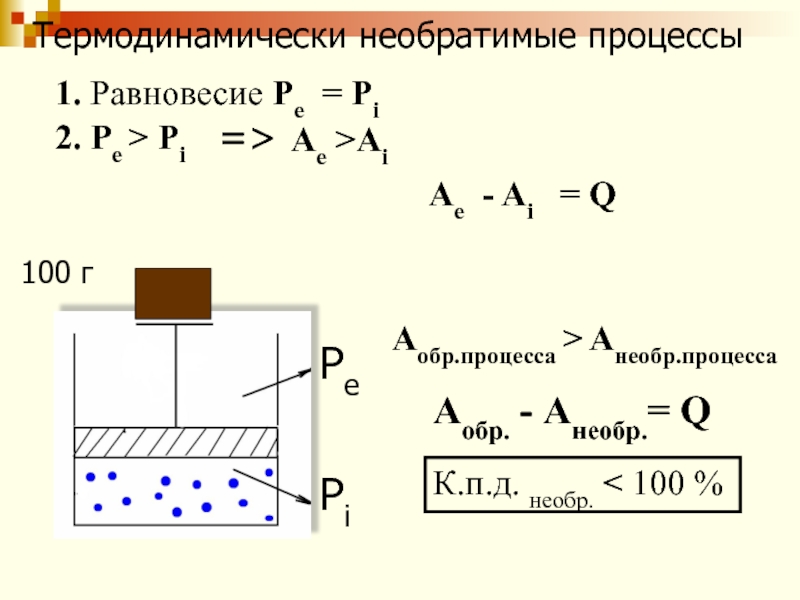
Pe (externus)-наружный
Pi (internus)-внутренний
Pe = Pi
100 г
Термодинамические процессы.
1. термодинамически обратимые процессы
2. термодинамически необратимые процессы.
Слайд 43Термодинамически необратимые процессы
Pe
Pi
1. Равновесие Pe = Pi
2. Ре
> Рi
=> Ae >Ai
Ae - Ai
= QАобр.процесса > Анеобр.процесса
Аобр. - Анеобр.= Q
К.п.д. необр. < 100 %
100 г
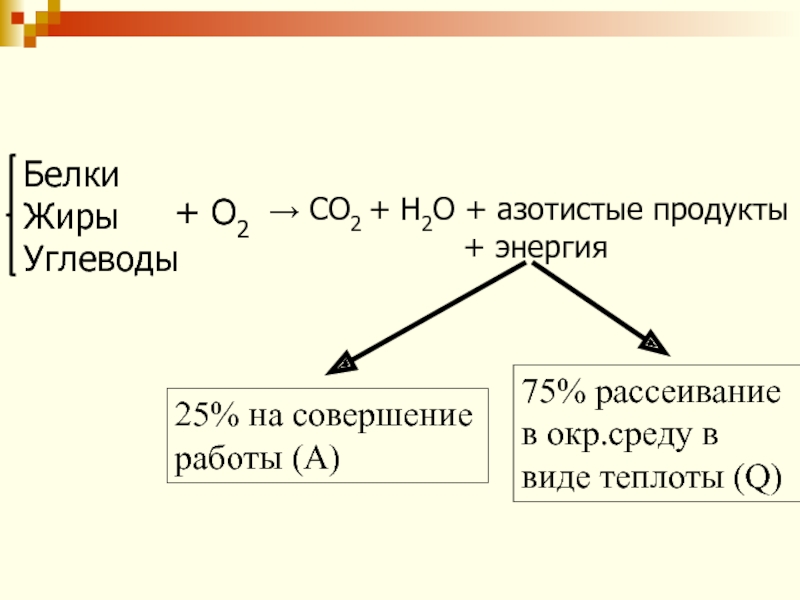
Слайд 44→ СО2 + Н2О + азотистые продукты
+ энергия
Белки
Жиры
Углеводы
+ О2
25% на совершение работы (А)
75% рассеивание в окр.среду в виде теплоты (Q)
Слайд 47Первый закон термодинамики
Количество энергии, которое выделяется или поглощается в форме
теплоты и работы, равно изменению внутренней энергии
ΔUсистемы = -Q +
Aнад системойV = const QV = -ΔU
p = const Qp = -ΔH
Энтальпия H ≡ U + pV
энтальпия – «энергосодержание»
Слайд 48
Р.Майер (1842 г.), Д. Джоуль (1842 г.),
Л. Гельмгольц
(1847 г.)
Q = ∆U + А
Первый закон термодинамики
Слайд 49
Применение первого закона (Q = ∆U + А) термодинамики
к различным процессам.
1. Изохорные процессы. V = const, ∆V
= 0
А = р · ∆V
Т.к. ∆V = 0, то и А = 0. Тогда
QV - изохорный тепловой эффект реакции
QV = ∆U
Слайд 502. Изобарные процессы. р =const, ∆р=0,
QР = U2
– U1 + р(V2 – V1); QР = U2
– U1 + рV2 – рV1QР = (U2 + р·V2) – (U1 + р·V1)
Н- энтальпия
Н= U + р·V; QР = Н2 – Н1 = ∆Н
QР=∆U+р·∆V
QР - изобарный тепловой эффект реакции
QР = ∆Н
Слайд 513. Изотермические процессы. Т = const, ∆Т =0
Q=∆U +
A∆Т = 0, ∆U = 0
QT = A
4. Адиабатические процессы.
∆Q = 0. 0 = ∆U + A
А = – ∆U
Слайд 52ТЕРМОХИМИЯ -
Тепловой эффект реакции - Q
Стандартный тепловой эффект
– Q0
Р = 1атм; 101,3 кПа; Т=298 К; 25
оC; n=1мольСлайд 53Термохимические уравнения:
Термохимическая форма записи:
Н2 (г) +
½ О2(г) → Н2О (ж) + Q;
Н2 (г) + ½ О2(г) → Н2О (ж) + 286 кДж/мольQ – термохимический тепловой эффект реакции
2) Термодинамическая:
Н2 (г) + ½ О2(г) → Н2О (ж); ∆Н = - 286 кДж,
∆Н – термодинамический тепловой эффект
Q = - ∆Н
Слайд 54Закон Гесса (1840 г.)
ΙΙ. а) С + ½ О2 →
СО ∆Н1 = - 283 кДж,
б) 2СО + О2 → 2СО2 ∆Н2 = - 110 кДж- 393 кДж
∆Н = ∆Н1 + ∆Н2
Ι. С + О2 → СО2 ∆Н = - 393 кДж,
Слайд 55 С6Н12О6(тв) + 6 О2(г) →6 СО2(г) + 6 Н2О(ж);
∆Н =?
∆Нор-ции= (6∆НообрСО2 + 6∆НообрН2О) – (∆НообрС6Н12О6 + 6НообрО2)
1. ∆Нореакции
= ∑∆Нообр.прод.-∑∆Нообр.исх.в-в. ∆Нореакции = – 2800 кДж
Следствия из закона Гесса
Стандартная энтальпия образования вещества (∆Нообр.) –
Слайд 57
1
2
3
4
1
3
4
2
5
5
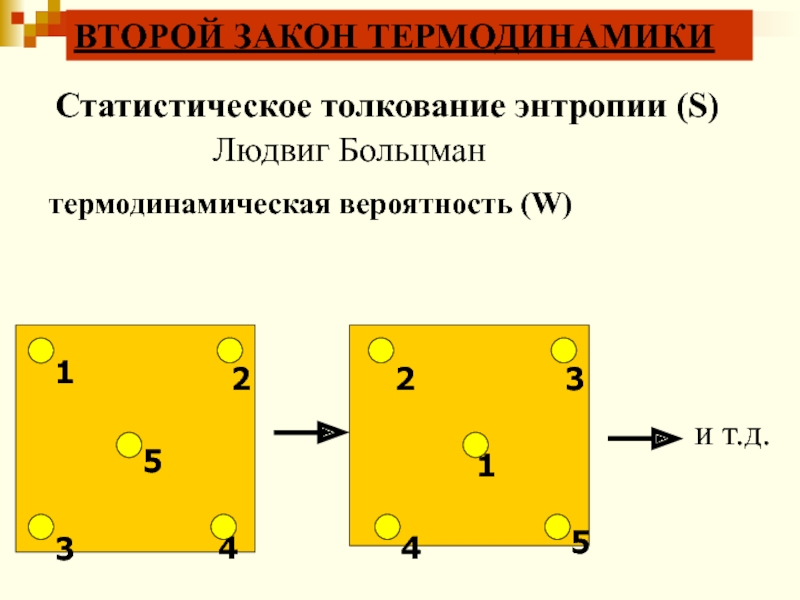
и т.д.
Статистическое толкование энтропии (S)
Людвиг Больцман
термодинамическая вероятность (W)
ВТОРОЙ ЗАКОН
ТЕРМОДИНАМИКИ
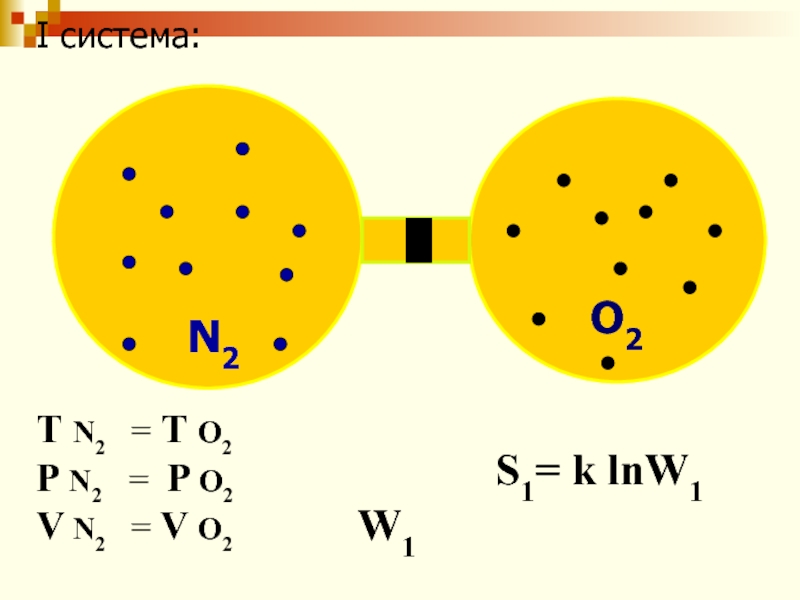
Слайд 58 S = k· lnW
W- термодинамическая вероятность; S –
энтропия; k – постоянная Больцмана;
R = 8,31 Дж/моль∙К;
NА
- число Авогадро.k =
Чем ↑W, тем ↑S
Твердое вещество Жидкость Газ
Max S
Min S
2KClO3 (тв)→ 2KCl(тв) + 3 O2(г)↑
S ↑
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы.
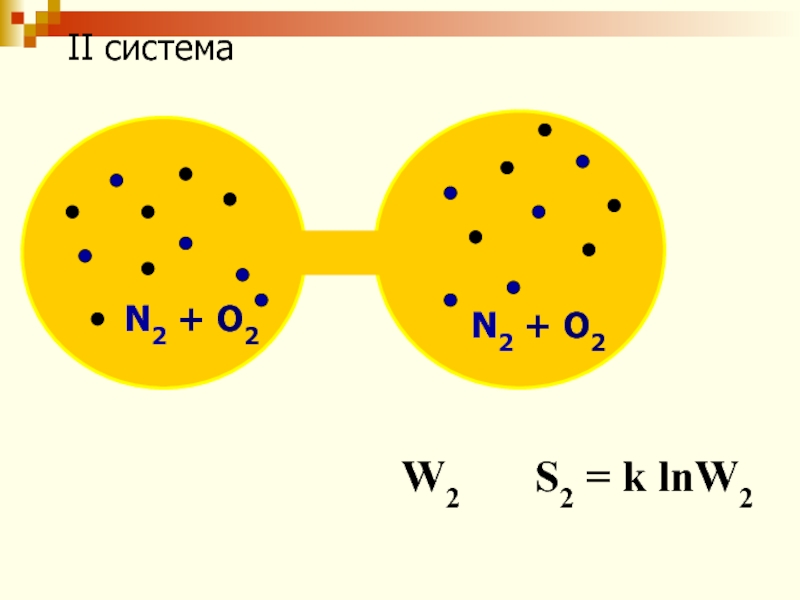
Слайд 61W2 > W1
=> S2 > S1
∆S = S2
- S1 = k lnW2- k lnW1
∆S = k ln
∆S > 0 - критерий самопроизвольности протекания процесса.
∆S = 0 - критерий термодинамического равновесия.
> 0
Слайд 62∆S
математическое выражение второго закона термодинамики.
[S]– [ Дж/ моль·К]
Изолированная система:
Q = 0 ∆S ≥ 0
«Если в изолированной
системе протекают самопроизвольные процессы, то ее энтропия возрастает» (закон возрастания энтропии)Второй закон термодинамики:
Слайд 63Объединенное уравнение первого и второго законов термодинамики.
I. Q = ∆U
+ А
II. ∆S =
Q = T·∆S
T·∆S =
∆U + АСлайд 64 Аобщ. = р·∆V + Аполезн.
T·∆S = ∆U + А
общая
T·∆S
= ∆U + р·∆V + Аполезн.∆H
T·∆S = ∆H + Аполезн.
- Аполезн. = ∆H - T·∆S
- Аполезн. = (Н2 – Н1) – (Т∙S2 – Т∙S1);
- Аполезн.= (Н2 – Т∙S2) – ( Н1 – Т∙S1);
Н – ТS = G – свободная энергия Гиббса
- Аполезн. = G2 – G1 = ∆G
Аполезн. = - ∆G
Слайд 66Анализ:
∆G = ∆Н - Т∆S
1) если ∆Н0,
то ∆G0 (эндо-) и ∆S0
3) ∆Н
и ∆S<0, или ∆Н>0 и ∆S>0, то знак ∆G зависит от абсолютных значений ∆Н и ∆S. │∆Н│>│Т∆S│; то ∆G<0 – самопроизвольный процесс;
│∆Н│<│Т∆S│; то ∆G>0 – самопроизвольно в стандартных условиях не идет.
│∆Н│=│Т∆S│; то ∆G=0 – равновесие.
Слайд 67 Расчет свободной энергии Гиббса при стандартных условиях (∆Gо) в
химических реакциях.
∆Gо298 обр. - стандартная из справочника
1) ∆Gореакции = ∑∆Gообр.продуктов
- ∑∆Gообр.исх. в-в.с учетом стехиометрических коэффициентов.
2) ∆Gореакции = ∆Нореакции - T∆Sореакции
∆G<0, самопроизвольные (экзергонические) реакции
∆G>0, не самопроизвольные (эндергонические) реакции.
∆G=0, равновесие.
Слайд 68 Расчет ∆Gреакции в реальных условиях.
А + В
С + D
∆G = ∆Gо + RT
ln R – 8,31 Дж/моль·К ;
∆Gо – const для данной реакции
Слайд 69Термодинамика химического равновесия.
хА + уВ
mC + nD
V1
V2
V1 = V2
химическое равновесие.
Равновесные концентрации -
Слайд 70 Кх.р. =
Чем > Кх.р., тем более глубоко процесс
идет вправо
Кх.р. зависит:
от Т ;
от природы реагентов
Слайд 71Уравнение изотермы химической реакции.
А + В
C + D
∆G = ∆Gо + RT
lnРеальные концентрации веществ и Т
в равновесии: ∆G =0
0 = ∆Gо + RT ln
- равновесные концентрации
0 = ∆Gо + RT ln Кх.р.
∆Gо = - RT ln Кх.р.
! Взаимосвязь ∆Gо и Кх.р.
Подставим это выражение в формулу (*).
(*)
∆G = RT (ln
- ln Кх.р)
- уравнение изотермы
Слайд 72Анализ: ∆G = RT (ln
R, T, Кх.р.
- это const в уравнении, поэтому, знак ∆G зависит
от соотношения концентрационного переменного члена –ln
обозначим (1)
и постоянного члена ln Кх.р обозначим (2).
1) Если (1)>(2), то ∆ G>0 и равновесие влево ←
2) Если (1)<(2), то ∆G<0 и равновесие вправо →
3) Если (1)=(2), то ∆G=0 состояние равновесия.
- ln Кх.р)
Слайд 73 Уравнение изобары химической реак-и
р=const; ∆р=0
А + В
C + D
∆Gо =
- RT ln Кх.р.∆Gо = ∆Но - Т∆Sо
=> интегральная форма уравнения изобары:
ln
=
, где
К1 - это Кх.р при Т1;
К2 - это Кх.р при Т2;
∆Но- тепловой эффект реакции;
R = 8,31 Дж/моль∙К.
Слайд 75б) понижаем Т => Т2< Т1 и
> 0
тогда ln
< 0 и К1< К2
=> равновесие →
2.
эндотермические реакции: ∆Н>0а) ↑ Т→ равновесие вправо
б) ↓ Т ← равновесие влево
Слайд 76
Томсон: невозможен круговой процесс, единственным результатом которого было бы производство
работы за счёт охлаждения теплового резервуара (источника тепла, нагревателя).
Клаузиус: теплота
не может самопроизвольно переходить от тела, менее нагретого, к телу, более нагретому, т.е. невозможно создать какое-либо устройство или придумать способ, когда без всяких изменений в природе можно передавать тепло от менее нагретого тела к более нагретому.Но если процесс не самопроизвольный, сопровождается изменениями в окружающей среде, то это возможно, что, например, осуществляется за счёт работы машины в холодильнике.














































![Физические основы термодинамики ∆Sматематическое выражение второго закона термодинамики. [S]– [ Дж/ моль·К]Изолированная система: Q ∆Sматематическое выражение второго закона термодинамики. [S]– [ Дж/ моль·К]Изолированная система: Q = 0 ∆S ≥](/img/thumbs/d0db888d5bb6eec9016dbd286db58141-800x.jpg)

































