Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисперсные системы (продолжение)
Содержание
- 1. Дисперсные системы (продолжение)
- 2. Строение коллоидных частиц лиофобных золейМицелла – это
- 3. {m[AgCI] n Ag+ (n – x) NO3-
- 4. Строение мицеллы слюныПомимо органических веществ в состав
- 5. агрегатПОИадсорбционныйдиффузный слойслойпротивоионыядроколлоидная частица (гранула)мицелла{m[AgCI] n Ag+ (n
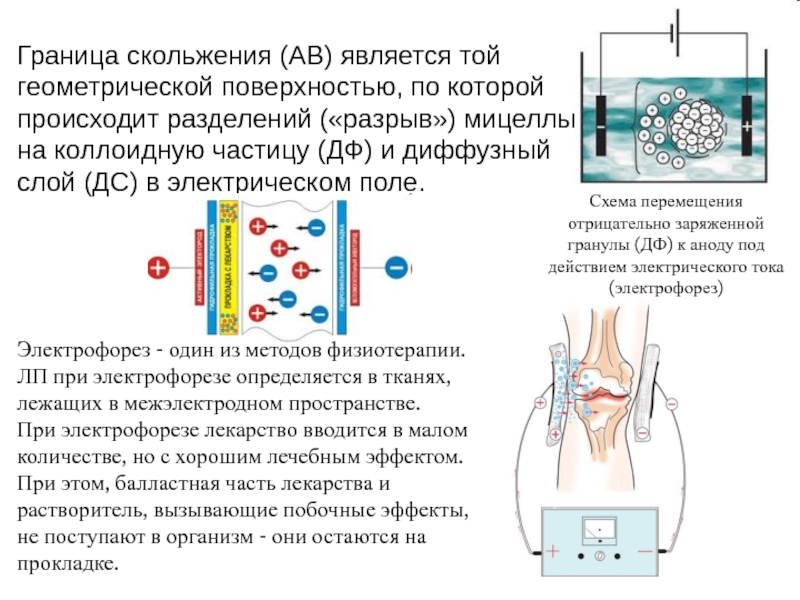
- 6. Граница скольжения (АВ) является той геометрической поверхностью,
- 7. Потенциалы ДЭСПоверхностный(-потенциал) наблюдается на межфазной границе (СД).
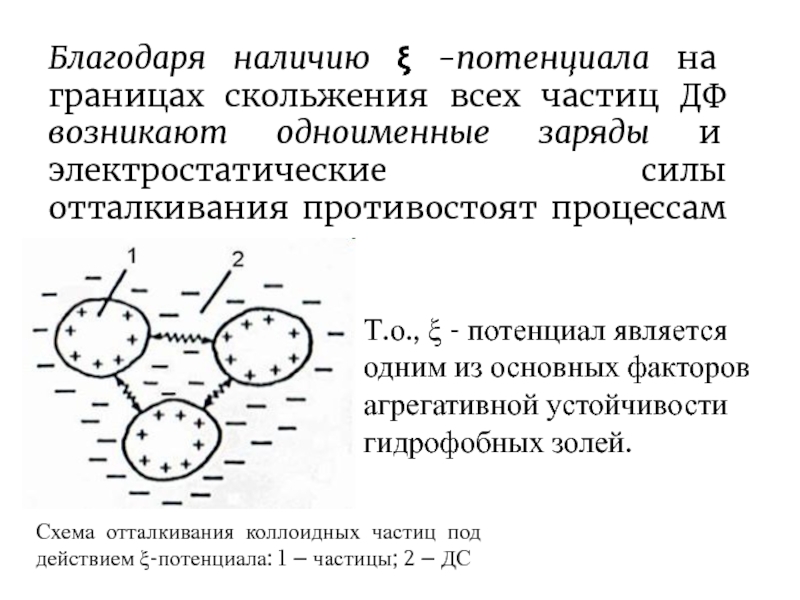
- 8. Благодаря наличию -потенциала на границах скольжения
- 9. Под устойчивостью коллоидной системы понимают
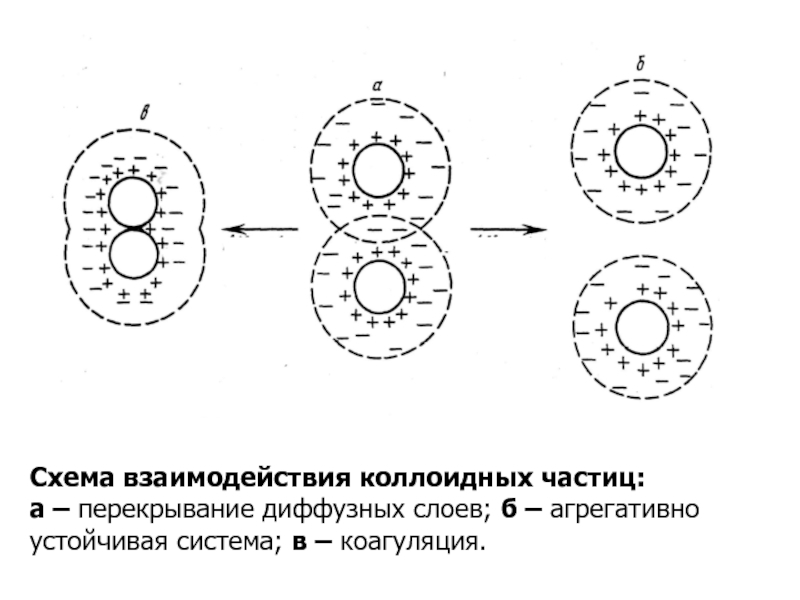
- 10. Схема взаимодействия коллоидных частиц:а – перекрывание диффузных слоев; б – агрегативно устойчивая система; в – коагуляция.
- 11. Коагуляция дисперсных систем
- 12. Коагуляция - это процесс слипания (или
- 13. Факторы, снижающие устойчивость коллоидов Коагуляция -
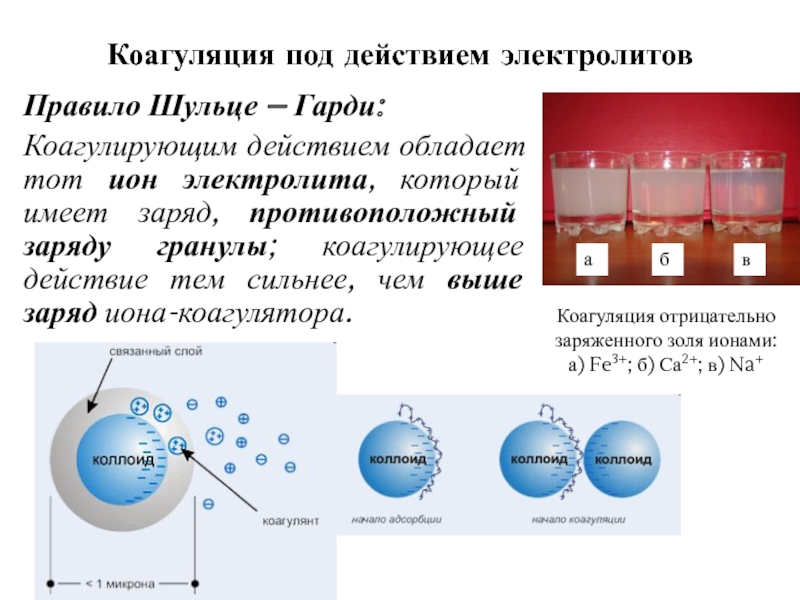
- 14. Коагуляция под действием электролитов Правило Шульце –
- 15. Порог коагуляции. Коагулирующая способностьПорогом коагуляции (СПК)
- 16. ЛИОФИЛЬНЫЕ СИСТЕМЫ
- 17. К лиофильным коллоидным растворам относятся растворы ПАВ
- 18. Способностью к мицеллообразованию обладают не все ПАВ.
- 19. Влияние концентрации ПАВ и ВМС на характер
- 20. В живом организме формированию бислоя (даже при
- 21. С помощью липосом изучают воздействие на мембраны
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Строение коллоидных частиц лиофобных золей
Мицелла – это структурная коллоидная единица,
состоящая из микрокристалла ДФ, окруженной сольватированными ионами стабилизатора.
Слайд 3
{m[AgCI] n Ag+ (n – x) NO3- }х+ x NO3-
агрегат
ПОИ
адсорбционный
диффузионный
слой
слой
противоионы
ядро
коллоидная
частица (гранула)
мицелла
АgNO3 + KCI = KNO3 + AgCI
избыток↓
Слайд 4Строение мицеллы слюны
Помимо органических веществ в состав слюны входят ионы:
Cl-, Mg+2, NH4+, Na+, K+, Ca+2, PO43-, HPO42-, причем содержание
последних трех наибольшее.Ионы Ca+2 и HPO42- находятся в слюне в неравновесных концентрациях, причем содержание гидрофосфат-ионов в 3-4 раза выше, чем ионов кальция.
Ионы Ca+2 и PO43- способны к активному взаимодействию с образованием нерастворимого ядра мицеллы.
В связи с изложенным, вероятный состав мицеллы слюны можно представить в следующем виде:
{ [m(Са3(Р04)2]n НР042- (n — х)Са2+ }2х+ хСа2+
Слайд 5агрегат
ПОИ
адсорбционный
диффузный слой
слой
противоионы
ядро
коллоидная частица (гранула)
мицелла
{m[AgCI] n Ag+ (n – x)NO3- }х+
x NO3-
Твердая фаза
Жидкая фаза
«связанные»
«свободные»
С
Д
А
В
Образование двойного слоя
ионов приводит к появлению определенных электрических потенциалов на границе раздела твердой и жидкой фаз. СД – межфазная граница; АВ – граница скольжения
Слайд 6Граница скольжения (АВ) является той геометрической поверхностью, по которой происходит
разделений («разрыв») мицеллы на коллоидную частицу (ДФ) и диффузный слой
(ДС) в электрическом поле.Схема перемещения отрицательно заряженной гранулы (ДФ) к аноду под действием электрического тока (электрофорез)
Электрофорез - один из методов физиотерапии.
ЛП при электрофорезе определяется в тканях, лежащих в межэлектродном пространстве.
При электрофорезе лекарство вводится в малом количестве, но с хорошим лечебным эффектом. При этом, балластная часть лекарства и растворитель, вызывающие побочные эффекты, не поступают в организм - они остаются на прокладке.
Слайд 7Потенциалы ДЭС
Поверхностный(-потенциал) наблюдается на межфазной границе (СД).
Величина -
потенциала зависит от природы твердой фазы, заряда и концентрации ПОИ,
адсорбированных на ней.Величина -потенциала определяется толщиной диффузного слоя: чем она меньше, тем меньше -потенциал.
Толщина диффузного слоя зависит от концентрации и заряда противоионов. Чем выше заряд и концентрация противоионов, т.е. больше их в плотном слое и меньше в диффузном, то -потенциал меньше.
Электрокинетический (-потенциал (дзета)) возникает на границе скольжения (АВ).
Слайд 8Благодаря наличию -потенциала на границах скольжения всех частиц ДФ
возникают одноименные заряды и электростатические силы отталкивания противостоят процессам агрегации.
Схема отталкивания коллоидных частиц под действием ξ-потенциала: 1 – частицы; 2 – ДС
Т.о., - потенциал является одним из основных факторов агрегативной устойчивости гидрофобных золей.
Слайд 9 Под устойчивостью коллоидной системы понимают её способность сохранять
во времени:
- средний размер частиц;
- их равномерное распределение в среде;
-
характер взаимодействия м/д частицами (т.е. условия постоянства состава частиц, исключая тем самым возможные химические превращении).Виды устойчивости:
Седиментационная устойчивость – это способность частиц ДФ находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость - это способность частиц ДФ противостоять агрегации (слипанию), т.е. сохранять свои размеры.
Слайд 10Схема взаимодействия коллоидных частиц:
а – перекрывание диффузных слоев; б –
агрегативно устойчивая система; в – коагуляция.
Слайд 12 Коагуляция - это процесс слипания (или слияния) частиц ДФ
при потере системой агрегативной устойчивости.
Весь процесс коагуляции можно разделить на
2 стадии:Скрытая. Это стадия агрегации, при которой не наблюдается каких либо внешних изменений золя. О скрытой коагуляции судят по изменению физико-химических свойств.
Явная. Это такой процесс агрегации коллоидных частиц, который можно обнаружить невооруженным глазом. О явной коагуляции судят по изменению цвета (помутнению), выпадению осадка.
Слайд 13Факторы, снижающие устойчивость коллоидов
Коагуляция - процесс укрупнения частиц,
в гидрофобных системах протекает самопроизвольно.
Факторами, вызывающими коагуляцию могут
быть:изменение температуры;
концентрирование;
механическое воздействие;
действие света и различного рода излучений, действие электрических разрядов.
действие электролитов.
Слайд 14Коагуляция под действием электролитов
Правило Шульце – Гарди:
Коагулирующим действием обладает
тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее
действие тем сильнее, чем выше заряд иона-коагулятора.Коагуляция отрицательно заряженного золя ионами: а) Fe3+; б) Са2+; в) Na+
а
б
в
Слайд 15Порог коагуляции.
Коагулирующая способность
Порогом коагуляции (СПК) - это минимальное количество
электролита, которое необходимо добавить к коллоидному раствору, чтобы вызвать явную
коагуляцию - помутнение раствора или изменение его окраски., [ммоль/л] или [моль/л]
где Сэл – исходная концентрация раствора электролита; Vэл – объем раствора электролита, добавленного к коллоидному раствору; Vзоля – объем коллоидного раствора.
Коагулирующей способностью () – это величина обратная порогу коагуляции ( = 1/СПК).
Слайд 17К лиофильным коллоидным растворам относятся растворы ПАВ и ВМС.
Мицеллами лиофильных
коллоидных растворов называются ассоциаты из молекул ПАВ и ВМС, возникающие
самопроизвольно при концентрации, равной или большей критической концентрации мицеллообразования (ККМ), и образующие в растворе новую фазу.Слайд 18Способностью к мицеллообразованию обладают не все ПАВ. Для водных растворов
к такими относятся: соли жирных и желчных кислот, СМВ, фосфолипиды,
белки, гликолипиды и др.В зависимости от свойств ДС из молекул ПАВ формируются мицеллы с различной структурой. ПАВ, образуя мицеллу, ориентируются так, чтобы ее поверхность была близка ДС.
Структура мицелл ПАВ в полярной (а) и неполярной (б) среде
Подобная структура мицелл обеспечивает сильное взаимодействие с ДС, что делает коллоидную систему лиофильной, устойчивой и не требующей стабилизации.
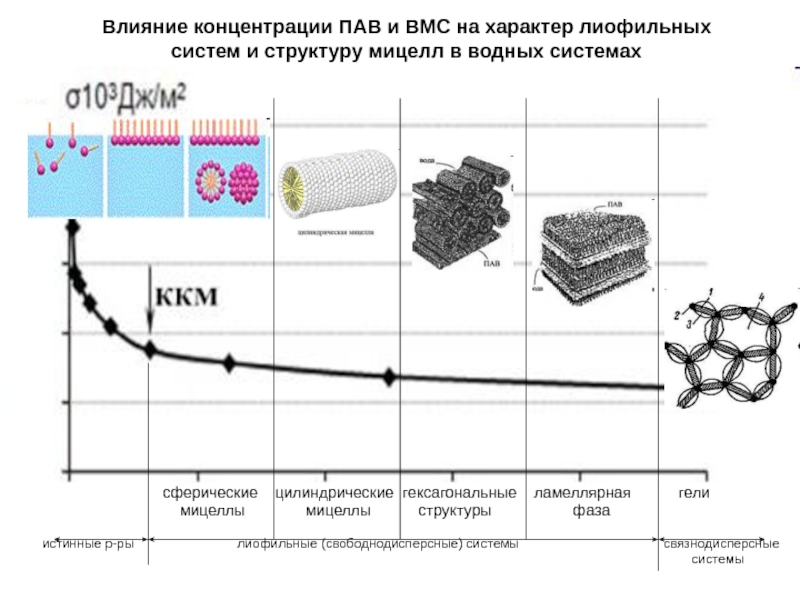
Слайд 19Влияние концентрации ПАВ и ВМС на характер лиофильных систем и
структуру мицелл в водных системах
сферические цилиндрические гексагональные ламеллярная гелимицеллы мицеллы структуры фаза
истинные р-ры лиофильные (свободнодисперсные) системы связнодисперсные
системы
Слайд 20В живом организме формированию бислоя (даже при низких концентрациях) наиболее
способны фосфо- и сфинголипиды («двухвостые» молекулы), а при увеличении их
концентрации легко возникает ламеллярная фаза.При встряхивании, перемешивании, особенно под действием ультразвука, в них возникают бислойные микрокапсулы (полости), содержащие воду – липосомы.
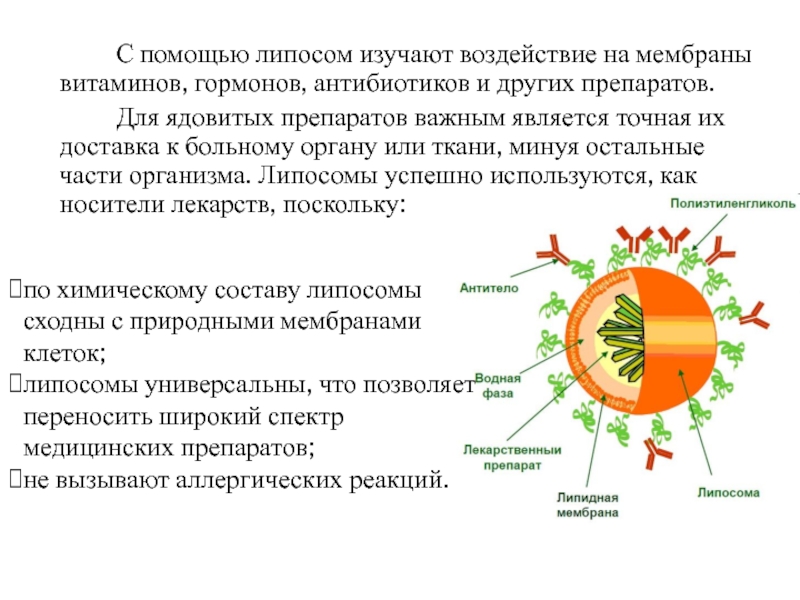
Слайд 21 С помощью липосом изучают воздействие на мембраны витаминов, гормонов, антибиотиков
и других препаратов.
Для ядовитых препаратов важным является точная их
доставка к больному органу или ткани, минуя остальные части организма. Липосомы успешно используются, как носители лекарств, поскольку:по химическому составу липосомы сходны с природными мембранами клеток;
липосомы универсальны, что позволяет переносить широкий спектр медицинских препаратов;
не вызывают аллергических реакций.


![Дисперсные системы (продолжение) {m[AgCI] n Ag+ (n – x) NO3- }х+ x NO3-агрегатПОИадсорбционныйдиффузионныйслойслойпротивоионыядроколлоидная частица {m[AgCI] n Ag+ (n – x) NO3- }х+ x NO3-агрегатПОИадсорбционныйдиффузионныйслойслойпротивоионыядроколлоидная частица (гранула)мицелла АgNO3 + KCI =](/img/thumbs/ede8cc5f3ddb295991e1c977a1287160-800x.jpg)

![Дисперсные системы (продолжение) агрегатПОИадсорбционныйдиффузный слойслойпротивоионыядроколлоидная частица (гранула)мицелла{m[AgCI] n Ag+ (n – x)NO3- }х+ x агрегатПОИадсорбционныйдиффузный слойслойпротивоионыядроколлоидная частица (гранула)мицелла{m[AgCI] n Ag+ (n – x)NO3- }х+ x NO3-Твердая фаза Жидкая фаза «связанные»](/img/thumbs/7df349dd8c4dc72f45d9584cb8426f37-800x.jpg)