Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ДОМЕННАЯ СТРУКТУРА БЕЛКА
Содержание
- 1. ДОМЕННАЯ СТРУКТУРА БЕЛКА
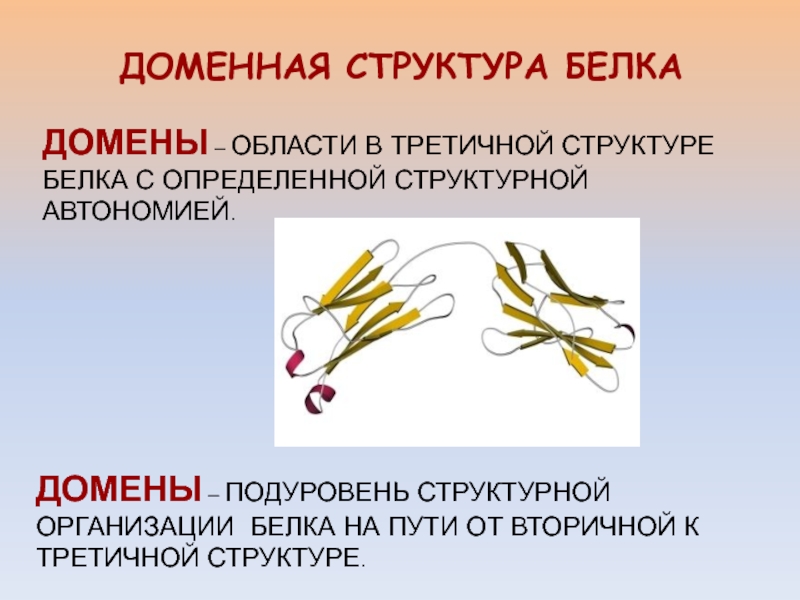
- 2. ДОМЕННАЯ СТРУКТУРА БЕЛКАДОМЕНЫ – ОБЛАСТИ В ТРЕТИЧНОЙ
- 3. ВПЕРВЫЕ ДОМЕННАЯ СТРУКТУРА ПОКАЗАНА НА ПРИМЕРЕ ЛИЗОЦИМА,
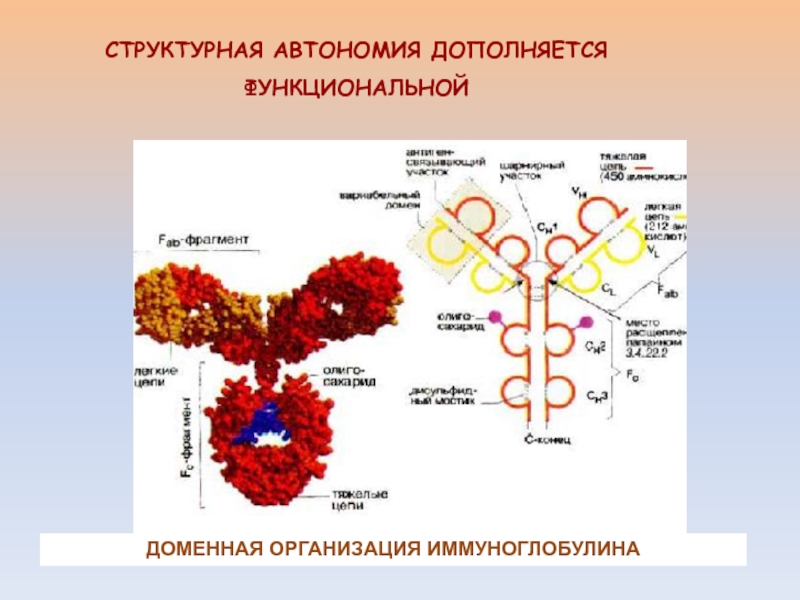
- 4. СТРУКТУРНАЯ АВТОНОМИЯ ДОПОЛНЯЕТСЯ ФУНКЦИОНАЛЬНОЙДОМЕННАЯ ОРГАНИЗАЦИЯ ИММУНОГЛОБУЛИНА
- 5. Доменная организация димерного фрагмента глутатионредуктазы.Каждая субъединица состоит
- 6. Третичная структура одного из доменов протромбина. При
- 7. РАЗЛИЧАЮТ ДВА ВИДА ДОМЕНОВ (Д.УЕТЛАУФЕР)С НЕПРЕРЫВНОЙ ПОЛИПЕПТИДНОЙ ЦЕПЬЮС РАЗРЫВНОЙ ПОЛИПЕПТИДНОЙ ЦЕПЬЮОБЛАСТЬ, ОБЪЕДИНЯЮЩАЯ ДОМЕНЫ – ЯДРО (НУКЛЕАЦИЯ)
- 8. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА И СИЛЫ, ЕЁ СТАБИЛИЗИРУЮЩИЕ
- 9. Третичная структура белка - пространственная ориентация полипептидной
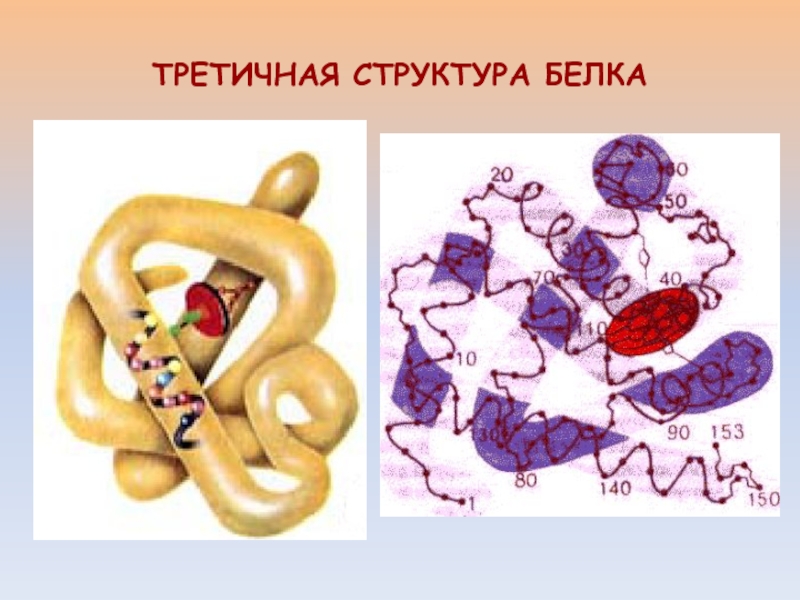
- 10. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА
- 11. РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А–
- 12. электростатические силы притяжения (ионные связи); водородные связи;
- 13. ВОДОРОДНЫЕ СВЯЗИ в белковой молекуле:А - между
- 14. ДЛЯ САМОПРОИЗВОЛЬНО ПРОТЕКАЮЩИХ ПРОЦЕССОВ ΔG
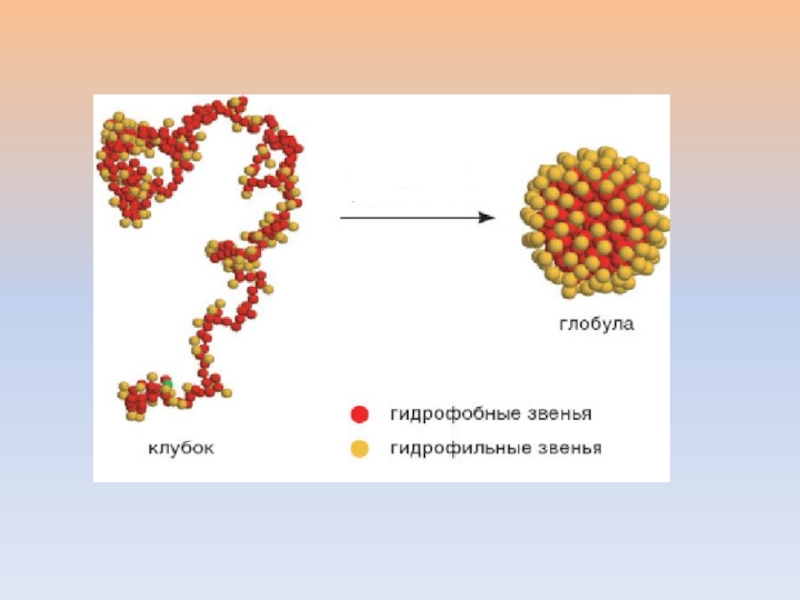
- 15. При свертывании белковой глобулы выигрыша в числе
- 16. ТЕРМОДИНАМИКА ОБРАЗОВАНИЯ ГЛОБУЛЫСВОБОДНАЯ ЭНЕРГИЯ ГИББСАΔG = ΔH - TΔS ДЛЯ САМОПРОИЗВОЛЬНЫХ ПРОЦЕССОВ ΔG
- 17. СТЕПЕНЬ ГИДРОФОБНОСТИ АМИНОКИСЛОТЫ ОПРЕДЕЛЯЮТ ПО РАЗНОСТИ СВОБОДНЫХ
- 18. Слайд 18
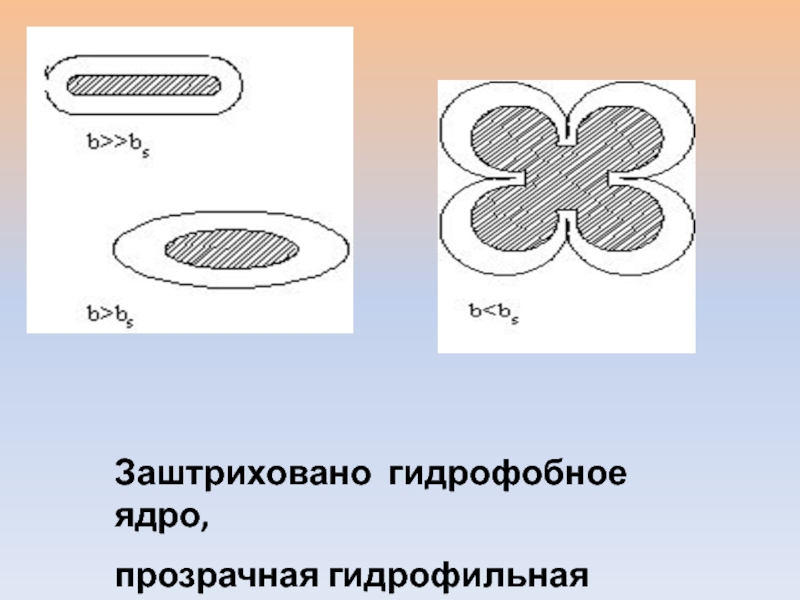
- 19. В 1964 году Фишер установил, что, зная
- 20. Заштриховано гидрофобное ядро, прозрачная гидрофильная оболочка
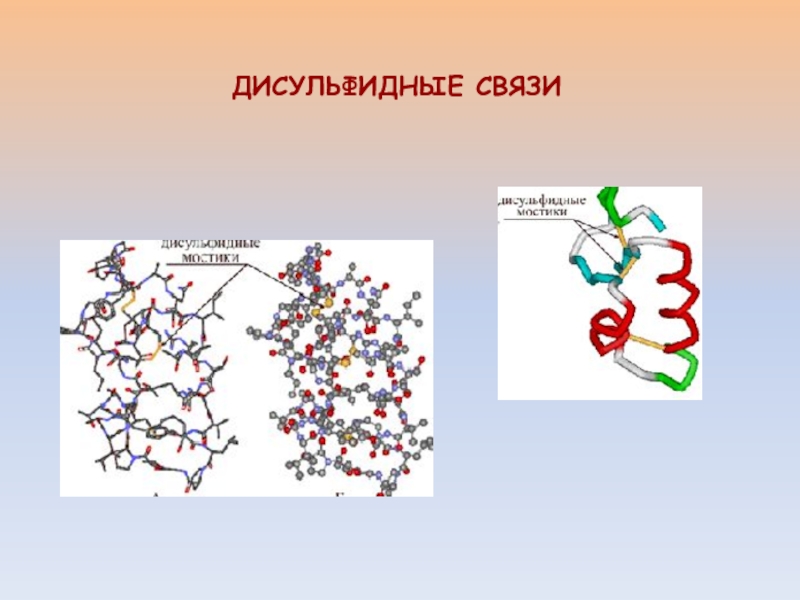
- 21. ДИСУЛЬФИДНЫЕ СВЯЗИ
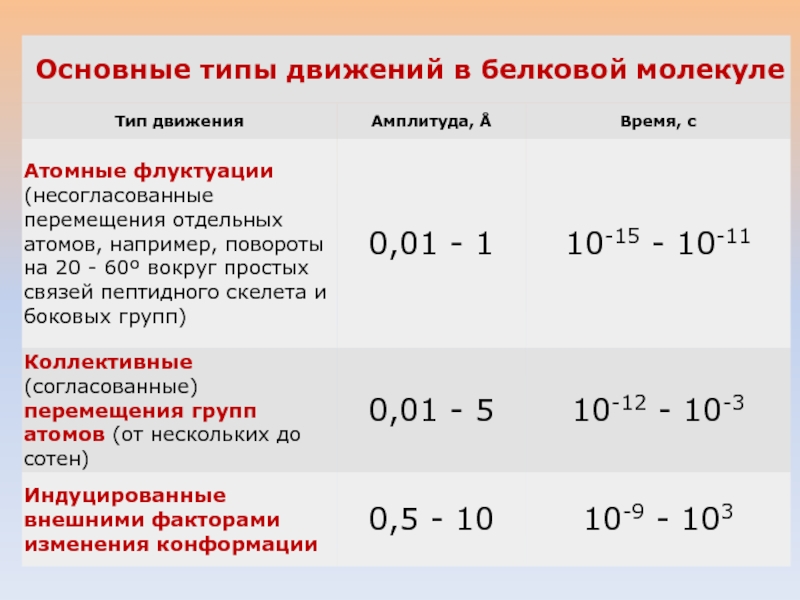
- 22. ОСНОВНЫЕ ТИПЫ ДВИЖЕНИЙ В БЕЛКОВОЙ МОЛЕКУЛЕ
- 23. Слайд 23
- 24. Гидрофильные остатки не полностью покрывают гидрофобное ядро, что приводит к образованию надмолекулярных структур.ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА
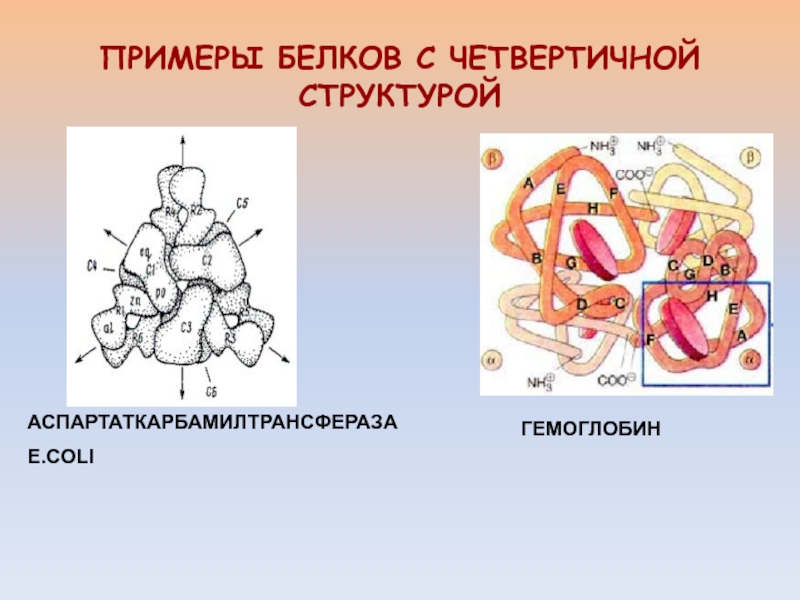
- 25. ГЕМОГЛОБИНПРИМЕРЫ БЕЛКОВ С ЧЕТВЕРТИЧНОЙ СТРУКТУРОЙАСПАРТАТКАРБАМИЛТРАНСФЕРАЗАE.COLI
- 26. РОЛЬ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫАРХИТЕКТУРНАЯ ФУНКЦИЯОБЕСПЕЧЕНИЕ МНОЖЕСТВЕННЫХ ВЗАИМОДЕЙСТВИЙ БЕЛКА
- 27. САМООРГАНИЗАЦИЯ БЕЛКААминокислотная последовательность сама (при подходящей температуре
- 28. Несмотря на громадное число теоретически возможных для
- 29. Каждый ако имеет около 10 возможных конформаций.Цепь
- 30. С одной стороны, нативная пространственная структура ведет
- 31. С.Левинталь предположил, что нативная структура белка определяется
- 32. КОНЦЕПЦИЯ СТАДИЙНОГО СВОРАЧИВАНИЯ БЕЛКА О.Б.ПТИЦЫНА (1973)(концепция каркасной модели)
- 33. Очень быстрое формирование элементов вторичной структуры, служащих
- 34. Специфическая ассоциация некоторых элементов вторичной структуры с
- 35. Формирование 'расплавленной глобулы' (создание основных элементов третичной
- 36. Формирование нативной структуры белка ЕЕ ОБЕСПЕЧИВАЮТВандерваальсовы силыВодородные связиИонные связи
- 37. Слайд 37
- 38. ВНУТРИКЛЕТОЧНАЯ РЕГУЛЯЦИЯ ФОРМИРОВАНИЯ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКА
- 39. ФЕРМЕНТЫ, УСКОРЯЮЩИЕ ПРОЦЕСС СВОРАЧИВАНИЯ
- 40. Транс-конформация более стабильна, она преобладает во вновь
- 41. Второй фермент (протеиндисульфидизомераза), ускоряющий процесс сворачивания, катализирует
- 42. ШАПЕРОНЫ И ШАПЕРОНИНЫ
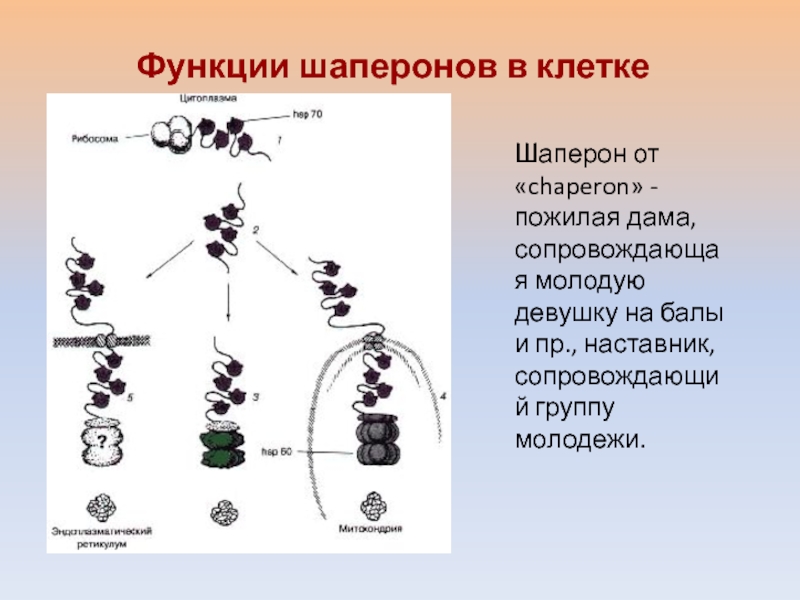
- 43. Функции шаперонов в клетке Шаперон от «chaperon»
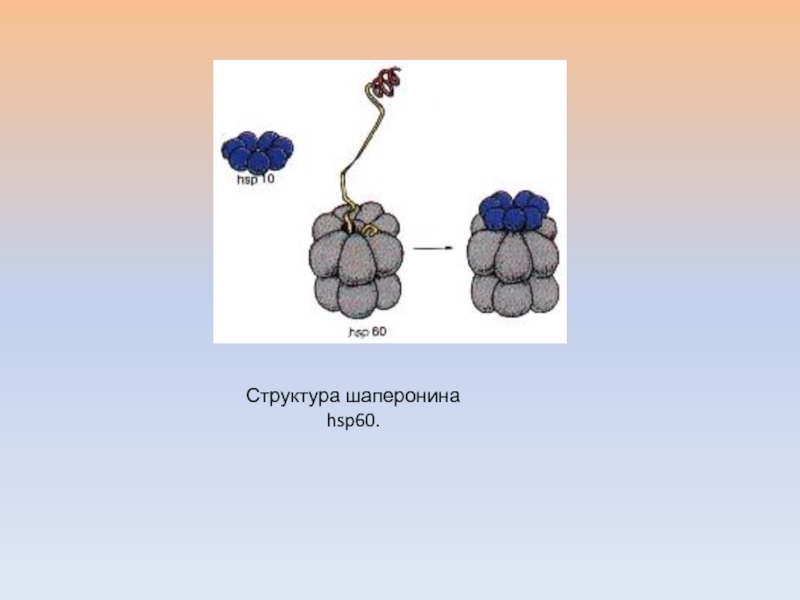
- 44. Структура шаперонина hsp60.
- 45. Модель сворачивания белков с участием шаперонинов.1- белок
- 46. Скачать презентанцию
ДОМЕННАЯ СТРУКТУРА БЕЛКАДОМЕНЫ – ОБЛАСТИ В ТРЕТИЧНОЙ СТРУКТУРЕ БЕЛКА С ОПРЕДЕЛЕННОЙ СТРУКТУРНОЙ АВТОНОМИЕЙ.ДОМЕНЫ – ПОДУРОВЕНЬ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА НА ПУТИ ОТ ВТОРИЧНОЙ К ТРЕТИЧНОЙ СТРУКТУРЕ.
Слайды и текст этой презентации
Слайд 1
ПРОСТРАНСТВЕННАЯ СТРУКТУРА БЕЛКА:
ДОМЕНЫ
ТРЕТИЧНАЯ СТРУКТУРА
ЧЕТВЕРТИЧНАЯ СТРУКТУРА
САМООРГАНИЗАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Слайд 2ДОМЕННАЯ СТРУКТУРА БЕЛКА
ДОМЕНЫ – ОБЛАСТИ В ТРЕТИЧНОЙ СТРУКТУРЕ БЕЛКА С
ОПРЕДЕЛЕННОЙ СТРУКТУРНОЙ АВТОНОМИЕЙ.
ОТ ВТОРИЧНОЙ К ТРЕТИЧНОЙ СТРУКТУРЕ.Слайд 3ВПЕРВЫЕ ДОМЕННАЯ СТРУКТУРА ПОКАЗАНА НА ПРИМЕРЕ ЛИЗОЦИМА, ИММУНОГЛОБУЛИНОВ, ХИМОТРИПСИНА, ПАПАИНА
И ДР.
Домены в структуре протеолитического фермента папайи - папаина.
Прерывистыми
линиями намечено направление впадины между двумя доменами, в которой связывается субстрат и размещен каталитический центр. Дисульфидные связи заштрихованы Слайд 5
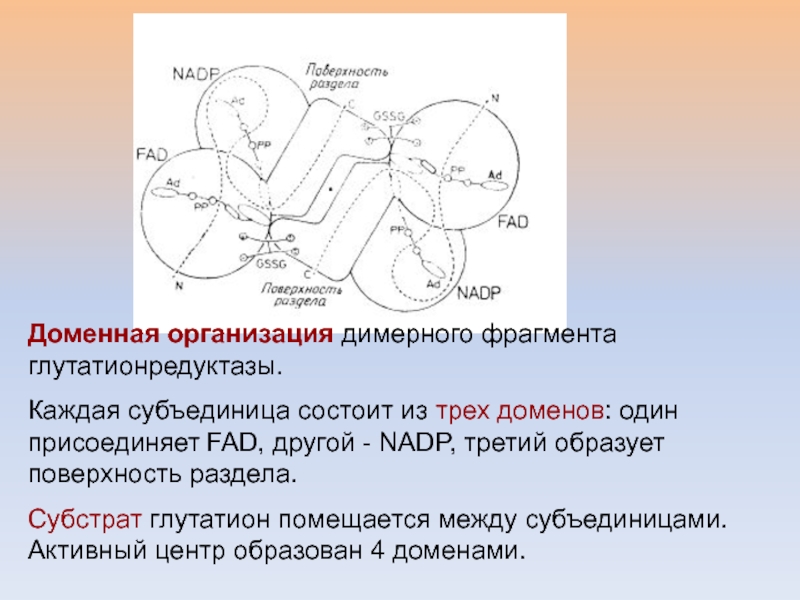
Доменная организация димерного фрагмента глутатионредуктазы.
Каждая субъединица состоит из трех доменов:
один присоединяет FAD, другой - NADP, третий образует поверхность раздела.
Субстрат глутатион помещается между субъединицами. Активный центр образован 4 доменами.
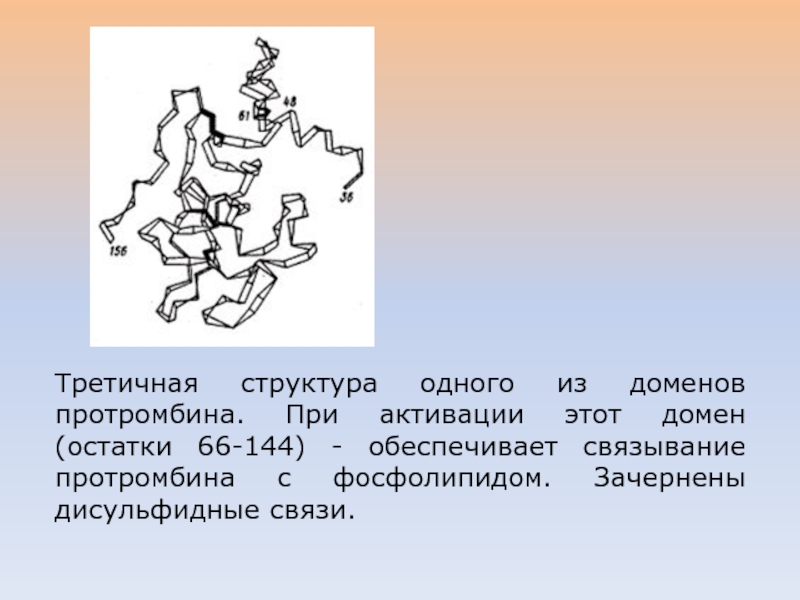
Слайд 6Третичная структура одного из доменов протромбина. При активации этот домен
(остатки 66-144) - обеспечивает связывание протромбина с фосфолипидом. Зачернены дисульфидные
связи.Слайд 7РАЗЛИЧАЮТ ДВА ВИДА ДОМЕНОВ (Д.УЕТЛАУФЕР)
С НЕПРЕРЫВНОЙ ПОЛИПЕПТИДНОЙ ЦЕПЬЮ
С РАЗРЫВНОЙ ПОЛИПЕПТИДНОЙ
ЦЕПЬЮ
ОБЛАСТЬ, ОБЪЕДИНЯЮЩАЯ ДОМЕНЫ – ЯДРО (НУКЛЕАЦИЯ)
Слайд 9Третичная структура белка - пространственная ориентация полипептидной спирали или способ
укладки полипептидной цепи в определенном объеме.
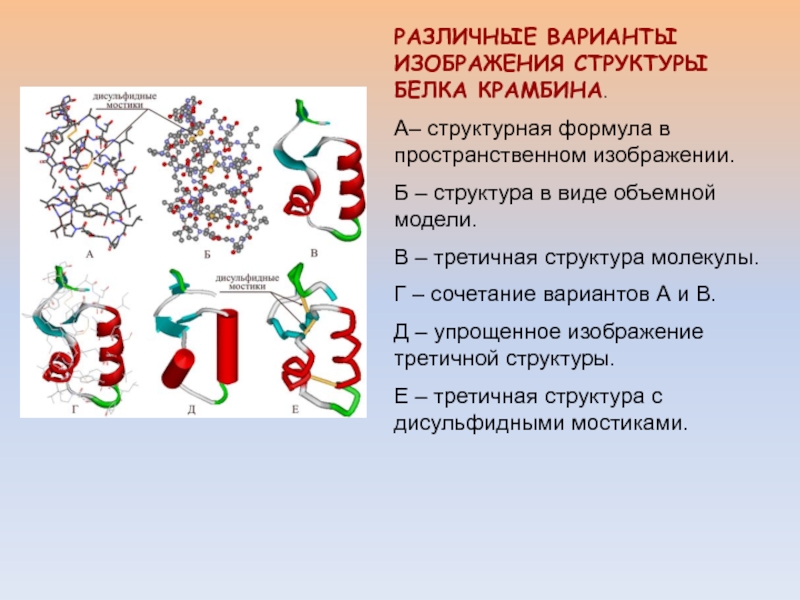
Слайд 11РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула в
пространственном изображении.
Б – структура в виде объемной модели.
В
– третичная структура молекулы. Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.
Слайд 12
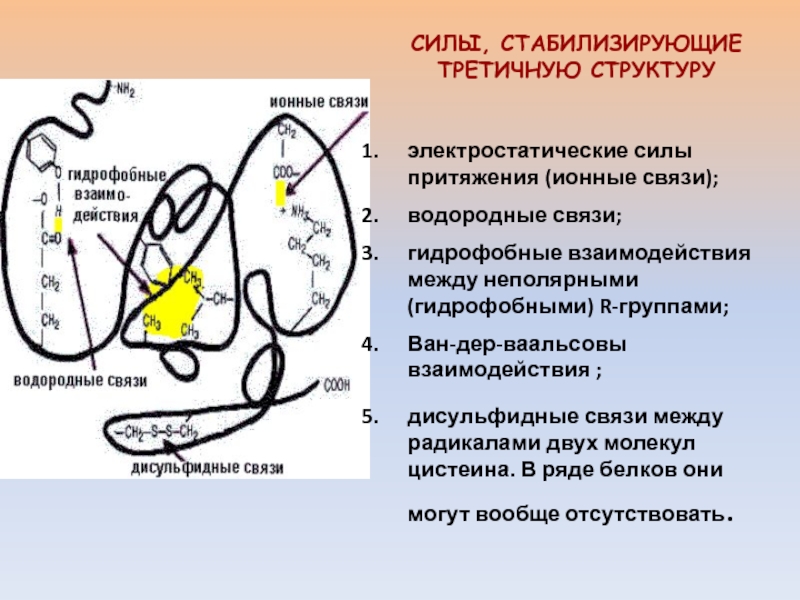
электростатические силы притяжения (ионные связи);
водородные связи;
гидрофобные взаимодействия между
неполярными (гидрофобными) R-группами;
Ван-дер-ваальсовы взаимодействия ;
дисульфидные связи между радикалами двух молекул
цистеина. В ряде белков они могут вообще отсутствовать. СИЛЫ, СТАБИЛИЗИРУЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ
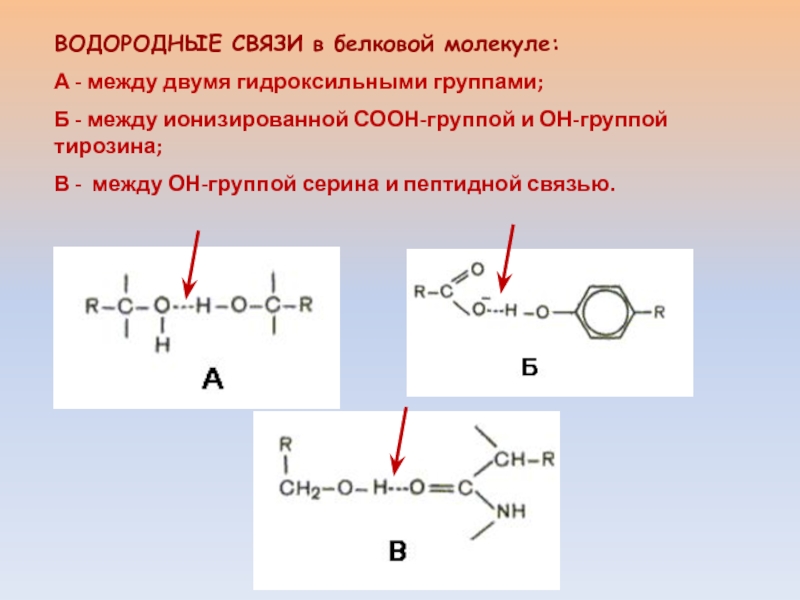
Слайд 13ВОДОРОДНЫЕ СВЯЗИ в белковой молекуле:
А - между двумя гидроксильными группами;
Б - между ионизированной СООН-группой и ОН-группой тирозина;
В -
между ОН-группой серина и пептидной связью.Слайд 14 ДЛЯ САМОПРОИЗВОЛЬНО ПРОТЕКАЮЩИХ ПРОЦЕССОВ ΔG
ЭНТРОПИИ.
ОБРАЗОВАНИЕ СВЯЗЕЙ →ЭНТАЛЬПИЯ СНИЖАЕТСЯ
РАЗРЫВ СВЯЗЕЙ →ЭНТАЛЬПИЯ ПОВЫШАЕТСЯ.
СВОБОДНАЯ
ЭНЕРГИЯ ГИББСАΔG = ΔH - TΔS
Слайд 15При свертывании белковой глобулы выигрыша в числе водородных связей не
происходит, т к одновременно утрачиваются водородные связи «полипептидная цепь –
вода».При свертывании глобулы убывает энтропия пептидной цепи, но одновременно происходит возрастание энтропии растворителя - воды, что играет решающую роль в стабилизации третичной структуры белка.
Слайд 16ТЕРМОДИНАМИКА ОБРАЗОВАНИЯ ГЛОБУЛЫ
СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
ΔG = ΔH - TΔS
ДЛЯ
САМОПРОИЗВОЛЬНЫХ ПРОЦЕССОВ ΔG
Слайд 17СТЕПЕНЬ ГИДРОФОБНОСТИ АМИНОКИСЛОТЫ ОПРЕДЕЛЯЮТ ПО РАЗНОСТИ СВОБОДНЫХ ЭНЕРГИЙ ЕЕ РАСТВОРЕНИЯ
В СЛАБОПОЛЯРНОМ РАСТВОРИТЕЛЕ И ВОДЕ
ГИДРОФОБНЫЕ АМИНОКИСЛОТЫ: ТРИ, ИЛЕ, ТИР, ФЕН,
ПРО, ЛЕЙ, ВАЛ, ЛИЗ, ГИСГИДРОФИЛЬНЫЕ АМИНОКИСЛОТЫ: АЛА, АРГ, ЦИС, ГЛУ, АСП, ТРЕ, СЕР, ГЛИ, АСН, ГЛН
ГИПОТЕЗА ОБ ОПРЕДЕЛЯЮЩЕЙ РОЛИ ГИДРОФОБНЫХ ВЗАИМОДЕЙСТВИЙ ДОКАЗАНА В 1944.
Слайд 19В 1964 году Фишер установил, что, зная общее число аминокислотных
остатков в ядре и отношение полярных остатков к неполярным, можно
предсказать форму глобулы.Отношение числа полярных остатков к неполярным – bs.
Радиус глобулы – r0
Толщина полярных остатков, покрывающих глобулу, – d
Слайд 24
Гидрофильные остатки не полностью покрывают гидрофобное ядро, что приводит к
образованию надмолекулярных структур.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА
Слайд 26РОЛЬ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
АРХИТЕКТУРНАЯ ФУНКЦИЯ
ОБЕСПЕЧЕНИЕ МНОЖЕСТВЕННЫХ ВЗАИМОДЕЙСТВИЙ БЕЛКА С ПРОТЯЖЕННЫМИ СТРУКТУРАМИ
РЕГУЛЯТОРНАЯ
ФУНКЦИЯ
ОБЪЕДИНЕНИЕ НЕСКОЛЬКИХ ВЗАИМОСВЯЗАННЫХ ФУНКЦИЙ В ЕДИНОЙ СТРУКТУРЕ
Слайд 27САМООРГАНИЗАЦИЯ БЕЛКА
Аминокислотная последовательность сама (при подходящей температуре и рН среды)
определяет пространственную структуру белка — т.е. белок способен к самоорганизации.
Слайд 28Несмотря на громадное число теоретически
возможных для отдельной аминокислотной
последовательности
пространственных структур, сворачивание каждого белка приводит к образованию
единственной нативной
конформации. Слайд 29Каждый ако имеет около 10 возможных конформаций.
Цепь из 100 ако
– порядка 10100 возможных конформаций.
Переход из одной конформации в другую
– 10 –13 с.Тогда время перебора конформаций – 1080 лет (время жизни нашей Вселенной 1010 лет).
Слайд 30С одной стороны, нативная пространственная структура ведет себя как самая
стабильная из всех существующих структур цепи: белковая цепь попадает в
нее при разных кинетических процессах [и при сворачивании на рибосоме в процессе биосинтеза, и после секреции сквозь мембрану, и при сворачивании в пробирке (ренатурации), - чем бы и как бы она ни была в этой пробирке развернута].С другой стороны, нет никаких гарантий, что эта структура - самая стабильная из всех возможных: у белковой цепи просто нет времени на то, чтобы убедиться в этом!
ПАРАДОКС С.ЛЕВИНТАЛЯ
Слайд 31С.Левинталь предположил, что нативная структура белка определяется не стабильностью, не
термодинамикой, а кинетикой, т.е. она соответствует не глобальному, а просто
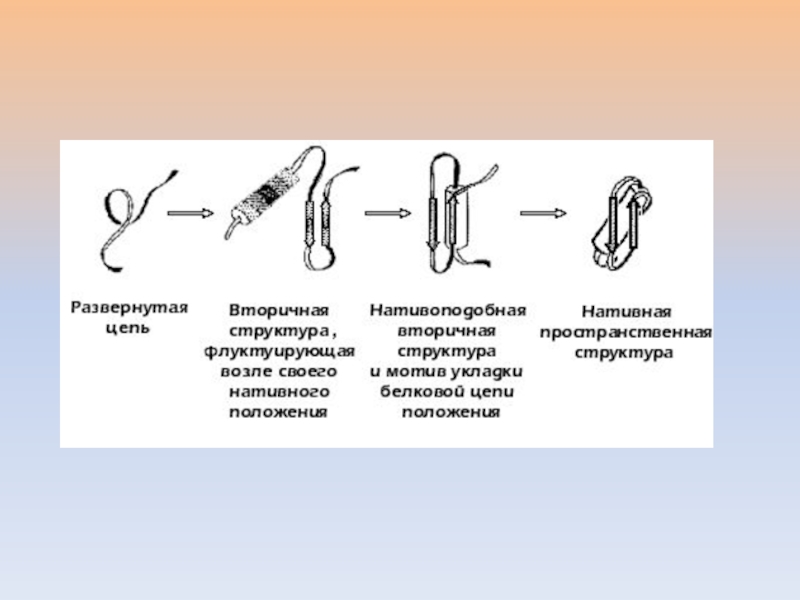
быстро достижимому минимуму свободной энергии цепи.Слайд 33Очень быстрое формирование элементов вторичной структуры, служащих как бы "затравками"
для образования более сложных архитектурных мотивов (за десятую долю микросекунды
альфа-спираль охватывает пептид из 20-30 остатков).Движущая сила – образование водородных связей.
Слайд 34Специфическая ассоциация некоторых элементов вторичной структуры с образованием супервторичной структуры:
сочетания нескольких α-спиралей, нескольких β-цепей либо смешанные ассоциаты данных элементов
(тоже очень быстрая стадия)Движущая сила – гидрофобные взаимодействия
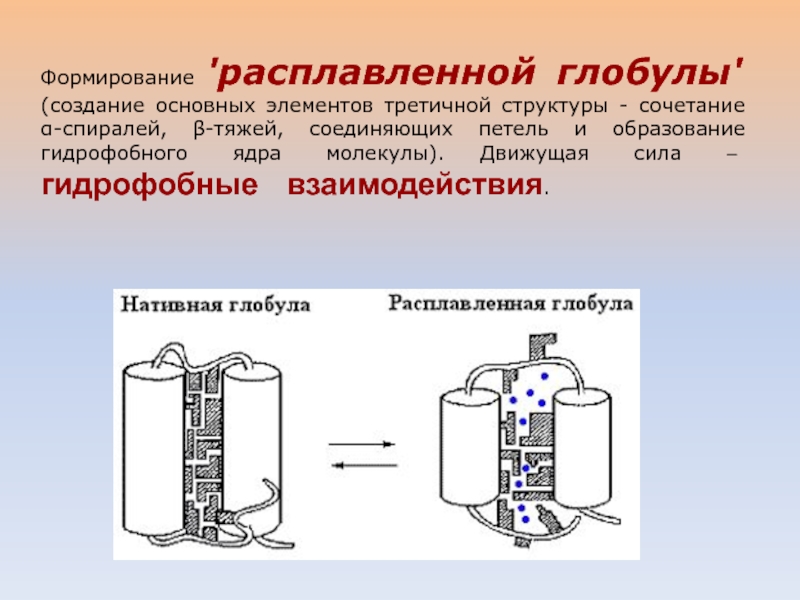
Слайд 35Формирование 'расплавленной глобулы' (создание основных элементов третичной структуры - сочетание
α-спиралей, β-тяжей, соединяющих петель и образование гидрофобного ядра молекулы). Движущая
сила – гидрофобные взаимодействия.Слайд 36
Формирование нативной структуры белка
ЕЕ ОБЕСПЕЧИВАЮТ
Вандерваальсовы силы
Водородные связи
Ионные связи
Слайд 40
Транс-конформация более стабильна, она преобладает во вновь синтезированной полипептидной цепи.
Для образования нативной структуры белка необходимо, чтобы часть связей, образованных
остатками пролина, изомеризовались в цис-конформацию. Эта реакция, приводящая к повороту цепи на 180° вокруг C-N связи, идет чрезвычайно медленно. In vivo она ускоряется благодаря действию специального фермента – пептидил-пролил-цис/транс-изомеразы.
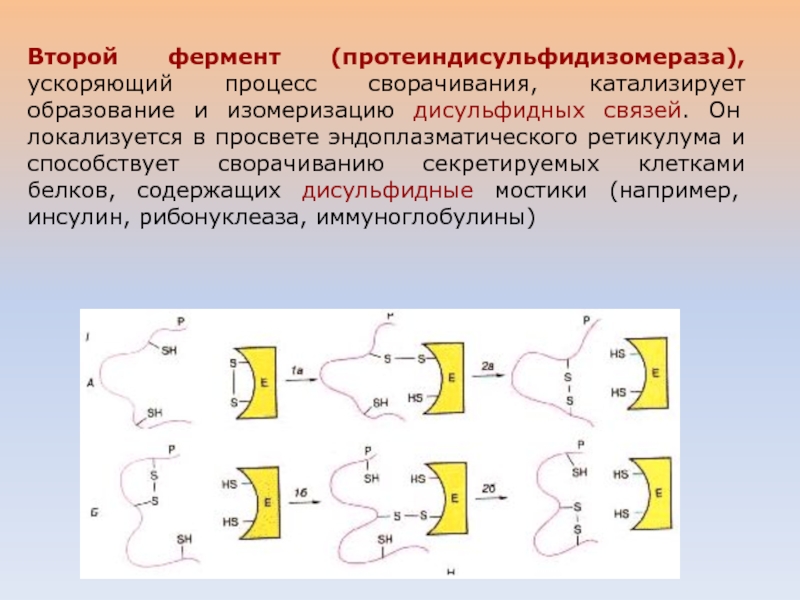
Слайд 41Второй фермент (протеиндисульфидизомераза), ускоряющий процесс сворачивания, катализирует образование и изомеризацию
дисульфидных связей. Он локализуется в просвете эндоплазматического ретикулума и способствует
сворачиванию секретируемых клетками белков, содержащих дисульфидные мостики (например, инсулин, рибонуклеаза, иммуноглобулины)