Слайд 1Дәріс №1
Тақырыбы: Атом құрылысы.Периодтық заң және
периодтық жүйе.
Жоспар:
Атомның құрылысы. Атомдар орбиталі. Квант сандары. Көп электронды атомдар.
Электрондардың таралуының негізгі принциптері.
Периодтық заң және периодтық жүйе. Химиялық элементтер қасиеттерінің периодты түрде өзгеруі.
Слайд 2«Атом» деген грек сөзі – бөлінбейді деген мағынасы. Атом құрылысының
күрделігін дәлелдейтін негізгі ғылыми жаңалықтарының ашылулары:
Электролиттердің тоқ өткізуін зерттеу (Фарадей,
Дэви, Петров В.В.)
ЭПЖ-сінің ашылуы (Менделеев Д.И., Мейер, Ньюленс)
Рентген сәулесінің ашылуы (Рентген, 1895ж)
Катод сәулесінің ашылуы (Крукс, 1879ж)
Термоэлектрондардың бөлініп шығуларының ашылуы (қыздырғанда электрондардың бөліп шығуы) (Эдисон, 1881ж) және фотоэффект=сәуле түсіргенде бөліп шығару (Герц, 1887ж)
Радиоактивтіктің ашылуы (Анри Беккерель, 1896ж)
Электрондардың ашылуы (Джозеф Джон Томпсон, 1897ж)
Слайд 3Атом модельдері
Томсон моделі (1903ж) – мейізделген пудинг. Мағынасы: атом
– электрондары бар оң зарядталған сфера
Хантаро Нага Око (1904ж) –
Сатурн моделі – мағынасы: Сатурн планетасын айналып тұрған шеңбер сияқты, электрондар орталық оң зарядты ядроны айналып тұратын шеңбер түзеді.
Планетарлық моделі – Резерфорд (1911ж) – мағынасы: «мөлшері атомның мөлшерінен 100 мың еседей кіші ядроның айналасын күнді айналып жүрген планеталар сияқты теріс зарядты электрондар айналып қоршап жүреді»
Кемшілігі: Модель классикалық электродинамика тұрғысынан шыққан.
Қайшылық:
1) Модель бойынша – ядроны айнала қозғалып жүрген үздіксіз сәуле шығарудың нәтижесінде өз энергиясын бірте-бірте азайтып, ақырында, ядроға құлап түсу керекте, ал атом жойылуы керек. Ал негізінде атом жойылмайтын тұрақты жүйе.
2) Сәуле шығару спектрі біртұтас, ұзындығы әр түрлі сәулелердің үздіксіз қатарынан тұруы керек, ал шын мәнінде атомның спектрі сызықты, үздікті жүйе боп табылады.
Слайд 4Кванттық модель және атом құрылысы тұралы Нильс Бор теориясы (1913).
1)
Атомдағы электрон ядроны тек белгілі кванттық шарттарға жауап беретін стационарды
орбита бойымен айналып жүреді:
Мұнда
m-электронның массасы m=9,1·10-31кг, (q=1,6·10-19Кл)
v-электронның қозғалыс жылдамдығы
n- бүтін сан (негізгі квант саны = орбитальдын нөмері)
h-Планк тұрақтысы
h=6,626·10-34 Дж·с
r-орбитальдың радиуысы
π-математикалық мағынасы=3,14
Слайд 52) Электрон ядроны стационар орбита бойынша айналғанда Е (энергия) сіңірілмейді
да, бөлінбейді де.
3) Электрон ядроға ең жақын орбитада болғанда, оның
энергия қоры аз. Бұл күйі қалыпты немесе негізгі күйі деп аталады.
Электрон ядродан қашық жатқан орбитада, және Е қоры көп болғандығы атомның күйі қозған күйі деп аталады.
4) Бір деңгейден екінші деңгейге көшкенде энергияның сіңірілуі және бөлінуі тек кванттар түрінде болады: Е=Есоңы-Ебастапқы=hυ=һ·с/λ
Мұндағы: һ-Планк тұрақтысы = 6,63·10-34 Дж·с
υ-тербеліс жиілігі
λ-толқын ұзындығы
с-жарық жылдамдығы с=3·108 см/с (вакуумда)
Слайд 6Бор теориясының кемшілігі:
a) сутек атомынан басқа күрделі жүйелерде электрондардың қозғалыстарының
барлық ерекшіліктерін түсіндіре алмайды.
b) Теория электрон туралы тек бөлшек=корпускула сияқты
дұрыс емес қозқараста құрылған.
c) Неміс ғалымы А.Зоммерфельд (1916ж.) Бор моделіне түзетпес еңгізді: электрондар ядроны эллипс тәрізді орбитальмен планеталардың күнді айналу жолы сияқты айналуы керек.
Кванттық механика тұрғысынан атом құрылысы
Негізгі принциптері:
Екі жақтылық принципті – «дуализм принципі»: электрон -«толқын – бөлшек» (Луи де Бройль, 1924ж)
Тұжырымдасы: Кез келген бөлшектердің қозғалысы бұл толқындың процесс, яғни кез келген материялдық объект, жарық сияқты ( толқындық ) әрі бөлшектік қасиеті бар (электромагниттік құбылыс)
Слайд 7Жарық үшін :
λ-ұзындығы (толқын)
m-фотон массасы
с-жарық жылдамдығы 3·108 м/с
Электрон үшін:
m-электронның массасы
v-электрон
жылдамдығы
Слайд 8Атомдар орбиталі. Квант сандары.
Атомдық орбиталь – бұл электрондардың болу ықтималдағы
көбірек кеңістік.
Орбитальдың формалары әр түрлі және ядродан әр түрлі қашықтықта
болады. Атомдағы электронның күйін 4 квант сандарымен өрнектейді:
1) n-негізгі квант саны – энергиясын және электрон бұлтының мөлшерін анықтайтын сан.
n=1, 2, 3, 4, 5, 6, 7 мәндерін қабылдайды
K L M N O P Q
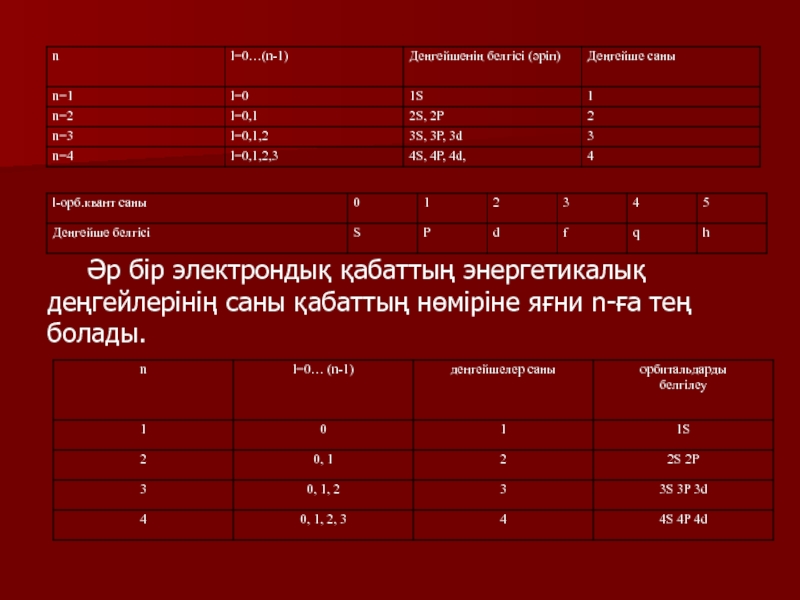
2) l-орбитальдық квант саны - қосымша квант саны - бұлтарының пішінінің анықтайды l=0, 1, 2, 3, 4 … (n-1)
Берілген n-да l- мәні бірдей – энергетикалық деңгейлерін құрады
Слайд 9 Әр бір электрондық қабаттың энергетикалық деңгейлерінің саны қабаттың нөміріне яғни
n-ға тең болады.
Слайд 10Орбиталь квант саны 0 тең (l=0) электрондар S-электронар деп аталады
және пішіні шар тәрізді болады.
Орбиталь квант саны 1 тең (l=1)
электрондар р-электрондар деп аталады және орбитальдың пішіні гантель тәрізді Р
Орбиталь квант саны 2 тең (l=2) электрондар d- - электрондар деп аталады және орбиталінің пішіні розетка, күрделі гантель тәрізді болады.
Орбиталь квант саны 3 тең (l=3) электрондар f-электрондар деп аталады және орбитальдары күрделірек болады.
3) Магниттік квант саны me бұл сан орбитальдардың кеністікте орналасуын анықтайды
me = (2I+1)
4) Спиндік квант сандар ms - электрондардың спиндерінің бағытын көрсетеді.
Спин өз осінің айналасында ұршықша айналады ms = +1/2
ms = -1/2
Слайд 11Жалпы деңгейдегі электрондардың максималды санын анықтайтын формула:
N=2n2
n=1 N=2
n=2 N=8
n=3 N=18
Слайд 12Көп электронды атомдар электрондардың таралуының негізгі принциптері
Үш негізгі принципі бар:
Паулидін
тыйыл салу принципі:
Бір атомның ішінде төрт квант санның төртеуі де
бірдей болуы мүмкін емес, яғни атомдағы кезкелген екі электрон ең кемінде бір квант санымен өзгешілегі болу керек.
Мысалы: n=1 онда l=0, m=1, онда бір электронның спині +1/2, екіншісінің спині
-1/2 болады
Слайд 132) Ең аз энергия принципі
Электронның атомдағы орналасу реттілігі олардың ядромен
көбірек байланысуына, яғни электронның энергиясы ең аз орбитаға орналасуға тырысуына
жауап беруі керек.
Клечковскидің бірінші ережесі: элемент атомының электрондары оның деңгейлерімен деңгейшелерінде бас және қосымша квант сандары қосындысының (n+l) өсу ретімен орналасады.
Мысалы: 2S пен 2P деңгейшелерінің толтыруын қарастырайық
n+l= 2+0=2
n+l=2+1=3 сондықтан бірінші 2S деңгейшесі
толтырылады
Слайд 14Клечковскидің екінші ережесі:
Егер екі әр түрлі деңгейшеде (n+l) қосындысы бірдей
болса онда n аз орбиталі бірінші толтырылады.
Мысалы: 3d мен 4P
n+l= 3+2=5
n+l=4+1=5
Клечковскидің екінші ережесі бойынша n аз l үлкен бірінші толтырылады, сондықтан 3d бірінші толтырылады, ал одан кейін n үлкен l аз толтырылады.
3d → 4P
Слайд 153) Гунд ережесі (Спин сандарының жиынтығының максимумының ережесі)
Берілген денгейшеде электрондар
спин сандарының қосындысы максимал болатындай орналасады немесе әрбір электрон мүмкін
болса жеке уяшыққа орналасуға тырысады
+1/2+1/2+1/2=3/2 (max)
+1/2-1/2+1/2=1/2
+1/2-1/2-1/2=-1/2 (min)
Слайд 16Көп электронды атомдарының толтыруы :
1S2 → 2S2 → 2P6 →
3S2 → 3P6 → 4S2 → 3d10 → 4P6 →
5S2 → 4d10 → 5P6 → 6S2 → 5d1 → 4f14 → 5d2-10 → 6P6 → 7S2 → 6d1 → 5f14 → 6d2-10 → 7P6