Слайд 1Дыхательная цепь: строение и функции. Окислительное фосфорилирование.
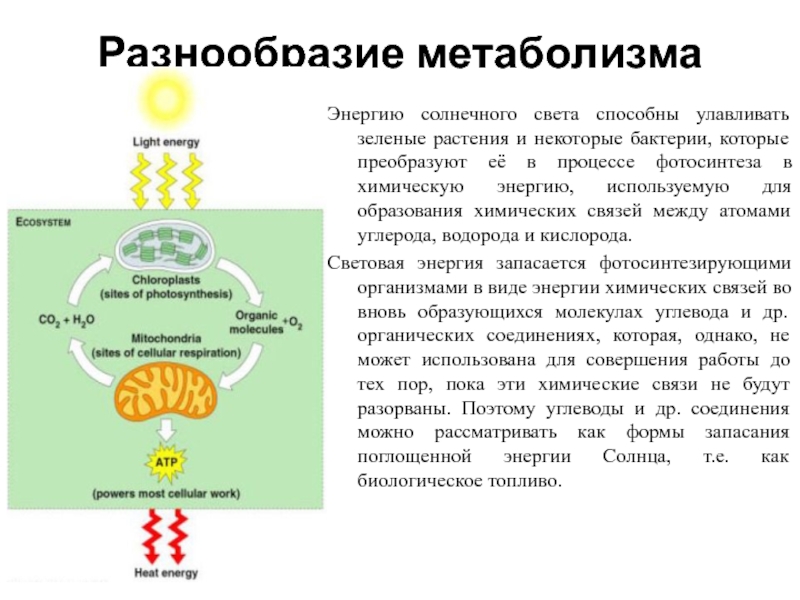
Слайд 2Разнообразие метаболизма
Энергию солнечного света способны улавливать зеленые растения и некоторые
бактерии, которые преобразуют её в процессе фотосинтеза в химическую энергию,
используемую для образования химических связей между атомами углерода, водорода и кислорода.
Световая энергия запасается фотосинтезирующими организмами в виде энергии химических связей во вновь образующихся молекулах углевода и др. органических соединениях, которая, однако, не может использована для совершения работы до тех пор, пока эти химические связи не будут разорваны. Поэтому углеводы и др. соединения можно рассматривать как формы запасания поглощенной энергии Солнца, т.е. как биологическое топливо.
Слайд 32-ой закон Термодинамики
при необратимых процессах энтропия системы и окружающей среды
увеличивается
системы стремятся к неупорядоченности
ЭНТРОПИЯ (S) от греч. entropia -- поворот,
превращение
Слайд 4Энтропия
Энтропия
растет!
мера беспорядка (случайности) в системе (S)
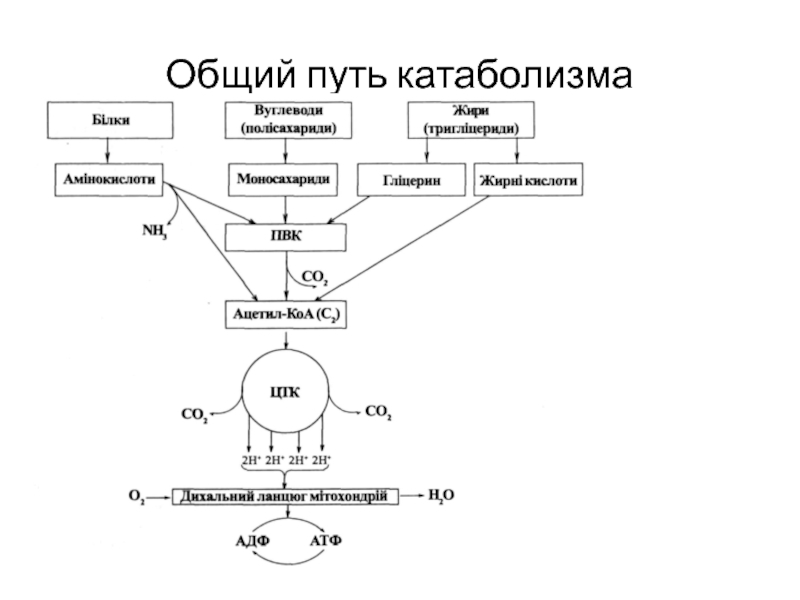
Слайд 5ВЗАИМОСВЯЗЬ ОБМЕНА ВЕЩЕСТВ
И
ЭНЕРГИИ.
Пищевые вещества
Метаболиты
Катаболизм
Анаболизм
Энергия
Образование конечных продуктов обмена (углекислого
газа и воды, мочевина)
Синтез структурно-функцио-
нальных компонентов клетки
Функциональная активность
Энергия ?????
Слайд 6АТФ
Fritz Albert Lipmann (1899-1986)
“ATP is energy-transfering molecule in the
cell” (1941)
Karl Lohmann (1898-1978) –
the discoverer of ATP (1929)
Слайд 7В организме АТФ синтезируется путём фосфорилирования АДФ:
АДФ + H3PO4 +
энергия → АТФ + H2O.
Фосфорилирование АДФ возможно тремя способами:
1-субстратное фосфорилирование,
2-окислительное
фосфорилирование,
3- фотофосфорилирование в процессе фотосинтеза у растений.
Цикл АТФ ↔ АДФ + Ф
Реакция фосфорилирования
Слайд 8АТФ у человека образуется в клетке двумя путями: - окислительное
фосфорилирование: синтез АТФ с использованием энергии выделяемой при окислении S:
Q
– это энергия окисления субстрата
- субстратное фосфорилирование: синтез АТФ с использованием энергии S ( макроэрга)
Макроэргические соединения имеют макроэргические связи, т. е. связи, при гидролитическом расщеплении которых высвобождается более 30 кДж/моль (или 7 ккал/моль) энергии.
Слайд 9Три способа анаэробного синтеза АТФ
Субстратное фосфорилирование- в процессе гликолиза в
ходе фосфоглицераткиназной реакции и пируваткиназной реакции, в ЦТК в реакции
катализируемой сукцинил-КоА-синтазой с участием нуклеозиддифосфаткиназы( реакции идут без участия кислорода).
2. Получение АТФ из фосфокреатина (это аварийный запас, который можно быстро использовать для получения АТФ и спасти жизнь), но запасы фосфокреатина расходуются очень быстро – за несколько секунд.
3. Образование АТФ из АДФ под действием аденилаткиназы.
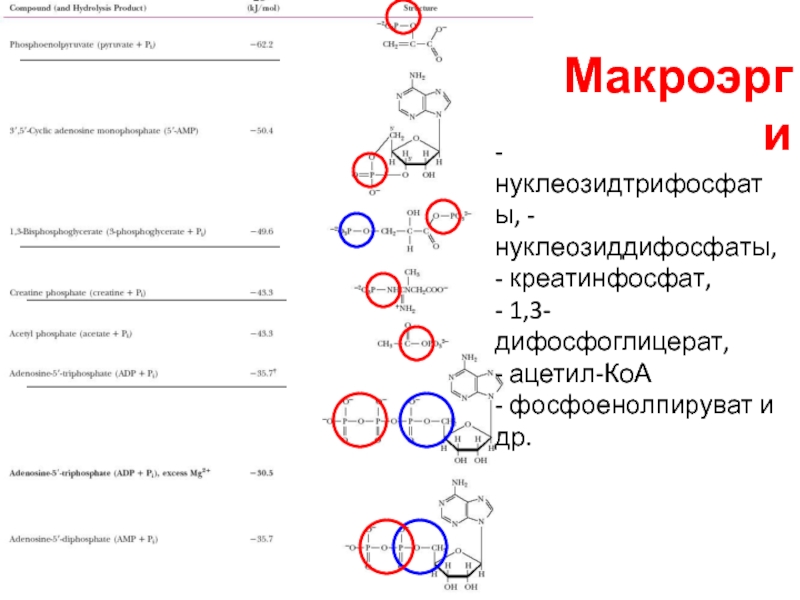
Слайд 10Макроэрги
- нуклеозидтрифосфаты, - нуклеозиддифосфаты, - креатинфосфат,
- 1,3-дифосфоглицерат,
- ацетил-КоА
- фосфоенолпируват и др.
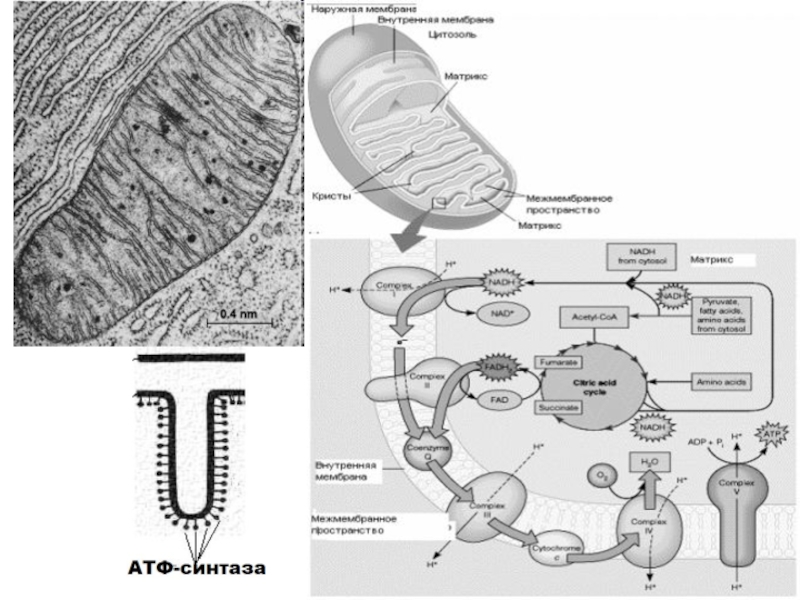
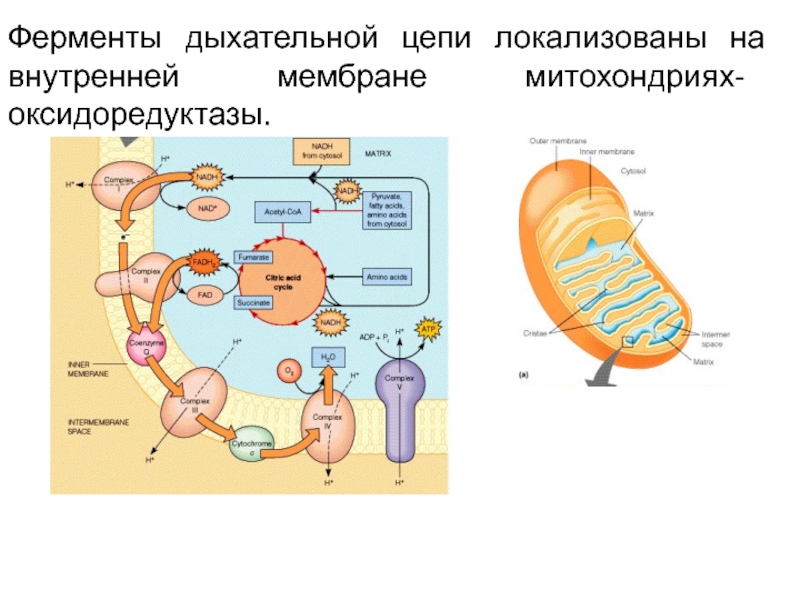
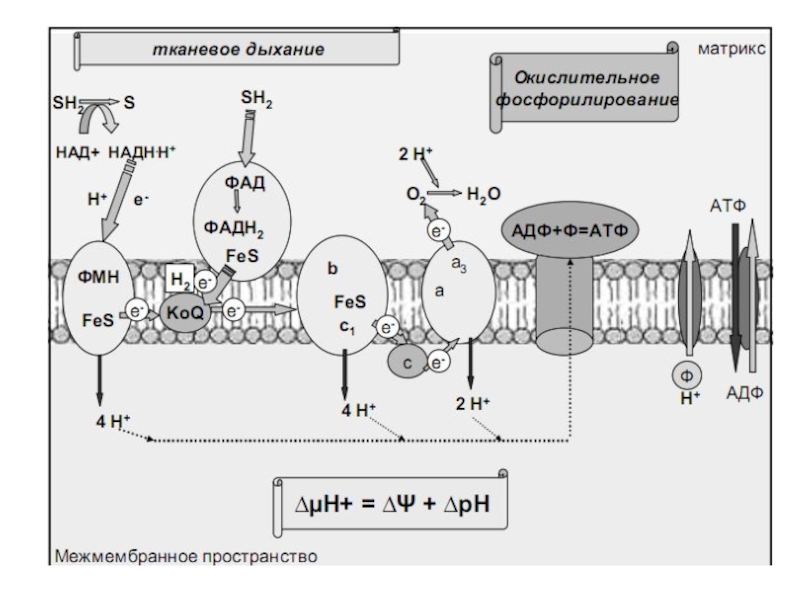
Слайд 11Тканевое дыхание- это последовательность окислительно-восстановительных реакций
Они катализируются оксидоредуктазами и протекают
при участии внутренней мембраны митохондрий. В митохондриях поток электронов устремляется
от субстрата, содержащего водород, к молекулярному кислороду. Реакция соединения водорода с кислородом сопровождается выделением большого количества тепла:
Н2+1/2О2 2Н2О+Тепло(239кДж/моль)
В клетке такая реакция протекать не может и отличием биологического окисления является , во первых постепенное, поэтапное выделение энергии, во вторых, окисляется не молекулярный водород, а в составе субстратов (SH2), в третьих энергия высвобождается не только в виде тепла, но и аккумулируется в виде электрохимического потенциала.
Слайд 12 Синтез АТФ в организме сопряжен с реакцией
образования воды
Этот
процесс происходит многостадийно с помощью многих
участников, которые называются дыхательной
цепью (ДЦ).
Тканевое дыхание – окисление S кислородом воздуха до СО2 и Н2О.
Слайд 15Ферменты дыхательной цепи локализованы на внутренней мембране митохондриях- оксидоредуктазы.
Слайд 16Выделение энергии происходит постепенно, порциями.
Дыхательная цепь Цепь переноса электронов (ЦПЭ)
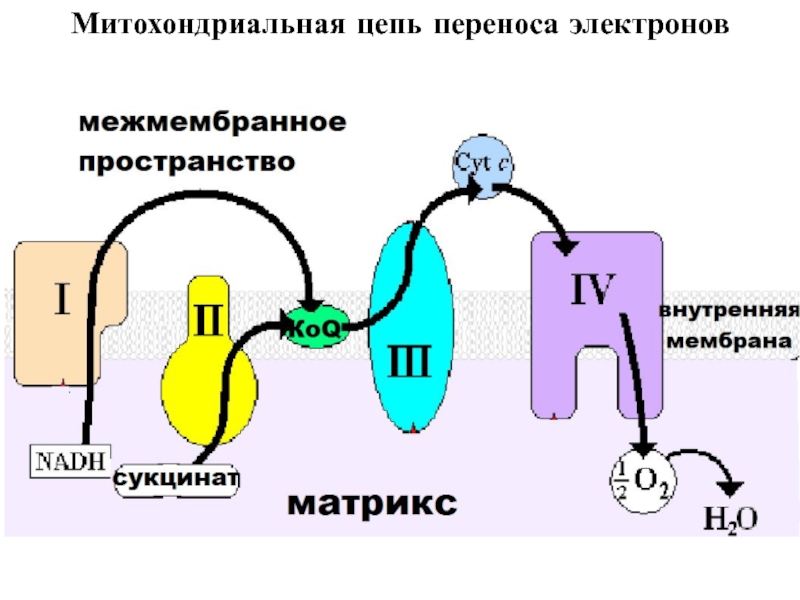
Слайд 17Митохондриальная цепь переноса электронов
Слайд 18Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих
из матрикса. Электроны передаются на конечный акцептор — кислород; протоны
выбрасываются в митохондриальное межмембранное пространство (ММП).
Слайд 19Дыхательные ферменты расположены в порядке
↑ величины редокс - потенциала
Место
того или иного переносчика в ДЦ определяется величиной редокс-потенциала
Слайд 20Редокс-потенциал (Ео)
численно равен электрондвижущей силе в Вольтах, возникающей между
растворами окислителя и восстановителя (концентрации 1М, рН = 7,0, температура
25С).
Чем отрицательнее Ео системы, тем выше ее способность отдавать электроны (восстановители). Чем положительнее редокс-потенциал, тем выше способность вещества присоединять электроны (окислители).
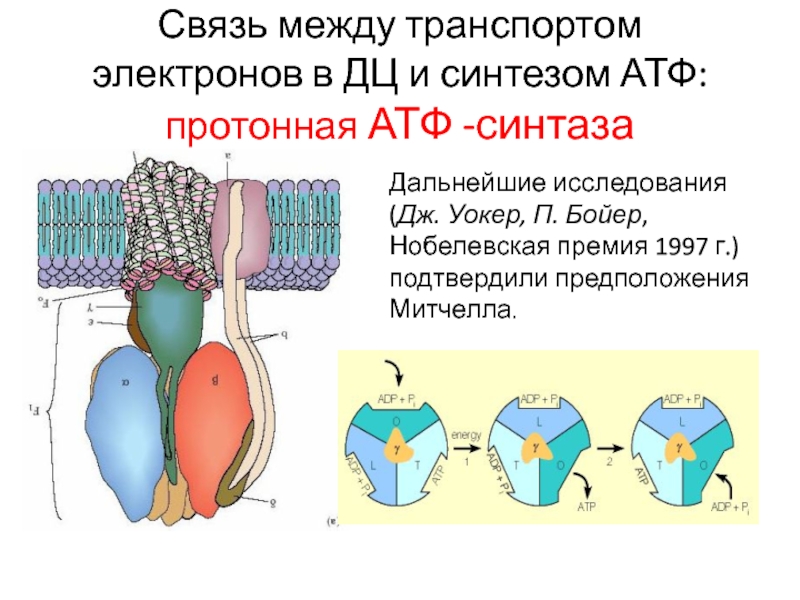
Слайд 21Связь между транспортом электронов в ДЦ и синтезом АТФ: протонная
АТФ -синтаза
Дальнейшие исследования (Дж. Уокер, П. Бойер, Нобелевская премия 1997
г.) подтвердили предположения Митчелла.
Слайд 22
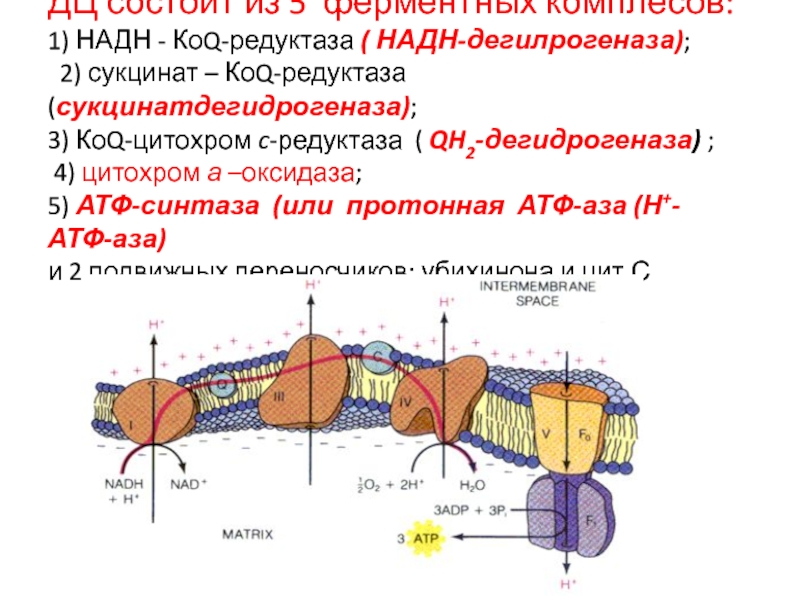
ДЦ состоит из 5 ферментных комплесов:
1) НАДН - КоQ-редуктаза
( НАДН-дегилрогеназа);
2) сукцинат – КоQ-редуктаза (сукцинатдегидрогеназа);
3) КоQ-цитохром
c-редуктаза ( QH2-дегидрогеназа) ;
4) цитохром а –оксидаза;
5) АТФ-синтаза (или протонная АТФ-аза (Н+- АТФ-аза)
и 2 подвижных переносчиков: убихинона и цит.С
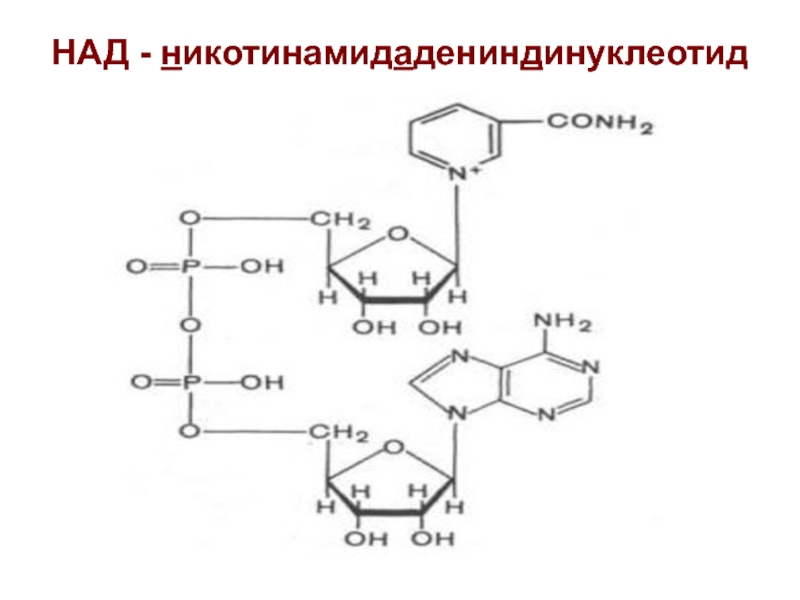
Слайд 23НАД - никотинамидадениндинуклеотид
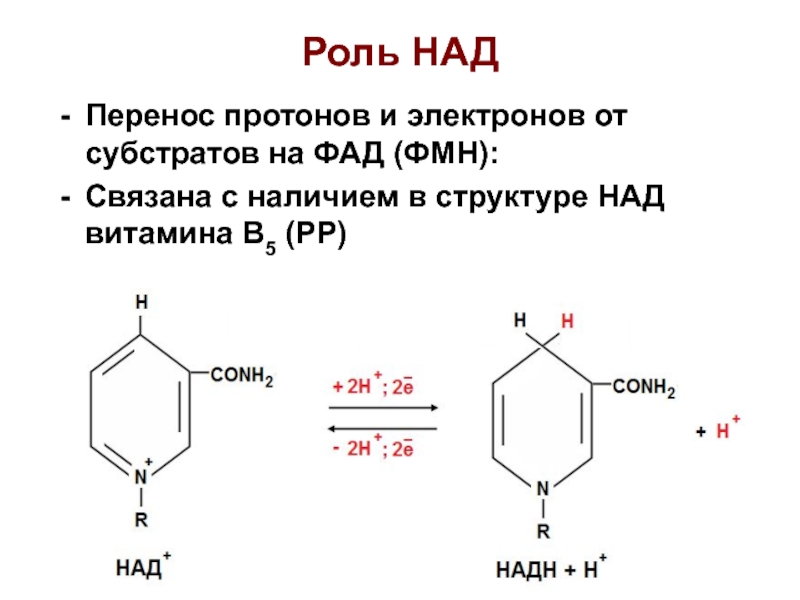
Слайд 24Роль НАД
Перенос протонов и электронов от субстратов на ФАД (ФМН):
Связана
с наличием в структуре НАД витамина В5 (РР)
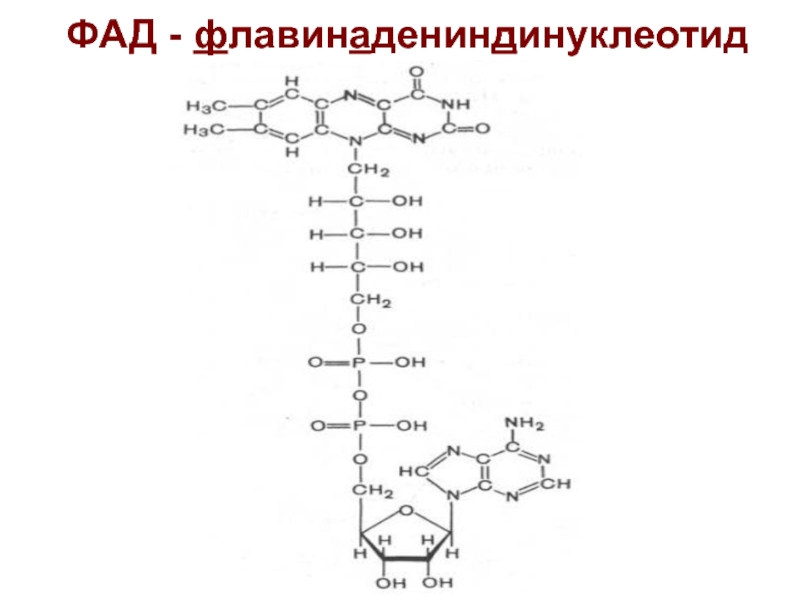
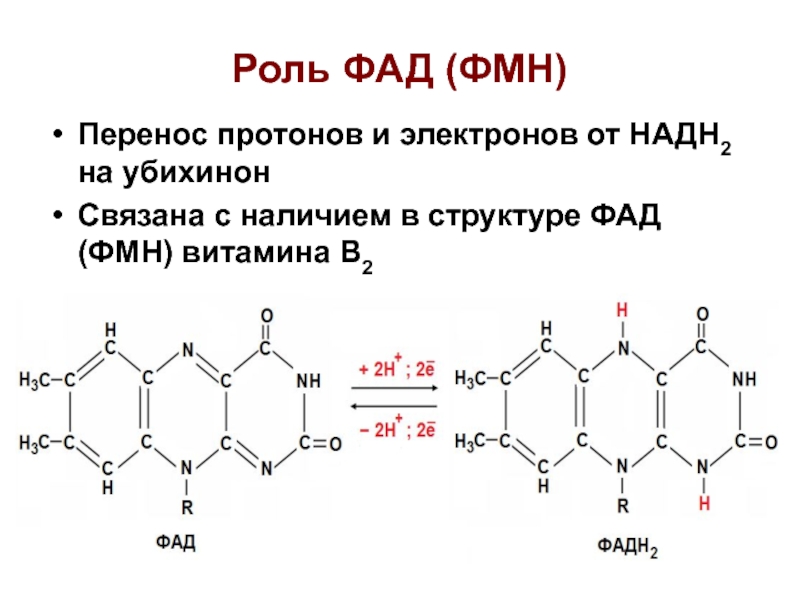
Слайд 26Роль ФАД (ФМН)
Перенос протонов и электронов от НАДН2 на убихинон
Связана с наличием в структуре ФАД (ФМН) витамина В2
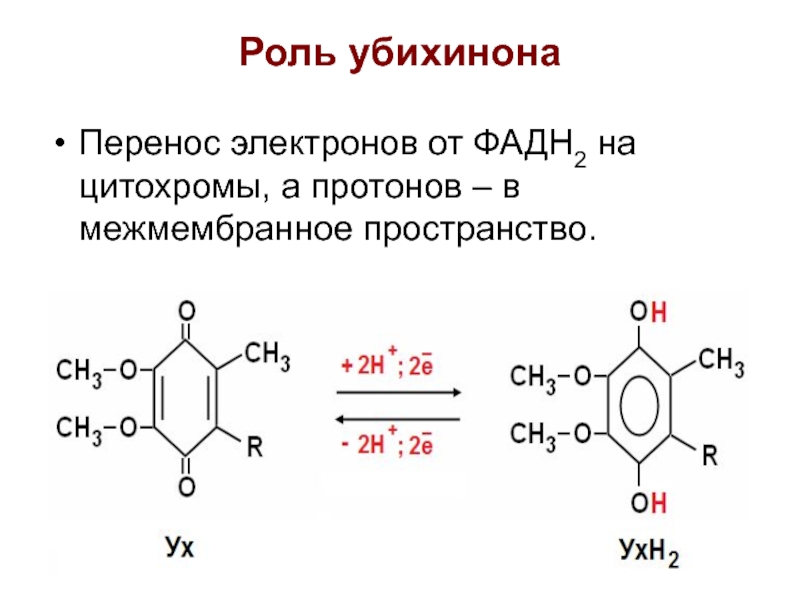
Слайд 27Роль убихинона
Перенос электронов от ФАДН2 на цитохромы, а протонов –
в межмембранное пространство.
Слайд 28
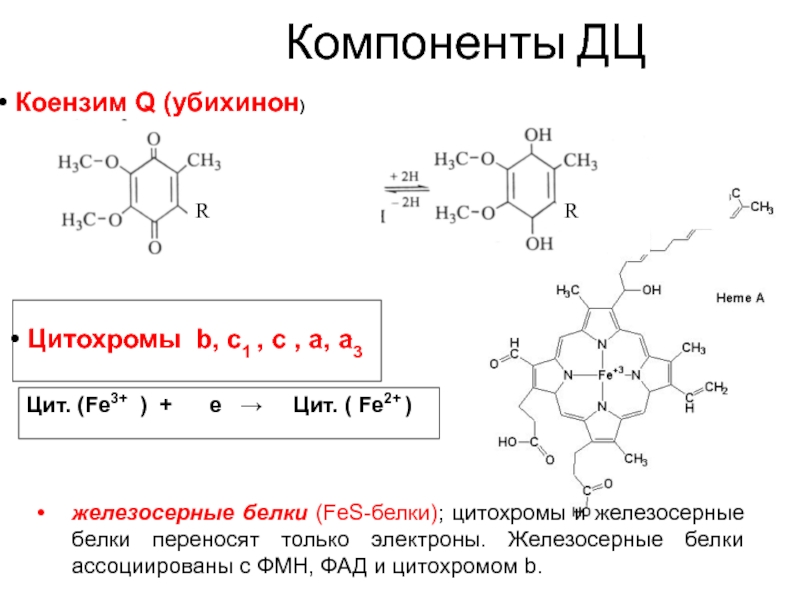
Цитохромы b, c1 , c , a, a3
Цит. (Fe3+
) + е → Цит.
( Fe2+ )
Коензим Q (убихинон)
Компоненты ДЦ
R
R
железосерные белки (FeS-белки); цитохромы и железосерные белки переносят только электроны. Железосерные белки ассоциированы с ФМН, ФАД и цитохромом b.
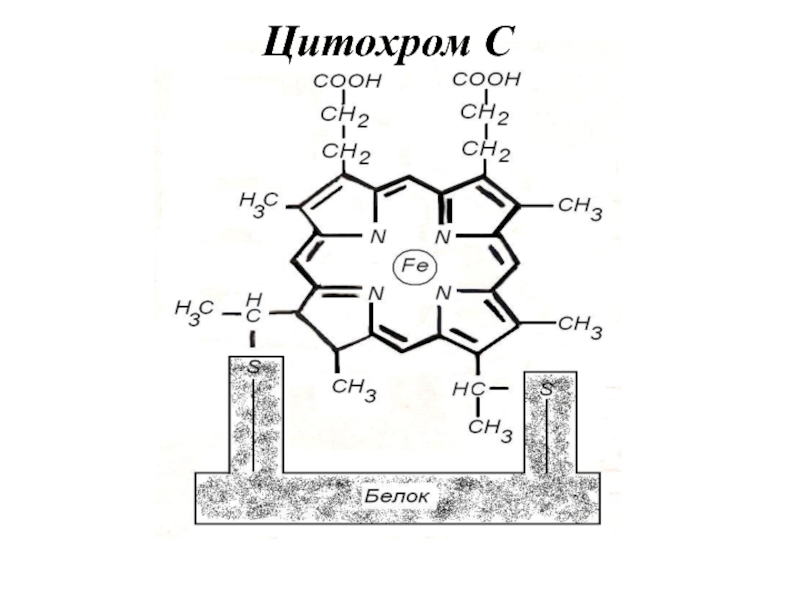
Слайд 29Цитохромы (Цх)
- гемсодержащие ферменты, осуществляют перенос электронов за счет изменения
степени окисления атома железа в составе гема.
Fe3+
+ e- ↔ Fe2+
Аутооксидабельность – способность передавать электроны непосредственно на кислород.
Единственным аутооксидабельным является цитохром аа3 – цитохромоксидаза.
Цитохромоксидаза состоит из 6 субъединиц, каждая из которых содержит гем и атом меди.
Ионы меди также могут переносить электроны:
Cu2+ + e- ↔ Cu+
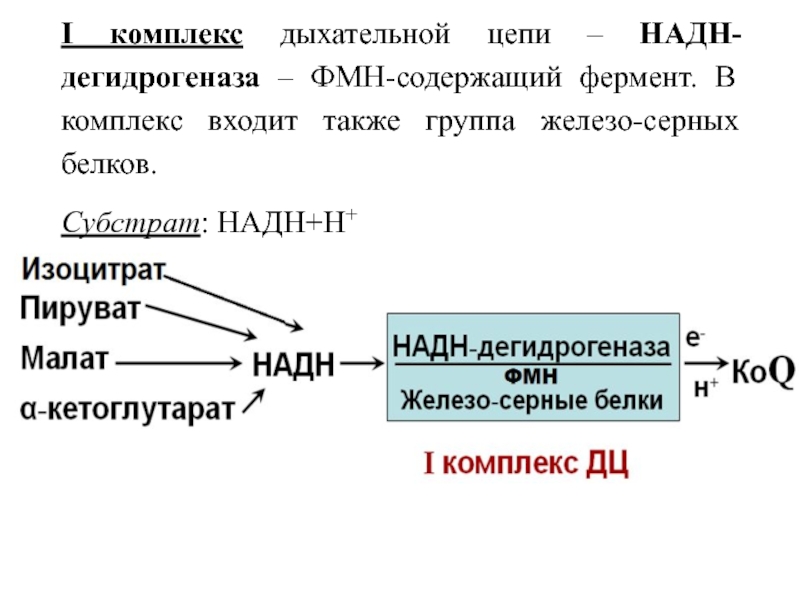
Слайд 30I комплекс дыхательной цепи – НАДН-дегидрогеназа – ФМН-содержащий фермент. В
комплекс входит также группа железо-серных белков.
Субстрат: НАДН+Н+
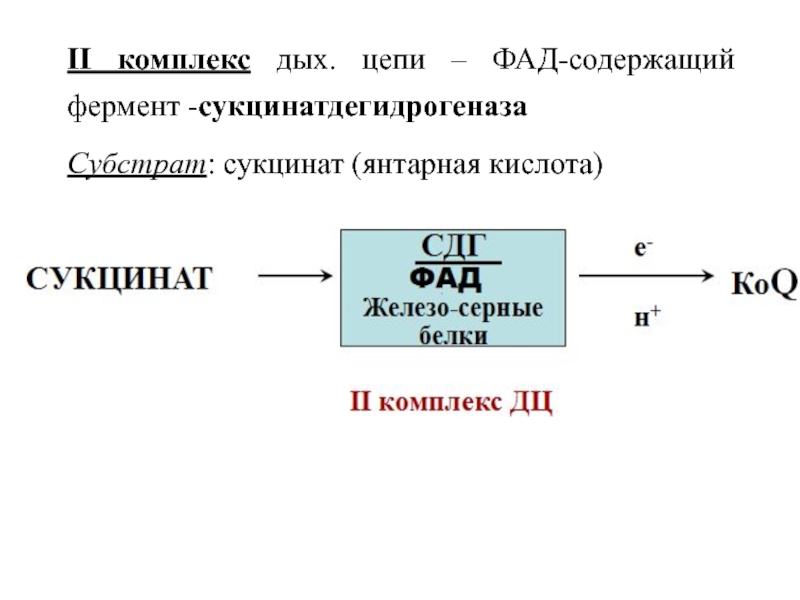
Слайд 31II комплекс дых. цепи – ФАД-содержащий фермент -сукцинатдегидрогеназа
Субстрат: сукцинат (янтарная
кислота)
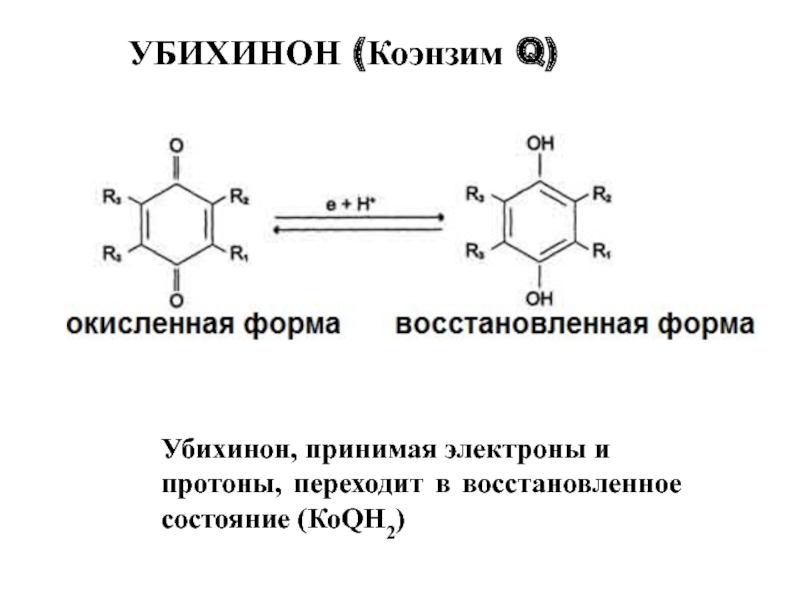
Слайд 32Убихинон, принимая электроны и
протоны, переходит в восстановленное состояние (КоQН2)
УБИХИНОН (Коэнзим
Слайд 33После КоQ в дыхательной цепи расположена группа цитохромов – гем-содержащих
ферментов, обеспечивающих транспорт электронов.
Различают несколько классов цитохромов: А, В,
С, образующих организованные комплексы.
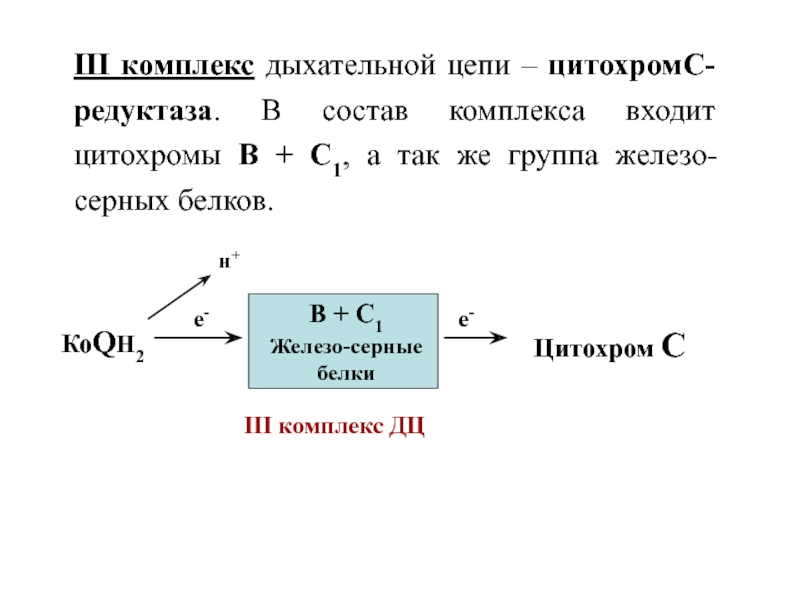
Слайд 34III комплекс дыхательной цепи – цитохромС-редуктаза. В состав комплекса входит
цитохромы В + С1, а так же группа железо-серных белков.
КоQН2
е-
н+
В
+ С1
Железо-серные белки
III комплекс ДЦ
е-
Цитохром С
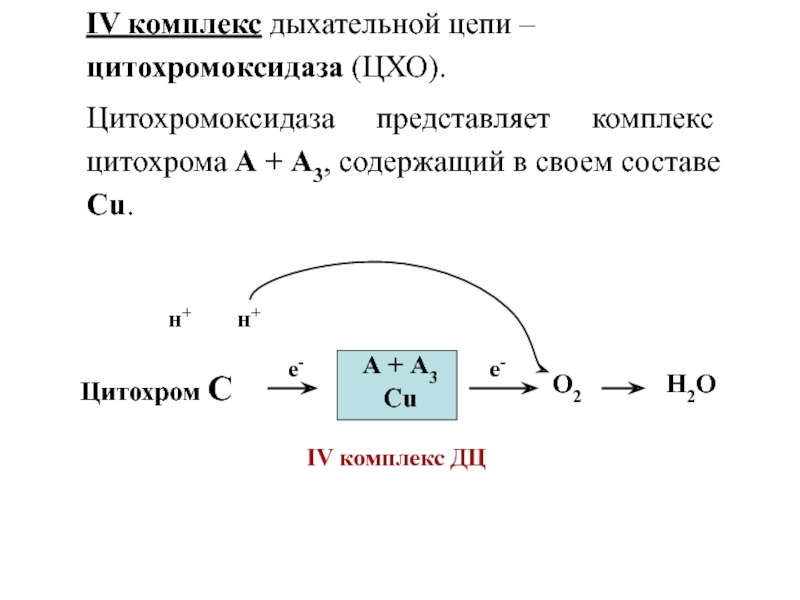
Слайд 36IV комплекс дыхательной цепи – цитохромоксидаза (ЦХО).
Цитохромоксидаза представляет комплекс цитохрома
А + А3, содержащий в своем составе Cu.
Цитохром С
е-
А +
А3
Cu
IV комплекс ДЦ
О2
н+
е-
н+
Н2О
Слайд 37Изменение свободной энергии при переносе электронов по ЦПЭ. E-FMN -
комплекс I; E-FAD - комплекс II; b-с1 - комплекс III;
aa3 - комплекс IV
Слайд 383Х7,3=21,9 ккал =3АТФ
ΔG°’=52,6 ккал
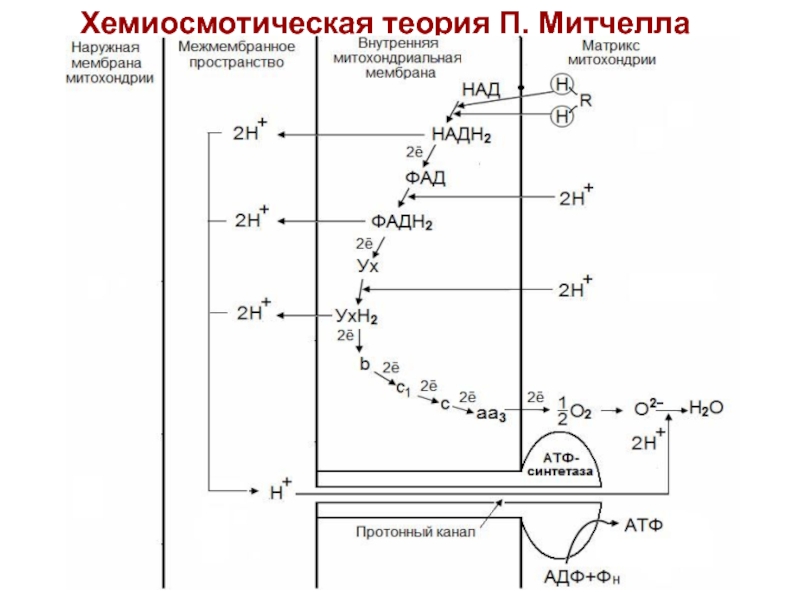
Слайд 40Хемиоосмотическая теория окислительного фосфорилирования (Нобелевская премия 1978 г.).
Слайд 41Хемиосмотическая теория П. Митчелла
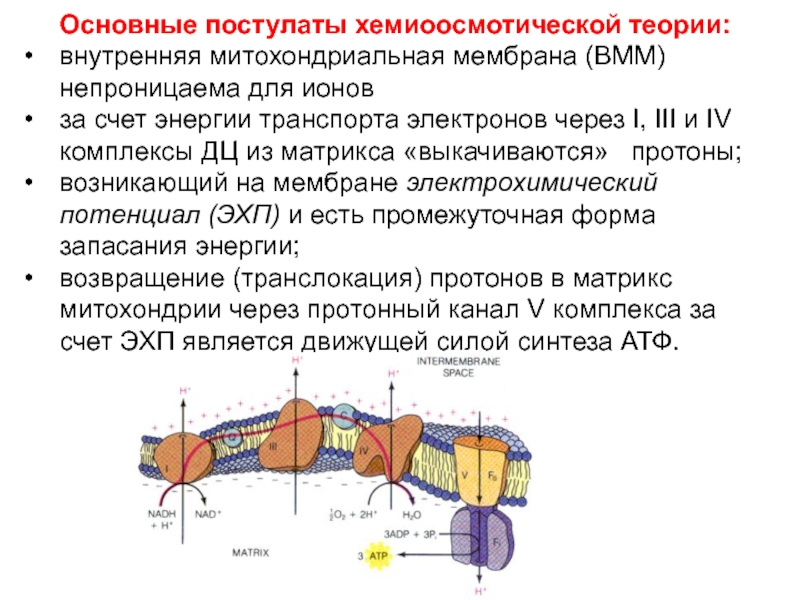
Слайд 42Основные постулаты хемиоосмотической теории:
внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов
за
счет энергии транспорта электронов через I, III и IV комплексы
ДЦ из матрикса «выкачиваются» протоны;
возникающий на мембране электрохимический потенциал (ЭХП) и есть промежуточная форма запасания энергии;
возвращение (транслокация) протонов в матрикс митохондрии через протонный канал V комплекса за счет ЭХП является движущей силой синтеза АТФ.
Слайд 43Хемиосмотическая теория П. Митчелла
(1961-1966 гг)
Дыхание и фосфорилирование связаны между
собой через электрохимический потенциал Н+ на митохондриальной мембране.
Согласно Митчеллу,
первичным событием в окислительном фосфорилировании является транслокация H+ на наружную сторону внутренней митохондриальной мембраны, осуществляемую за счет окисления в дыхательной цепи.
Процесс протекает следующим образом:
Слайд 44ДГГ НАДН2 отдает пару ē на ДГГ ФАД, что позволяет
ФАД принять пару протонов (Н+) из матрикса с образованием ФАДН2.
Пара Н+, принадлежащих НАД выталкивается на наружную поверхность внутренней митохондриальной мембраны.
ДГГ ФАДН2 выталкивает пару Н+ на наружную поверхность внутренней мембраны, а пару ē отдает на убихинон (Ух), который при этом получает способность присоединить пару Н+ из матрикса с образованием УхН2.
УхН2 выталкивает пару Н+ в межмембранное пространство, а ē переносятся через цитохромы на О2 в матриксе. В итоге создается разница потенциалов и разница рН между поверхностями внутренней мембраны.
Слайд 45Разница потенциалов и разница рН обеспечивает движение протонов через протонный
канал в матрикс. Протонный канал открывается, когда разность потенциалов превышает
0,2 В.
Движение протонов через протонный канал ведет к активации АТФ-синтетазы и синтезу АТФ из АДФ и Н3РО4.
Транспорт АТФ из матрикса в цитоплазму обеспечивается специфическим переносчиком – транслоказой. Этот фермент катализирует перенос 1 молекулы АТФ с одновременным переносом в обратном направлении одной молекулы АДФ.
Слайд 46 Таким образом, тканевое дыхание заряжает митохондриальную мембрану, а
окислительное фосфорилирование разряжает ее, используя энергию мембранного потенциала для синтеза
АТФ.
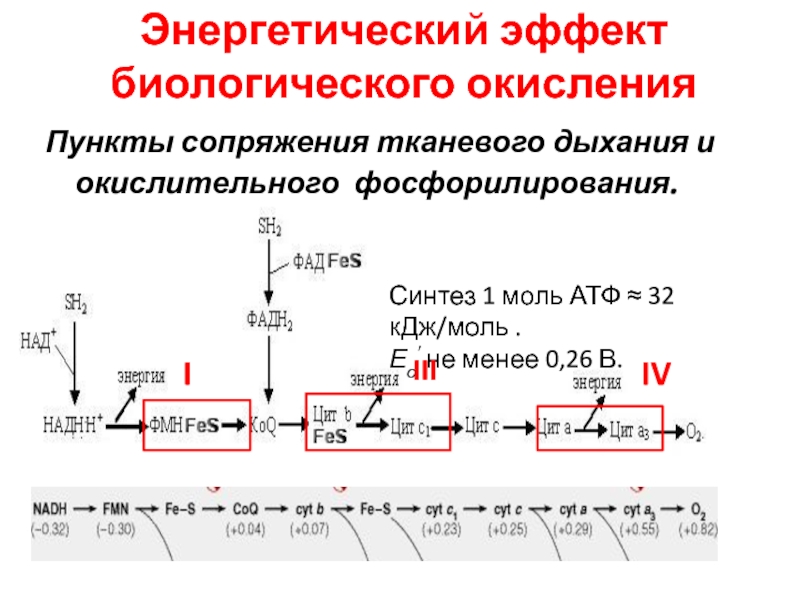
Слайд 47Энергетический эффект биологического окисления
Пункты сопряжения тканевого дыхания и окислительного фосфорилирования.
Синтез
1 моль АТФ ≈ 32 кДж/моль .
Ео не менее
0,26 В.
I
IV
III
Слайд 48Дыхательный контроль
Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки, т.
е. соотношением АТФ/АДФ.
Эффективность окислительного фосфорилирования оценивают по коэффициенту фосфорилирования
Р/О: количество молекул Ф, использованных для синтеза АТФ, в расчете на один атом поглощенного кислорода.
Р/О ≤ 3
Для НАД-зависимых S - P/O =3;
Для ФАД зависимых S - Р/О = 2
Слайд 49Синтез АТФ – окислительное фосфорилирование - представляет процесс одновременного потребления
О2, АДФ и Фн.
В пределах ДЦ этот процесс происходит
трижды на уровне I, III и IV комплексов.
Слайд 50Функции дыхательной цепи:
●Транспорт электронов на О2 – тканевое дыхание.
●Преобразование энергии
транспорта электронов в энергию макроэргических связей АТФ.
Слайд 51Синтез АТФ происходит при участии фермента-
АТФ-синтетазы
(протонная АТФаза)
Слайд 52Коэффициент фосфорилирования (Р/О)- количество молекул неорганического фосфата, которое включается в
АТФ в расчете на 1 атом кислорода
При окислении НАДН•Н+ может
быть синтезировано 3 моля АТФ, то есть коэффициент фосфорилирования (Р/О)=3
При окислении ФАДН2 может быть синтезировано 2 моля АТФ, то есть коэффициент фосфорилирования (Р/О)=2
Слайд 53Регуляция тканевого дыхания (транспорта электронов):
● Регуляция за счет концентрации О2
●Дыхательный
контроль (зависимость митохондриального окисления от концентрации АДФ)
●Регуляция за счет ингибиторов,
прерывающих поток электронов по дыхательной цепи.
Слайд 54Некоторые представители ингибиторов транспорта электронов
Слайд 55Регуляция синтеза АТФ:
● Регуляция протонного потока за счет разобщителей:
- Протонофоры
(динитрофенол, жирные кислоты, тироксин, катехоламины, термогенин)
ионофоры (валиномицин, грамицидин, ионы
Са2+),
● Регуляция за счет влияния на протонную АТФазу:
- Ингибиторы фермента (олигомицин)
- Детергенты (блокада протонного канала внутри фермента) (желчные кислоты, тритон и т.д.).
Слайд 56-субстраты цикла Кребса,
-отношение [ATP]/[ADP] (обратимость АТФ-синтетазной реакции),
-кислород (гипоксия),
-физиологические разобщители (жирные
кислоты, лизофосфолипиды, гормоны, ионы Са2+, термогенин).
Физиологические регуляторы окислительного фосфорилирования:
Слайд 57Особенности энергетического обмена у ребенка обусловлены его интенсивным ростом, биосинтетической
деятельностью, функциональной незрелостью ряда регуляторных систем и формирующейся двигательной активностью.
Наибольшие отличия энергетического обмена свойственны новорожденным.
Обмен энергии на единицу массы тела у новорожденных детей значительно (в 3 раза) выше, чем у взрослых.
2) У грудных детей значительная часть энергозатрат покрывается за счет липидов, а не углеводов, как у взрослых.
3) В течение 1-го года жизни происходит адаптация ребенка к легочному типу снабжения организма кислородом: анаэробные процессы окисления сменяются аэробными.
4) Наличие у новорожденных специфические механизмов термогенеза- «несократительный»термогенез, химическая терморегуляция (термогенин).
5) Формирование системы двигательного аппарата также нуждается в значительных энергетических затратах.
Слайд 59
Общая характеристика митохондриальных болезней
Митохондриальные болезни – это мультисистемные заболевания,
причиной или главным элементом патогенеза которых является нарушение функций митохондрий
тканей, вызванных мутациями митохондриальной или ядерной ДНК. В последние годы достигнут большой прогресс в понимании сущности этой большой группы расстройств, что привело к разработке путей их лечения, хотя в большинстве случаев эти заболевания не распознаются и не лечатся
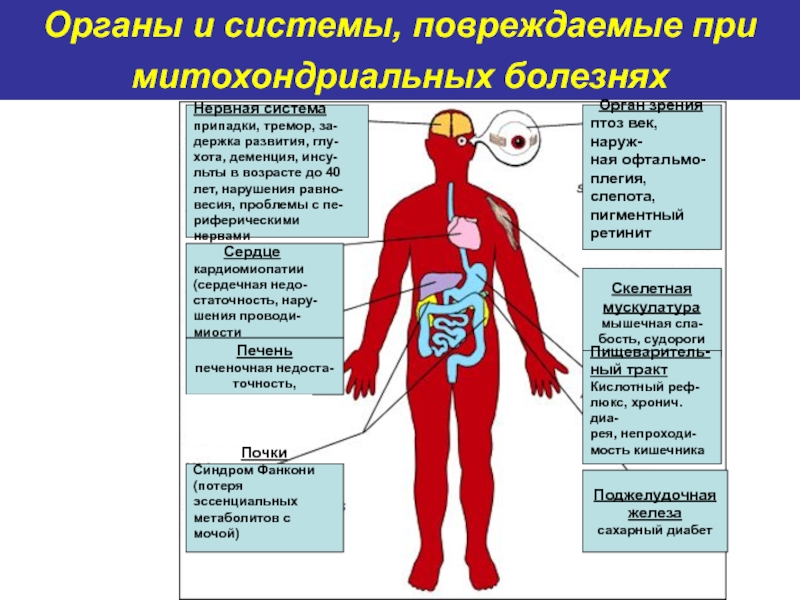
Слайд 60Органы и системы, повреждаемые при митохондриальных болезнях
Нервная система
припадки, тремор,
за-
держка развития, глу-
хота, деменция, инсу-
льты в возрасте до 40
лет,
нарушения равно-
весия, проблемы с пе-
риферическими нервами
Сердце
кардиомиопатии
(сердечная недо-
статочность, нару-
шения проводи-
миости
Печень
печеночная недоста-
точность,
Почки
Синдром Фанкони
(потеря эссенциальных
метаболитов с мочой)
Орган зрения
птоз век, наруж-
ная офтальмо-
плегия, слепота,
пигментный
ретинит
Скелетная
мускулатура
мышечная сла-
бость, судороги
Пищеваритель-
ный тракт
Кислотный реф-
люкс, хронич. диа-
рея, непроходи-
мость кишечника
Поджелудочная
железа
сахарный диабет
Слайд 61 Первичные (врожденные) митохондриальные болезни могут быть обусловлены мутациями либо
в ядерном, либо в митохондриальном геноме.
Ядерные мутации
могут искажать гены, кодирующие ферменты или структурные белки митохондрий, транслоказы, митохондриальный импорт белков, а также межгенную сигнализацию
Слайд 63Вторичные (приобретенные) митохондриопатии
1. Специфический дефицит метаболических интермедиатов или кофакторов
(тиаминпирофосфата, липоамида, флавиновых и пиридиновых нуклеотидов, пантотената, коэнзима Q, карнитина
и др.),
а также снижение активности ферментов дыхательной цепи негенетического характера;
2. Эндокринопатии (гипоталамо-гипофизарная патология, патология щитовидной железы, поджелудочной железы, надпочечников) могут служить провоцирующим фактором развития митохондриопатий;
3. Ишемия-реперфузия. Гипоксия и ингибиторы митохондриального дыхания приводят к таким же изменениям метаболизма и функции тканей, которые имеют место при первичных митохондриопатиях [36]. Наиболее чувствительными к недостаточному снабжению кислородом являются строго аэробные ткани, такие как мозг, миокард или почка;
4. Химические, лекарственные и бактериальные токсины;
5. Онкогенез;
6. Старение.
Слайд 64Разобщение тканевого дыхания и окислительного фосфорилирования -
состояние, при котором
потребление кислорода и окисление субстратов продолжаются, а синтез АТФ невозможен.
Наблюдается при наличии в клетке веществ, способных переносить протоны через внутреннюю мембрану митохондрий.
В этом случае выравнивается градиент концентрации рН, исчезает движущая сила фосфорилирования.
При этом энергия переноса протонов и электронов рассеивается в виде тепла, поэтому температура тела повышается.
Слайд 65Виды разобщения
1) физиологическое (холод, тироксин, кортикостероиды, женские половые гормоны)
2) медикаментозное
(дикумарин)
3) токсическое (динитрофенол)
Слайд 66Ингибиторы ТД и ОФ
а) ингибиторы электронного транспорта – это вещества,
которые взаимодействуют с ферментами дыхательной цепи и тем самым нарушают
перенос электронов.
Они являются клеточными токсинами, вызывают тканевую гипоксию. К ним относятся:
Барбитураты и ротенон (инсектицид) – блокируют НАД-ДГГ
Малоновая кислота – блокируют ФАД-ДГГ
Антимицин (антибиотик) – блокирует дыхательную цепь на уровне цитохром в – цитохром с.
Цианиды (ионы СN-), угарный газ (СО), сероводород (Н2S) – блокируют цитохромоксидазу и перенос электронов на кислород.
б) ингибиторы окислительного фосфорилирования
Олигомицин (антибиотик) – угнетает работу АТФ-синтазы (Fо-фрагмент).
Слайд 67Микросомальное окисление
Протекает в мембранах ЭПР (микросомах) клеток печени и коры
надпочечников.
Не дает клетке энергии
Кислород непосредственно включается в субстрат с образованием
новой гидроксильной группы в реакциях:
1) Гидроксилирования (пролина и лизина в синтезе коллагена, желчных кислот, холестерина, стероидных гормонов)
2) Обезвреживания токсичных веществ
(эндогенных ядов, лекарственных препаратов и др.).
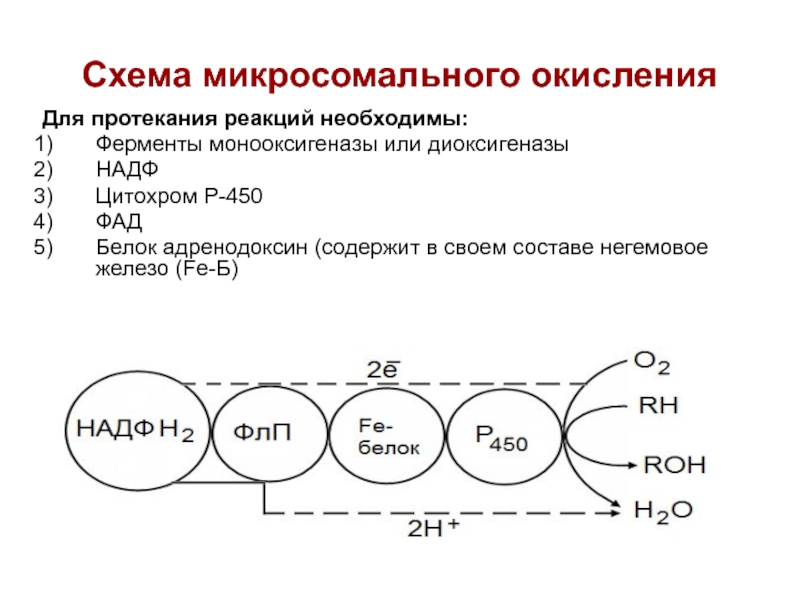
Слайд 68Схема микросомального окисления
Для протекания реакций необходимы:
Ферменты монооксигеназы или диоксигеназы
НАДФ
Цитохром Р-450
ФАД
Белок
адренодоксин (содержит в своем составе негемовое железо (Fe-Б)
Слайд 69Активные формы кислорода (АФК)
Это продукты неполного восстановления кислорода, содержащие неспаренные
электроны. АФК являются свободными радикалами.
Свободные радикалы – агрессивные молекулы, способные
атаковать другие молекулы с целью забрать недостающий электрон.
К активным формам кислорода относят:
ОН• - гидроксильный радикал;
О2- - супероксидный анион;
Н2О2 - пероксид водорода.
Полное восстановление кислорода до воды требует 4-х электронов и катализируется цитохромоксидазой.
О2 + 4 е- + 4 Н+→ 2 Н2О
Но присоединение электронов происходит поэтапно и при этом образуются АФК.
О2 + е- → O2- (супероксидный радикал)
O2 - + е- + 2H+ → H2O2
H2O2 + е- + H+ → H2O + HO• (гидроперекисный радикал)
HO• + е- + H+ → H2O
Слайд 70Вспомогательные ферменты тканевого дыхания
1) Супероксиддисмутаза (превращает супероксидные
радикалы в менее токсичную
перекись водорода);
2О2- + 2Н+ →
Н2О2 + О2
2) Каталаза
2Н2О2 → 2Н2О + О2
3) Пероксидаза
Н2О2 + RН2 → 2Н2О + R
Роль каталазы и пероксидазы – разрушение перекиси водорода.































![Дыхательная цепь: строение и функции. Окислительное фосфорилирование -субстраты цикла Кребса,-отношение [ATP]/[ADP] (обратимость АТФ-синтетазной реакции),-кислород (гипоксия),-физиологические разобщители (жирные кислоты, -субстраты цикла Кребса,-отношение [ATP]/[ADP] (обратимость АТФ-синтетазной реакции),-кислород (гипоксия),-физиологические разобщители (жирные кислоты, лизофосфолипиды, гормоны, ионы Са2+, термогенин). Физиологические](/img/thumbs/3a9afddaa35f32d321d3fde470b4454d-800x.jpg)