Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
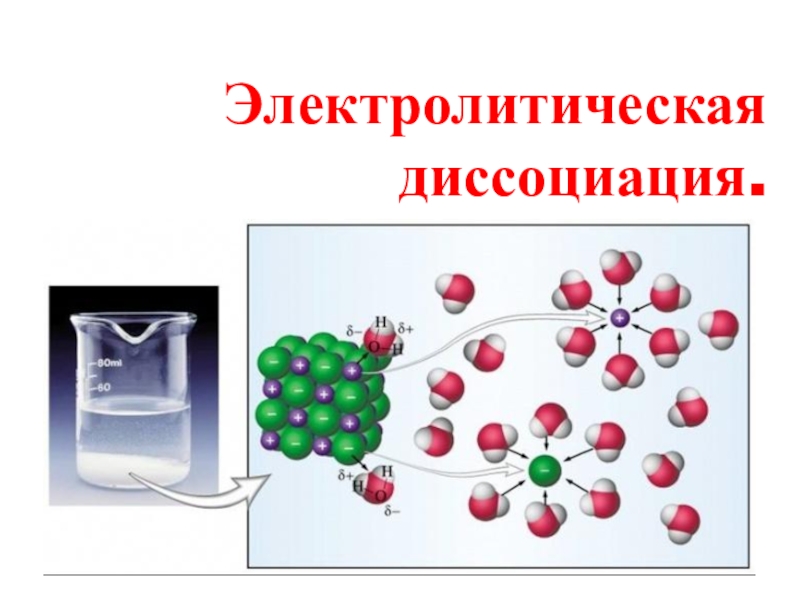
Электролитическая диссоциация
Содержание
- 1. Электролитическая диссоциация
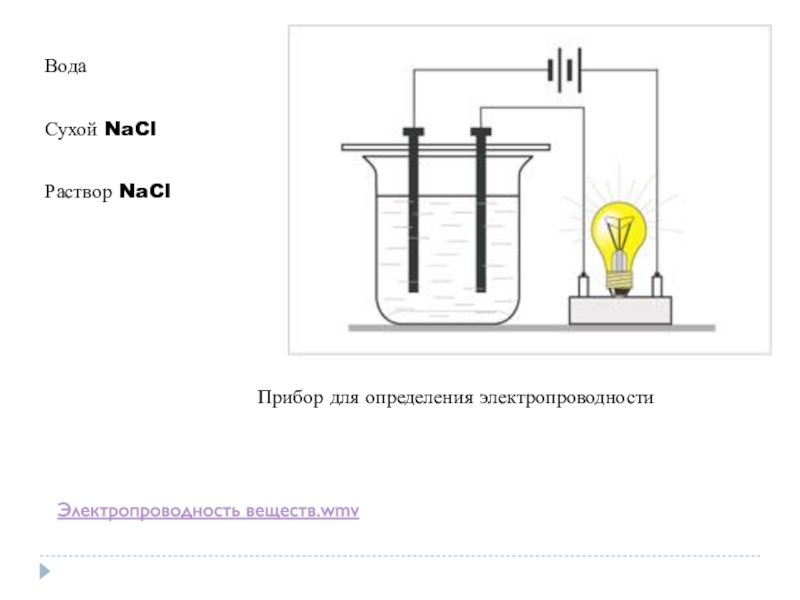
- 2. Прибор для определения электропроводностиВодаСухой NaClРаствор NaCl Электропроводность веществ.wmv
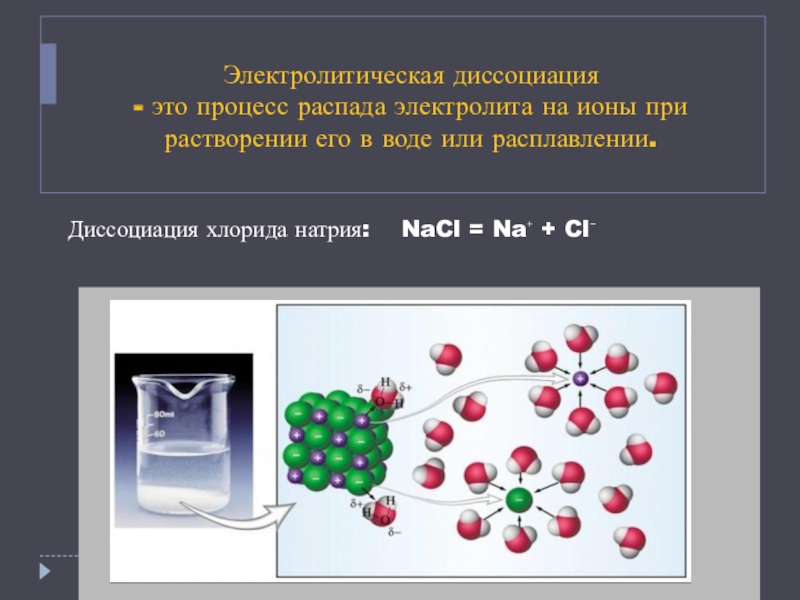
- 3. Электролитическая диссоциация - это процесс
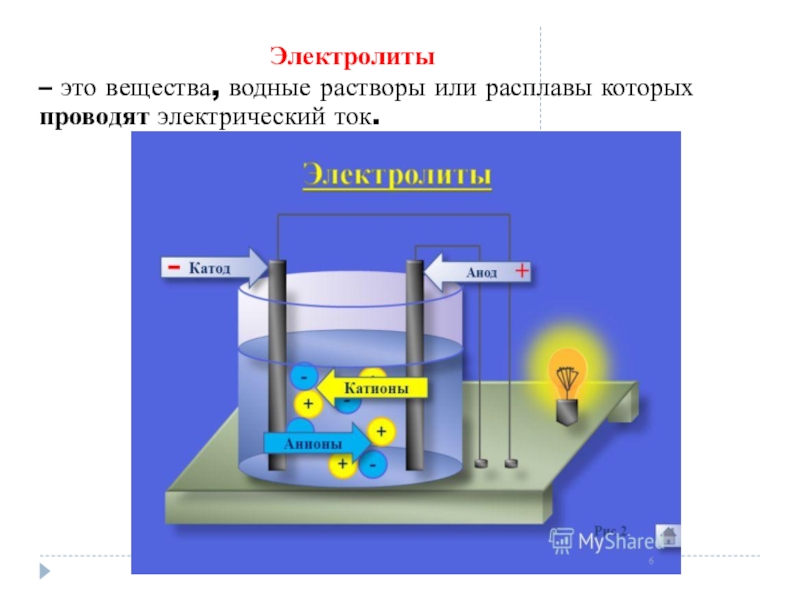
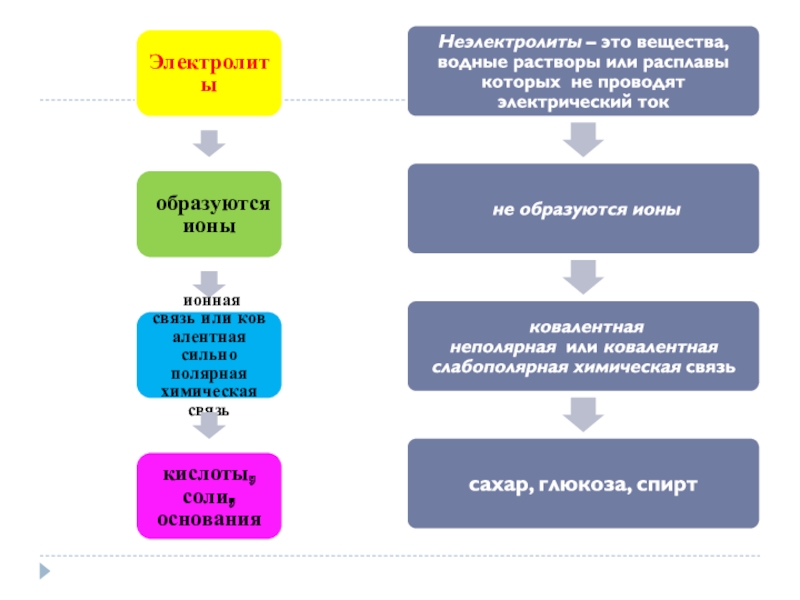
- 4. Электролиты– это вещества, водные растворы или расплавы которых проводят электрический ток.
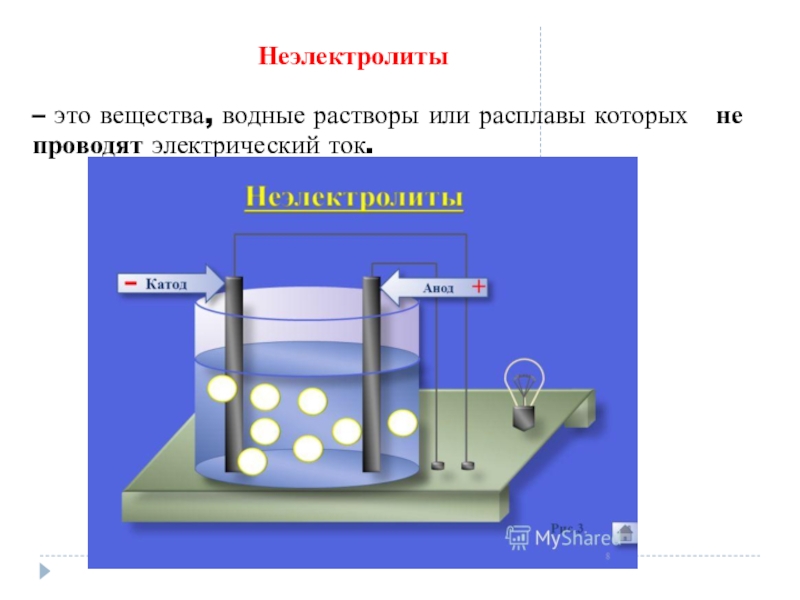
- 5. Неэлектролиты– это вещества, водные растворы или расплавы которых не проводят электрический ток.
- 6. Слайд 6
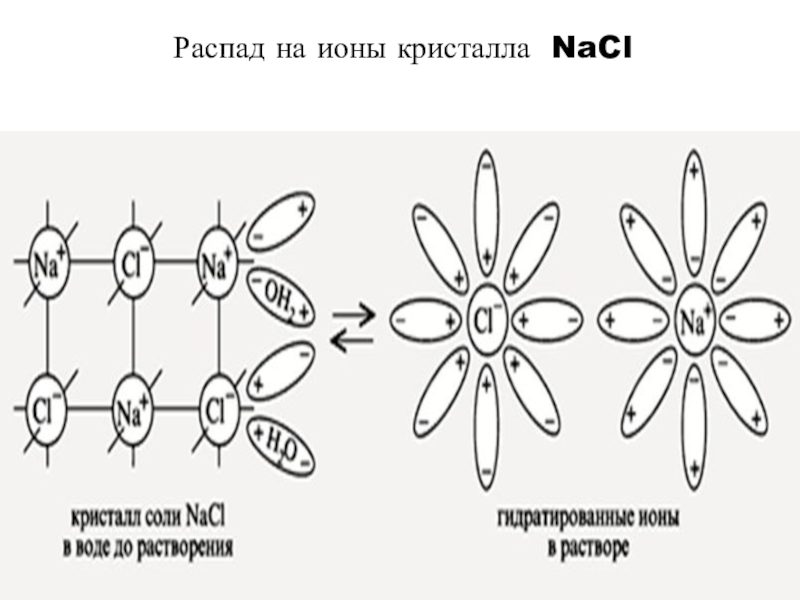
- 7. Распад на ионы кристалла NaCl
- 8. Диссоциация кислот Кислотами называются электролиты, при диссоциации которых
- 9. Диссоциация оснований (щелочей) Основаниями называются электролиты, при диссоциации
- 10. Диссоциация солей Солями называются электролиты, при диссоциации которых образуются
- 11. ЗАДАНИЕ №1. Используя таблицу растворимости солей, кислот,
- 12. Скачать презентанцию
Прибор для определения электропроводностиВодаСухой NaClРаствор NaCl Электропроводность веществ.wmv
Слайды и текст этой презентации
Слайд 2Прибор для определения электропроводности
Вода
Сухой NaCl
Раствор NaCl
Электропроводность веществ.wmv
Слайд 3 Электролитическая диссоциация - это процесс распада электролита на ионы при растворении
его в воде или расплавлении.
Na⁺ + Cl⁻Слайд 5Неэлектролиты
– это вещества, водные растворы или расплавы которых не проводят
электрический ток.
Слайд 8Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются
только катионы водорода (H+).
HCl ↔ H+ + Cl-
HNO3 ↔ H+ + NO3-
H2SO4 ↔ 2Н+ +
SО2-4 Н3РО4 ↔ 3Н+ + PОЗ-4