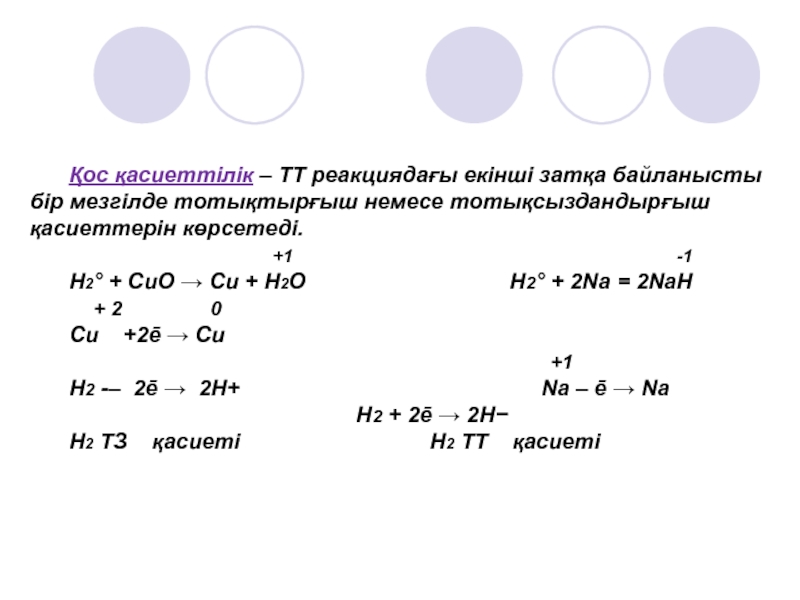
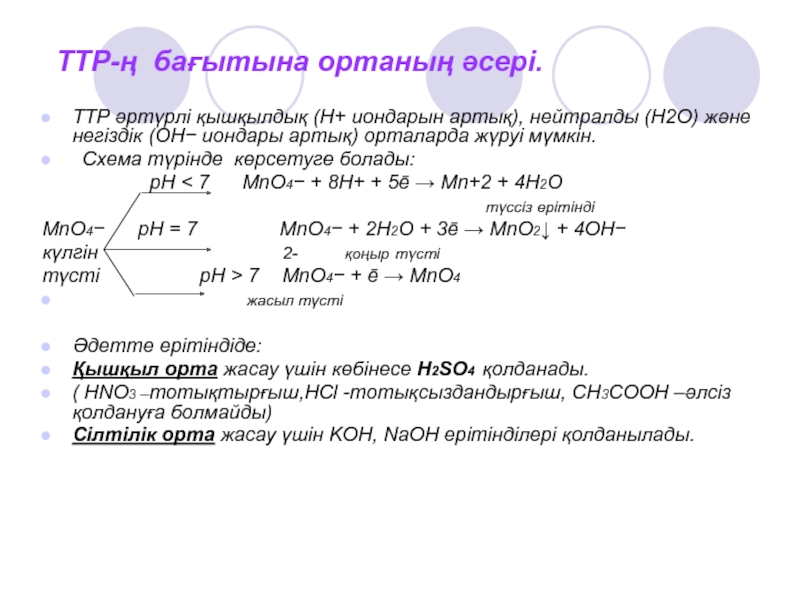
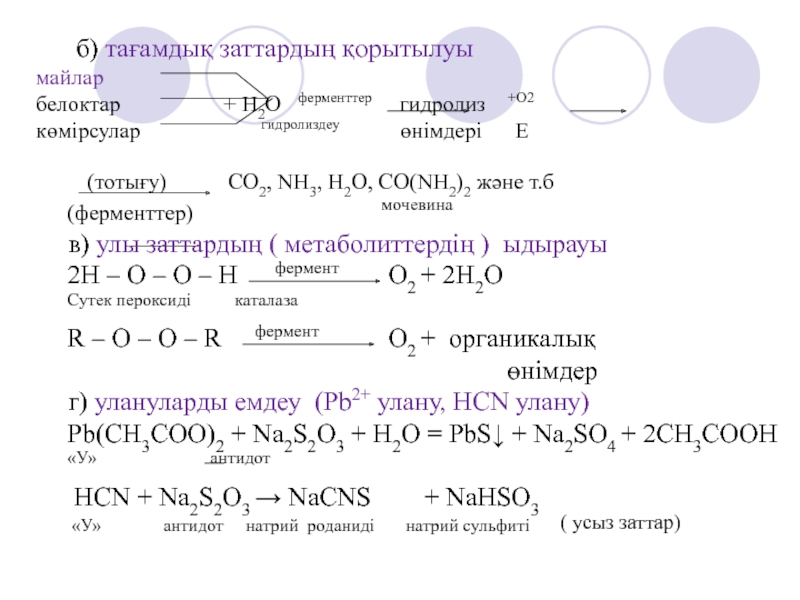
∆G < 0) анықталады.
2) ТТР бағыты электродтық потенциалдарының өзгеруімен анықталады.
Электрод
– металл мен оны батырған электролит ерітіндісінен тұратын жүйе.
Электродтық потенциал φ – металлды сол металлдың тұзының ерітіндісіне батырғанда пайда болатын потенциал.
Zn/ ZnSO4 немесе Zn/Zn+2 (жазылуы)
Жүретін процесс:
Zn – 2e → Zn+2
Электродтық потенциалдарды салыстыру үшін оларды стандартты жағдайда өлшейді.
Стандартты немесе қалыпты жағдай:
P0 = 101,3 kПa, T0 = 273 K, n = 1 моль
Стандартты электродтық потенциал φ бұл концентрациясы С(Меn+)= 1 моль/л қалыпты жағдайда өлшенген электродтық потенциал
Мысалы: φ°298(Zn/Zn+2) = -0,76 B
Стандартты электродтық потенциалдардың кернеу бар
Li/Li+ . . . Zn/Zn+2 H2/2H+ Cu/Cu+2
−3,2 −0,76 0,0 +0,34
ТЗ қасиеттері артады
ТТ қасиеттері артады