Слайд 1Шишкин А.В., АЭТУ, НГТУ
Элементы химической термодинамики
Гетерогенные равновесия
Слайд 2Шишкин А.В., АЭТУ, НГТУ
1. Основные понятия
В термодинамике рассматриваются изолированные, закрытые
и открытые системы.
Под изолированной системой понимается система, совершенно не
взаимодействующая с окружающей средой.
Системы, обменивающиеся с окружающей средой только энергией (тепло, работа, излучение), называются закрытыми.
Системы, которые обмениваются с окружающей средой и веществом, и энергией, называются открытыми.
Стационарное состояние – такое состояние системы, в котором ее параметры не зависят от времени, но в общем случае могут зависеть от пространственных координат.
Равновесное состояние системы (равновесие) – это стационарное состояние, в котором отсутствуют потоки массы и энергии.
Слайд 3Шишкин А.В., АЭТУ, НГТУ
Гомогенными называются системы, внутри которых свойства характеризуются
непрерывной зависимостью от пространственных координат.
Гетерогенными называются системы, состоящие из
гомогенных частей, на границе которых свойства характеризуются разрывами непрерывности. Гетерогенная система состоит из нескольких фаз.
Фаза – совокупность гомогенных, ограниченных поверхностями раздела, частей системы, термодинамические свойства которых одинаково определяются параметрами состояния (параметрами системы, не зависящими от пути перехода системы из одного состояния в другое). Фазы могут принадлежать к разным или одинаковым агрегатным состояниям вещества.
Компонент – такая пространственно распределенная составляющая системы, содержание которой не зависит от содержания других составляющих. Компонент в системе может существовать в различных формах: в виде атома или иона, входить в состав молекулы или радикала и др.
Слайд 4Шишкин А.В., АЭТУ, НГТУ
2. Термодинамические потенциалы
Внутренняя энергия:
dU (S, V, ni)
= TdS – pdV + idni (i = 1 …
k).
Энтальпия:
H(S, p, ni) = U + pV; dH = TdS + Vdp + idni (i = 1 … k).
Энергия Гельмгольца:
F(T, V, ni) = U – TS; dF = – SdT – pdV + idni (i = 1 … k).
Энергия Гиббса:
G(T, p, ni) = U – TS + pV = H – TS;
dG = – SdT + Vdp + idni (i = 1 … k).
Химический потенциал: i (U /ni)S,V,nji – определяет перераспределение числа молей компонента в системе.
Слайд 5Шишкин А.В., АЭТУ, НГТУ
3. Принцип равновесия Гиббса
Изолированная система находится в
состоянии равновесия, если ее энтропия при всех возможных изменениях, совместимых
с условиями изоляции, остается постоянной или уменьшается:
(δS)U,V,nj 0 или (U)S,V,nj 0.
Слайд 6Шишкин А.В., АЭТУ, НГТУ
4. Состояния равновесия
Стабильное (устойчивое) состояние равновесия. Состояние
системы называется стабильным, если оно устойчиво относительно воздействий конечной величины:
(S)U,V,nj 0 или (U)S,V,nj 0.
Метастабильное состояние равновесия. Состояние равновесия называется метастабильным, если оно устойчиво относительно воздействий бесконечно малой величины: (dS)U,V,nj 0 или (dU)S,V,nj 0.
Нейтральное состояние равновесия. Состояние равновесия называется нейтральным, если возможны изменения состояния, при которых энтропия и внутренняя энергия системы не изменяются с точностью до второго порядка малости: (S)U,V,nj = 0 или (U)S,V,nj = 0.
Лабильное (абсолютно неустойчивое) состояние равновесия. Состояние системы называется лабильным, если любые воздействия, в том числе бесконечно малой величины, приводят к возрастанию энтропии (уменьшению внутренней энергии): (S)U,V,nj > 0 или
(U)S,V,nj > 0.
Слайд 7Шишкин А.В., АЭТУ, НГТУ
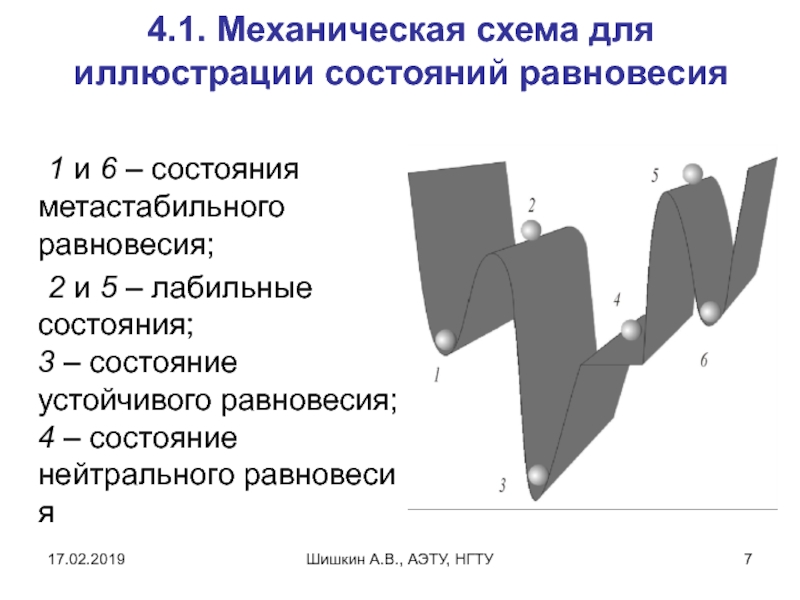
4.1. Механическая схема для иллюстрации состояний равновесия
1
и 6 – состояния метастабильного равновесия;
2 и 5 – лабильные состояния;
3 – состояние устойчивого равновесия;
4 – состояние нейтрального равновесия
Слайд 8Шишкин А.В., АЭТУ, НГТУ
5. Гетерогенные равновесия
Равновесие всегда устанавливается между чем-то.
Равновесие, устанавливающееся в системе в результате перераспределения компонентов и энергии
между фазами, называется фазовым, т. е. в равновесии находятся фазы.
Равновесие, устанавливающееся в системе в результате протекания химических реакций, называется химическим,
т.е. в равновесии находятся химические вещества.
Образование нового вещества в результате химической реакции может приводить к образованию новой фазы и необходимости установления фазового равновесия.
Объединение условий фазового и химического равновесий называется условиями гетерогенного равновесия.
Слайд 9Шишкин А.В., АЭТУ, НГТУ
5.1. Условия фазового равновесия
Для j-фазной k-компонентной системы
нахождение условного минимума внутренней энергии приводит к выражениям:
термического равновесия T(i)
= T(j),
механического равновесия p(i) = p(j),
диффузионного равновесия l(i) = l(j),
(i, j = 1, …, ; l = 1, …, k).
Слайд 10Шишкин А.В., АЭТУ, НГТУ
6. Твердые растворы
Раствор – многокомпонентная гомогенная система, состав
которой в определенных пределах может меняться без выделения новой фазы.
Кристаллические фазы принято делить на два основных вида: твердые растворы и промежуточные фазы.
Твердые растворы – многокомпонентные кристаллические фазы, при образовании которых сохраняется кристаллическая решетка одного из компонентов – растворителя. Твердые растворы – кристаллические фазы переменного состава.
Атомы растворенного элемента размещаются в узлах кристаллической решетки растворителя, образуя твердый раствор замещения, или занимают пустоты (поры) междоузельного пространства, образуя твердый раствор внедрения. Внедрение чужеродного атома в кристаллическую решетку чистого вещества приводит к ее искажению.
Слайд 11Шишкин А.В., АЭТУ, НГТУ
Если растворимость в твердом состоянии ограничена и
область твердого раствора прилегает к одному из чистых элементов, то
такой твердый раствор называется первичным (или граничным) и имеет, соответственно, структуру этого чистого элемента. На основе химических соединений также образуются твердые растворы.
Твердые растворы внедрения возникают обычно при сплавлении переходных металлов с неметаллами, имеющими малый атомный радиус: H, N, C, B. Искажения кристаллической решетки при образовании раствора внедрения больше, чем при образовании раствора замещения.
Слайд 12Шишкин А.В., АЭТУ, НГТУ
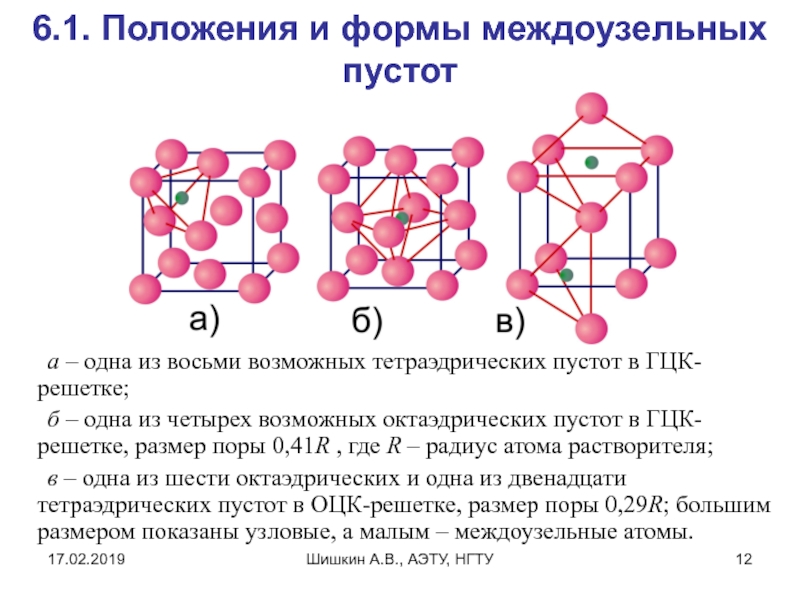
6.1. Положения и формы междоузельных пустот
а –
одна из восьми возможных тетраэдрических пустот в ГЦК-решетке;
б –
одна из четырех возможных октаэдрических пустот в ГЦК-решетке, размер поры 0,41R , где R – радиус атома растворителя;
в – одна из шести октаэдрических и одна из двенадцати тетраэдрических пустот в ОЦК-решетке, размер поры 0,29R; большим размером показаны узловые, а малым – междоузельные атомы.
Слайд 13Шишкин А.В., АЭТУ, НГТУ
6.2. Размерный фактор
Атому с малым радиусом легче
внедриться в кристаллическую решетку более крупных атомов, чем наоборот. Поэтому
при образовании твердых растворов существенное значение имеют размеры (объемы, радиусы) атомов, межатомные расстояния в кристаллической решетке растворителя, виды и размеры пустот в ней.
В растворах замещения растворимость ограничивается, если атомные радиусы отличаются более чем на 1415 %. Это условие называется размерным фактором.
Если отношение радиусов неметалла и металла Rнм / Rм < 0,59 , то образуются фазы внедрения, когда атомы неметалла располагаются в порах кристаллической решетки, образуемой металлом.
Неограниченная растворимость при образовании твердых растворов замещения возможна при соблюдении размерного фактора и одинаковом типе кристаллических решеток элементов. Неограниченная растворимость наблюдается в сплавах Cu-Au, Cu-Ni, Si-Ge. В этих системах образуется непрерывный ряд твердых растворов.
Слайд 14Шишкин А.В., АЭТУ, НГТУ
6.3. Упорядочение в твердых растворах
Твердые растворы замещения
могут быть упорядоченными или неупорядоченными. В упорядоченной фазе атомные позиции
становятся неэквивалентными для заполнения атомами разного сорта: кристаллическая решетка неупорядоченной фазы распадается на несколько подрешеток.
Фазовый переход порядок – беспорядок происходит с повышением температуры. При более высокой температуре устойчива неупорядоченная фаза.
Упорядоченные области в кристалле называются антифазными доменами (АФД), а границы между ними – антифазными границами (АФГ).
Для упорядоченных растворов используется также термин сверхструктура.
Слайд 15Шишкин А.В., АЭТУ, НГТУ
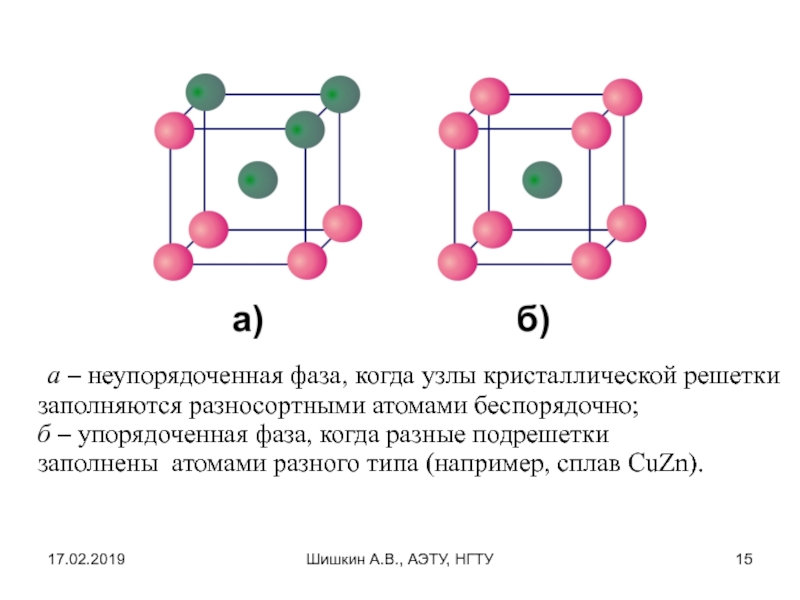
а – неупорядоченная фаза, когда узлы кристаллической
решетки заполняются разносортными атомами беспорядочно;
б – упорядоченная фаза, когда разные
подрешетки заполнены атомами разного типа (например, сплав CuZn).
Слайд 16Шишкин А.В., АЭТУ, НГТУ
7. Промежуточные фазы
Промежуточные фазы – многокомпонентные кристаллические фазы,
при образовании которых возникает кристаллическая решетка, отличающаяся от кристаллических решеток
исходных компонентов.
Такие фазы имеют место при образовании химических соединений, например, интерметаллических (интерметаллидов) – соединений разных металлов.
Большое число химических соединений, образующихся в металлических сплавах, не подчиняется законам валентности и не имеет постоянного стехиометрического состава. Они образуют различного рода промежуточные фазы.
На основе химического соединения могут возникать твердые растворы, обусловленные дефектами структуры. Появление стабильных промежуточных соединений приводит к сужению области первичных твердых растворов.