Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФармФ Органическая химия АЛКАНЫ ЦИКЛОАЛКАНЫ Лекция 6
Содержание
- 1. ФармФ Органическая химия АЛКАНЫ ЦИКЛОАЛКАНЫ Лекция 6
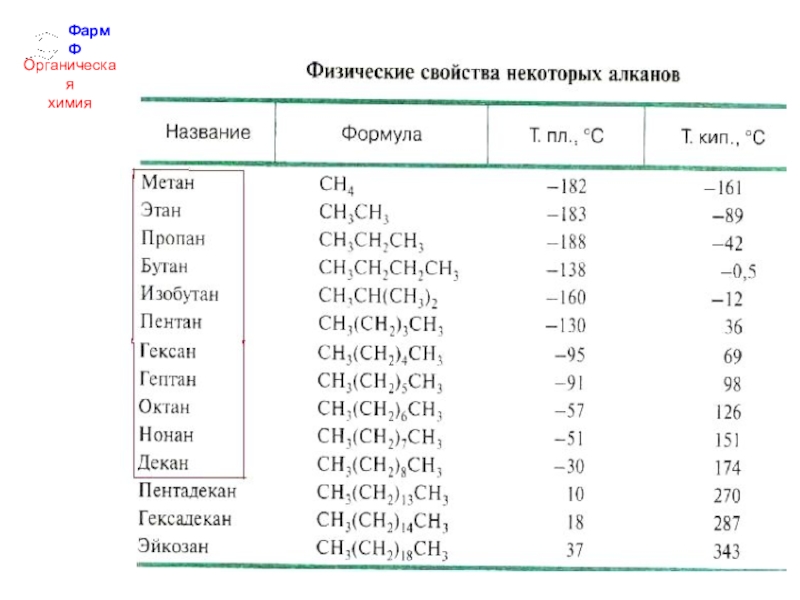
- 2. ФармФОрганическаяхимияАЛКАНЫОбщая формула гомологического ряда алканов:CnH2n+2 Алканы – это предельные углеводороды, не содержащие кратных связей.
- 3. ФармФОрганическаяхимия
- 4. ФармФОрганическаяхимияСпособы получения алканов Источники промышленного получения
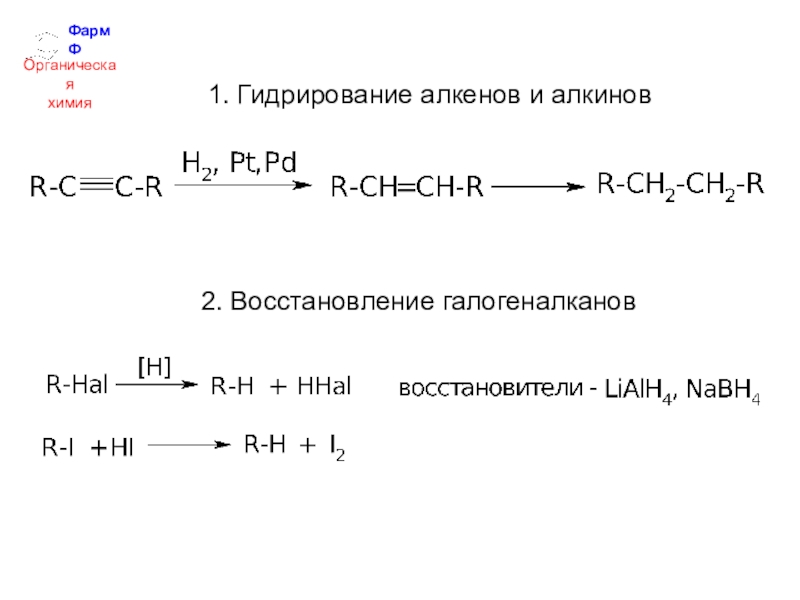
- 5. ФармФОрганическаяхимия1. Гидрирование алкенов и алкинов2. Восстановление галогеналканов
- 6. ФармФОрганическаяхимия3. Реакция Дюма4. Реакция Вюрца5. Реакция Кольбе
- 7. ФармФОрганическаяхимияМЕХАНИЗМ РЕАКЦИИИ АКТИВНЫЕ ЧАСТИЦЫ Химическая реакция
- 8. ФармФОрганическаяхимия Активные частицы – это частицы,
- 9. ФармФОрганическаяхимия Электрофил – это электронодефицитная частица,
- 10. ФармФОрганическаяхимия Нуклеофил– это электроноизбыточная частица, она
- 11. ФармФОрганическаяхимия3. РадикалыРадикалы на негибридизованной р-орбитали имеют один
- 12. ФармФОрганическаяхимия Активные частицы образуются в результате
- 13. ФармФОрганическаяхимияПолярные связи разрываются гетеролитически, и образуются нуклеофил и электрофил.
- 14. ФармФОрганическаяхимияХимические свойства алканов Алканы – наиболее
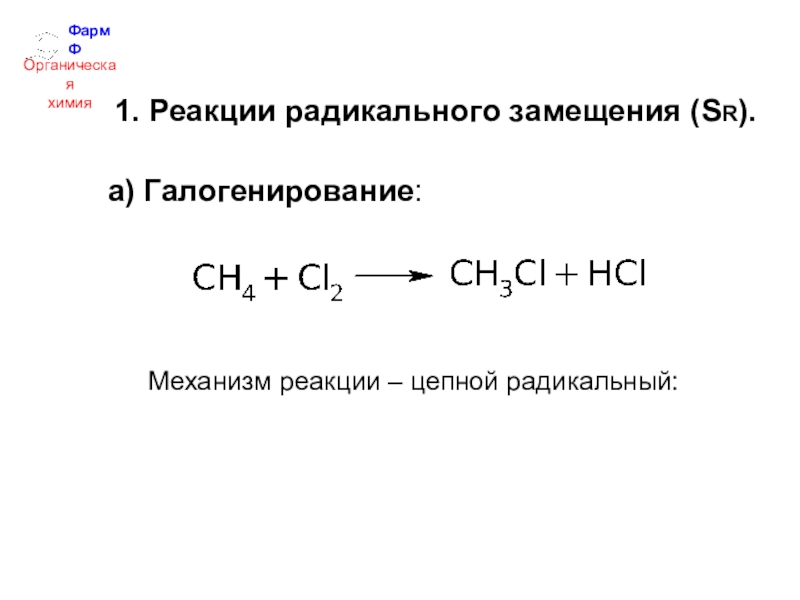
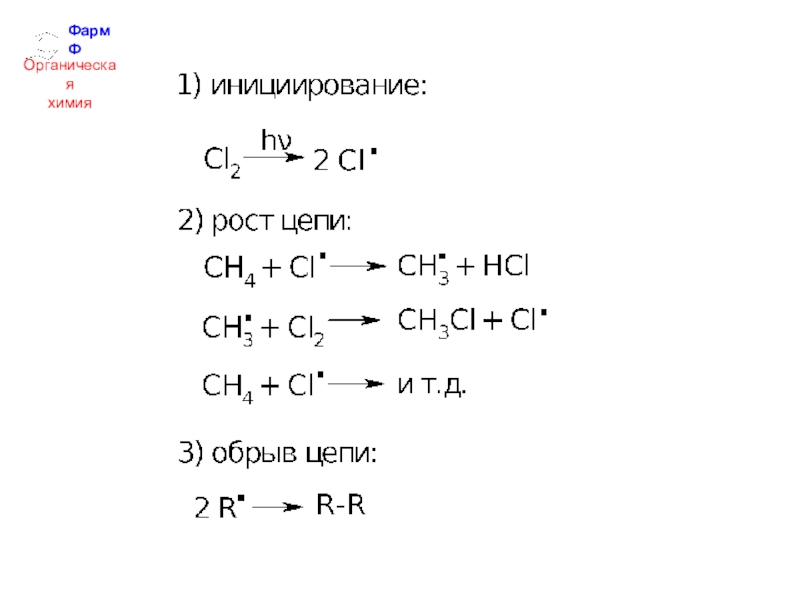
- 15. ФармФОрганическаяхимия1. Реакции радикального замещения (SR).а) Галогенирование:Mеханизм реакции – цепной радикальный:
- 16. ФармФОрганическаяхимия
- 17. ФармФОрганическаяхимия Скорость реакции у первичного, вторичного
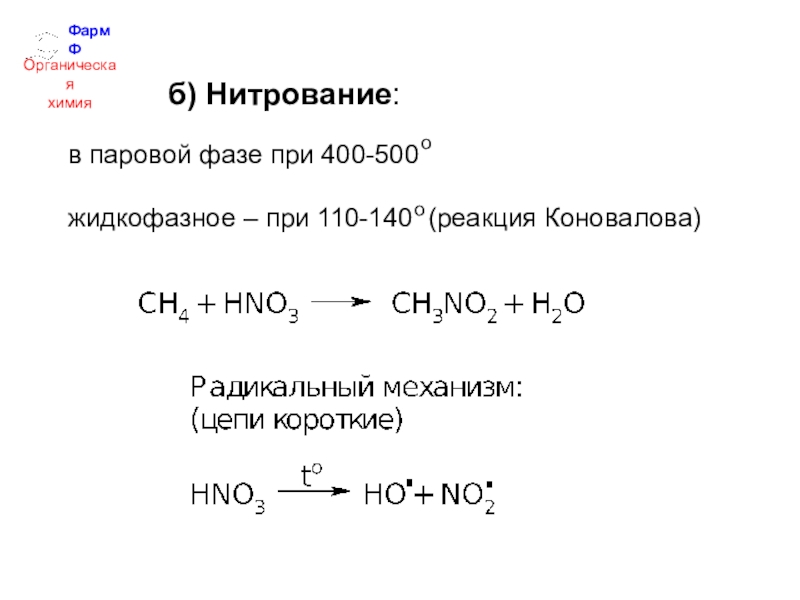
- 18. ФармФОрганическаяхимияб) Нитрование:в паровой фазе при 400-500 жидкофазное – при 110-140 (реакция Коновалова)оо
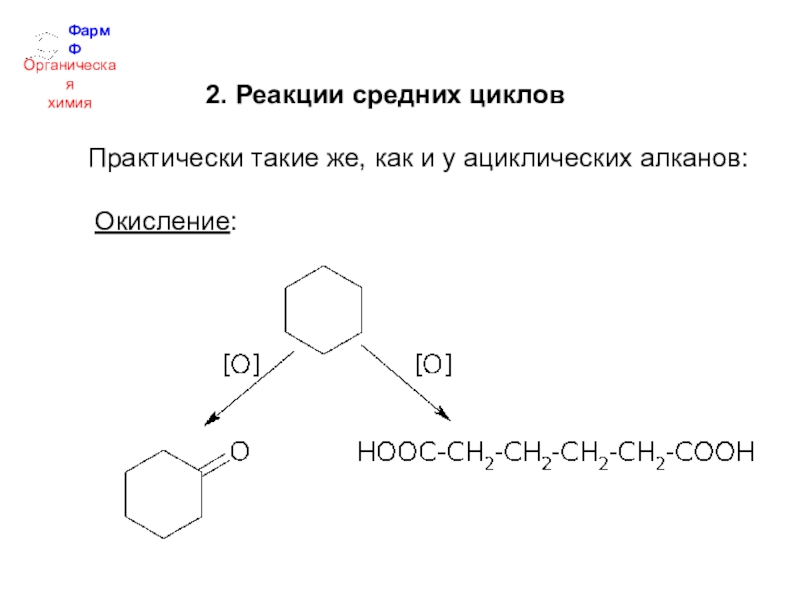
- 19. ФармФОрганическаяхимия2. Окисление Алканы – одни из
- 20. ФармФОрганическаяхимия Регулируемое окисление кислородом при 200
- 21. ФармФОрганическаяхимия3.Термическое расщепление:
- 22. ФармФОрганическаяхимия4. Крекинг:Крекинг очень широко применяется при переработке
- 23. ФармФОрганическаяхимияЦИКЛОАЛКАНЫ Циклоалканы – это предельные углеводороды
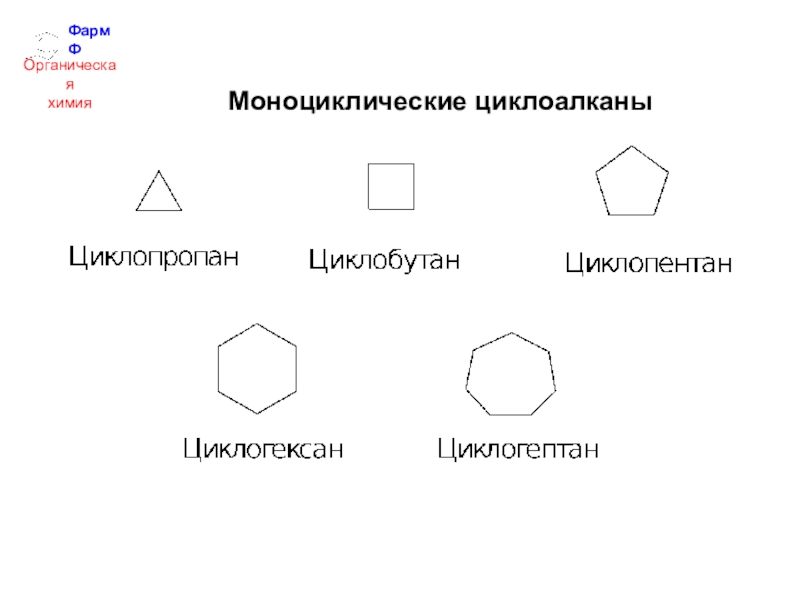
- 24. ФармФОрганическаяхимияМоноциклические циклоалканы
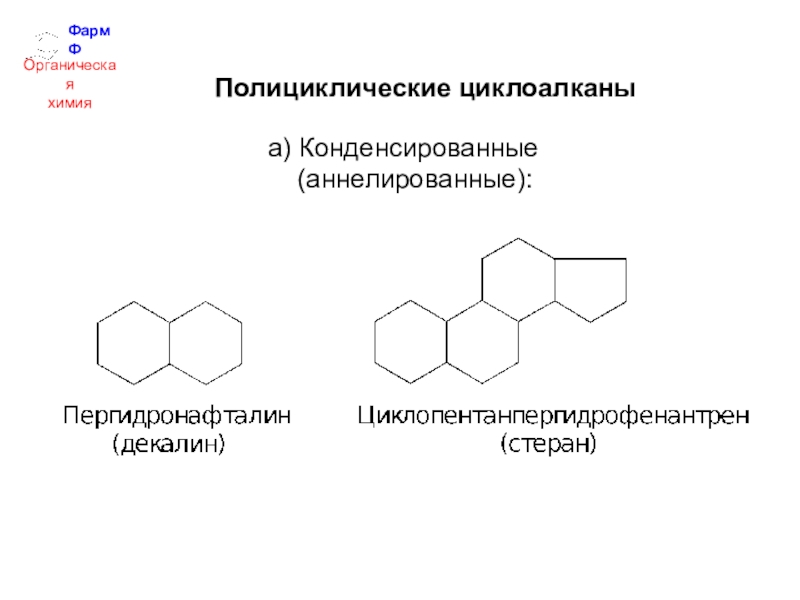
- 25. ФармФОрганическаяхимияПолициклические циклоалканы а) Конденсированные (аннелированные):
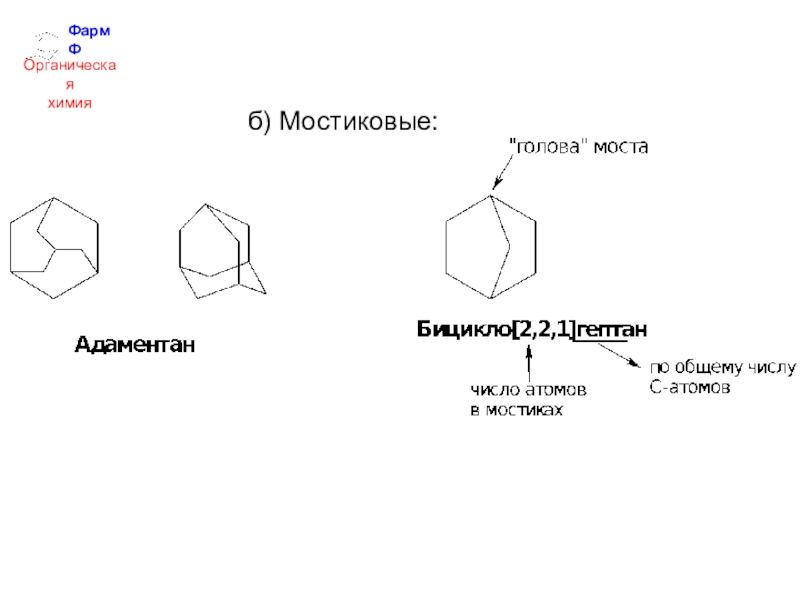
- 26. ФармФОрганическаяхимияб) Мостиковые:
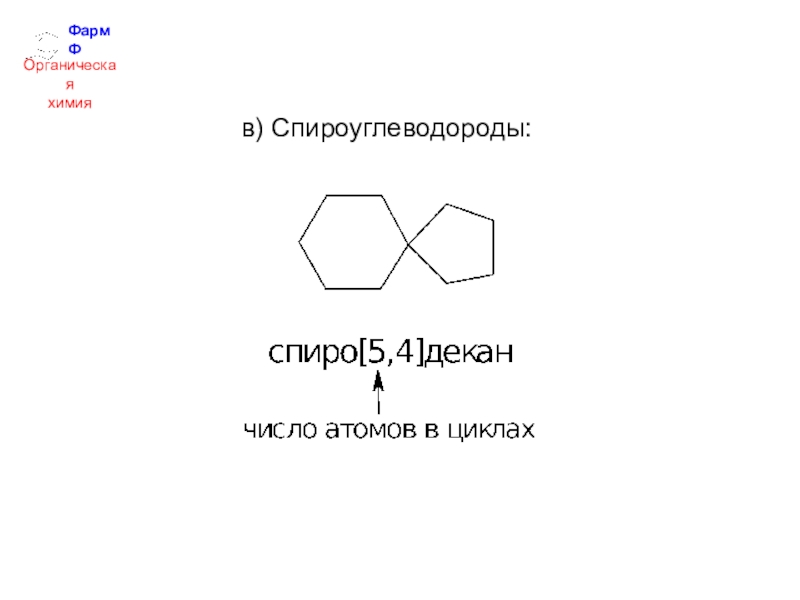
- 27. ФармФОрганическаяхимияв) Спироуглеводороды:
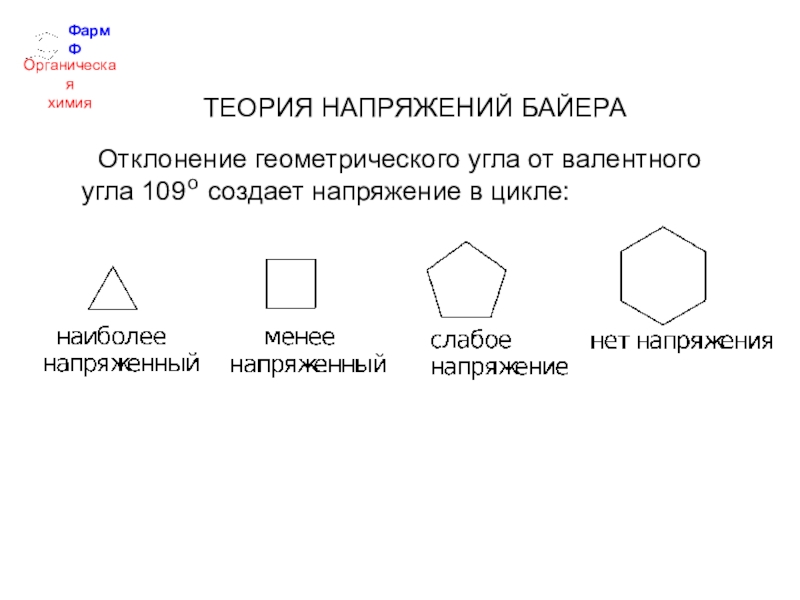
- 28. ФармФОрганическаяхимияТЕОРИЯ НАПРЯЖЕНИЙ БАЙЕРА Отклонение геометрического угла от валентного угла 109 создает напряжение в цикле:о
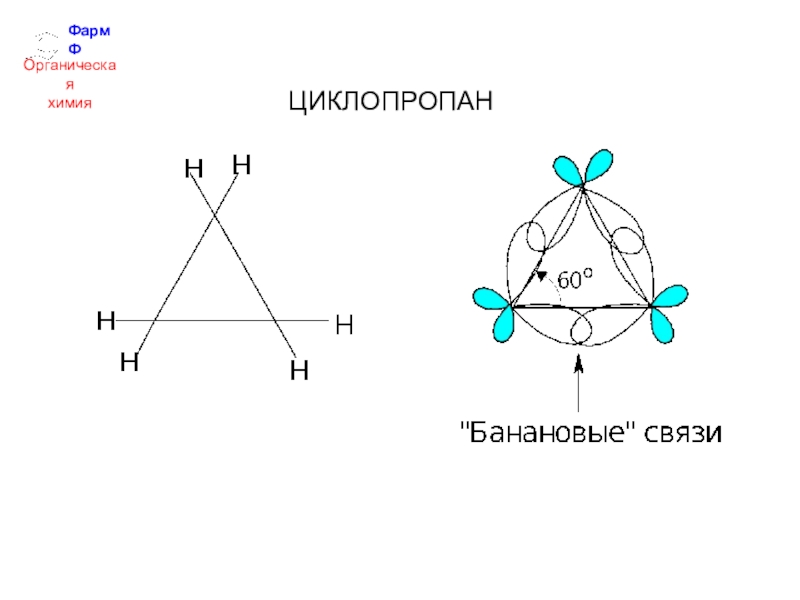
- 29. ФармФОрганическаяхимияЦИКЛОПРОПАН
- 30. ФармФОрганическаяхимия "Банановые" связи промежуточные по своему
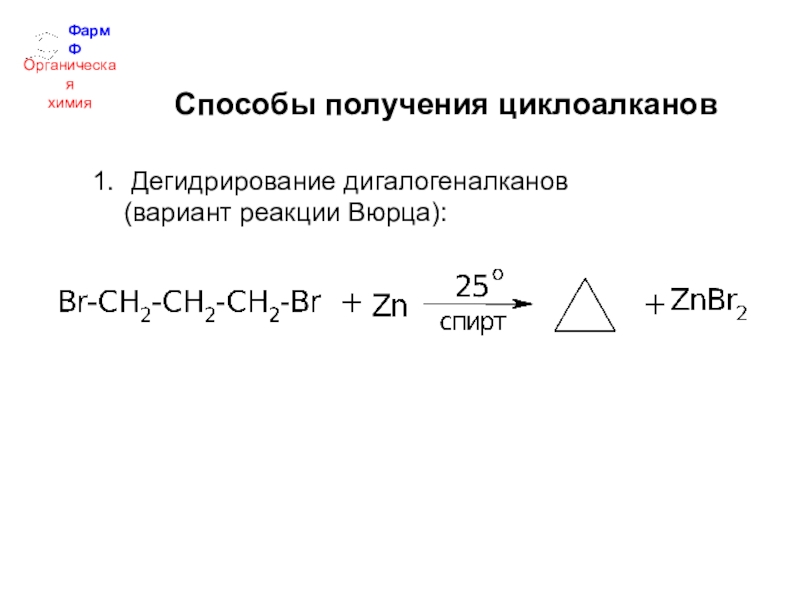
- 31. ФармФОрганическаяхимияСпособы получения циклоалкановДегидрирование дигалогеналканов (вариант реакции Вюрца):
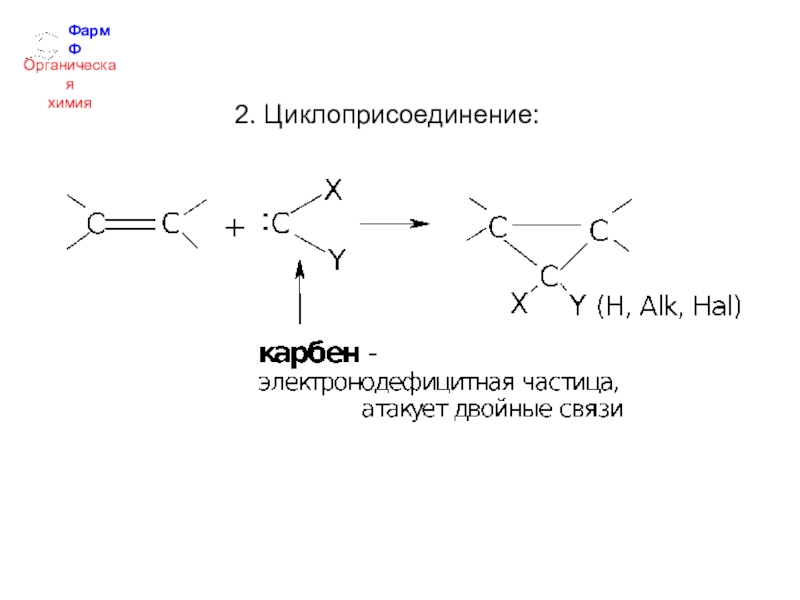
- 32. ФармФОрганическаяхимия2. Циклоприсоединение:
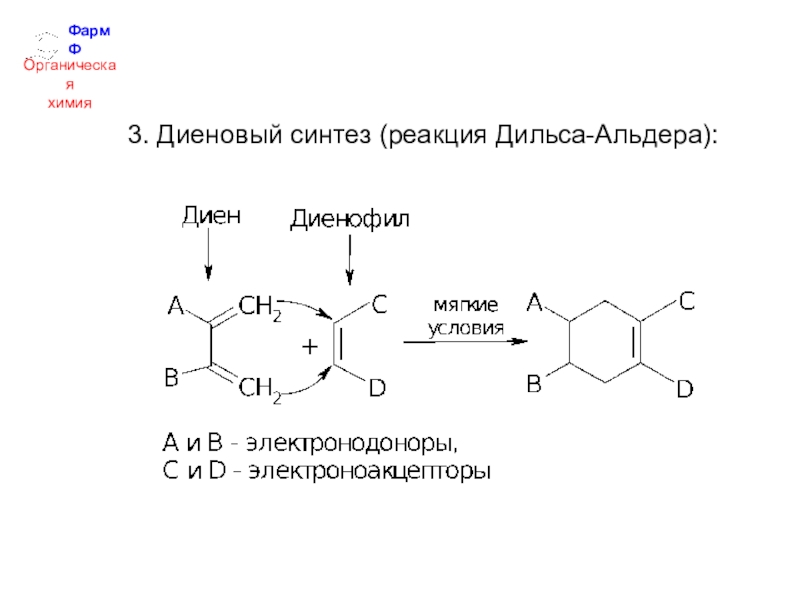
- 33. ФармФОрганическаяхимия3. Диеновый синтез (реакция Дильса-Альдера):
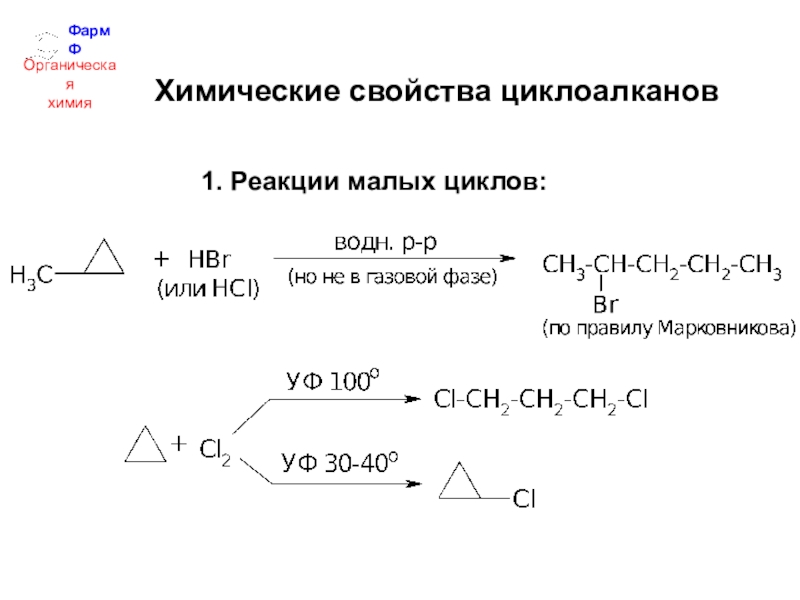
- 34. ФармФОрганическаяхимияХимические свойства циклоалканов1. Реакции малых циклов:
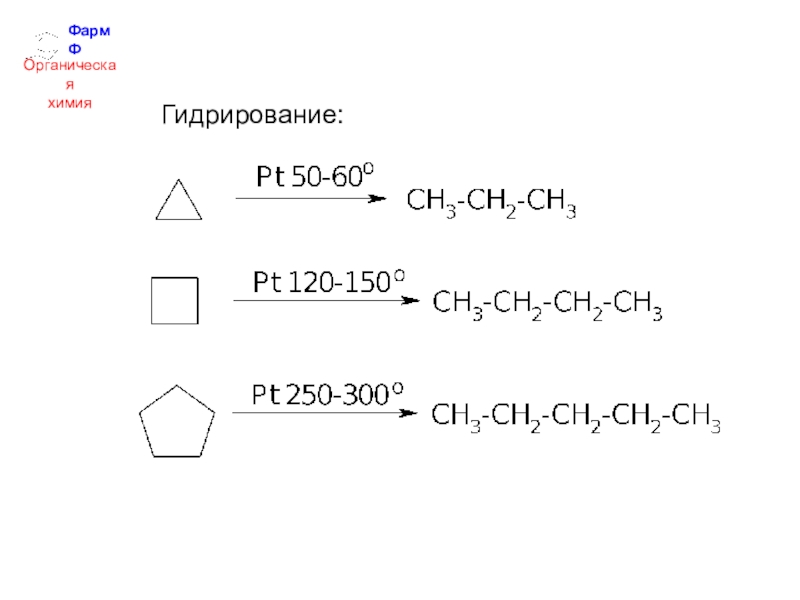
- 35. ФармФОрганическаяхимияГидрирование:
- 36. ФармФОрганическаяхимия
- 37. ФармФОрганическаяхимияОтдельные представители циклоалканов – см. учебник.ЛИТЕРАТУРА:
- 38. Скачать презентанцию
ФармФОрганическаяхимияАЛКАНЫОбщая формула гомологического ряда алканов:CnH2n+2 Алканы – это предельные углеводороды, не содержащие кратных связей.
Слайды и текст этой презентации
Слайд 2
ФармФ
Органическая
химия
АЛКАНЫ
Общая формула гомологического ряда алканов:
CnH2n+2
Алканы – это предельные углеводороды,
Слайд 4
ФармФ
Органическая
химия
Способы получения алканов
Источники промышленного получения алканов – природный
газ, нефть.
Синтетические способы -применяются, в основном, в лабораторных условиях для
получения сложных алкановСлайд 7
ФармФ
Органическая
химия
МЕХАНИЗМ РЕАКЦИИ
И АКТИВНЫЕ ЧАСТИЦЫ
Химическая реакция – это,
как правило, многостадийный процесс. Она начинается с разрыва связей в
исходных соединениях, после чего образуются новые связи и новые соединения. В ходе реакции образуются неустойчивые промежуточные частицы. Последовательность всех этих стадий называется механизмом реакции.Слайд 8
ФармФ
Органическая
химия
Активные частицы – это частицы, обладающие высокой внутренней
энергией и высокой химической активностью, они инициируют реакцию.
ТИПЫ АКТИВНЫХ ЧАСТИЦ
1.
Электрофилы2. Нуклеофилы
3. Радикалы
Слайд 9
ФармФ
Органическая
химия
Электрофил – это электронодефицитная частица, она атакует в
места с повышенной электронной плотностью.
1.Электрофилы
Общим в электронной структуре электрофилов является
то, что они имеют негибридизованную р-орбиталь, на которой нет электронов (вакантная орбиталь):
Слайд 10
ФармФ
Органическая
химия
Нуклеофил– это электроноизбыточная частица, она атакует в места
с пониженной электронной плотностью.
2. Нуклеофилы
Общее в электронной структуре нуклеофилов -
этор-орбиталь, несущая пару электронов с противо-положными спинами (неподеленная пара электронов):
Слайд 11
ФармФ
Органическая
химия
3. Радикалы
Радикалы на негибридизованной р-орбитали имеют один электрон с некомпенсированным
спином (неспаренный электрон):
Наличие неспаренного электрона повышает внутреннюю
энергию радикалов и придает им высокую химическую активность. Радикалы атакуют и разрывают преимущественно малополярные связи.
Слайд 12
ФармФ
Органическая
химия
Активные частицы образуются в результате разрыва химической связи.
Малополярные связи разрываются гомолитически, и образуются два радикала.
Слайд 13
ФармФ
Органическая
химия
Полярные связи разрываются гетеролитически, и образуются нуклеофил и электрофил.
Слайд 14
ФармФ
Органическая
химия
Химические свойства алканов
Алканы – наиболее инертные в
химическом отношении вещества. Связи С-С и С-Н малополярны и устойчивы
к атаке электрофилов и нуклеофилов, они разрываются под действием радикалов.Для алканов характерны радикальные реакции.
Слайд 15
ФармФ
Органическая
химия
1. Реакции радикального замещения (SR).
а) Галогенирование:
Mеханизм реакции – цепной радикальный:
Слайд 17
ФармФ
Органическая
химия
Скорость реакции у первичного, вторичного и третичного углеродов
различна:
она увеличивается в ряду: С(1) < С(2) < С(3).
В этом отношении хлорирование мало избира-тельно, бромирование гораздо более избирательно из-за меньшей активности радикала Br.Слайд 18
ФармФ
Органическая
химия
б) Нитрование:
в паровой фазе при 400-500
жидкофазное – при
110-140 (реакция Коновалова)
о
о
Слайд 19
ФармФ
Органическая
химия
2. Окисление
Алканы – одни из самых трудно окисляемых
веществ. При комнатной температуре на них не действуют даже сильные
окислители.При горении алканы превращаются в СО2 и Н2О.
Слайд 20
ФармФ
Органическая
химия
Регулируемое окисление кислородом при 200 и
90 атм.
протекает в жидкой фазе с расщеплением
С-С-связей и образованием смеси
карбоновых кислот.Например, промышленный способ получения уксусной кислоты:
о
Слайд 22
ФармФ
Органическая
химия
4. Крекинг:
Крекинг очень широко применяется при переработке нефти для получения
высокооктанового бензина.
Отдельные представители алканов – см. учебник.
Слайд 23
ФармФ
Органическая
химия
ЦИКЛОАЛКАНЫ
Циклоалканы – это предельные углеводороды с замкнутой цепью.
Циклоалканы
различаются:
- по величине цикла,
- по количеству
циклов,- по способу соединения циклов.