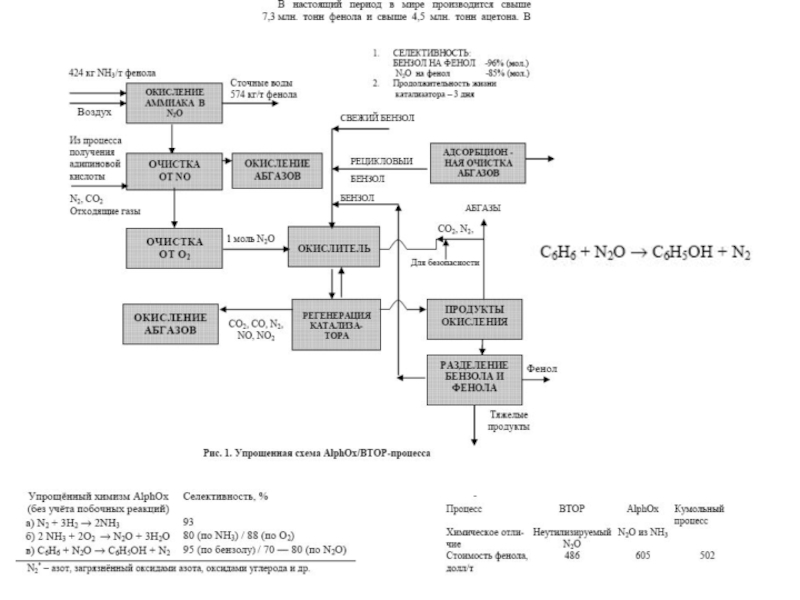
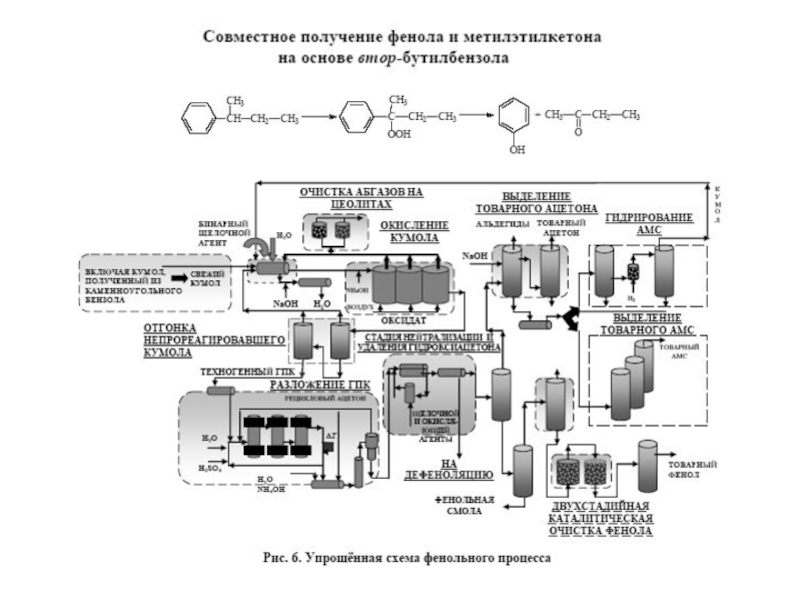
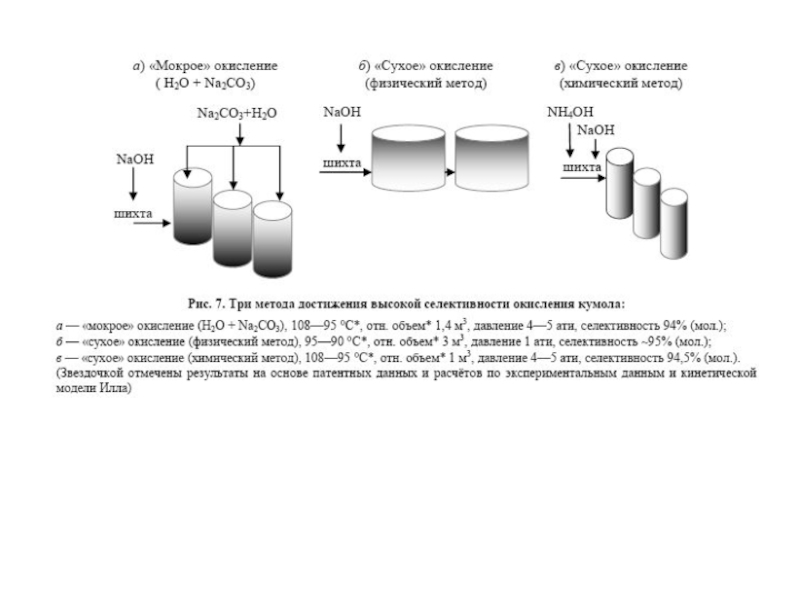
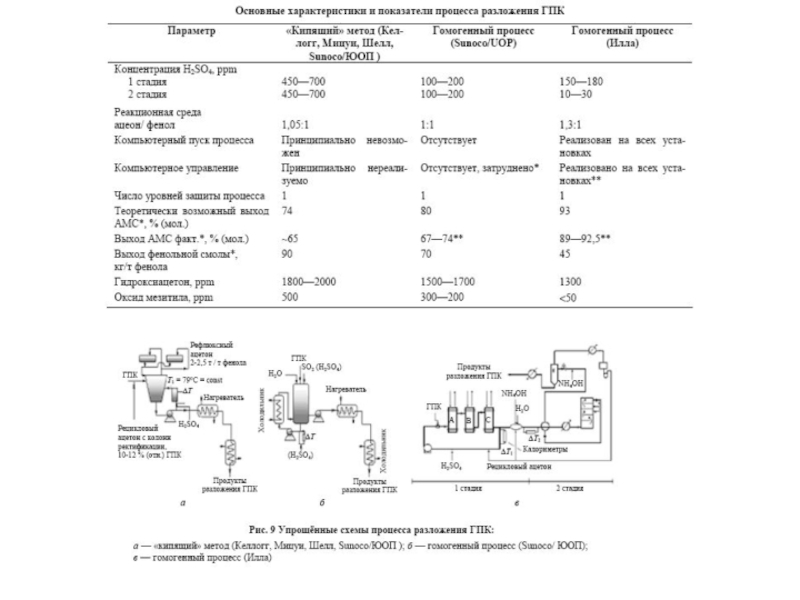
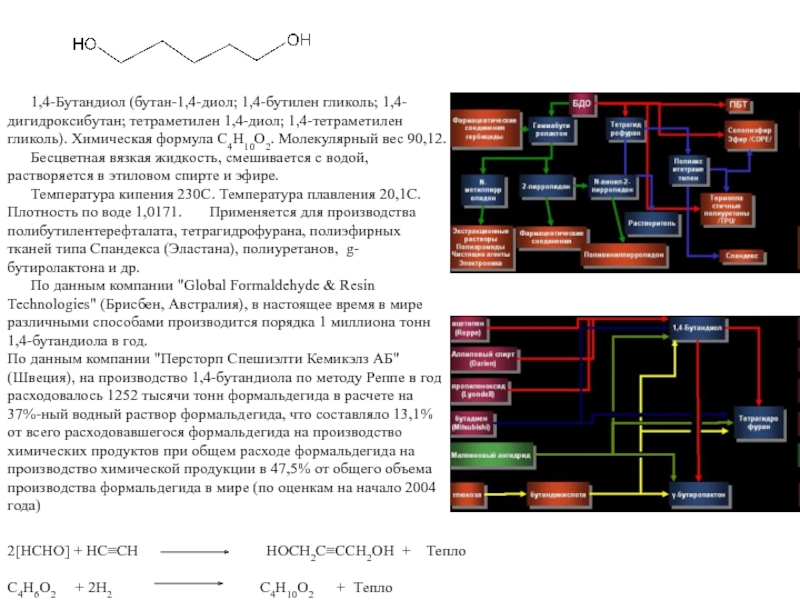
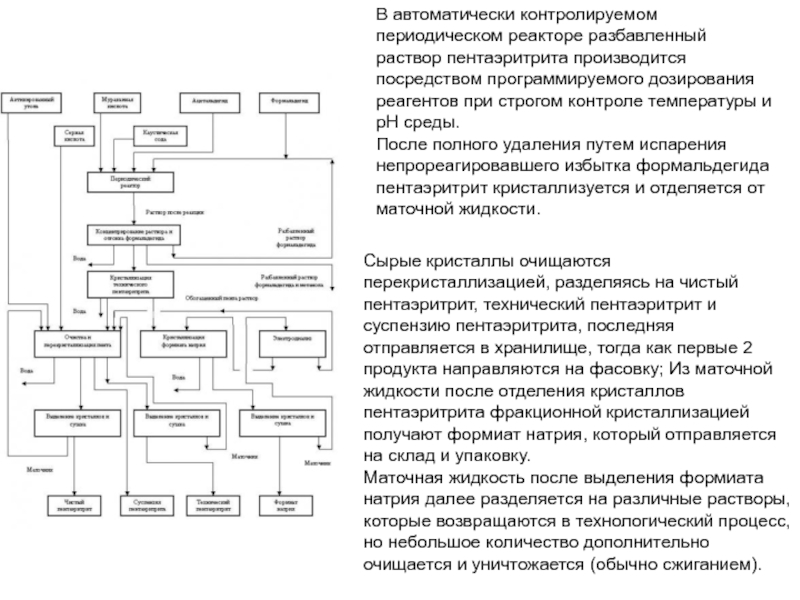
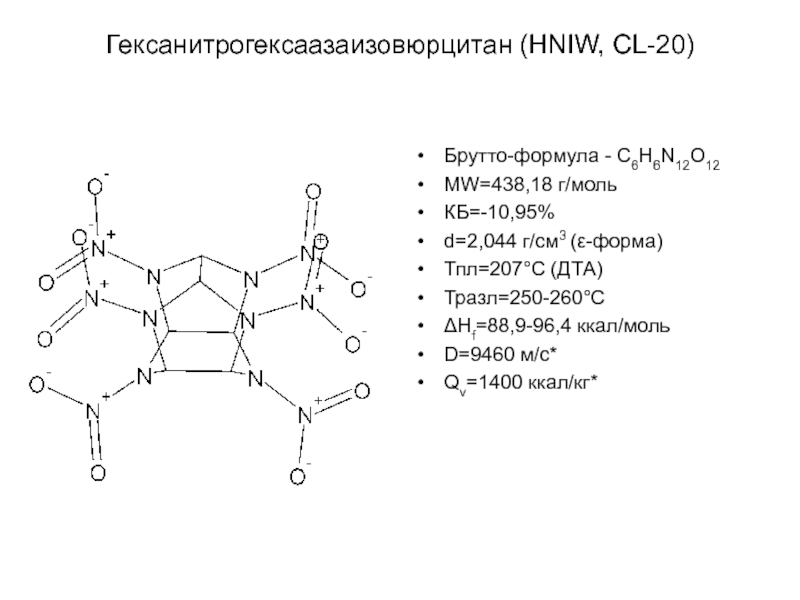
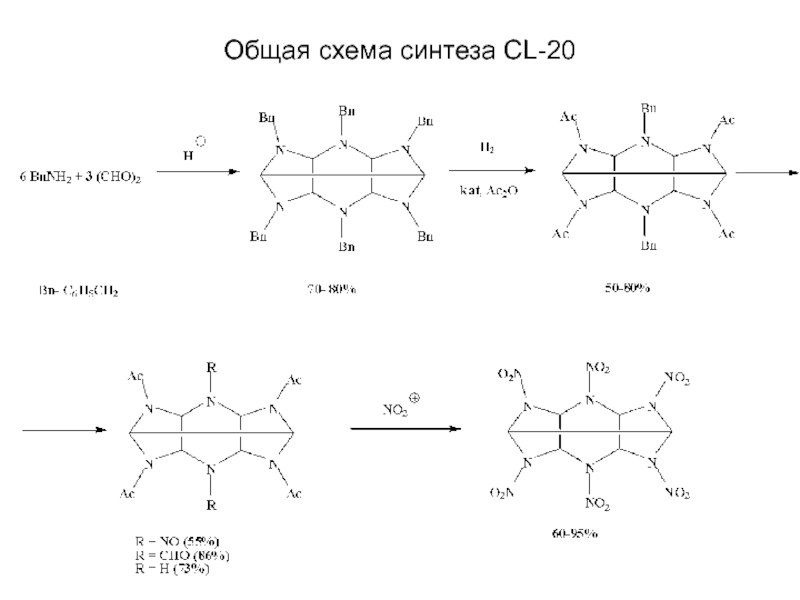
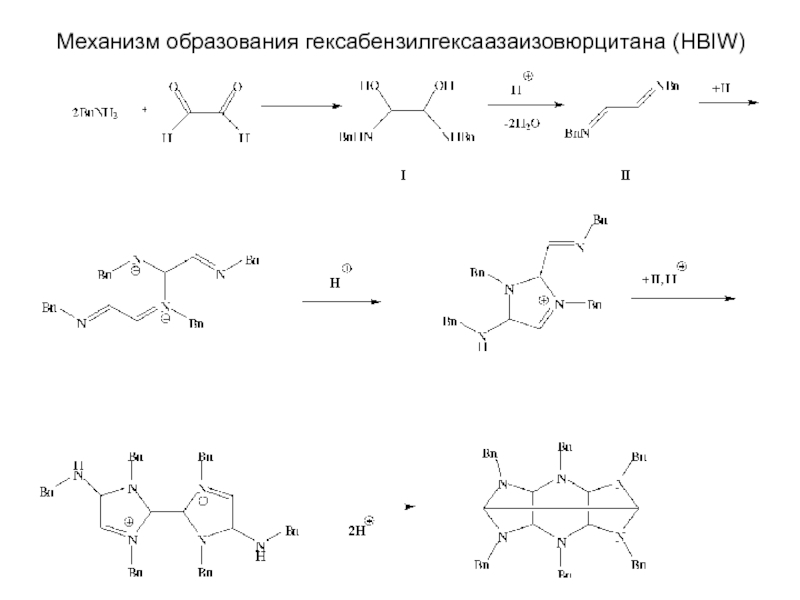
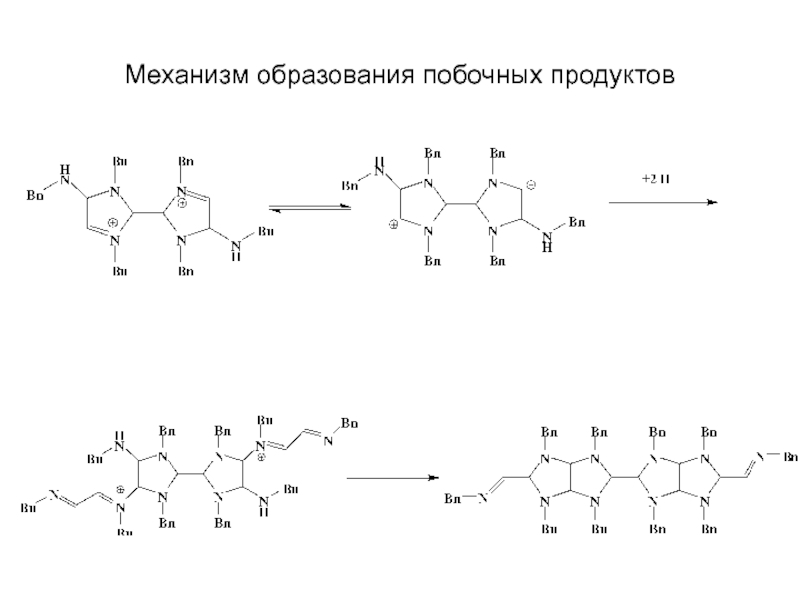
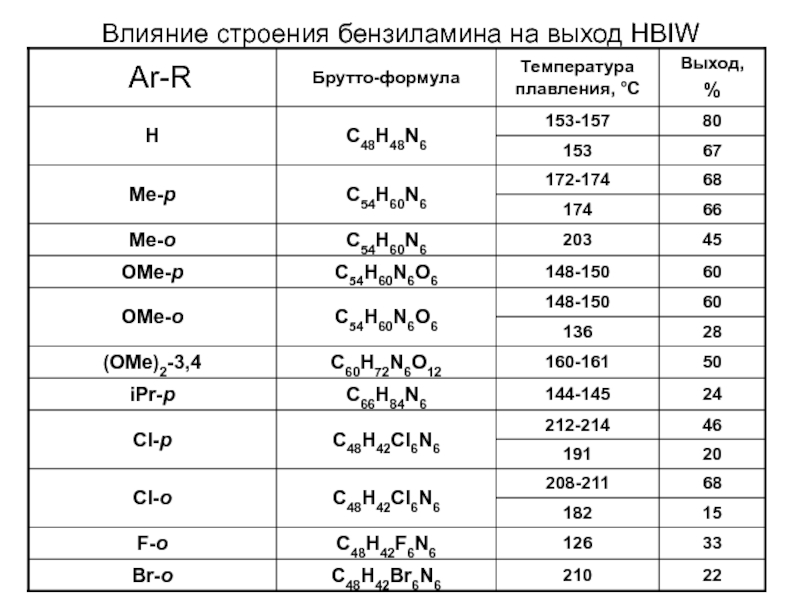
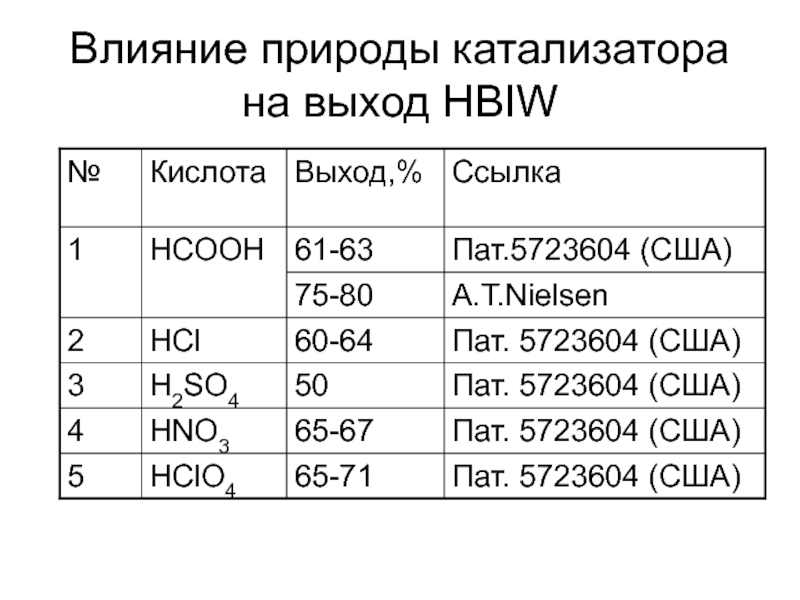
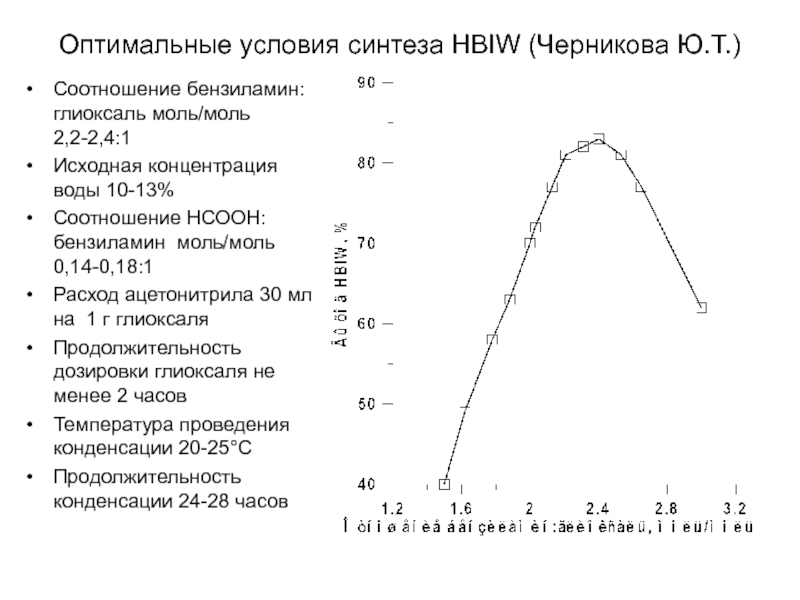
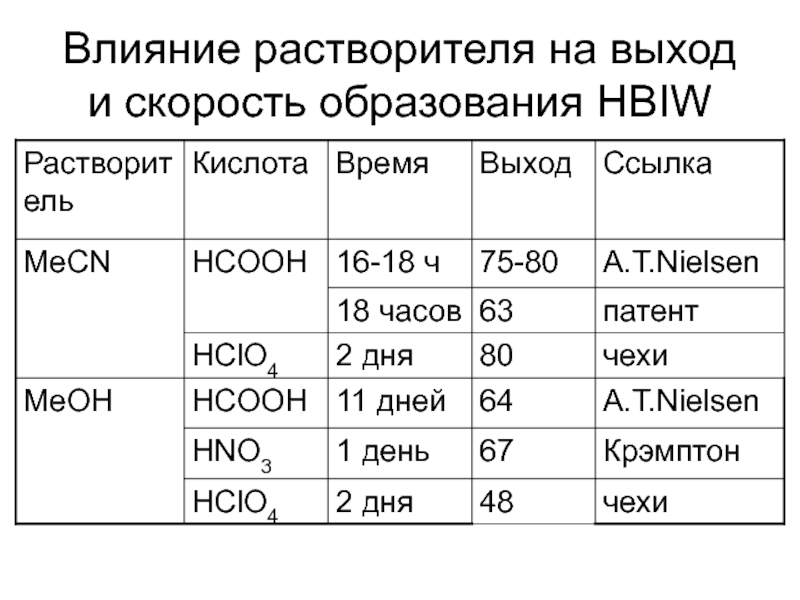
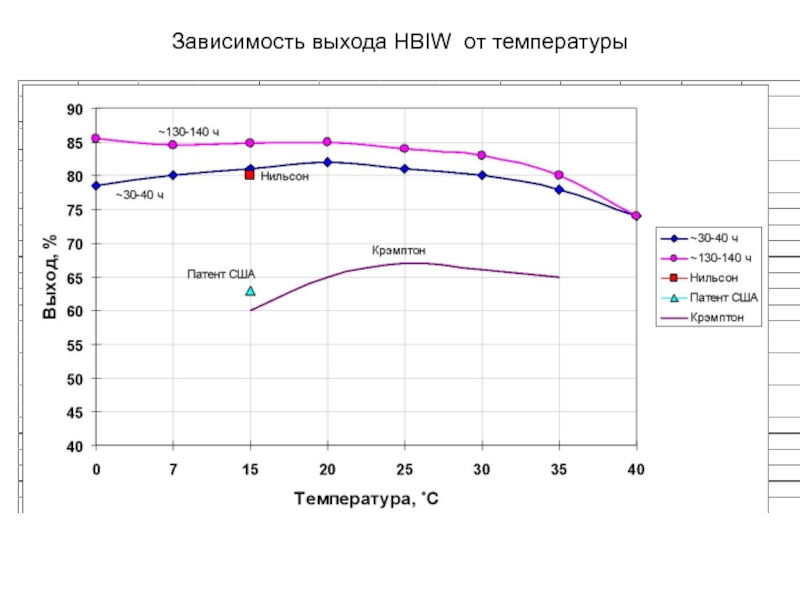
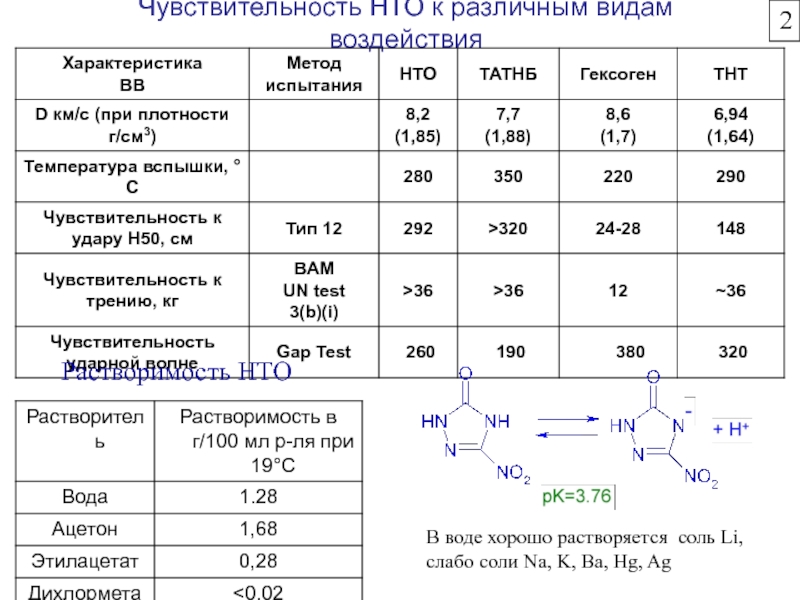
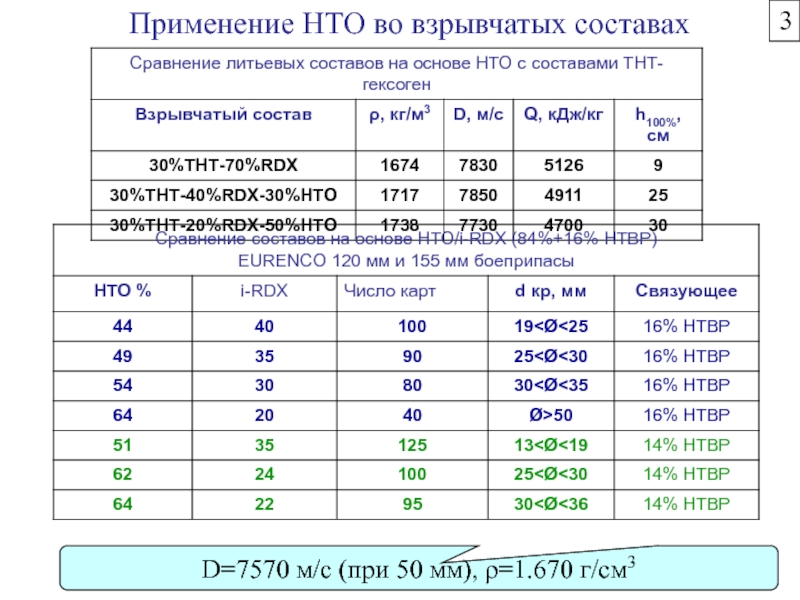
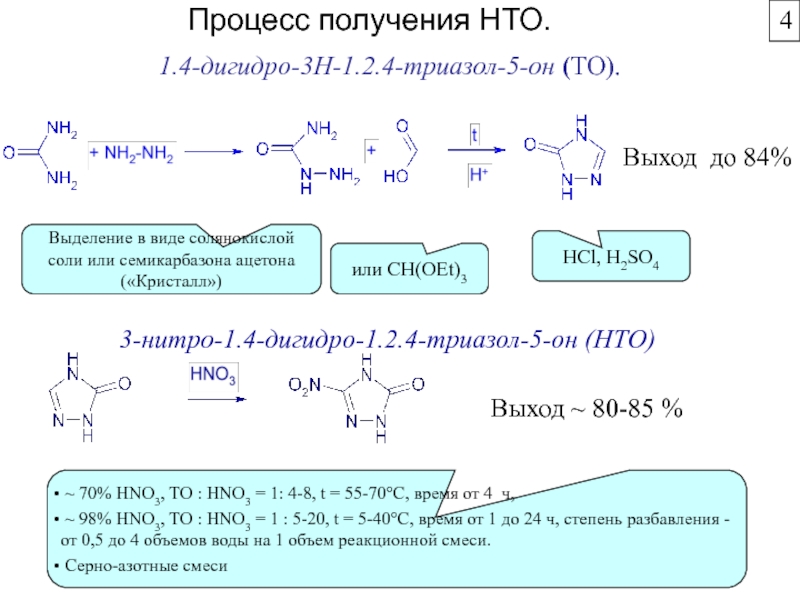
Химическая формула C4H10O2. Молекулярный вес 90,12. Бесцветная вязкая жидкость, смешивается с
водой, растворяется в этиловом спирте и эфире. Температура кипения 230С. Температура плавления 20,1С. Плотность по воде 1,0171. Применяется для производства полибутилентерефталата, тетрагидрофурана, полиэфирных тканей типа Спандекса (Эластана), полиуретанов, g-бутиролактона и др.По данным компании "Global Formaldehyde & Resin Technologies" (Брисбен, Австралия), в настоящее время в мире различными способами производится порядка 1 миллиона тонн 1,4-бутандиола в год.
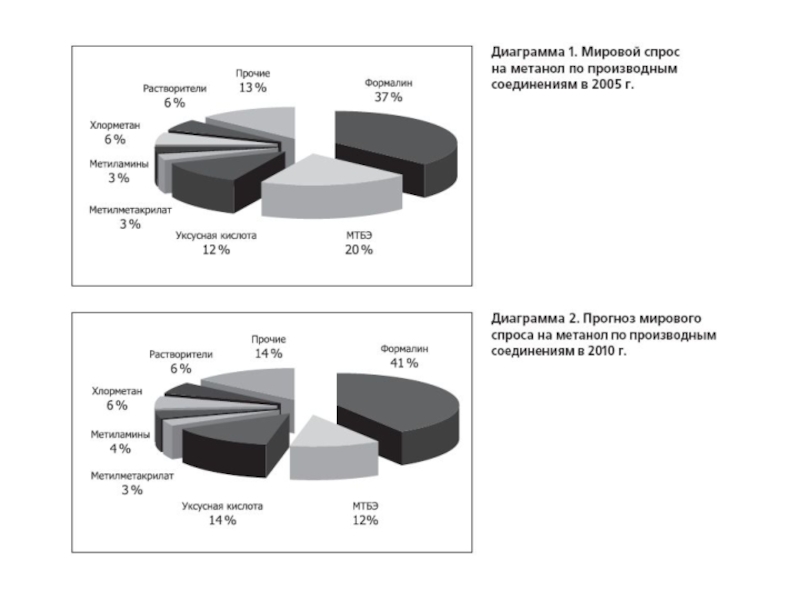
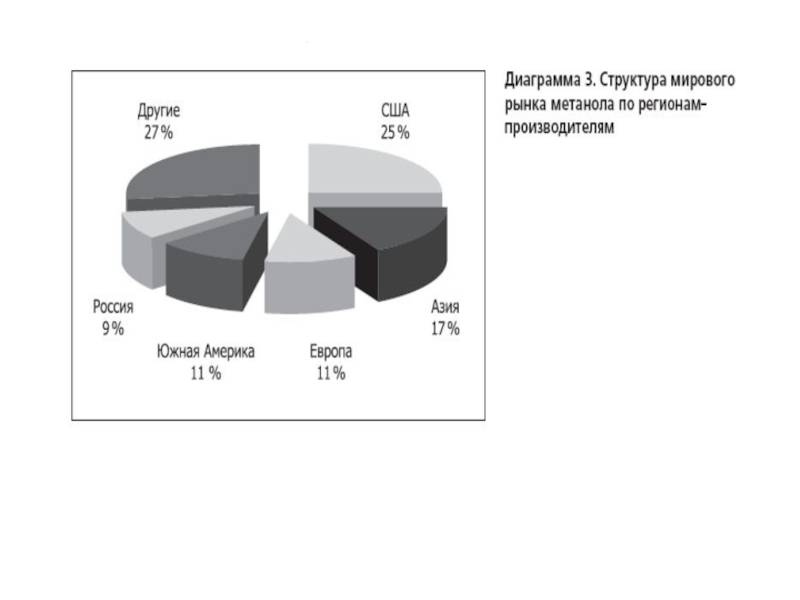
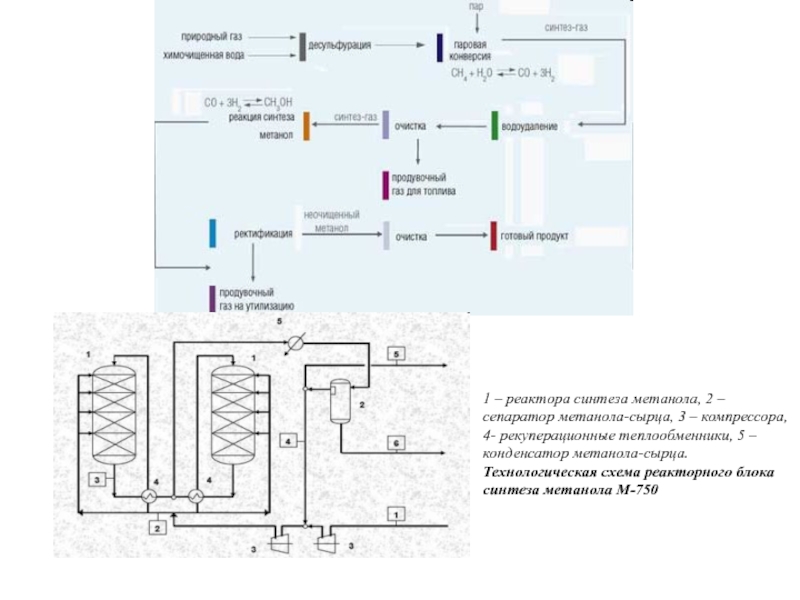
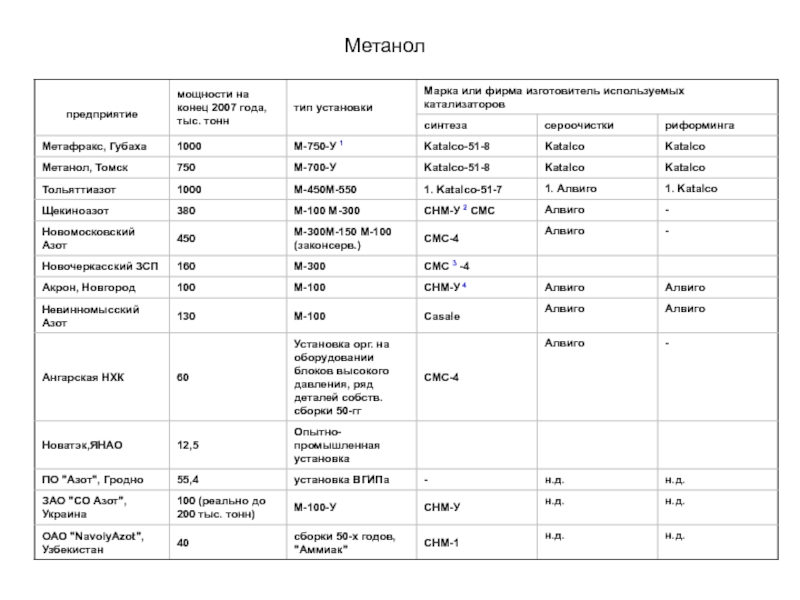
По данным компании "Персторп Спешиэлти Кемикэлз АБ" (Швеция), на производство 1,4-бутандиола по методу Реппе в год расходовалось 1252 тысячи тонн формальдегида в расчете на 37%-ный водный раствор формальдегида, что составляло 13,1% от всего расходовавшегося формальдегида на производство химических продуктов при общем расходе формальдегида на производство химической продукции в 47,5% от общего объема производства формальдегида в мире (по оценкам на начало 2004 года)
2[HCHO] + HC≡CH HOCH2C≡CCH2OH + Тепло
C4H6O2 + 2H2 C4H10O2 + Тепло