Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты: строение, основные свойства, регуляция активности ферментов в организме человека
Содержание
- 1. Ферменты: строение, основные свойства, регуляция активности ферментов в организме человека
- 2. Ферменты (энзимы) – каталитические белкиПервый фермент, выделенный
- 3. Характеристика ферментовВысокая специфичность: 1 фермент – 1
- 4. Общие принципы строения ферментовВсе ферменты – глобулярные
- 5. Виды ферментов по строениюИзостерические ферменты – имеют
- 6. Слайд 6
- 7. Условия максимальной активности ферментоврН – оптимумТемпературный оптимумФизиологическая
- 8. Кофакторы и коферментыИоны металловМогут связываться с
- 9. Простетическая группа (ПГ)Это особая разновидность кофактора ферментов.ПГ
- 10. Строение ферментов, использующих кофакторы (коферменты)Апофермент - белковая
- 11. Регуляция активности ферментов1. Контроль транскрипции гена (генов),
- 12. Регуляция активности ферментов2. Активация фермента путем ограниченного
- 13. Регуляция активности ферментов3.Модуляция лигандами, характерными для данного
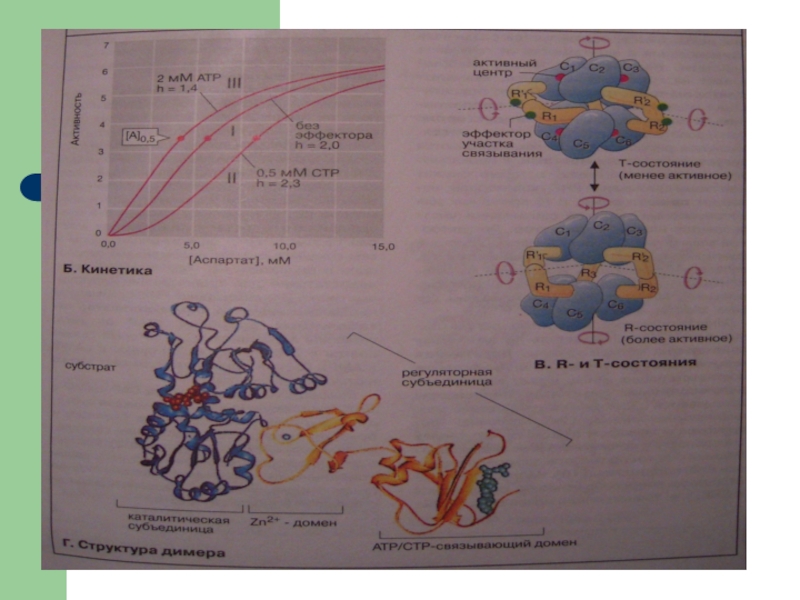
- 14. Регуляция активности ферментов4. Аллостеризм как принцип регуляции
- 15. Аллостерическая регуляция лежит в основе изменения активности
- 16. Регуляция активности ферментов5. Каскадные механизмы активации (инактивации)
- 17. Принцип каскадной регуляцииА. Гормон связывается с рецептором
- 18. Принцип каскадной регуляцииГ. Вторичный посредник быстро уничтожается
- 19. СЛЕДУЕТ ЗНАТЬ К ЗАНЯТИЮ:1. Строение аллостерических и
- 20. Слайд 20
- 21. Слайд 21
- 22. Скачать презентанцию
Ферменты (энзимы) – каталитические белкиПервый фермент, выделенный в чистом виде - уреаза бобов, разлагающая мочевину до воды и углекислоты.С 1935 г белковая природа ферментов общепризнана.В 1946 г первые исследователи природы ферментов–
Слайды и текст этой презентации
Слайд 1Ферменты: строение, основные свойства, регуляция активности
ферментов в организме человека
Биохимия как
составная часть медицинского образования
Слайд 2Ферменты (энзимы) – каталитические белки
Первый фермент, выделенный в чистом виде
- уреаза бобов, разлагающая мочевину до воды и углекислоты.
С 1935
г белковая природа ферментов общепризнана.В 1946 г первые исследователи природы ферментов– Самнер, Нортроп и Стенли – получили Нобелевскую премию по химии
Слайд 3Характеристика ферментов
Высокая специфичность: 1 фермент – 1 реакция и чаще
всего 1 субстрат
Мягкие (физиологические) условия катализа
Очень высокая эффективность (высокий выход
продукта)РЕГУЛИРУЕМАЯ АКТИВНОСТЬ!
Слайд 4Общие принципы строения ферментов
Все ферменты – глобулярные белки
Все ферменты имеют
активный центр (АЦ), в котором происходит узнавание, связывание субстрата и
превращение его в продукт реакцииСлайд 5Виды ферментов по строению
Изостерические ферменты – имеют только активный центр
Аллостерические
ферменты кроме АЦ, имеют 1 или более регуляторных (аллостерических)
центров, в которых связываются вещества – регуляторыАллостерические ферменты обычно являются ОЛИГОМЕРАМИ, т.е. состоят из 2 – 12 отдельных белковых субъединиц
Слайд 7Условия максимальной активности ферментов
рН – оптимум
Температурный оптимум
Физиологическая осмолярность среды
Доступность субстрата
Для
некоторых ферментов необходимы также кофакторы или коферменты
Слайд 8Кофакторы и коферменты
Ионы металлов
Могут связываться с АЦ фермента на
время катализа (в присутствии субстрата)
Органические соединения, производные витаминов
В некоторых случаях
связываются с АЦ на время катализа В ряде ферментов удерживаются в АЦ постоянно
Слайд 9Простетическая группа (ПГ)
Это особая разновидность кофактора ферментов.
ПГ ковалентно связывается с
активным центром фермента.
ПГ может содержать в своем составе как органические,
так и неорганические элементыФерменты, содержащие простетические группы, обычно «долгоживущие»: гемоглобин, цитохромы, миоглобин, флавопротеид тканевого дыхания, родопсин (зрительный пурпур)
Слайд 10Строение ферментов, использующих кофакторы (коферменты)
Апофермент - белковая глобула, не связанная
с кофактором или коферментом
Холофермент – апофермент, связавшийся с коферментом или
кофактором.Как правило, апофермент гораздо менее активен, чем холофермент
Слайд 11Регуляция активности ферментов
1. Контроль транскрипции гена (генов), кодирующих фермент с
помощью факторов транскрипции или гормонов
Индукция фермента - активация транскрипции
Репрессия -
инактивация транскрипции Этот путь регуляции активности ферментов используют СТГ, кортизол, тироксин, инсулин и половые гормоны
Слайд 12Регуляция активности ферментов
2. Активация фермента путем ограниченного протеолиза: исходная глобула
фермента неактивна, т.к. содержит дополнительную аминокислотную последовательность, мешающую работе АЦ.
Удаление
такой избыточной последовательности приводит к активации ферментаСлайд 13Регуляция активности ферментов
3.Модуляция лигандами, характерными для данного фермента
Концентрацией субстрата
Доступностью кофермента
или кофактора
Накоплением продукта реакции
Если конечный продукт метаболического пути снижает активность
ключевого фермента, то говорят о РЕТРОИНГИБИРОВАНИИ. Это одна из форм аллостерической регуляции (аллостеризма)Слайд 14Регуляция активности ферментов
4. Аллостеризм как принцип регуляции активности ферментов
Связывание в
одном участке поверхности белка (вне активного центра) может вызвать конформационные
изменения в другом участке. При этом изменяется взаимодействие АЦ с субстратом и, следовательно, скорость катализа.Слайд 15
Аллостерическая регуляция лежит в основе изменения активности некоторых ферментов в
присутствии АДФ, цАМФ, цитрата и др.
Аллостерический регулятор (эффектор) связывается в
РЦ фермента. Последующее конформационное изменение глобулы приводит к изменению формы АЦ и его доступности для субстрата.Слайд 16Регуляция активности ферментов
5. Каскадные механизмы активации (инактивации) ключевого фермента
Эти
механизмы характерны для реализации быстрой гормональной регуляции.
В каскадном механизме всегда
задействовано явление аллостеризма.Слайд 17Принцип каскадной регуляции
А. Гормон связывается с рецептором на клеточной мембране,
активируя синтез вторичного посредника.
Б. Вторичный посредник повышает активность специального
активирующего фермента.В. Активирующий фермент переводит ключевой фермент в активное состояние, чаще всего путем присоединения фосфатных групп к поверхностным аминокислотам фермента.