Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФГБОУ ВО ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ СЕВЕРНОГО
Содержание
- 1. ФГБОУ ВО ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ СЕВЕРНОГО
- 2. Составление уравнений реакций горения в кислороде,воздухе
- 3. Табл. 1‑1 Состав горючих и продуктов горения.
- 4. При большом избытке галогена в составе горючего
- 5. Составление уравнений реакций горения в кислороде1. Составить
- 6. Состав продуктов горения зависит от состава исходного вещества.
- 7. Горение пропана в кислородеЗаписываем реакцию горения: С3Н8 +
- 8. Коэффициенты, стоящие в уравнении реакции, называются стехиометрическими
- 9. Горение глицерина в кислороде 1. Записываем уравнение реакции
- 10. Горение аммиака в кислороде Аммиак состоит из водорода
- 11. Горение сероуглерода в кислороде Продуктами горения сероуглерода CS2
- 12. Составить уравнение реакции горения пропилового спирта С3H8O
- 13. Составить уравнение реакции горения метиламина CH3 NH2
- 14. Коэффициент при воздухе определяется по формуле (1.5)
- 15. и уравнение примет вид
- 16. Составление реакций горения веществ в воздухе аналогично
- 17. Горение угарного газа в воздухе СО + 0,5(О2
- 18. Расчет молей (киломолей) исходных веществ и продуктов реакции по уравнению реакции горения
- 19. 1. Запишем уравнение реакции горения бензойной кислоты.С6Н5СООН
- 20. Расчет объема воздуха, необходимого для горения, Смеси
- 21. Расчет объема воздуха, необходимого для горения, предполагает
- 22. Vв= Vвпр – Vвтеор
- 23. При > 1 горючую смесь называют
- 24. Расчет теоретического объема воздуха, необходимого для горения
- 25. Какой теоретический объем воздуха необходим для полного
- 26. Р и Т – данные в задаче
- 27. Расчет объема воздуха, необходимого для горения индивидуального
- 28. 3. По уравнению реакции найдем
- 29. Vвтеор = (2.6)м3,где 1, 2,
- 30. Расчет объема воздуха, необходимого для горения газовой
- 31. 2. По формуле (2.6) определяем теоретический объем
- 32. Горючее – сложное вещество с известным элементным
- 33. Vв(Н)теор = х = = 26,656 м3
- 34. Рассчитаем объем воздуха, в котором содержится 1
- 35. После подстановки в формулу (2.7) полученных выше
- 36. 2. С учетом коэффициента избытка воздуха реально
- 37. Расчет объема и процентного состава продуктов горения
- 38. 4. Горение протекает с коэффициентом избытка воздуха,
- 39. Расчет объема и процентного состава продуктов горения
- 40. При сгорании 1 м3 этана С2Н6 образуется
- 41. При сгорании 10 м3 газовой смеси объем
- 42. Теоретический объем продуктов горения 10 м3 газовой
- 43. С учетом избытка воздуха практический объем продуктов
- 44. Горючее – сложное вещество с известным элементным
- 45. Для углерода:1 кг
- 46. V(Н2О) = х1 = = 11,2 м3
- 47. Слайд 47
- 48. Если в состав горючего вещества входит кислород,
- 49. Слайд 49
- 50. Используя данные таблицы 2.1., можно вычислить объем
- 51. Расчет объема и процентного состава продуктов горения
- 52. V(N2) = 5 = 33,14 м3VПГ =
- 53. С учетом избытка воздуха практический объем продуктов
- 54. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯТепловое воздействие – один
- 55. Расчет теплового эффекта реакции горения индивидуального веществаРассчитать
- 56. В пожарно-технических расчетах часто пользуются понятием удельной
- 57. Слайд 57
- 58. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ФГБОУ ВО
«ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
СЕВЕРНОГО ЗАУРАЛЬЯ»
_______________________________________________
КАФЕДРА «ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ»
Тюмень
- 2014
Слайд 4При большом избытке галогена в составе горючего и нехватке водорода
в свободном состоянии в виде молекул X2 может выделяться и
галоген. Под символом X в таблице понимаются элементы-галогены (главная подгруппа VII группы периодической системы), т.е. F, Cl, Br, I.Слайд 5Составление уравнений реакций горения в кислороде
1. Составить уравнение реакции горения
в кислороде пропана С3Н8 и глицерина С3Н8О3 , аммиака NH3,
сероуглерода CS2.Составляя уравнение реакции горения, следует помнить, что в пожарно-технических расчетах принято все величины относить к 1 молю горючего вещества. Это, в частности, означает, что в уравнении реакции горения перед горючим веществом коэффициент всегда равен 1.
Слайд 7Горение пропана в кислороде
Записываем реакцию горения:
С3Н8 + О2 = СО2
+ Н2О
2. В молекуле пропана 3 атома углерода, из них
образуется 3 молекулы углекислого газа.С3Н8 + О2 = 3СО2 + Н2О
3. Атомов водорода в молекуле пропана 8, из них образуется 4 молекулы воды:
С3Н8 + О2 = 3СО2 + 4Н2О
4. Подсчитаем число атомов кислорода в правой части уравнения
23 + 4 = 10
5. В левой части уравнения так же должно быть 10 атомов кислорода. Молекула кислорода состоит из двух атомов, следовательно, перед кислородом нужно поставить коэффициент 5.
С3Н8 + 5О2 = 3СО2 + 4Н2О
Слайд 8Коэффициенты, стоящие в уравнении реакции, называются стехиометрическими коэффициентами и показывают,
сколько молей (кмолей) веществ участвовало в реакции или образовалось в
результате реакции.Стехиометрический коэффициент, показывающий число молей кислорода, необходимое для полного сгорания вещества, обозначается буквой .
В первой реакции = 5.
Слайд 9Горение глицерина в кислороде
1. Записываем уравнение реакции горения.
С3Н8О3 + О2
= СО2 + Н2О
2. Уравниваем углерод и водород:
С3Н8О3 + О2
= 3СО2 + 4Н2О.3. В правой части уравнения 10 атомов кислорода.
В составе горючего вещества есть 3 атома кислорода, следовательно, из кислорода в продукты горения перешли 10 – 3 = 7 атомов кислорода.
Таким образом, перед кислородом необходимо поставить коэффициент 7 : 2 = 3,5
С3Н8О3 +3,5О2 = 3СО2 + 4Н2О.
В этой реакции = 3,5.
Слайд 10Горение аммиака в кислороде
Аммиак состоит из водорода и азота, следовательно,
в продуктах горения будут вода и молекулярный азот.
NH3 + 0,75O2
= 1,5H2O + 0,5N2 = 0,75.Обратите внимание, что перед горючим веществом коэффициент 1, а все остальные коэффициенты в уравнении могут быть дробными числами.
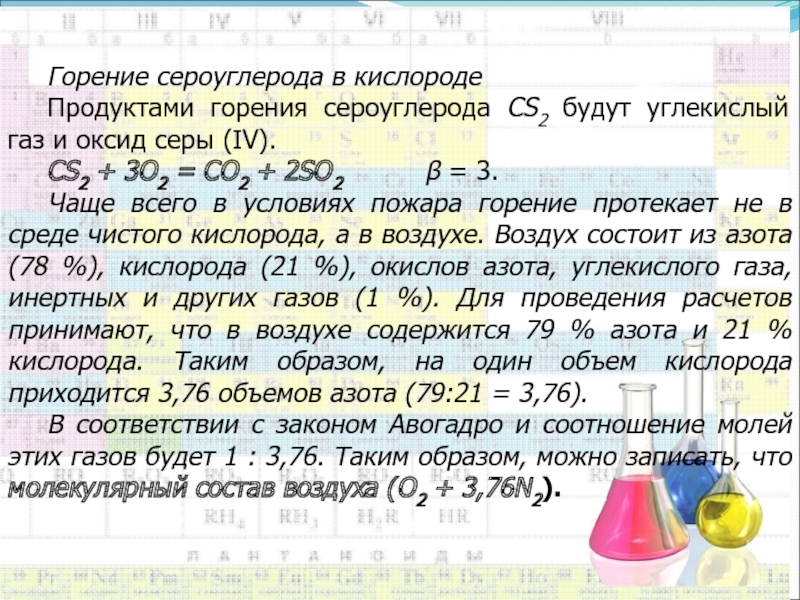
Слайд 11Горение сероуглерода в кислороде
Продуктами горения сероуглерода CS2 будут углекислый газ
и оксид серы (IV).
CS2 + 3O2 = CO2 + 2SO2
= 3. Чаще всего в условиях пожара горение протекает не в среде чистого кислорода, а в воздухе. Воздух состоит из азота (78 %), кислорода (21 %), окислов азота, углекислого газа, инертных и других газов (1 %). Для проведения расчетов принимают, что в воздухе содержится 79 % азота и 21 % кислорода. Таким образом, на один объем кислорода приходится 3,76 объемов азота (79:21 = 3,76).
В соответствии с законом Авогадро и соотношение молей этих газов будет 1 : 3,76. Таким образом, можно записать, что молекулярный состав воздуха (О2 + 3,76N2).
Слайд 12Составить уравнение реакции горения пропилового спирта С3H8O на воздухе.
В состав
молекулы пропилового спирта входят углерод, водород и кислород, продуктами реакции
будут углекислый газ CO2 и водяной пар H2O.Исходя из формулы горючего, определяем количества продуктов
реакции и
По количествам продуктов реакции определяем коэффициент при воздухе
Уравнение реакции принимает вид
Слайд 13Составить уравнение реакции горения метиламина CH3 NH2 на воздухе.
В состав
метиламина входят углерод, водород и азот, следовательно, продуктами реакции будут
углекислый газ, водяной пар и свободный азот.Азот, получающийся при горении вещества, записывается отдельно от азота, входившего в состав воздуха. Коэффициенты при продуктах реакции находим в соответствии с таблицей
Слайд 14Коэффициент при воздухе определяется по формуле (1.5)
Итоговое уравнение реакции
Составить уравнение реакции горения дихлорэтана C2H4Cl2 на воздухе.
По составу вещества
определяем состав продуктов горения CO2. H2O и HCl. Количества продуктов горения составят
Коэффициент при воздухе составит
Слайд 16Составление реакций горения веществ в воздухе аналогично составлению реакций горения
в кислороде. Особенность состоит только в том, что азот воздуха
при температуре горения ниже 20000С в реакцию горения не вступает и выделяется из зоны горения вместе с продуктами горения. Н2 + 0,5(О2 + 3,76N2) = Н2О + 0,53,76 N2 = 0,5.
Обратите внимание, что стехиометрический коэффициент перед кислородом 0,5 необходимо поставить и в правой части уравнения перед азотом.
Горение водорода в воздухе
Горение пропанола в воздухе
С3Н7ОН + 4,5(О2 + 3,76N2) =3СО2 + 4Н2О +4,53,76 N2 = 4,5.
В составе горючего есть кислород, поэтому расчет коэффициента проводят следующим образом: 10 – 1 = 9; 9 : 2 = 4,5.
Горение анилина в воздухе
С6Н5NН2 + 7,75(О2 + 3,76N2) =6СО2 + 3,5Н2О + 0,5N2 +7,753,76 N2
= 7,75.
В этом уравнении азот в правой части уравнения встречается дважды: азот воздуха и азот из горючего вещества.
Слайд 17Горение угарного газа в воздухе
СО + 0,5(О2 + 3,76N2) =СО2
+ 0,53,76 N2
= 0,5.
Горение хлорметана в воздухе
СН3Сl + 1,5(О2 + 3,76N2) =СО2 + НСl + Н2О +1,53,76 N2
= 1,5.
Горение диэтилтиоэфира в воздухе
(С2Н5)2 S + 7,5(О2 + 3,76N2) =4СО2 + 5Н2О + SO2 + 7,53,76N2
= 7,5.
Горение диметилфосфата в воздухе
(СН3)2НР О4 + 3(О2 + 3,76N2) =2СО2 + 3,5Н2О + 0,5Р2О5 + 33,76N2
= 3.
В процессах горения исходными веществами являются горючее вещество и окислитель, а конечными - продукты горения.
Слайд 19
1. Запишем уравнение реакции горения бензойной кислоты.
С6Н5СООН + 7,5(О2 +
3,76N2 ) =7СО2 + 3Н2О +7,53,76N2
2. Исходные вещества: 1
моль бензойной кислоты;7,5 молей кислорода;
7,53,76 молей азота.
Газов воздуха всего 7,54,76 молей.
Всего: (1 + 7,54,76) молей исходных веществ.
3. Продукты горения: 7 молей углекислого газа;
3 моля воды;
7,53,76 моля азота.
Всего: (7 + 3 + 7,53,76) молей продуктов горения.
Аналогичные соотношения и в том случае, когда сгорает 1 киломоль бензойной кислоты.
Сколько молей исходных веществ участвовало в реакции и сколько молей продуктов горения образовалось при полном сгорании 1 моля бензойной кислоты С6Н5СООН?
Слайд 20Расчет объема воздуха, необходимого для горения,
Смеси сложных химических соединений
или вещества сложного элементного состава нельзя выразить химической формулой, их
состав выражается чаще всего в процентном содержании каждого элемента. К таким веществам можно отнести, например, нефть и нефтепродукты, древесину и многие другие органические вещества.Слайд 21 Расчет объема воздуха, необходимого для горения, предполагает вычисление
а) теоретического объема
воздуха Vвтеор и б) практического объема воздуха Vвпр, затраченного на
горение (с учетом коэффициента избытка воздуха).Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vвтеор).
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух Vв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен
Vвпр = Vвтеор + Vв (2.1)
и, следовательно, избыток воздуха будет равен
Слайд 22Vв= Vвпр – Vвтеор
(2.2)
Обычно в
расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (). Коэффициент избытка воздуха показывает, во сколько раз в зону горения поступило воздуха больше, чем это теоретически необходимо для полного сгорания вещества:(2.3)
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха = 1, при этом реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения.
Слайд 23При > 1 горючую смесь называют бедной по горючему
компоненту, а при < 1 – богатой по горючему
компоненту.Избыток воздуха имеется только в смеси, бедной по горючему компоненту. Из формул (3.2) и (3.3) следует
Vв= Vвтеор( 1) (2.4)
В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной концентрации кислорода в продуктах горения (О2 ) ПГ. Для большинства органических веществ она составляет 12 – 16 % О2. Для некоторых веществ, например, ацетилена С2Н2, ряда металлов, горение возможно и при значительно меньшем содержании кислорода (до 5 % объемных О2).
Зная содержание кислорода в продуктах горения, можно определить коэффициент избытка воздуха (коэффициент участия воздуха в горении) на реальном пожаре:
Слайд 24Расчет теоретического объема воздуха, необходимого для горения индивидуального вещества
Теоретический объем
воздуха, необходимый для горения рассчитывается по уравнению реакции горения.
Слайд 25Какой теоретический объем воздуха необходим для полного сгорания 1 кг
диэтилового эфира С2Н5ОС2Н5? Температура 100С, давление 1,2 ат
1. Записываем
уравнение реакции горения1 кг х м3
С2Н5ОС2Н5 + 6(О2 + 3,76N2) =4СО2 + 5Н2О +63,76N2
М = 74 кг 64,76 Vм =
=64,7619,35 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса диэтилового эфира 74 кг/кмоль. Записываем эту величину под формулой эфира.
4. При нормальных условиях молярный объем (Vм) любого газообразного вещества составляет 22, 4 л/моль или 22,4 м3/кмоль.
Если условия отличаются от нормальных, то необходимо определить, какой объем будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет VМ ведут по формуле объединенного газового закона:
Слайд 26Р и Т – данные в задаче температура и давление.
Рассчитаем,
какой объем занимает 1 кмоль воздуха (как и любого другого
газообразного вещества) при данных температуре и давлении. м3/кмоль
Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (64,76).
5. По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания эфира:
7,5 м3
Vвтеор =
Слайд 27Расчет объема воздуха, необходимого для горения индивидуального вещества
Какой объем воздуха
необходим для полного сгорания 50 кг ацетона СН3СОСН3 при температуре
230С и давлении 95 кПа, если горение протекало с коэффициентом избытка воздуха 1,2?1. Записываем уравнение реакции горения
50 кг х м3
СН3СОСН3 + 4(О2 + 3,76N2) = 3СО2 + 3Н2О +43,76N2
М = 58 кг 44,76 Vм =
=4 4,76 25,9 м3
2. Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
м3/кмоль
Слайд 28 3. По уравнению реакции найдем теоретический объем воздуха,
необходимый для полного сгорания эфира:
Vвтеор =
м3
4.
По условию задачи коэффициент избытка воздуха = 1,2.С учетом этого определим практический объем воздуха, необходимый
для горения:
Vвпр = Vвтеор = 425,1 1,2 = 510,1 м3.
Горючее – смесь газов и паров
Природный, попутный нефтяной газ, промышленные газы (доменный, коксовый, генераторный и т.п.) представляют собой смеси газов. Состав газов выражается обычно в объемных процентах (объемн, %). Алгоритм расчета в данном случае следующий: для каждого горючего компонента вычисляется теоретическое количество воздуха с учетом его концентрации в смеси, и полученные концентрации суммируются. Формула для расчета теоретического объема воздуха для сгорания газовой смеси имеет следующий вид:
Слайд 29Vвтеор =
(2.6)
м3,
где 1, 2, 3 – стехиометрические
коэффициенты при воздухе в уравнении реакции горения для каждого горючего
компонента газовой смеси;1, 2, 3 – концентрации каждого горючего компонента смеси (в объемных %);
(О2) – процентное содержание кислорода в горючем газе (в объемных %);
VГГ – объем газовой смеси, м3.
Если горение протекает с избытком воздуха, то практический объем воздуха рассчитывают по уже известной формуле:
Vвпр = Vвтеор .
Слайд 30Расчет объема воздуха, необходимого для горения газовой смеси
Определить объем воздуха, необходимого для полного сгорания 10 м3
доменного газа следующего состава (в % объемных): оксид углерода (II) СО – 27 %, водород Н2 – 3 %, углекислый газ СО2 – 13 %, метан СН4 – 1 %, азот N2 – 56 %. Горение протекает при = 1,3.1. Определяем стехиометрические коэффициенты в уравнении реакции горения для каждого горючего компонента газовой смеси. Горючими газами в этой смеси являются угарный газ СО, водород Н2 и метан СН4.
СО + 0,5(О2 + 3,76N2) = СО2 + 0,53,76 N2 1 = 0,5
Н2 + 0,5(О2 + 3,76N2) = Н2О +0,53,76 N2 2 = 0,5
СН4 + 2(О2 + 3,76N2) = СО2 + 2Н2О +23,76 N2 3 = 2
Слайд 312. По формуле (2.6) определяем теоретический объем воздуха, необходимый для
горения данной газовой смеси:
3. С учетом коэффициента избытка воздуха реально
на сгорание данной газовой смеси будет затрачено воздухаVвпр = Vвтеор = 8,1 1,3 = 10,5 м3.
Vвтеор =
= 8,1 м3
Слайд 32Горючее – сложное вещество с известным элементным составом
Состав таких веществ
выражается в массовых долях (, %) каждого элемента. При горении
кислород воздуха расходуется на окисление углерода С, водорода Н, серы S и других горючих составляющих.Рассчитаем, какой теоретический объем воздуха необходим для сгорания 1 кг каждого элемента при нормальных условиях.
1 кг х м3
С + (О2 + 3,76N2 ) = СО2 + 3,76N2
12 кг 4,7622,4 м3
Vв(С)теор = х =
=8,885 м3 – объем воздуха для сгорания 1 кг углерода.
1 кг - х м3
Н + 0,25(О2 + 3,76N2) = 0,5Н2О + 0,253,76N2
1 кг -0,254,7622,4 м3
Слайд 33Vв(Н)теор = х =
= 26,656 м3 – объём воздуха
для сгорания 1 кг водорода.
1 кг
х м3S + (О2 + 3,76N2 ) = SО2 + 3,76N2
32 кг 4,7622,4 м3
Vв(S)теор = х =
= 3,332 м3 – объем воздуха для сгорания 1 кг серы.
Углерод, водород и сера являются основными составляющими большинства органических соединений. Значительное число органических веществ имеют в своем составе кислород, и, следовательно, воздуха на горение будет затрачено меньше.
Слайд 34Рассчитаем объем воздуха, в котором содержится 1 кг кислорода.
32 кг
О2 4,7622,4 м3 воздуха
1 кг
х м3Vв(О)теор = х =
= 3,332 м3
–объем воздуха, содержащий 1 кг кислорода.
Vвтеор = Vв(С)теор
+ Vв(Н)теор
+ Vв(S)теор
Vв(О)теор
, м3 (2.7)
где,
(С), (Н), (S), (О) – массовые доли элементов в веществе, %.
Сопоставим полученные значения.
Vв(Н)теор : Vв(С)теор : Vв(S)теор :Vв(О)теор =
= 26,665 : 8,885 : 3,332 : 3,332 = 1 : 1/3 : 1/8 : 1/8
Теоретическое количество воздуха для сгорания 1 кг вещества сложного элементного состава в общем виде можно записать следующим образом:
Слайд 35После подстановки в формулу (2.7) полученных выше расчетных значений теоретический
объем воздуха для сгорания заданной массы (m) вещества сложного элементного
состава при нормальных условиях определяется по формуле:Vвтеор =m 0,267
м3/кг.
(2.8)
1. По формуле (2.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца торфа:
Определить объем воздуха, необходимого для полного сгорания 5 кг торфа следующего состава (в %): С – 56,4 %, Н – 5,04 %, О – 24,0 %, S – 0,06 %, N – 3,6 %, зола – 10,9 %. Горение протекает при = 1,5, условия нормальные.
Vвтеор = 5
Слайд 362. С учетом коэффициента избытка воздуха реально на сгорание данной
массы образца торфа будет затрачено воздуха
Vвпр = Vвтеор
= 27,7 1,5 = 41,6 м3. Расчет объема и процентного состава продуктов горения
Состав продуктов горения зависит от химической природы горючего материала и условий его горения. Практически всегда органические вещества горят с образованием продуктов полного и неполного горения.
К продуктам полного сгорания относятся: углекислый газ, образующийся при горении углерода, разложении карбонатов; водяной пар, образующийся при горении водорода и испарении влаги в исходном веществе; оксид серы (IV) SO2 и азот – продукты горения соединений, содержащих серу и азот.
Продукты неполного сгорания – это оксид углерода (II) – угарный газ СО, сажа С, продукты термоокислительного разложения – смолы.
Неорганические вещества сгорают, как правило, до соответствующих оксидов.
Выход продуктов горения количественно установить невозможно из-за чрезвычайной сложности их состава, поэтому материальный баланс процесса горения рассчитывается из предположения, что вещество сгорает полностью до конечных продуктов. При этом в состав продуктов горения включают также азот воздуха, израсходованного на горение, и избыток воздуха при > 1.
Слайд 37Расчет объема и процентного состава продуктов горения индивидуального вещества
Определить объем
и состав в объемных % продуктов горения, образовавшихся при сгорании
3 кг бензола С6Н6. Температура 200С, давление 770 мм рт.ст., коэффициент избытка воздуха = 1,4.1.Записываем уравнение реакции горения
3 кг х1 м3 х2 м3 х3 м3 х4 м3
С6Н6 + 7,5(О2 + 3,76N2 ) = 6СО2 + 3Н2О + 7,53,76N2
М = 78 кг 7,54,76 Vм = 6Vм = 3Vм = 7,53,76Vм =
=7,54,7623,7 м3 =623,7 м3 =323,7 м3 =7,53,7623,7 м3
2. Рассчитаем, какой объем занимает 1 кмоль газообразных веществ при заданных температуре и давлении.
м3/кмоль
3. Теоретический объем продуктов горения (VПГ) определяем по уравнению реакции.
VПГ =
33,9 м3
Слайд 384. Горение протекает с коэффициентом избытка воздуха, следовательно, в состав
продуктов горения войдет избыточный воздух Vв.
Для расчета избытка воздуха
по уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания бензола: Vвтеор = х1 =
= 32,5 м3
Избыток воздуха определим по формуле
Vв= Vвтеор( 1) = 32,5(1,4 – 1) = 13 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + Vв = 33,9 + 13 = 46,9 м3
Слайд 39Расчет объема и процентного состава продуктов горения газовой смеси
Определить объем
и состав продуктов горения 10 м3 природного газа следующего состава
(в % объемных): метан СН4 – 75 %, этан С2Н6 – 4 %, пропан С3Н8 – 2 %, углекислый газ СО2 – 19 %. Горение протекает при = 1,2. 1. Составляем уравнение реакции горения для всех горючих газов смеси:
СН4 + 2(О2 + 3,76N2) = СО2 + 2Н2О +23,76N2 (СН4 ) = 2
Для газообразных веществ отношение числа моль равно отношению объемов, следовательно, стехиометрические коэффициенты для каждого вещества в реакции горения – это и есть объем в м3 каждого компонента продуктов горения, выделившийся при сгорании 1 м3 горючего газа.
По уравнению реакции можно определить, что при сгорании 1 м3 метана СН4 образуется 1 м3 СО2, 2 м3 Н2О и 23,76 м3 N2.
С2Н6 + 3,5(О2 + 3,76N2) =2СО2 + 3Н2О +3,53,76N2 (С2Н6) =3,5
Слайд 40При сгорании 1 м3 этана С2Н6 образуется 2 м3 СО2,
3 м3 Н2О и 3,53,76 м3 N2.
С3Н8 +,5(О2 + 3,76N2)
=3СО2 + 4Н2О +53,76N2 (С3Н8) =5При сгорании 1 м3 этана С3Н8 образуется 3 м3 СО2, 4 м3 Н2О и 53,76 м3 N2.
2. Определим теоретический объем продуктов горения.
Суммарный объем углекислого газа, образовавшегося при сгорании 1 м3 газовой смеси определяется с учетом процентного состава каждого горючего компонента газовой смеси, и также включается объем углекислого газа, входящий в состав исходной газовой смеси:
V(СО2) =
=
=
1,08 м3
Слайд 41При сгорании 10 м3 газовой смеси объем образовавшегося углекислого газа
составит:
V(СО2) = 1,08 10 = 10,8 м3
Аналогично рассчитываем объем
паров воды, образовавшийся в результате сгорания 1 м3 смеси газов: = 1,7 м3
V(Н2О) =
При сгорании 10 м3 газовой смеси объем паров воды будет:
V(Н2О) = 1,7 10 = 17 м3
Объем азота в продуктах горения составит для 1 м3 природного газа:
V(N2) =
= 6,55 м3,
а для 10 м3
V(N2) = 6,55 10 = 65,5 м3
Слайд 42Теоретический объем продуктов горения 10 м3 газовой смеси составит:
VПГ =
V(СО2 )+ V(Н2О)+ V(N2) = (10,8 + 17 + 65,5)
= 93,3 м32. Горение протекает с коэффициентом избытка воздуха = 1,2, следовательно, в состав продуктов горения войдет и избыток воздуха. Для его расчета по формуле (3.6) определяем теоретический объем воздуха, необходимый для горения данной газовой смеси:
Vвтеор =
= 82,9 м3
Избыток воздуха определим по формуле (3.4):
Vв= Vвтеор( 1) = 82,9(1,2 – 1) = 16,6 м3
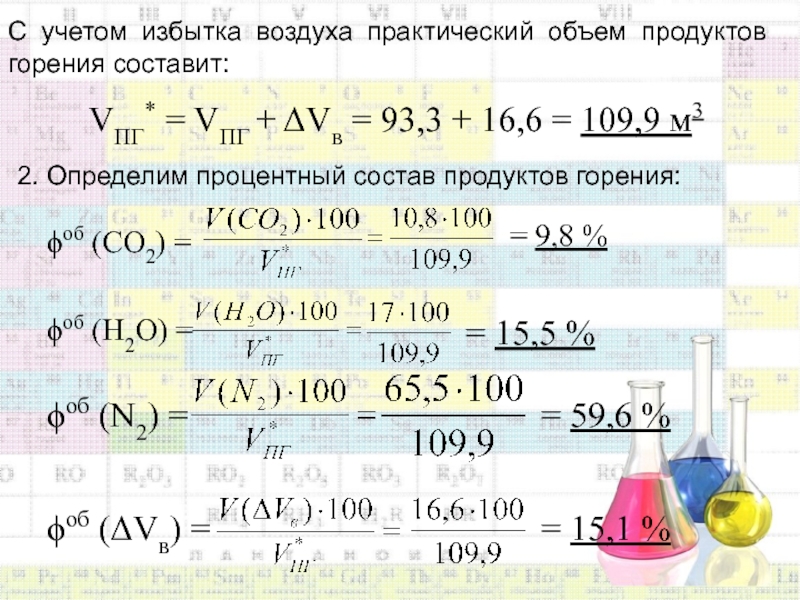
Слайд 43С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* =
VПГ + Vв = 93,3 + 16,6 = 109,9 м3
2.
Определим процентный состав продуктов горения:об (СО2) =
= 9,8 %
об (Н2О) =
= 15,5 %
об (N2) =
= 59,6 %
об (Vв) =
= 15,1 %
Слайд 44Горючее – сложное вещество с известным элементным составом
В этом случае
теоретический выход продуктов горения определяется как сумма продуктов горения каждого
элемента, входящего в состав вещества.Рассчитаем, какой теоретический объем продуктов горения образуется при сгорании 1 кг каждого элемента при нормальных условиях.
Слайд 45Для углерода:
1 кг
х1
м3 х2 м3С + (О2 + 3,76N2 ) = СО2 + 3,76N2
12 кг 22,4 м3 3,7622,4 м3
V(СО2) = х1 =
= 1,87 м3
V(N2) = х2 =
= 7,0 м3
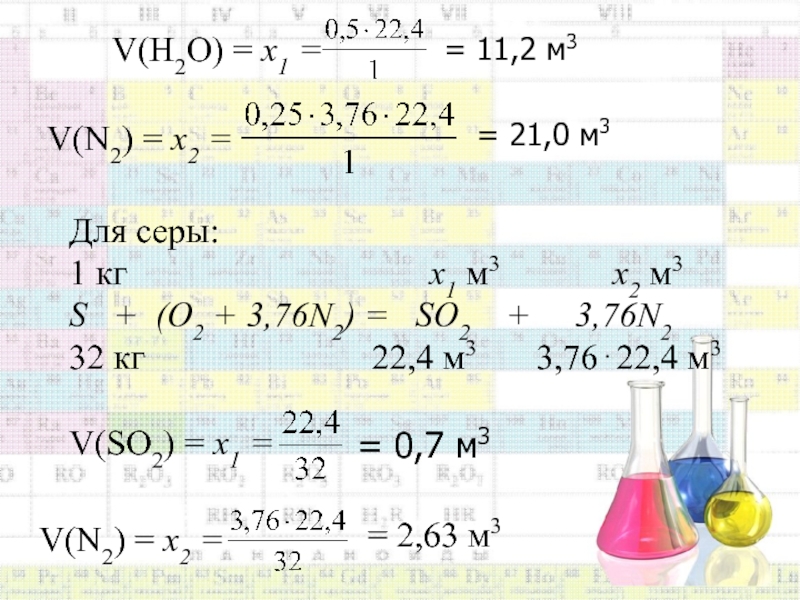
Для водорода:
1 кг х1 м3 х2 м3
Н+0,25(О2+3,76N2)=0,5Н2О + 0,253,76N2
1 кг 0,522,4м3 0,253,7622,4 м3
Слайд 46V(Н2О) = х1 =
= 11,2 м3
V(N2) = х2
=
= 21,0 м3
Для серы:
1 кг
х1 м3 х2 м3S + (О2 + 3,76N2) = SО2 + 3,76N2
32 кг 22,4 м3 3,7622,4 м3
V(SО2) = х1 =
= 0,7 м3
= 2,63 м3
V(N2) = х2 =
Слайд 48Если в состав горючего вещества входит кислород, то при горении
он будет расходоваться на окисление горючих компонентов (углерода, водорода, серы,
фосфора) и, поэтому из воздуха на горение будет израсходовано кислорода меньше на количество, которое содержалось в горючем веществе. Следовательно, в продуктах горения и азота будет меньше на количество, которое приходилось бы на кислород, если бы он находился не в горючем веществе, а в воздухе.На 1 кг кислорода в воздухе будет приходиться объем азота, равный
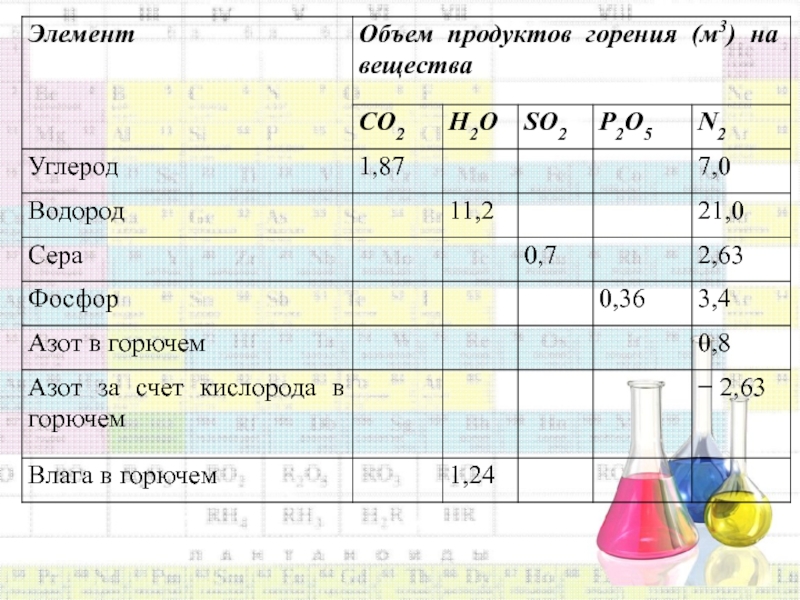
Полученные значения выходов продуктов горения элементов приведены в таблице 2.1.
Таблица 2.1. Теоретический объем продуктов горения элементов сложных веществ при нормальных условиях
Слайд 50Используя данные таблицы 2.1., можно вычислить объем продуктов горения любого
вещества с известным элементным составом.
Пусть (С), (Н),
(S), (О), (N) – – массовые доли элементов в веществе, %; (W) – содержание влаги в веществе, %. Тогда общие формулы для расчета каждого компонента продуктов горения при сгорании заданной массы (m) вещества будут иметь следующий вид:
2.9
2.10
V(SО2) = m
, м3 (2.11)
V(N2) = m
2.12
Слайд 51Расчет объема и процентного состава продуктов горения вещества сложного элементного
состава
Определить объем и процентный состав продуктов горения 5 кг каменного
угля следующего состава (в %): С – 75,8 %, Н – 3,8 %, О – 2,8 %, S – 2,5 %, N – 1,1 %, W – 3,0 %, зола – 11,0 %. Горение протекает при = 1,3, условия нормальные. 1. По формулам (2.9) – (2.12) определяем объем каждого компонента продуктов горения 5 кг каменного угля.
V(СО2) = 5
= 7 м3
V(H2O) = 5
= 2,31 м3
V(SО2) = 5
= 0,085 м3
Слайд 52V(N2) = 5
= 33,14 м3
VПГ = 7 +
2,31 + 0,085 + 33,14 = 42,5 м3
2.Горение протекает с
коэффициентом избытка воздуха 1,3, следовательно, в состав продуктов горения будет входить избыточный воздух.По формуле (2.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
Vвтеор = 5
= 38,6 м3
Избыток воздуха определим по формуле (2.4):
Vв= Vвтеор( 1) = 38,6(1,3 – 1) = 11,6 м3
Слайд 53С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* =
VПГ + Vв = 42,5 + 11,6 = 54,1 м3
3.
Определим процентный состав продуктов горения:об (СО2) =
= 12,9 %
об (Н2О) =
= 4,3 %
об (SО2) =
об (N2) =
об (Vв ) =
Слайд 54ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
Тепловое воздействие – один из наиболее опасных
факторов пожара, который вызывает основные разрушения, уничтожает материальные ценности, вызывает
гибель людей, определяет обстановку на пожаре, создает огромные трудности при его ликвидации. Расчет тепловых явлений, сопровождающих горение, позволяет принять правильные и своевременные меры противопожарной защиты.Практически единственным источником тепловой энергии любого процесса горения, а значит, и любого пожара, является тепловой эффект химических реакций окисления в пламени, т.е. теплота горения, которая относится к важнейшим характеристикам пожарной опасности веществ и материалов.
Расчет теплоты горения
Энтальпией горения (Нгор, кДж/моль) вещества называется тепловой эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов.
Теплота горения (Qгор) численно равна энтальпии горения, но противоположна по знаку.
Для индивидуальных веществ тепловой эффект реакции может быть рассчитан по I следствию закона Гесса.
Слайд 55Расчет теплового эффекта реакции горения индивидуального вещества
Рассчитать тепловой эффект реакции
горения 1 моль бутана С4Н10.
1. Запишем уравнение реакции горения бутана.
С4Н10
+ 6,5(О2 +3,76 N2) = 4СО2 + 5Н2О + 6,5·3,76 N2 2. Выражение для теплового эффекта этой реакции по I следствию закона Гесса
Н0р-и = 4Н0(СО2) + 5Н0(Н2О) - Н0(С4Н10).
3. По таблице 1 приложения находим значения энтальпий образования углекислого газа, воды (газообразной) и бутана.
Н0(СО2) = 393,5 кДж/моль; Н0(Н2О) = 241,8 кДж/моль;
Н0(С4Н10) = 126, 2 кДж/моль.
Подставляем эти значения в выражение для теплового эффекта реакции
Н0р-и = 4(–393,5) + 5(–241,8) – ( 126,2) = 1656,8 кДж
Н0р-и = Н0гор = 1656,8 кДж/моль или Qгор = + 1656,8 кДж/моль.
Таким образом, при сгорании 1 моля бутана выделяется 1656,8 кДж тепла.
Слайд 56В пожарно-технических расчетах часто пользуются понятием удельной теплоты горения. Удельная
теплота горения – это количество теплоты, которое выделяется при полном
сгорании единицы массы или объема горючего вещества. Размерность удельной теплоты горения – кДж/кг или кДж/м3.В зависимости от агрегатного состояния воды в продуктах горения различают низшую и высшую теплоту горения. Если вода находится в парообразном состоянии, то теплоту горения называют низшей теплотой горения Qн. Если пары воды конденсируются в жидкость, то теплота горения – высшая Qв.
Температура пламени достигает 100 К и выше, а вода кипит при 373 К, поэтому в продуктах горения на пожаре вода всегда находится в парообразном состоянии, и для расчетов в пожарном деле используется низшая теплота горения Qн.
Низшая теплота горения индивидуальных веществ может быть определена переводом значения Нгор, кДж/моль в Qн, кДж/кг или кДж/м3. Для веществ сложного элементного состава низшая теплота горения может быть определена по формуле Д.И. Менделеева. Кроме того, для многих веществ значения низшей теплоты горения приведены в справочной литературе, некоторые данные представлены в приложении