Слайд 1ФИЗИЧЕСКИЕ И ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ЛУЧЕВОЙ ТЕРАПИИ
Доцент кафедры онкологии, к.м.н.
Евстифеев С.В.
Слайд 2Лучевая терапия - это вид лечения,
при котором происходит передача
энергии ионизирующего излучения в
ткани человека, длящаяся доли
секунды и
приводящая к целой
цепи биофизических,
функциональных и морфологических
изменений в клетках и тканях организма
Слайд 3Лучевая терапия (ЛТ) - клиническая дисциплина, которая использует ионизирующие излучения
для лечения злокачественных новообразований (ЗНО) и некоторых воспалительных и дегенеративно-дистрофических
заболеваний.
Лучевая терапия в настоящее время наряду с хирургическим вмешательством и химиотерапевтическими препаратами является одним из основных методов лечения больных злокачественными опухолями. До 2/3 общего числа онкологических больных подвергаются лучевому лечению. При этом в неоперабельных случаях лучевая терапия по эффективности занимает первое место. В последние годы лучевой лечебный фактор довольно широко используется при лечении ряда воспалительных, дегенеративно-дистрофических, нервных, кожных и других заболеваний неопухолевого генеза.
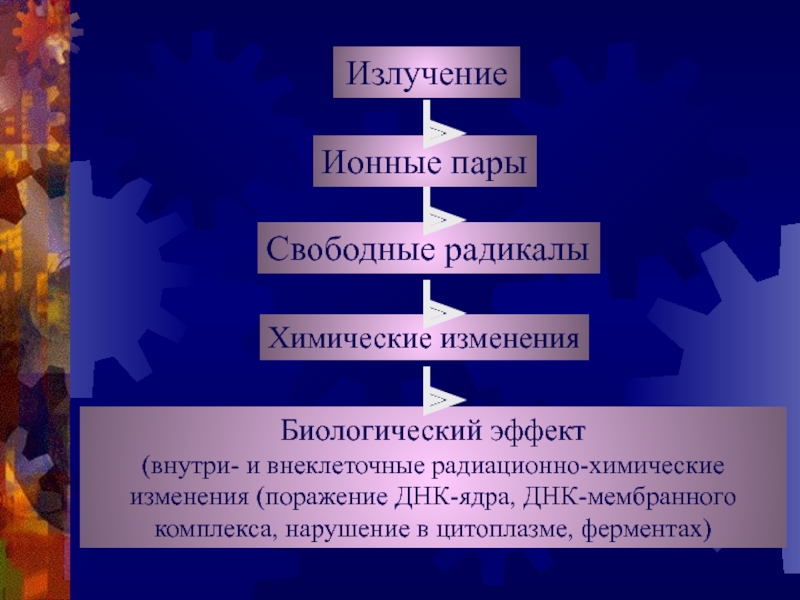
Слайд 4Излучение
Ионные пары
Свободные радикалы
Химические изменения
Биологический эффект
(внутри- и внеклеточные радиационно-химические
изменения (поражение ДНК-ядра,
ДНК-мембранного
комплекса, нарушение в цитоплазме, ферментах)
Слайд 5Лучевая терапия – это метод лечения с
использованием ионизирующих излучений
В
настоящее время около 70%
онкологических больных нуждаются
в лучевом лечении
Назначается
лучевая терапия только при
морфологической верификации диагноза
Слайд 6История лучевой терапии
В 2005 году мировая общественность отметила 110-летие одного
из величайших достижений науки – открытия рентгеновских лучей, которые сразу
же нашли применение и заняли прочные позиции в лучевой диагностике. С 1896 г. началось применение рентгеновских лучей в лечении кожных заболеваний, а чуть позже были предприняты попытки их использования и для лечения злокачественных опухолей. В том же году французский физик Анри Беккерель открыл радиоактивность солей урана, а в 1898 г. супругам Кюри удалось выделить из 8 т смоляной урановой руды 1 г нового химического элемента, радиоактивность которого оказалась в миллион раз выше, чем у урана. Элемент получил название «радий», что означает «лучистый». Открытие радия и исследование его излучения, свойства которого во многом сходны с таковыми рентгеновского излучения, явилось новым скачком в развитии атомной физики.
Слайд 7 В последующие 20 лет были открыты многие другие
естественные радиоактивные элементы. В 1934 г. супруги Жолио-Кюри впервые получили
в лаборатории искусственные радиоактивные изотопы, которые значительно расширили возможность использования ионизирующих излучений как в лучевой диагностике, так и в терапии злокачественных опухолей.
Первые попытки применения рентгеновского излучения для лечения злокачественных опухолей основывались на первоначальных сведениях о повреждающем действии этих излучений на ткани. Уже 110 лет отделяют нас от первого опыта использования рентгеновских лучей в онкологической практике. За этот период сильно изменились и технические возможности использования различных видов излучений и оценка их действия на биологические ткани.
Слайд 8 Внедрение в клиническую практику источников высокой энергии, искусственных
радиоактивных изотопов существенно расширило возможности лучевого лечения и обеспечило заметное
повышение его результативности.
В последние годы накоплен богатый клинический опыт, расширились исследования в области клинической радиобиологии, произошел скачок в техническом оснащении онкологических учреждений, и, таким образом, созданы предпосылки для рационального использования скрытых резервов лучевой терапии.
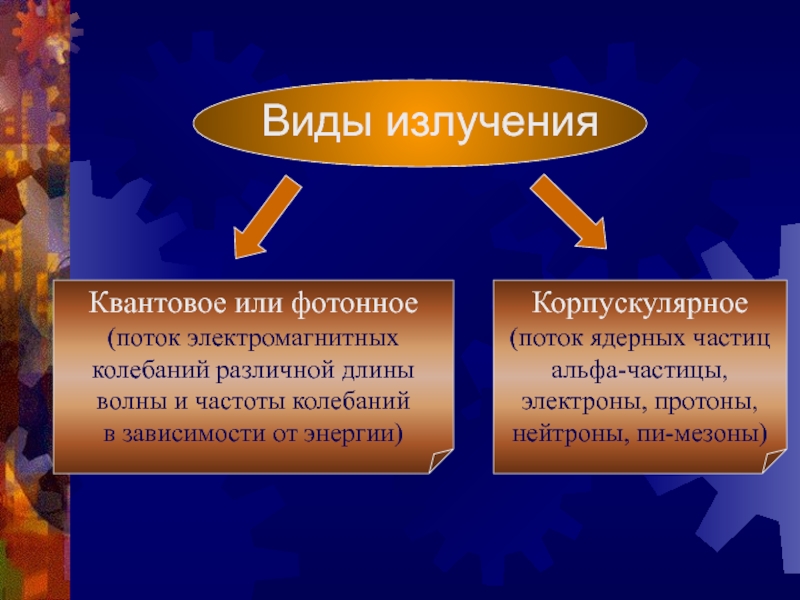
Слайд 9Виды излучения
Квантовое или фотонное
(поток электромагнитных
колебаний различной длины
волны и частоты
колебаний
в зависимости от энергии)
Корпускулярное
(поток ядерных частиц
альфа-частицы,
электроны, протоны,
нейтроны,
пи-мезоны)
Слайд 10Корпускулярные ионизирующие излучения
-излучение представляет собой поток ядер гелия, несущих два
положительных заряда. Так как масса -частиц значительна по сравнению с
массой электронов атомов, с которыми они соударяются, то траектория -частиц прямолинейна. Вследствие большого заряда и малой скорости -частицы весьма интенсивно взаимодействуют с электронами поглощающего материала; быстро расходуя свою энергию, они успевают пройти очень малое расстояние. В тканях человека -частицы поглощаются на глубине 50 мкм, в воздухе их пробег равен 7-12 см. Это определяет относительно малую радиационную опасность -частиц при наружном облучении.
Протонные пучки. Как и -частицы, характеризуются наибольшими массой и зарядом по сравнению с другими видами ИИ. Их траектории также прямолинейны. ЛПИ, создаваемая положительно заряженными частицами, неравномерна вдоль трека частицы, образует в конце пробега так называемый "пик Брегга", т. е. тяжелые частицы в конце пути дают ЛПИ, в сотни раз превышающую ЛПИ в начале пути. Это объясняется тем, что, замедляясь, тяжелые частицы взаимодействуют с веществом со значительно большей вероятностью. Положение пика Брегга зависит от энергии частиц - чем больше энергия, тем больше глубина его локализации.

Слайд 11-излучение представляет собой поток электронов и позитронов, возникающий в результате
внутриядерных превращений нейтронов и протонов.
В отличие от -частиц -частицы характеризуются
непрерывным энергетическим спектром. Путь электрона в веществе извилист, поскольку он обладает малой массой и легко изменяет направление вследствие соударения с электронами атомов. Поэтому начальный пучок электронов в тканях имеет тенденцию к расхождению (рассеяние электронов). При торможении быстрых электронов в поле ядра атомов возникает тормозное фотонное излучение.
Вследствие большой скорости проникающая способность -частиц выше, чем у -частиц. В воздухе она составляет около
10 м, в мышечных тканях - 10 мм. -активные препараты используются при лечении злокачественных опухолей, локализация которых позволяет обеспечить непосредственный контакт с этими препаратами. Реже они используются с целью диагностики.
Слайд 12С помощью современных ускорителей создаются электронные пучки высоких энергий (до
15-50 МэВ), обладающие большой проникающей способностью. Средняя длина свободного пробега
таких электронов может достигать в тканях человеческого организма 10-20 см. Электронный пучок, поглощаясь в тканях, создает дозное поле, отличающее этот вид излучения от других. Максимум ионизации при этом образуется вблизи поверхности тела. Размеры зоны максимума ионизации находятся в прямой зависимости от величины энергии излучения. За пределами максимума происходит довольно быстрый спад дозы.
Электронный пучок с энергией до 5 МэВ используется при лечении поверхностных злокачественных новообразований, с энергией от 20 до 50 МэВ - более глубоко расположенных. Современные ускорители дают возможность плавно регулировать энергию пучка электронов и тем самым создавать требуемую дозу на любой глубине.
Слайд 13Нейтронные пучки. Процессы взаимодействия нейтронов с веществом определяются как энергией
нейтронов, так и атомным составом поглощающей среды. Отсутствие у нейтронов
электрического заряда позволяет ему проникать через электронные оболочки атомов и свободно приближаться к ядру.
При воздействии на ткани нейтроны захватываются ядрами атомов, что приводит к нарушению их структуры и сопровождается испусканием - или -частиц и -квантов. Кроме того, при ядерных превращениях освобождаются ядра отдачи, которые обладают большой энергией, производят высокую ионизацию среды. Их ионизирующая способность близка к ионизирующей способности -частиц. Однако поражающее действие нейтронов значительно выше вследствие их большой проникающей способности. При облучении нейтронами в клетке возникает одномоментный разрыв ДНК, что приводит к ее гибели. Так как гибнут не только опухолевые, но и здоровые клетки, для нейтронов характерен высокий процент лучевых повреждений. Из всех видов ИИ быстрые нейтроны обладают наибольшей радиационной опасностью.
Высокая проникающая способность открывает перспективы для использования нейтронов в лучевой терапии злокачественных новообразований.

Слайд 14Фотонные ионизирующие излучения
К фотонным ИИ относятся -излучение радиоактивных веществ, характеристическое
и тормозное излучения, генерируемые различными ускорителями. ЛПИ фотонного излучения самая
низкая (1-2 пары ионов на 1 см3 воздуха), что определяет его высокую проникающую способность (в воздухе длина пробега составляет несколько сот метров).
-излучение возникает при радиоактивном распаде. Переход ядра из возбужденного в основное состояние сопровождается излучением -кванта с энергиями от 10 кэВ до 5 МэВ. Основными терапевтическими источниками -излучения являются -аппараты.
Тормозное рентгеновское излучение возникает за счет ускорения и резкого торможения электронов в вакуумных системах различных ускорителей и отличается от рентгеновского большей энергией квантов (от одного до десятков МэВ).
Слайд 15Излучение в диапазоне с энергией от 200 кэВ до 15
МэВ нашло самое широкое применение в терапии злокачественных новообразований. Большая
проникающая способность позволяет передавать энергию глубоко расположенным опухолям. При этом резко снижается лучевая нагрузка на кожу и подкожную клетчатку, что позволяет подвести требуемую дозу к очагу поражения без лучевого повреждения указанных участков тела (в отличие от мягкого рентгеновского излучения).
Существующие способы облучения больного можно разделить на две основные группы – способы дистанционного или наружного облучения и способы контактного облучения, при котором источники излучения размещаются либо в полости органа, либо внутри опухолевой ткани (соответственно внутриполостная или внутритканевая лучевая терапия). Сочетание двух способов облучения или двух видов излучений принято называть сочетанной лучевой терапией.
По виду и качеству используемого излучения выделяют несколько методов терапии: рентгенотерапия, бета-терапия, гамма-терапия, лучевая терапия тормозным излучением высокой энергии и лучевое лечение электронами высокой энергии.

Слайд 16Способы лучевой терапии
ДИСТАНЦИОННОЕ или НАРУЖНОЕ
облучение (статическое, ротационное)
БРАХИТЕРАПИЯ или КОНТАКТНОЕ
облучение
Аппликационное
Внутриполостное (подвижное, неподвижное,
открытыми и закрытыми источниками)
Внутритканевое
Слайд 17Дистанционная лучевая терапия
Дистанционной лучевой терапией называется такое лечение, в процессе
которого источник излучения находится на расстоянии от 3-5 см до
1 м от поверхности тела больного. Чаще всего дистанционное облучение применяют в виде длительных курсов продолжительностью от 3 до 8 недель. Ежедневные сеансы длятся обычно несколько минут.
Методы дистанционной ЛТ определяются видом и качеством ИИ:
Рентгенотерапия
ЛТ тормозным рентгеновским излучением высокой энергии
-терапия
-терапия
Облучение протонами
Облучение нейтронами
Слайд 18Рентгенотерапия. Используется рентгеновское излучение низких и средних энергий (40-200 кВ).
Источником излучения является рентгеновская (вакуумная) трубка, находящаяся в рентгеновском аппарате
(РУМ-17, РУМ-7, РУМ-21). Рентгеновское излучение - это электромагнитные волны (т. е. излучение испускается отдельными порциями - фотонами). Чем меньше длина волны, тем больше энергия фотона. Спектр рентгеновского излучения сплошной, т. е. в пучке энергия фотонов варьирует от нулевой до максимальной.
Для того чтобы пучок рентгеновского излучения состоял из коротких волн (больших энергий), необходимо использовать фильтры, которые отфильтровывают длинноволновое излучение больших энергий. Фильтры - пластинки из металла, изготовленные из алюминия (Al), меди (Cu) или Al+Cu, Al+Cu+олово. Качество рентгеновского излучения определяется напряжением на трубке.
Слайд 19Рентгеновское излучение, которое генерируется с помощью аппаратов для рентгенотерапии, всегда
создает максимум поглощенной дозы на поверхности (коже). Величина дозы быстро
падает с глубиной.
Толерантная доза кожи к рентгеновскому излучению небольшая (30-35 Гр).
Большой вклад рассеянного излучения.
Небольшая проникающая способность.
Рентгенотерапия применяется для лечения поверхностных новообразований кожи и слизистых оболочек и для лечения неопухолевых заболеваний.
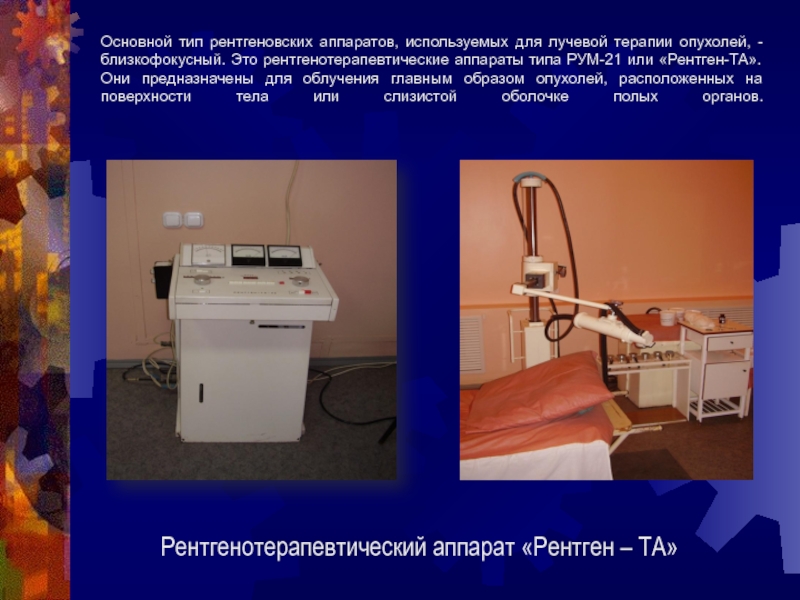
Слайд 20Основной тип рентгеновских аппаратов, используемых для лучевой терапии опухолей, -
близкофокусный. Это рентгенотерапевтические аппараты типа РУМ-21 или «Рентген-ТА». Они предназначены
для облучения главным образом опухолей, расположенных на поверхности тела или слизистой оболочке полых органов.
Рентгенотерапевтический аппарат «Рентген – ТА»
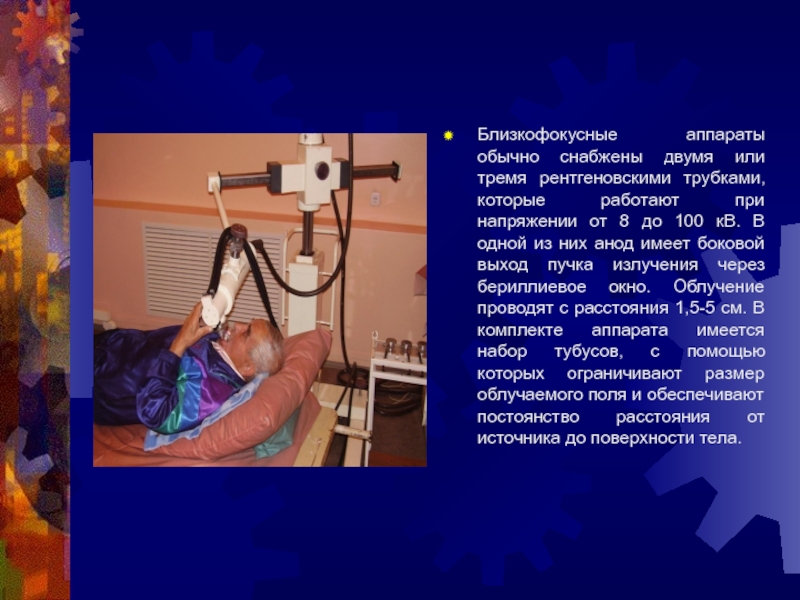
Слайд 21Близкофокусные аппараты обычно снабжены двумя или тремя рентгеновскими трубками, которые
работают при напряжении от 8 до 100 кВ. В одной
из них анод имеет боковой выход пучка излучения через бериллиевое окно. Облучение проводят с расстояния 1,5-5 см. В комплекте аппарата имеется набор тубусов, с помощью которых ограничивают размер облучаемого поля и обеспечивают постоянство расстояния от источника до поверхности тела.
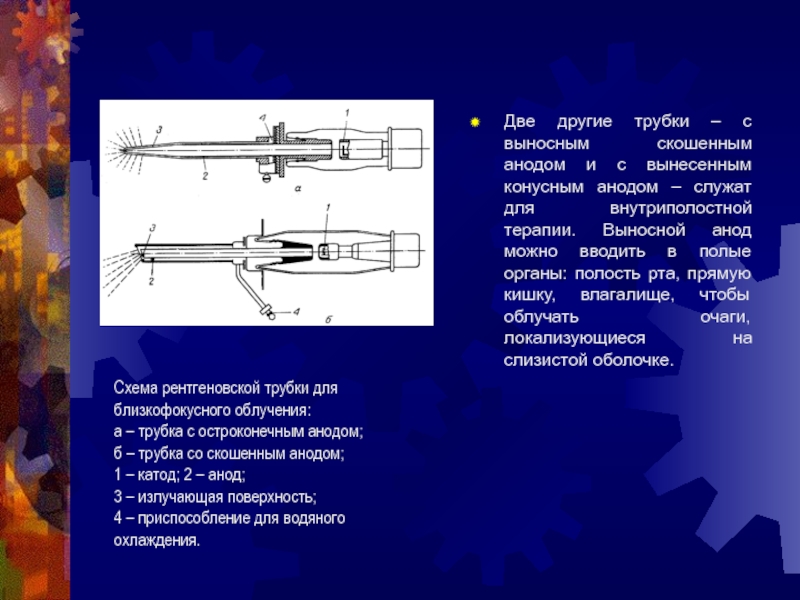
Слайд 22Две другие трубки – с выносным скошенным анодом и с
вынесенным конусным анодом – служат для внутриполостной терапии. Выносной анод
можно вводить в полые органы: полость рта, прямую кишку, влагалище, чтобы облучать очаги, локализующиеся на слизистой оболочке.
Схема рентгеновской трубки для близкофокусного облучения:
а – трубка с остроконечным анодом;
б – трубка со скошенным анодом;
1 – катод; 2 – анод;
3 – излучающая поверхность;
4 – приспособление для водяного охлаждения.
Слайд 23Облучение тормозным рентгеновским излучением высокой энергии (25 МэВ). Источниками этого
излучения являются линейные ускорители электронов (ЛУЭ), синхротрон, бетатрон. Максимум поглощенной
дозы находится глубоко в тканях (на расстоянии 3-5 см от облучаемой поверхности в зависимости от энергии излучения). Используется для облучения глубоко расположенных опухолей (рак пищевода, центральной нервной системы, мочевого пузыря, легкого и др.)
Линейный ускоритель ЛУЭР – 20 М
Слайд 24Облучение быстрыми электронами - -терапия
(20-30 МэВ). Источники электронов - ЛУЭ,
бетатрон, микротрон. Максимум поглощенной дозы находится на глубине эффективного пробега
электронов (эффективный пробег равен 1/3 максимальной энергии), т. е. 7-10 см от облучаемой поверхности тела. Величина дозы быстро падает с глубиной. В основном используется для повторной ЛТ или для лечения опухолей, расположенных рядом с критическими органами.
Слайд 25Дистанционная -терапия. В качестве источника излучения используется радионуклид (цезий 137,
а в настоящее время преимущественно кобальт 60).
Требования к радионуклидам для
-аппаратов:
Физический период полураспада должен быть большим:
цезий 137 - 33 года;
кобальт 60 - 5,3 года.
Энергия -лучей должна быть достаточной (1 МэВ и более):
энергия -лучей цезия - 0,66-0,75 МэВ;
энергия -лучей кобальта - 1,17-1,33 МэВ.
Должна быть сравнительно высокая удельная активность препарата (активность радионуклида в единице объема). Чем больше удельная активность, тем меньше размеры источника излучения. Так как удельная активность кобальта больше, чем у цезия, его удобнее использовать в клинике (в настоящее время размеры таблетки кобальта составляют
1,6 1,6 см).
Слайд 26В нашей стране выпускаются следующие аппараты для
-терапии: "ЛУЧ-1", "Рокус-М" (ротационно-конвергентная
установка), "АГАТ-С" (статический), "АГАТ-Р" (ротационный), "АГАТ-В" (внутриполостной). Более современными являются
"АГАТ-Р1" и "АГАТ-Р2". Их особенности: наличие центраторов для более точного подведения дозы к опухоли; выход на ЭВМ и способность работать в автоматическом режиме; в большом ассортименте представлены формирующие приспособления
АГАТ - Р
Слайд 27Максимум поглощенной дозы при -терапии находится прямо под поверхностными слоями
кожи, в дальнейшем величина дозы довольно быстро падает (1 см
мягких тканей ослабляет
-лучи кобальта на 5%).
Показания для дистанционной -терапии:
Для лечения с радикальной, паллиативной и симптоматической целью опухолей внутренних органов.
Может быть использована для облучения поверхностных опухолей (тангенциальное облучение).
Для лечения неопухолевых заболеваний.
Слайд 28Облучение протонами. Это тяжелые заряженные частицы, которые ускоряются с помощью
цикло- и синхроциклотрона. Энергия излучения - от 160 до 1000
МэВ. В отличие от фотонных ИИ при облучении протонами максимум ионизации (максимум поглощенной дозы) находится в конце пробега частиц (пик Брегга).
Облучение протонами применяется для ЛТ внутричерепных образований небольшого размера, а также для лечения радиорезистентных опухолей с малым диаметром. С помощью протонных пучков удается одномоментно облучать строго ограниченные объемы тканей дозами 100-200 Гр.
Облучение нейтронами. Проводится в 31 центре в мире, где есть генераторы нейтронов. Применяется для ЛТ радиорезистентных опухолей, саркомы костей, мягких тканей. Терапевтический эффект достигается только ценой лучевых повреждений.
Слайд 29Дистанционная ЛТ может осуществляться в статическом и подвижном режимах.
При
статическом облучении источник излучения неподвижно зафиксирован по отношению к пациенту.
Для изменения поля действия пучка излучения используются экранирующие блоки и решетки из свинца.
При подвижном способе облучения источник излучения двигается по дуге относительно тела больного. Различают:
круговое облучение (угол вращения 3600);
маятниковое или секторное облучение (угол качания меньше 3600).
Показаниями для этих видов подвижного облучения являются небольшие опухоли, расположенные в области центральной и сагиттальной плоскости тела больного (т. е. глубоко расположенные). К ним относятся опухоли головы и шеи, бронхопульмональные лимфатические узлы, опухоли пищевода, прямой кишки, мочевого пузыря и др.
Эксцентрическое (шалевидное) облучение - радиус качания составляет с центральным лучом определенный угол отклонения. Применяется, например, при лечении метастатических очагов в ребрах, при облучении селезенки, т. е. органов, расположенных близко к поверхности тела больного.
Слайд 30Контактная лучевая терапия
Контактные методы облучения - это такие методики ЛТ,
при которых источник ИИ находится на расстоянии менее 30 см
от облучаемого объекта. Различают следующие виды контактной ЛТ:
аппликационная ЛТ;
внутриполостное облучение;
внутритканевая ЛТ.
Основной особенностью дозного поля при всех контактных методах ЛТ является быстрое падение мощности дозы по мере отдаления от препарата на протяжении уже первого сантиметра, что позволяет создать высокую дозу излучения в патологическом очаге с крутым падением мощности дозы за его пределами. Эта особенность является преимуществом метода, так как при этом окружающие опухоль нормальные ткани подвергаются минимальному облучению.
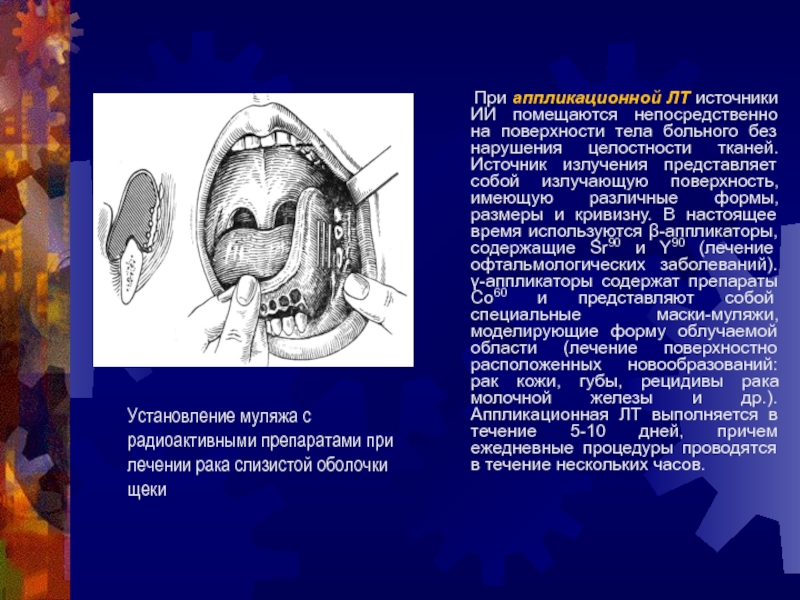
Слайд 31 При аппликационной ЛТ источники ИИ помещаются непосредственно
на поверхности тела больного без нарушения целостности тканей. Источник излучения
представляет собой излучающую поверхность, имеющую различные формы, размеры и кривизну. В настоящее время используются -аппликаторы, содержащие Sr90 и Y90 (лечение офтальмологических заболеваний). -аппликаторы содержат препараты Co60 и представляют собой специальные маски-муляжи, моделирующие форму облучаемой области (лечение поверхностно расположенных новообразований: рак кожи, губы, рецидивы рака молочной железы и др.). Аппликационная ЛТ выполняется в течение 5-10 дней, причем ежедневные процедуры проводятся в течение нескольких часов.
Установление муляжа с радиоактивными препаратами при лечении рака слизистой оболочки щеки
Слайд 32Внутриполостной метод облучения предназначен для подведения высокой поглощенной дозы к
опухоли, расположенной в стенке полого органа, при максимальном щажении окружающих
тканей. Кроме радиоактивного 60Со или 137Cs, являющихся источниками гамма- излучения, для внутриполостной терапии в настоящее время применяют и радионуклид калифорния – 252Cf. Калифорний является источником не только гамма-излучения, но и нейтронов с энергией 2,35 МэВ. Нейтронное облучение обладает высокой биологической активностью. Нейтронная внутриполостная терапия особенно показана при опухолях, резистентных к гамма-излучению и тормозному излучению.
Помещение для проведения внутриполостной лучевой терапии
Слайд 33В настоящее время наиболее оптимальным вариантом выполнения внутриполостного облучения является
применение шланговых гамма-терапевтических аппаратов типа АГАТ-В. Основной частью аппарата является
напольное стационарное хранилище. Внутри его размещены 7 источников излучения - пять источников в центральном канале и по одному в боковых каналах. Шланговый аппарат дает возможность осуществлять процедуру лечения в два этапа. Вначале в полость органа вводят аппликаторы (эндостаты) и рентгенологически проверяют их расположение, а затем по шлангам в аппликаторы вводят радиоактивные источники.
Шланговый гамма-терапевтический аппарат «Гаммамед»
Слайд 34Подача источников из хранилища в эндостаты (и обратно) производится дистанционно
по трем гибким шлангам-ампулопроводам сжатым воздухом от компрессора.
Поступление источников
в эндостаты контролируется с помощью сигнально-измерительного дозиметра. Данный метод облучения, получивший название “afterloading” (англ. after – после, load - заряжать), применяется при лечении опухолей полости рта, пищевода, рака тела и шейки матки, прямой кишки, мочевого пузыря и др.
При внутриполостной брахитерапии используются источники линейной или шаровидной формы с радиоактивным кобальтом или иридием. Препараты-бусы располагаются в специальном резиновом или полиуретановом зонде. Общая активность одного источника составляет 50-60 мКи. Активная длина источника излучения устанавливается в зависимости от размеров опухоли и должна превышать её на 2 см от краёв патологического процесса.
Слайд 35Другой разновидностью контактного воздействия на опухоль является внутритканевое облучение. В
этом случае радиоактивный препарат вводят непосредственно в ткань опухоли. Облучение
ее происходит непрерывно, вследствие чего его воздействию подвергаются опухолевые клетки во все фазы клеточного цикла. Для постоянной имплантации используют радионуклиды с коротким периодом полураспада – 198Au, 90Y, 125I, обладающие сравнительно низкой энергией излучения.
При внутритканевой лучевой терапии источник излучения находится непосредственно в опухоли или тканях организма больного в течение всего процесса лечения. Она осуществляется путем обкалывания гамма излучающими иглами, внедрения бета-излучающих стержней, гранул, «зерен»; прошивания опухоли радиоактивными нейлоновыми нитями с гамма-излучающими гранулами; используют также инъекционную имплантацию коллоидных растворов радионуклидов. При внутритканевой терапии существует необходимость ручных манипуляций с незащищенными источниками излучения, причем обязательно с соблюдением правил асептики, как и при хирургических операциях.
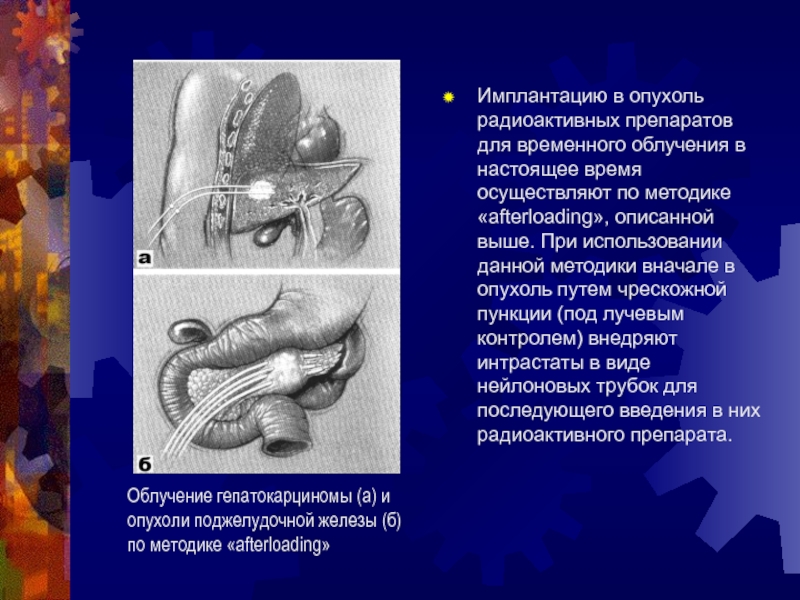
Слайд 36Имплантацию в опухоль радиоактивных препаратов для временного облучения в настоящее
время осуществляют по методике «afterloading», описанной выше. При использовании данной
методики вначале в опухоль путем чрескожной пункции (под лучевым контролем) внедряют интрастаты в виде нейлоновых трубок для последующего введения в них радиоактивного препарата.
Облучение гепатокарциномы (а) и опухоли поджелудочной железы (б) по методике «afterloading»
Слайд 37Внутритканевая лучевая терапия показана при ограниченных небольших опухолях, объём которых
можно определить довольно точно. Обычно он применяется при злокачественных новообразованиях
нижней губы, языка, молочной железы, наружных мужских и женских половых органов, внутреннего угла глаза, века.
Для внутритканевой лучевой терапии используются источники излучения кобальта и цезия в форме игл, отрезков тонкой проволоки, нейлоновых трубочек, гранул. Наиболее широкое применение получили иглы с кобальтом. Гамма-излучение кобальта является монохроматичным, а мягкое бета-излучение отсекается оболочкой из нержавеющей стали. Игла имеет форму цилиндра с заострённым концом и ушком. Если размер опухоли более 1 см, то иглы должны располагаться в двух или трёх плоскостях на расстоянии 1-1,5 см друг от друга.
Слайд 38Внутритканевую бета-терапию проводят только коллоидными растворами, так как они не
вступают в обменные процессы в организме. Целесообразно использовать в таких
случаях коллоидные растворы радиоактивного золота, индия и фосфора с энергией бета-частиц от 1,5 до 2 МэВ. Пути введения: непосредственное подведение к ложу опухоли или в рассасывающих материалах (метилцеллюлоза, кетгут, полисахариды). Показана внутритканевая бета-терапия при ограниченно малых размерах опухоли, при меланомах кожи и слизистых оболочек, метастазах меланомы в лимфатические узлы, саркоме мягких тканей, при метастазах различных опухолей в лимфатические узлы.
Слайд 39Основные радиационные величины и их единицы
Экспозиционная доза излучения - доза
излучения, которая измеряется в сухом (свободном) воздухе при отсутствии рассеивающих
тел. Она характеризует главным образом источник излучения (его мощность, постоянство параметров и др.). Экспозиционная доза применяется только для ионизирующего излучения с энергией не больше 3 МэВ.
Внесистемной единицей экспозиционной дозы является Рентген - это доза рентгеновского или -излучения, которая при нормальных условиях (00С и давлении 1 атмосфера) в 1 см3 воздуха образует заряд, равный 1 э. с. е. статического электричества (2,08 х 109 пар ионов каждого знака). Единицей измерения экспозиционной дозы в СИ является кулон на кг - это доза рентгеновского или -излучения, при которой в 1 кг воздуха при нормальных условиях образуется заряд, равный 1 кулону.
Слайд 40Одну и ту же дозу можно подвести в разные промежутки
времени. Поэтому вводится понятие мощности дозы - доза, рассчитанная на
единицу времени. В СИ она измеряется в амперах на килограмм (А/кг). Внесистемные единицы мощности экспозиционной дозы: рентген в секунду (Р/с), рентген в минуту (Р/мин) и рентген в час (Р/ч).
Поглощенная доза излучения - основной количественный показатель воздействия ионизирующих излучений на облучаемые ткани. Она определяется количеством энергии, переданной в процессе облучения единице массы облучаемого вещества. Поглощенная доза применяется для любого вида ионизирующего излучения. В СИ единица поглощенной дозы - Дж/кг. Эта величина получила название "Грей" (Гр). 1 Гр - это доза ионизирующего излучения, при которой в 1 кг облученного вещества поглотится энергия, равная 1 Дж. Внесистемная единица поглощенной дозы - рад.
Интегральная доза излучения - количество энергии, поглощенной в облучаемом объеме. В СИ единица интегральной дозы – грей-килограмм (Гр*кг); внесистемная единица – рад-грамм (рад*г).