Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФИЗИЧЕСКОЕ МАТЕРИАЛОВЕДЕНИЕ Лекция № 6 Фазовые переходы 1-го и 2-го порядка
Содержание
- 1. ФИЗИЧЕСКОЕ МАТЕРИАЛОВЕДЕНИЕ Лекция № 6 Фазовые переходы 1-го и 2-го порядка
- 2. Слайд 2
- 3. Слайд 3
- 4. Выше температуры Тs меньшей свободной энергией обладает
- 5. Для начала кристаллизации необходимо, чтобы процесс был
- 6. Слайд 6
- 7. Охлаждение металла в жидком состоянии сопровождается плавным
- 8. Фазовые переходы I-го и II-го рода.
- 9. Т.е., фазовые превращения первого рода сопровождаются скачкообразным изменением энтальпии (Н), объема (V) и энтропии (S).
- 10. Слайд 10
- 11. Слайд 11
- 12. Согласно принципу соответствия, каждой фазе и каждому
- 13. Слайд 13
- 14. Мерность геометрических элементов, характеризующих то или иное
- 15. Слайд 15
- 16. Для получения надежных выводов о строении ДФР
- 17. Слайд 17
- 18. Это значит, что при продолжающемся плавном снижении
- 19. 3.8. Возможные фазовые переходыСледует различать 4 возможных
- 20. Слайд 20
- 21. 3.5. Методы построения ДФР.Основной метод построения ДФР
- 22. Сущность термографического (ДТА) и дилатометрического методов построения
- 23. Скачать презентанцию
F= U – TS, (1) где U – внутренняя энергия системы; Т - абсолютная температура; S -
Слайды и текст этой презентации
Слайд 2 F= U – TS, (1) где
U – внутренняя энергия системы; Т - абсолютная температура; S - энтропия
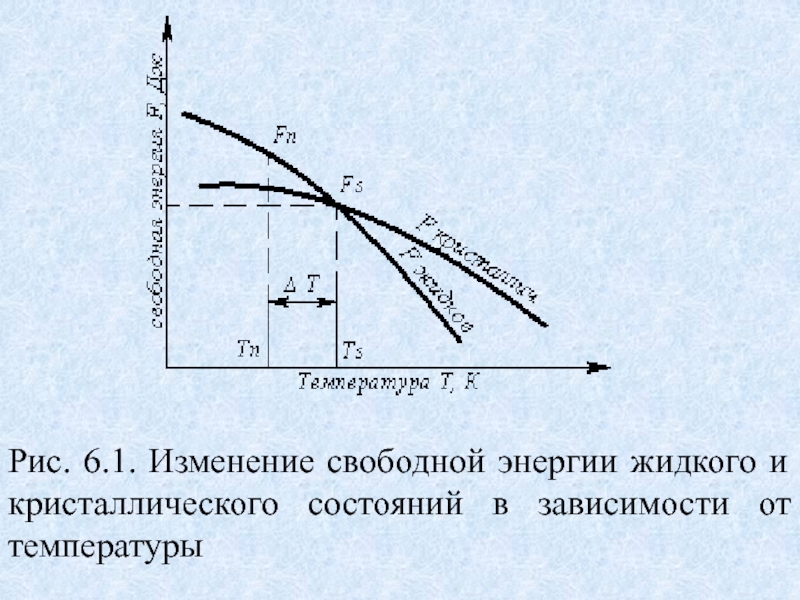
Можно сказать, что чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше. С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и твердого состояний (рис. 6.1).Слайд 3 Рис. 6.1. Изменение свободной энергии жидкого и кристаллического состояний в
зависимости от температуры
Слайд 4Выше температуры Тs меньшей свободной энергией обладает вещество в жидком
состоянии, ниже Ts – вещество в твердом состоянии. Следовательно, выше
Ts вещество должно находиться в жидком состоянии, а ниже Ts – в твердом, кристаллическом. При температуре, равной Ts свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическая температура кристаллизации. Однако, при Ts Fж = Fкр, и процесс кристаллизации (плавления) не может идти, так как при равенстве свободных энергий обеих фаз плавление (кристаллизация) не будут сопровождаться уменьшением свободной энергии.Слайд 5Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе
и сопровождался уменьшением свободной энергии системы. Из кривых (рис. 6.1)
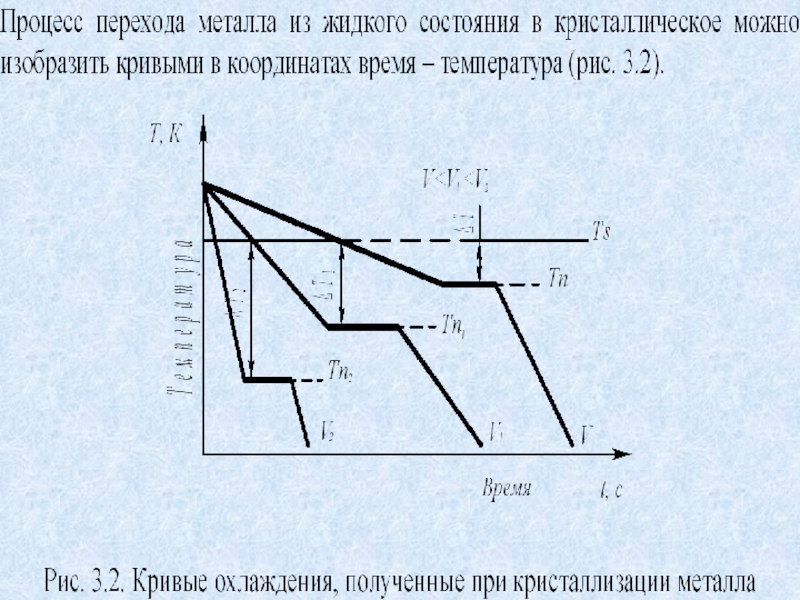
видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts. Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации. Охлаждение жидкости ниже температуры кристаллизации называется переохлаждением. Обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts, это явление называется перенагреванием. Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации T = Ts - Tф.Слайд 7Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и
может быть названо простым охлаждением, так как при этом нет
качественного изменения состояния. При достижении температур кристаллизации на кривой температура – время появляются горизонтальные площадки (рис.3.2), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации.Слайд 8Фазовые переходы I-го и II-го рода. К фазовым переходам первого
рода относятся такие переходы, при которых термодинамические потенциалы G, F,
H меняются без скачка, но скачкообразно меняются при температуре фазового перехода первые (частные) производные от термодинамических потенциалов: (G=H-TS=PV-TS)Слайд 9Т.е., фазовые превращения первого рода сопровождаются скачкообразным изменением энтальпии (Н),
объема (V) и энтропии (S).
Слайд 12Согласно принципу соответствия, каждой фазе и каждому фазовому равновесию отвечает
определенный геометрический образ на диаграмме фазового равновесия (ДФР). Принцип соответствия
более «емкий» принцип, чем принцип непрерывности.В рамках принципа соответствия могут быть также сформулированы важные положения, облегчающие анализ фазовых диаграмм:
Слайд 13 2. Все наклонные линии (поверхности) характеризуют предельную концентрацию основной легирующей
примеси в фазе. Наклон линий (поверхностей) характеризует температурную зависимость этих
предельных концентраций.Все линии двойных диаграмм и поверхности тройных диаграмм ограничивают фазовые области, число фаз в которых различается между собой на единицу.
Слайд 14Мерность геометрических элементов, характеризующих то или иное фазовое равновесие, отвечает
вариантности (С) соответствующего фазового равновесия. Пример: точки на диаграмме характеризуют
составы фаз, претерпевающих моновариантное превращение.Для сплава любого состава пересечение его ординатой (у )линий (поверхностей) на диаграмме в процессе охлаждения или нагрева сопровождается изменением фазового состава.
Слайд 16Для получения надежных выводов о строении ДФР следует изучать не
одно, а совокупность нескольких физических свойств. Важным методом определения числа
фаз (Ф) и их количества (концентрации) является металлографический анализ.При анализе ДФР (диаграмм состояния)пользуются прежде всего правилом фаз Гиббса (С-вариантность системы или число степеней свободы, К – число компонент):
С = К – Ф + 2
а) С = 0 - система нонвариантна. Система может существовать только при неизменных условиях. Изменение хотя бы одного из параметров системы вызовет изменение числа сосуществующих в равновесии фаз (Ф).
б) С = 1 - система моновариантна (одновариантна). При этом только один параметр может быть изменен без одновременного изменения числа равновесных фаз и т.д.
в). С = 2 – система дивариантна (двухвариантна). Два параметра могут быть изменены без одновременного изменения числа равновесных фаз.
Слайд 18Это значит, что при продолжающемся плавном снижении температуры нагревателя в
физико-химической системе будет поддерживаться температура за счет выделения теплоты кристаллизации.
На графике Т=f(τ) появится площадка Т=const, протяженность которой будет равна времени от начала до конца кристаллизации (τ-время).Что же поддерживает температуру системы Т=14120 С в условиях. Когда тепло непрерывно отводится внешней средой?
Источником поддержки температуры является выделяющаяся теплота кристаллизации.
При переходе вещества из одного фазового состояния в другое во внешнюю среду выделяется или из нее поглощается дополнительное количество энергии. Эта энергия называется теплотой фазового перехода и равна разности энтальпий старой и новой фаз.
(Задача. Рассмотреть кристаллизацию германия (Ge) при Р=const из его жидкого расплава, нагретого до 1200оС. Тпл(Ge) = 940oC. Определить значение С для разных фазовых областей.)
Слайд 193.8. Возможные фазовые переходы
Следует различать 4 возможных случаев фазовых переходов
(превращений):
При переходе из твердого состояния в жидкое или наоборот выделяется
теплота плавления или теплота кристаллизации.При переходе из одной твердой фазы в другую твердую фазу - теплота перекристаллизации.
При переходе из твердого состояния в газообразное или наоборот выделяется теплота сублимации.
При переходе из жидкого состояния в газообразное или наоборот выделяется теплота испарения.
Для случая 1, 3, 4 – характерны значительно большие абсолютные величины тепловых эффектов, чем для случая 2.
Слайд 213.5. Методы построения ДФР.
Основной метод построения ДФР – метод физико-химического
анализа, основы которого были разработаны академиком Курнаковым Н.С. (ИОНХ РАН
им. Курнакова). В основе физико-химического анализа лежит изучение функциональной зависимости между значениями физических свойств и параметрами Т, Р, Х. Знание этих зависимостей позволяет установить физико-химическую природу фаз и границ их существования. Физические свойства f(T), f(P), f(Х).Экспериментальные методы, используемые для построения ДФР.
Термографический анализ (дифференциально-термический анализ - ДТА).
Микрорентгеноспектральный анализ.
Рентгеноструктурный (рентгенографический) анализ (РСА, РФА). Также используется электронная микроскопия (ЭМ) и нейтронография (НГ).
Дилатометрический анализ (измерение плотности).