Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химические методы исследования белков
Содержание
- 1. Физико-химические методы исследования белков
- 2. Предмет курсаМетоды исследований биологических объектов (белков), основанные
- 3. План 6 лекцийМетоды определения размера, массы, олигомерного
- 4. Исследования биологических процессов и явленийIn vivoIn silicoIn vitro
- 5. Зачем исследовать белки в пробирке?Возможность сфокусироваться на
- 6. Размеры биологических объектов и белков
- 7. Олигомеры, ассоциаты, агрегаты, надмолекулярные структурыGFPфибриллыфикобилисомабактериофагпентамермикротрубочка
- 8. Слайд 8
- 9. Электронная микроскопия (ЭМ)
- 10. Электронная микроскопия (ЭМ)Resolving power (D) of light
- 11. Электронная микроскопия (ЭМ)Less diffraction of e- could be collected by electromagnetic lenses
- 12. Электронный микроскоп
- 13. Трансмиссионная электронная микроскопия (ТЭМ)Негативное окрашивание – получение
- 14. Что получаем в итоге? -микрофотографииМорфология агрегатов различных
- 15. Атомно-силовая микроскопия (AFM)
- 16. Атомно-силовая микроскопия (AFM)Регистрируются силы межатомного взаимодействия (притяжения
- 17. Атомно-силовая микроскопия (AFM)Вариации:Контактная AFMБесконтактная AFMВысокоскоростная AFMкантилевер
- 18. Атомно-силовая микроскопия (AFM)Вариации:Контактная AFMБесконтактная AFMВысокоскоростная AFMx,y scannerz scannerмогулкантилеверкантилевер
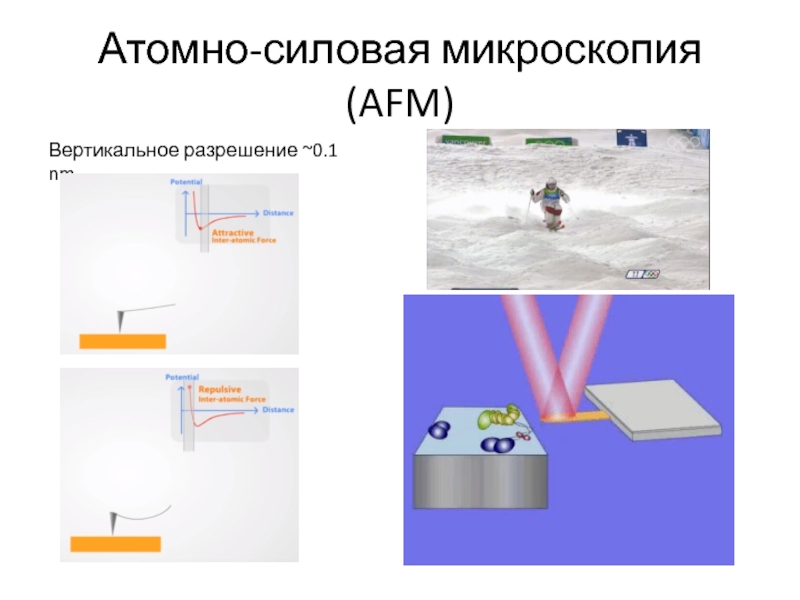
- 19. Атомно-силовая микроскопия (AFM)Вертикальное разрешение ~0.1 nm
- 20. Что мы получаем в итоге?Статические изображения поверхности
- 21. DLS – dynamic light scattering
- 22. Рассеяние светаЭлектромагнитное излучение, проходя через среду, взаимодействует
- 23. DLS – dynamic light scattering= Квазиупругое рассеяние
- 24. 9Схематическое изображение анализатора Malvern Zetasizer Nano ZSаба.
- 25. What happens with DLS?
- 26. Autocorrelation functionКоэффициент диффузии DTimeIntensityTime100 = 123CorrelationCoefficientZ(D) –
- 27. What to expect from small vs large particles?
- 28. Фитирование автокорреляционной функции с получением распределенияDiameter, nmDiameter,
- 29. What if we have a heterogenous sample?Необходимо
- 30. Applications of DLSovalbumin
- 31. DLS to study aggregationPhK aggregation at 40°C
- 32. Плюсы и минусы DLSВремя на опыт (определение
- 33. Fluorescence correlation spectroscopy (FCS)
- 34. Fluorescence correlation spectroscopy (FCS)Флуктуации интенсивности флуоресценции в
- 35. Fluorescence correlation spectroscopy (FCS)Флуктуации интенсивности флуоресценции в
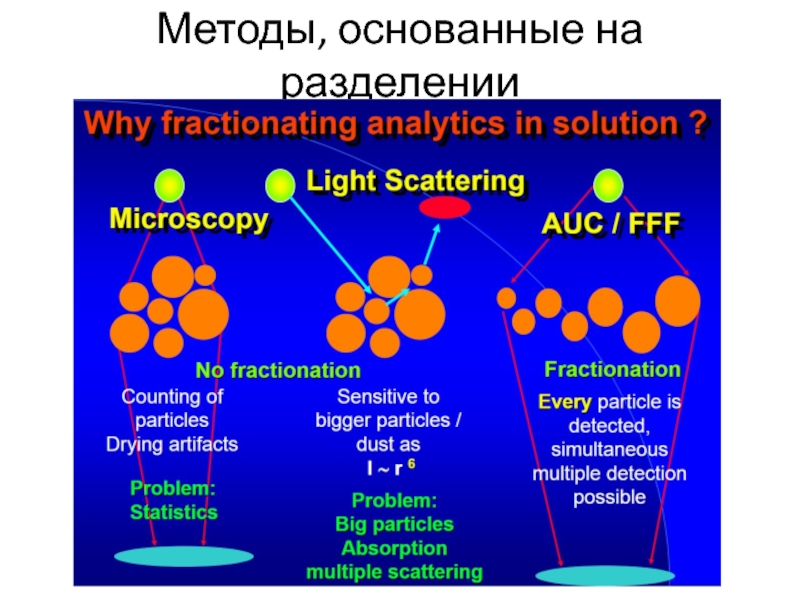
- 36. Методы, основанные на разделении
- 37. AUC – analytical ultracentrifugation
- 38. AUC – analytical ultracentrifugation1923 г. – первая
- 39. AUC – analytical ultracentrifugationячейка:ячейки:ротор:До 0.5 мл образца
- 40. Что происходит во время опыта?
- 41. Physics behind AUCTheodor Svedberg1884-1971Nobel Prize (chemistry), 1926Lamm
- 42. Эйнштейн (1905):
- 43. s may significantly differ at different temperature
- 44. AUC variationsСкоростной седиментационный анализ (скоростное ультрацентрифугирование, sedimentation
- 45. Sedimentation velocity (SV)
- 46. Sedimentation equilibrium (SE)
- 47. Analytical ultracentrifugation types
- 48. Sedimentation velocityОпределение скорости движения фронтаКоличество фронтов –
- 49. Sedimentation velocity
- 50. Sedimentation velocity
- 51. Shape of the particles matters, and can
- 52. Проблемы скоростного центрифугированияДля разделения частиц с большой
- 53. Sedimentation equilibriumФорма частиц уже не играет роли,
- 54. Sedimentation equilibriumРаспределение вещества по радиусу при разных
- 55. Sedimentation equilibriumМасса может быть определена независимо от
- 56. Sedimentation equilibriumРаспределение вещества по радиусу после установления равновесия говорит о массе частиц !
- 57. Что нам надо знать и что мы хотим узнать? Как выбрать тип AUC?SedFIT program input:http://www.analyticalultracentrifugation.com/sedfit_help_model.htm
- 58. Плюсы и минусы AUCНет разбавления, широкий диапазон
- 59. Oligomeric structure of the small heat shock
- 60. Сравнение размеров полноразмерного и укороченного белкаИсследование образования
- 61. AU-FDS – ультрацентрифугирование с флуоресцентной детекциейПервое упоминание
- 62. AU-FDS – ультрацентрифугирование с флуоресцентной детекциейВся оптика перемещается вдоль радиальной осиСканирование ~2 мин
- 63. AU-FDS – ультрацентрифугирование с флуоресцентной детекцией3,000 rpm50,000
- 64. AU-FDS – NUTS and BOLTSBiological Online Tracer Sedimentation Normal Use Tracer Sedimentation
- 65. Poly Q aggregation in C.elegans
- 66. Конец лекции 11.11.19
- 67. Аналитическая гель-фильтрация (SEC) с многопараметрической детекцией (ASESC, FASESC)
- 68. Аналитическая гель-фильтрация (SEC)Разделение частиц по размерам (согласно
- 69. Аналитическая гель-фильтрация (SEC) – принцип разделения
- 70. Selectivity and efficiency of separationSelectivity – the
- 71. Theoretical plates and resolutionAbstract term (~efficiency)Imaginary layers
- 72. Theoretical plates and resolutionAbstract term (~efficiency)Imaginary layers
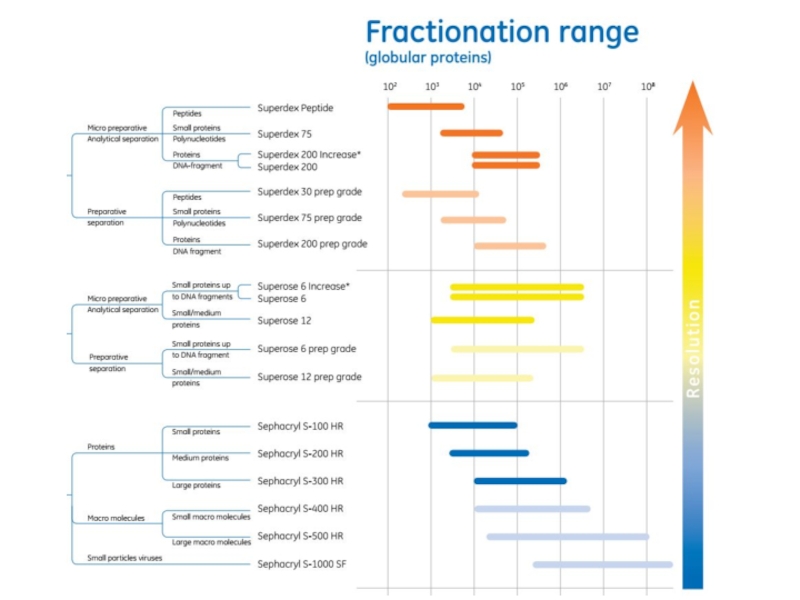
- 73. Selectivity curves and fractionation rangeS200 range
- 74. Слайд 74
- 75. SEC columns
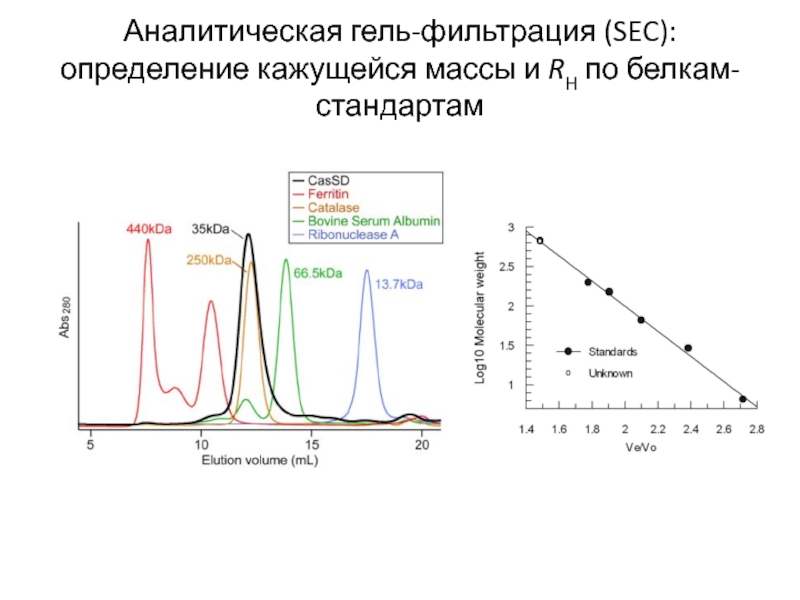
- 76. Аналитическая гель-фильтрация (SEC): определение кажущейся массы и RH по белкам-стандартам
- 77. Аналитическая гель-фильтрация (SEC): определение кажущейся массы и RH по белкам-стандартам
- 78. Oligomeric transitions, concentration dependencesSluchanko et al Nature Commun. 2018Maksimov et al Biophys J 2017
- 79. Protein aggregation – depletion of the soluble,
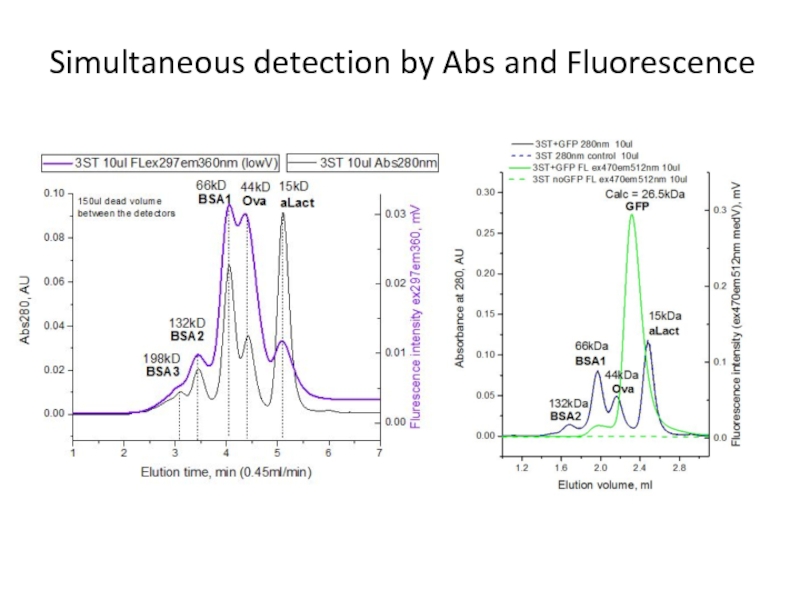
- 80. Simultaneous detection by Abs and Fluorescence
- 81. SESC allows to screen expression of FP-tagged proteins directly in clarified lysatesTagRFP-CTDHdimermonomer
- 82. Full spectrum detection using diode array detectors (DAD)
- 83. SESC provides unique combined information about hydrodynamics and spectral properties of samples
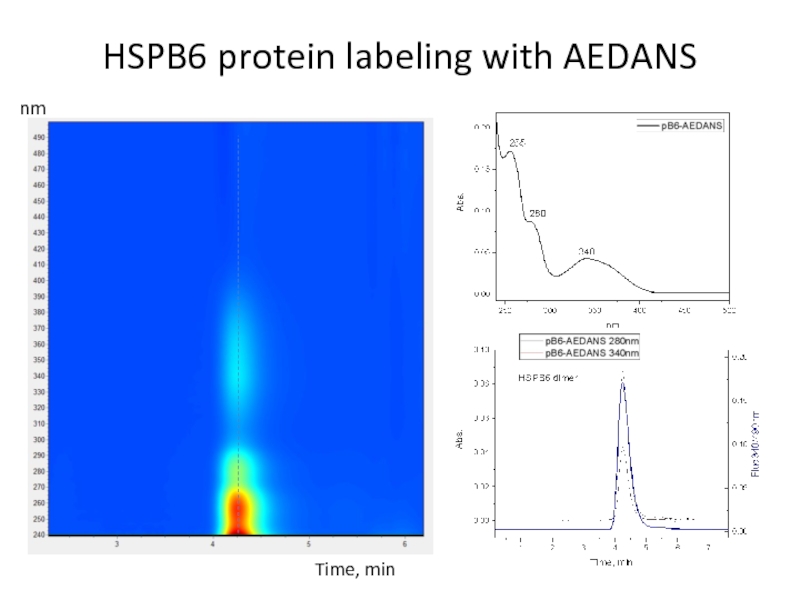
- 84. HSPB6 protein labeling with AEDANSnmTime, min
- 85. MALLS (Multi-Angle Laser Light Scattering)
- 86. SEC-MALLS (Multi-Angle Laser Light Scattering) Статическое
- 87. SEC-MALLS (Multi-Angle Laser Light Scattering) Статическое
- 88. BSA analysis by SEC-MALLS
- 89. MALLS detector Column calibrationAbsolute mass determination of the elutes particles
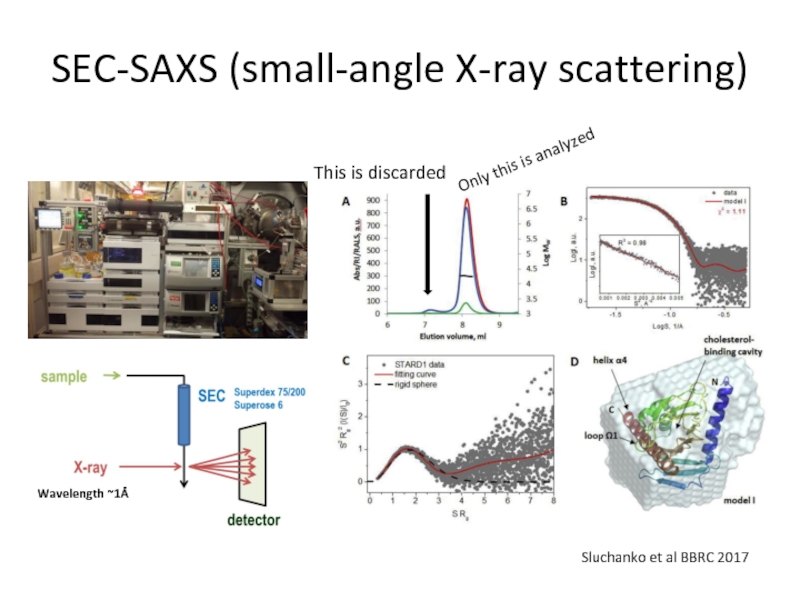
- 90. SEC-SAXS (small-angle X-ray scattering)Sluchanko et al BBRC 2017Wavelength ~1ÅThis is discardedOnly this is analyzed
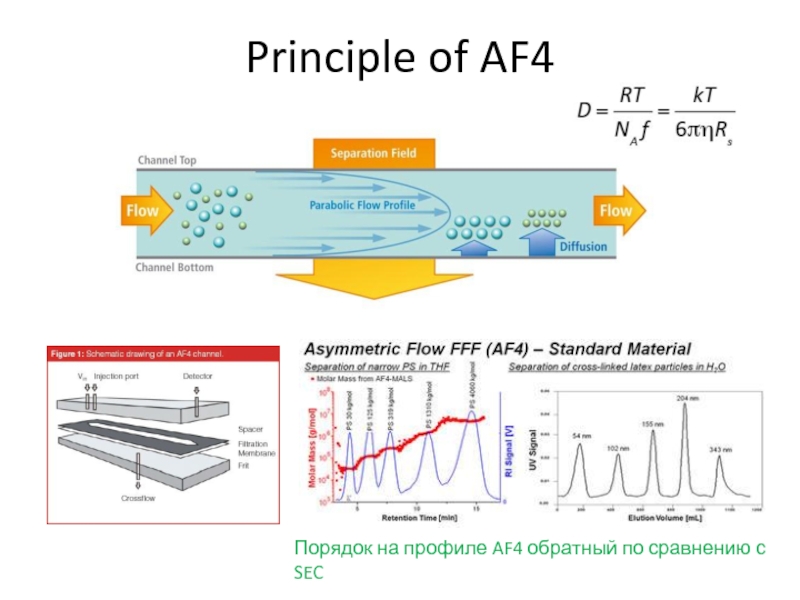
- 91. Фракционирование в поле асимметричного потока (asymmetric flow field flow fractionation, AF4)
- 92. Фракционирование в поле асимметричного потока (AF4)Asymmetric flow
- 93. Principle of AF4Порядок на профиле AF4 обратный по сравнению с SEC
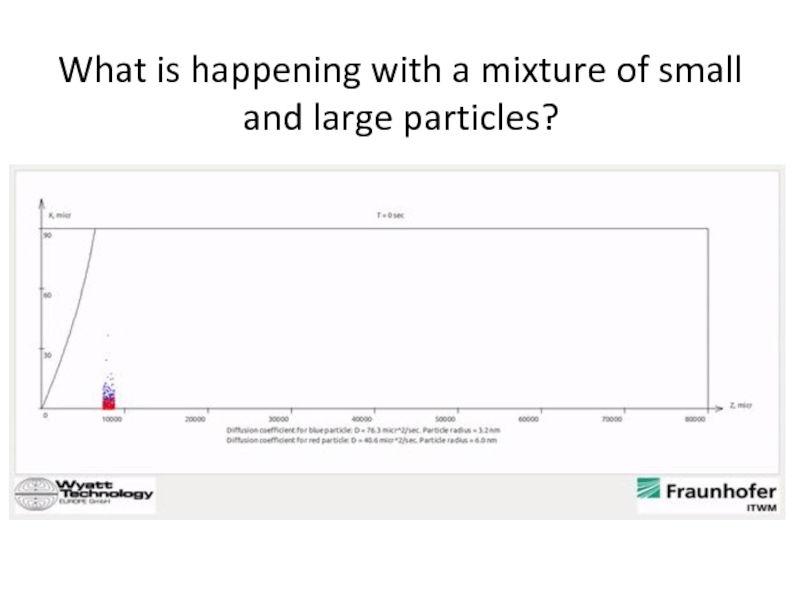
- 94. What is happening with a mixture of small and large particles?
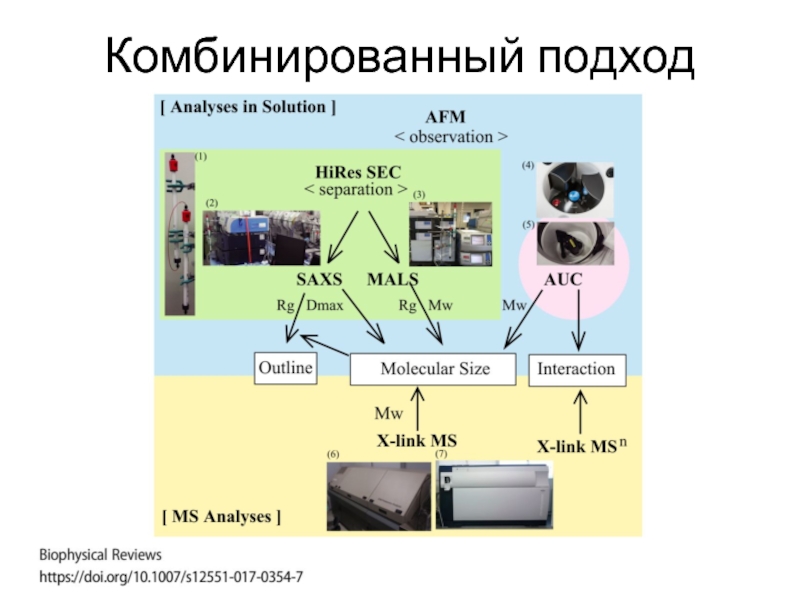
- 95. Комбинированный подход
- 96. Примеры экспериментальных задач – какой метод(ы) оптимален?
- 97. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Физико-химические методы исследования белков
Николай Николаевич Случанко
в.н.с., к.б.н.
Группа белок-белковых взаимодействий
ФИЦ
Биотехнологии РАН
Слайд 2Предмет курса
Методы исследований биологических объектов (белков), основанные на физических или
химических явлениях (их сочетании)
Набор методов и подходов крайне широк
Будут упомянуты
многие, но подробно освещены только актуальные и широко используемые сегодня (и то не все)Слайд 3План 6 лекций
Методы определения размера, массы, олигомерного состояния и гидродинамических
свойств белков (EM, AFM, DLS, AUC, SEC, AF4). Примеры.
Первичная структура,
идентификация белка. Масс-спектрометрия. Спектральные методы (CD, IR, Raman). Нативная структура, денатурация и агрегация белка. Методы исследования стабильности белков (CD, DSC, DSF). Примеры.Рентгеновская кристаллография (macromolecular crystallography, MX). Нейтронная и электронная кристаллография. Работа со структурными моделями (PBD и PyMOL). Примеры.
Малоугловое рассеяние лучей (SAXS и SANS). Примеры
Другие методы исследования структуры белков (NMR, Cryo-EM, Cryo-electrotomography, native-MS, HDX-MS). Интегральный подход и моделирование белков по гомологии (iTasser). Примеры.
Методы исследования белок-белковых взаимодействий (Co-IP, equilibrium dialysis, ITC, SPR, BLIC, MST, QMb, SESC). Примеры.
Слайд 5Зачем исследовать белки в пробирке?
Возможность сфокусироваться на конкретном процессе, явлении
с участием конкретного белка
Возможность исследовать бинарные взаимодействия
Переход к более простой
системе, позволяющей однозначные интерпретацииМногие сложные системы могут быть разбиты на составные элементы, подверженные редукционистскому подходу
Исследование свойств, структуры и функции конкретных белков, их взаимосвязи
Определение структуры макромолекулы (белка) с атомным разрешением
Понимание структуры, динамики, молекулярных ассоциаций определяет понимание того, как молекулы работают
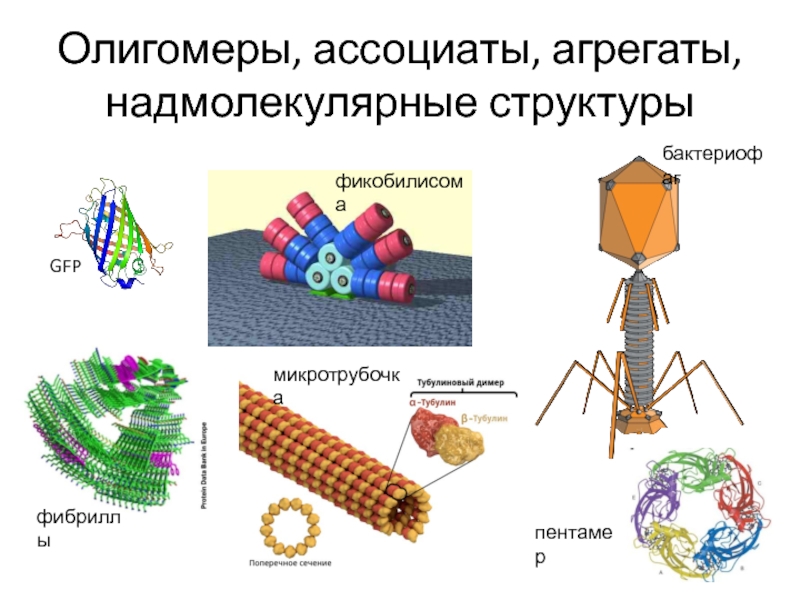
Слайд 7Олигомеры, ассоциаты, агрегаты, надмолекулярные структуры
GFP
фибриллы
фикобилисома
бактериофаг
пентамер
микротрубочка
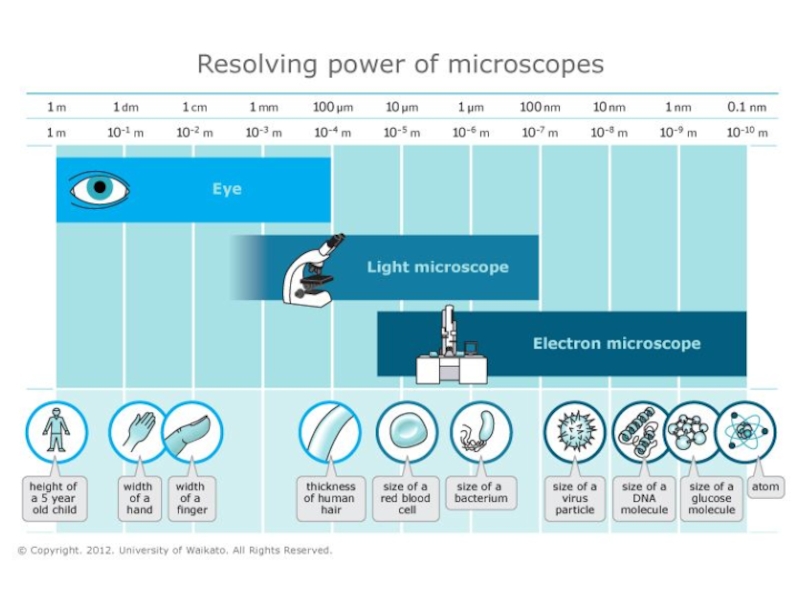
Слайд 10Электронная микроскопия (ЭМ)
Resolving power (D) of light microscope is 200-250
nm
Electron microscope was invented (Ernst Ruska, 1933) – resolving power
is up to 0.1 nm100,000 times shorter λ
TEM микрофотография GroEL/S
D ~ λ/2
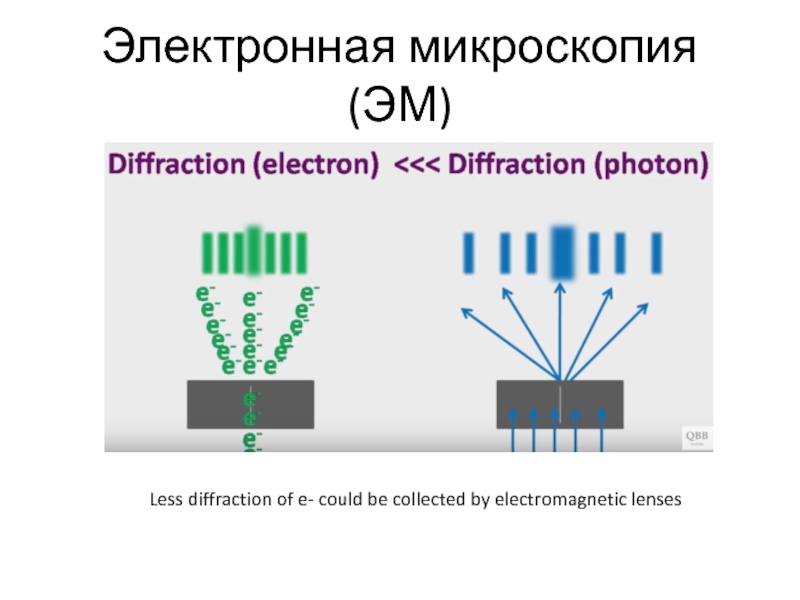
Слайд 11Электронная микроскопия (ЭМ)
Less diffraction of e- could be collected by
electromagnetic lenses
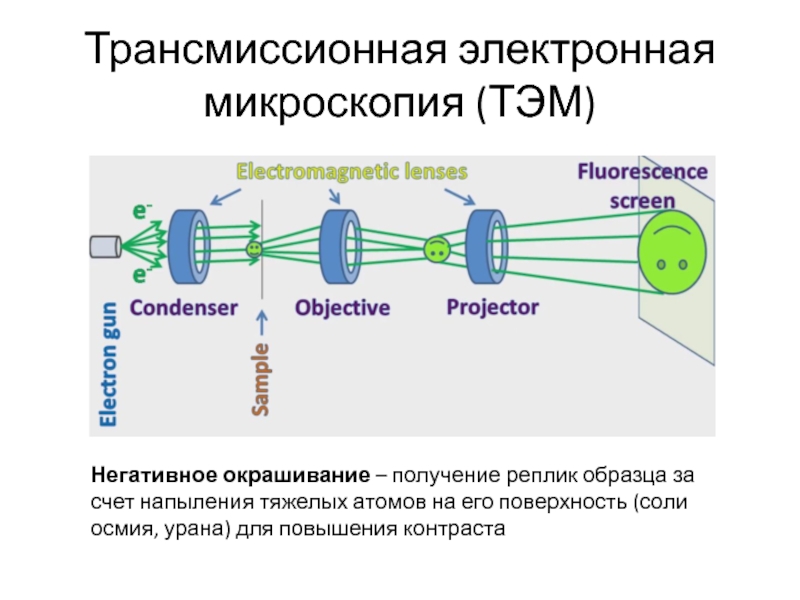
Слайд 13Трансмиссионная электронная микроскопия (ТЭМ)
Негативное окрашивание – получение реплик образца за
счет напыления тяжелых атомов на его поверхность (соли осмия, урана)
для повышения контрастаСлайд 14Что получаем в итоге? -микрофотографии
Морфология агрегатов различных белков
Представление о размере
и форме крупных белковых комплексов
100nm
aB-crystallin
Надо подбирать концентрацию образца!
Разрешение недостаточное для
структурного анализа100nm
https://doi.org/10.1371/journal.pone.0076427
Human Vitamin C Transporter SVCT1
Слайд 16Атомно-силовая микроскопия (AFM)
Регистрируются силы межатомного взаимодействия (притяжения или отталкивания) между
концом зонда и поверхностью образца
Особенности:
Кантилевер (зонд)
Лазер (для отслеживания положения кантилевера)
Обратная
связь с регистрацией отклонения луча из-за отклонения кантилевера от поверхности объектаx,y scanner
z scanner
кантилевер
Слайд 17Атомно-силовая микроскопия (AFM)
Вариации:
Контактная AFM
Бесконтактная AFM
Высокоскоростная AFM
кантилевер
Слайд 18Атомно-силовая микроскопия (AFM)
Вариации:
Контактная AFM
Бесконтактная AFM
Высокоскоростная AFM
x,y scanner
z scanner
могул
кантилевер
кантилевер
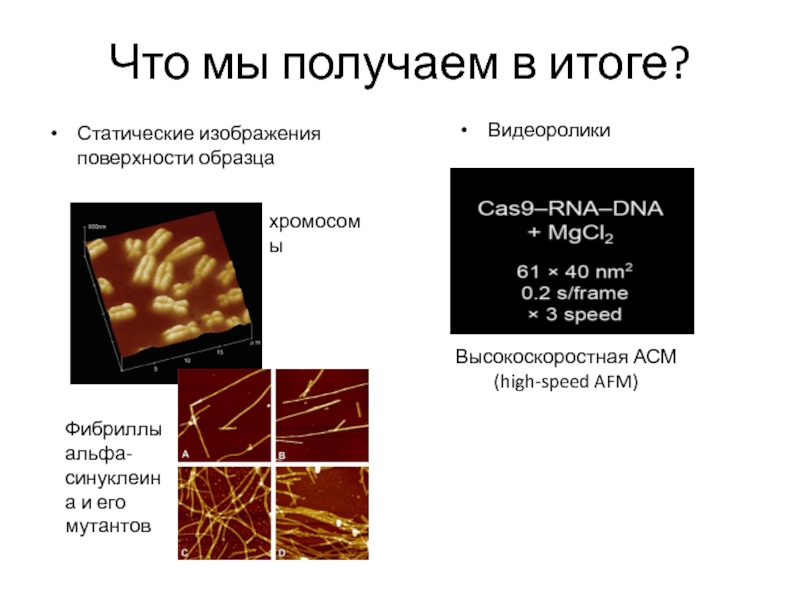
Слайд 20Что мы получаем в итоге?
Статические изображения поверхности образца
Видеоролики
хромосомы
Фибриллы альфа-синуклеина
и его мутантов
Высокоскоростная АСМ (high-speed AFM)
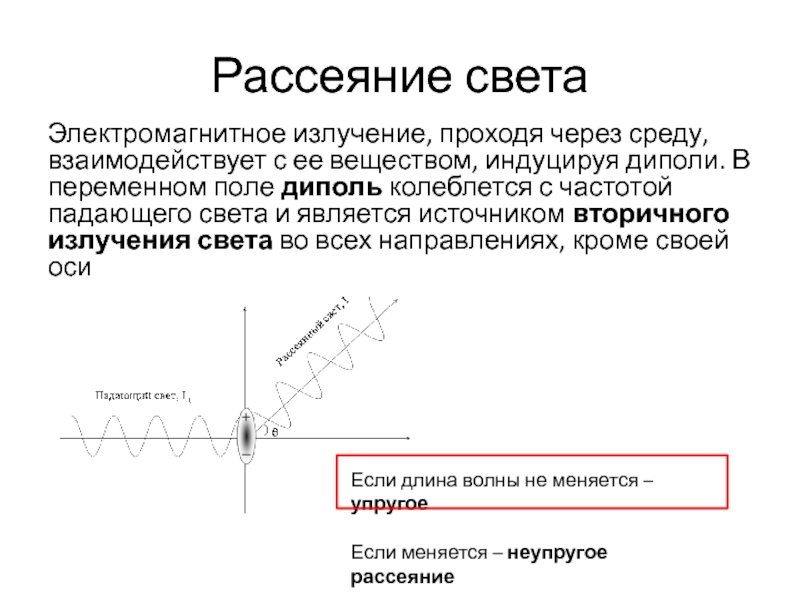
Слайд 22Рассеяние света
Электромагнитное излучение, проходя через среду, взаимодействует с ее веществом,
индуцируя диполи. В переменном поле диполь колеблется с частотой падающего
света и является источником вторичного излучения света во всех направлениях, кроме своей осиЕсли длина волны не меняется – упругое
Если меняется – неупругое рассеяние
Слайд 23DLS – dynamic light scattering
= Квазиупругое рассеяние (quasielastic scattering, qELS)
Регистрируются
флуктуации интенсивности света во времени под определенным (фиксированным) углом (90°,
173°)Связано с Броуновским движением частиц
Позволяет определить коэффициент диффузии, диаметр частиц (DH, RH)
Типичный объем образца 400-800 мкл
Необходимо «копить» сигнал (low-throughtput)
Поскольку температура и вязкость влияют на диффузию частиц, от них зависит DLS
MALVERN ZETASIZER NANO ZS
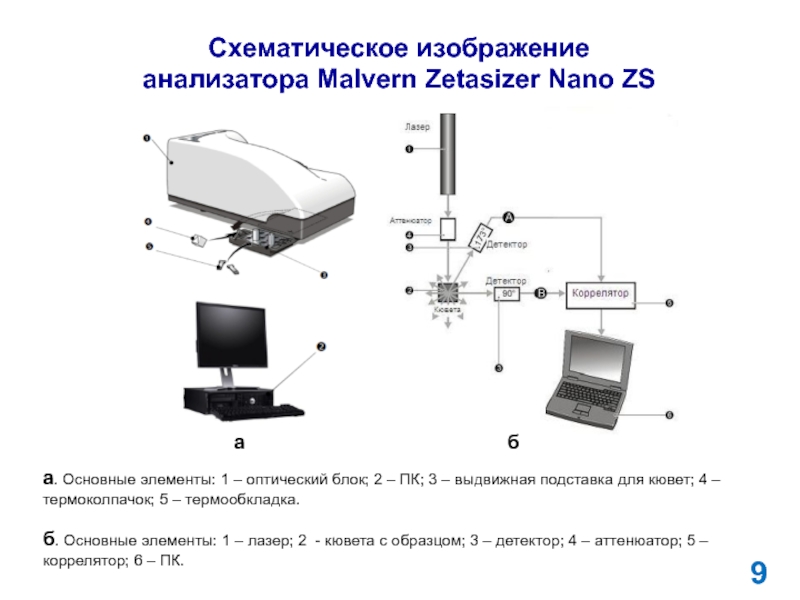
Слайд 249
Схематическое изображение
анализатора Malvern Zetasizer Nano ZS
а
б
а. Основные элементы: 1
– оптический блок; 2 – ПК; 3 – выдвижная подставка
для кювет; 4 – термоколпачок; 5 – термообкладка.б. Основные элементы: 1 – лазер; 2 - кювета с образцом; 3 – детектор; 4 – аттенюатор; 5 – коррелятор; 6 – ПК.
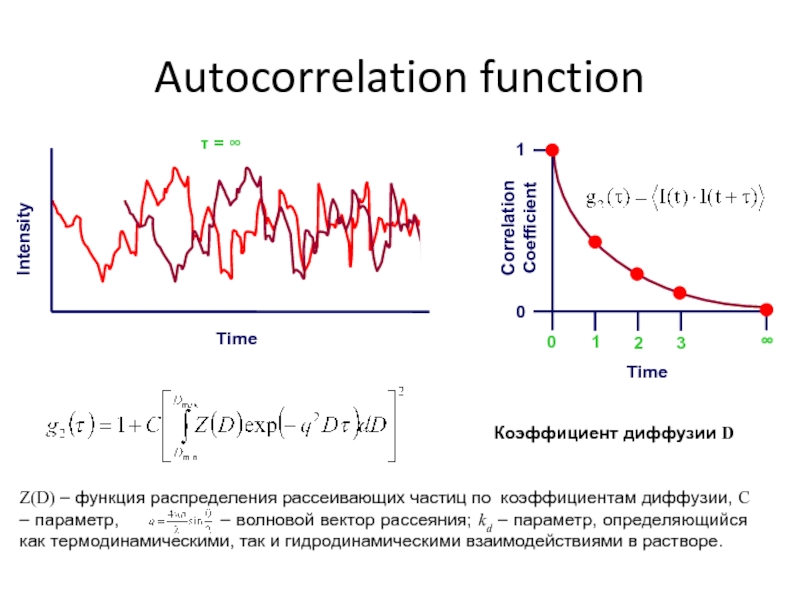
Слайд 26Autocorrelation function
Коэффициент диффузии D
Time
Intensity
Time
1
0
0
=
1
2
3
Correlation
Coefficient
Z(D) – функция распределения рассеивающих
частиц по коэффициентам диффузии, С – параметр,
– волновой вектор рассеяния; kd – параметр, определяющийся как термодинамическими, так и гидродинамическими взаимодействиями в растворе.Слайд 28Фитирование автокорреляционной функции с получением распределения
Diameter, nm
Diameter, nm
Diameter, nm
Relative %
in class
Relative % in class
Relative % in class
Среднеинтенсивностный
Среднеобъемный
Среднечисленный
Образец содержит 2
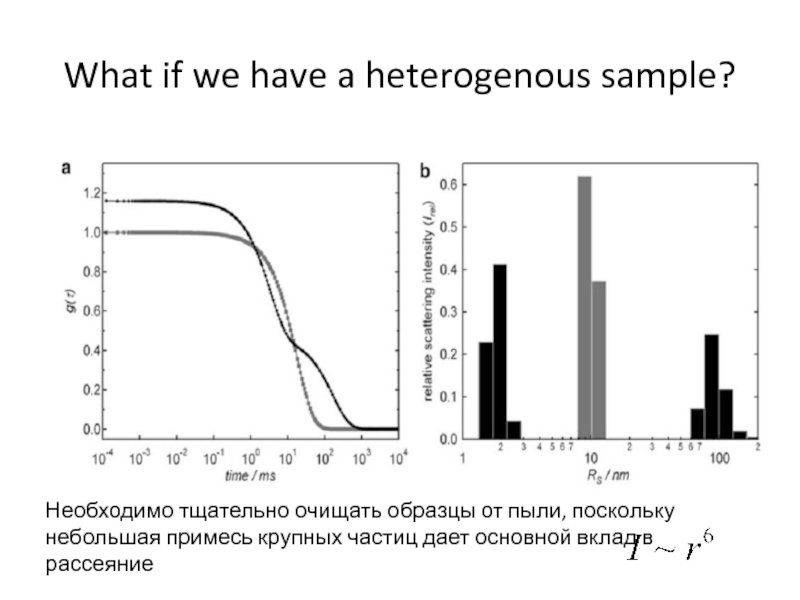
фракции частиц (50% и 50%) с размером 10 нм и 100 нмСлайд 29What if we have a heterogenous sample?
Необходимо тщательно очищать образцы
от пыли, поскольку небольшая примесь крупных частиц дает основной вклад
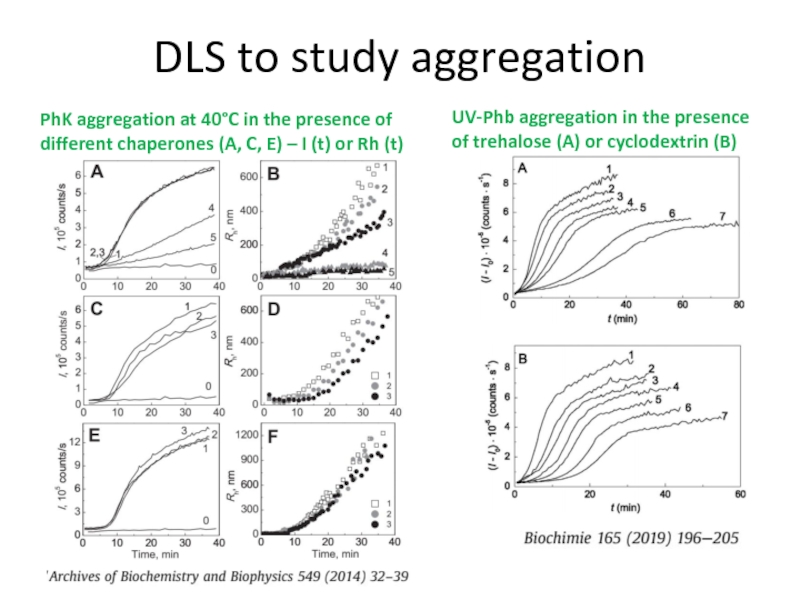
в рассеяниеСлайд 31DLS to study aggregation
PhK aggregation at 40°C in the presence
of different chaperones (A, C, E) – I (t) or
Rh (t)UV-Phb aggregation in the presence of trehalose (A) or cyclodextrin (B)
Слайд 32Плюсы и минусы DLS
Время на опыт (определение распределения размеров в
образце) – до 30 мин
Всего от 20 мкг образца
Можно не
разделять образец на компоненты (например, смесь олигомеров)Оборудование может позволить себе почти любая лаборатория
Капризный по отношению к загрязнениям (пыли)
Нет надежной объективной оценки качества анализа (любую автокорреляционную функцию можно фитировать)
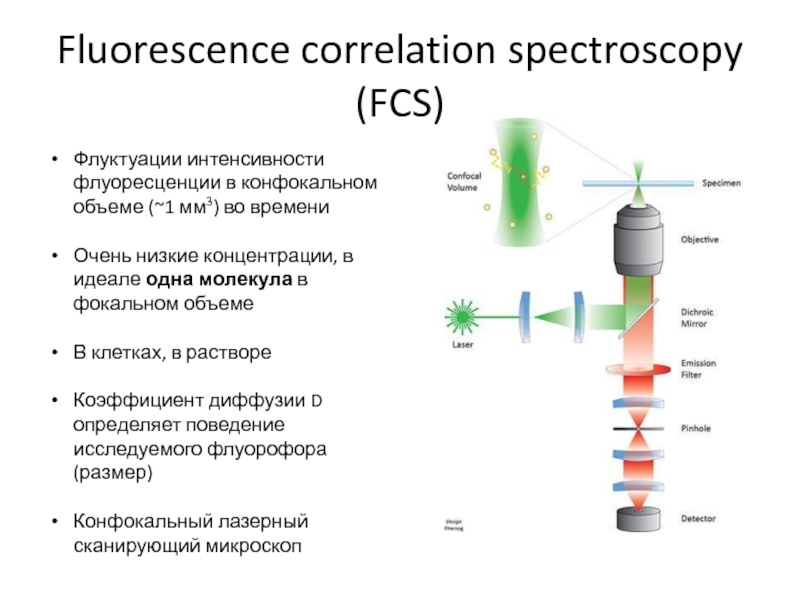
Слайд 34Fluorescence correlation spectroscopy (FCS)
Флуктуации интенсивности флуоресценции в конфокальном объеме (~1
мм3) во времени
Очень низкие концентрации, в идеале одна молекула в
фокальном объемеВ клетках, в растворе
Коэффициент диффузии D определяет поведение исследуемого флуорофора (размер)
Конфокальный лазерный сканирующий микроскоп
Слайд 35Fluorescence correlation spectroscopy (FCS)
Флуктуации интенсивности флуоресценции в конфокальном объеме (~1
мм3) во времени
Очень низкие концентрации, в идеале одна молекула в
фокальном объемеВ клетках, в растворе
Коэффициент диффузии D определяет поведение исследуемого флуорофора (размер)
Конфокальный лазерный сканирующий микроскоп
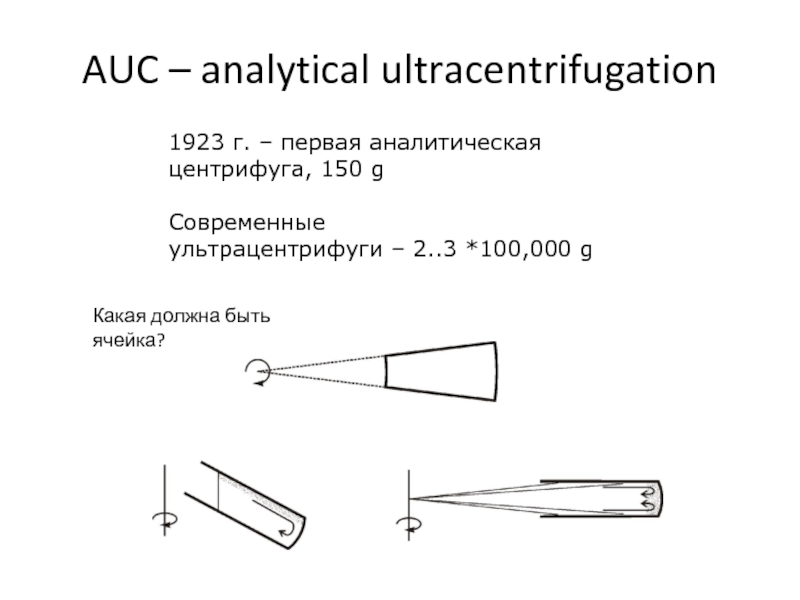
Слайд 38AUC – analytical ultracentrifugation
1923 г. – первая аналитическая центрифуга, 150
g
Современные
ультрацентрифуги – 2..3 *100,000 g
Какая должна быть ячейка?
Слайд 41Physics behind AUC
Theodor Svedberg
1884-1971
Nobel Prize (chemistry), 1926
Lamm equation
диффузия
осаждение
Описывает временные изменения
в распределении концентрации молекулы при осаждении:
Stokes law
Сила вязкости, действующая на
малую сферу радиуса r, движущуюся через вязкую жидкость:Сила трения = f * скорость молекулы
Слайд 43s may significantly differ at different temperature and viscosity and
is corrected for “standard” conditions
Olwin Byron, 2015
Слайд 44AUC variations
Скоростной седиментационный анализ (скоростное ультрацентрифугирование, sedimentation velocity)
Высокие скорости, осаждение
превышает диффузию
Равновесный седиментационный анализ (sedimentation equilibrium)
Средние скорости, осаждение и диффузия
одного порядкаОпыты долгие по времени – часы (скоростное осаждение) или десятки часов (равновесное осаждение)
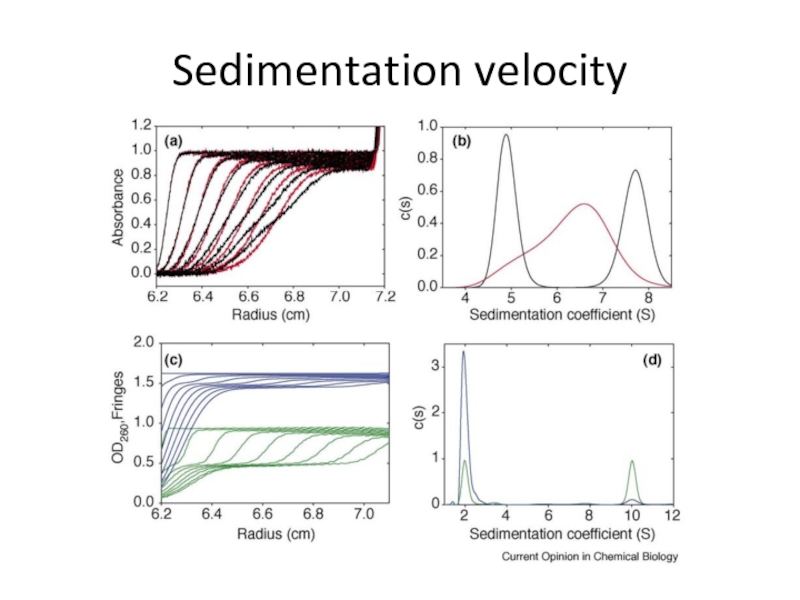
Слайд 48Sedimentation velocity
Определение скорости движения фронта
Количество фронтов – количество компонент
Расчет коэффициента
(скорости) оседания (S)
Расчет размера частиц или его распределения
Скорость оседания зависит
от: молярной массы
формы (фрикционное соотношение, сплюснутость),
заряда
относительной плотности
Рассчитывается для заданного набора условий (температура, плотность растворителя, вязкость и т.п.)
Слайд 51Shape of the particles matters, and can be estimated in
homogenous systems (additional parameter)
f/f0:
1 – сфера
1.2 – для среднего глобулярного
белкаa
b
a/b = aspect ratio
Слайд 52Проблемы скоростного центрифугирования
Для разделения частиц с большой разницей в размере
необходимо делать при разных скоростях (малые частицы не сдвинутся, тогда
как агрегаты быстро осядут на дно)Агрегация в ходе эксперимента (фронт уплотняет частицы, повышая концентрацию)
Сложные растворы тяжело описать с точки зрения размера частиц (расчет индивидуальных компонентов системы) – нужно точно знать состав и концентрации компонент буфера!
Зарядовые взаимодействия в некоторых системах сильно влияют на получаемые распределения размеров (одноименные заряды отталкиваются, разноименные притягиваются)
Сложно интерпретировать смеси частиц с разной массой, формой, плотностью, гидратной оболочкой
Низкое временное разрешение
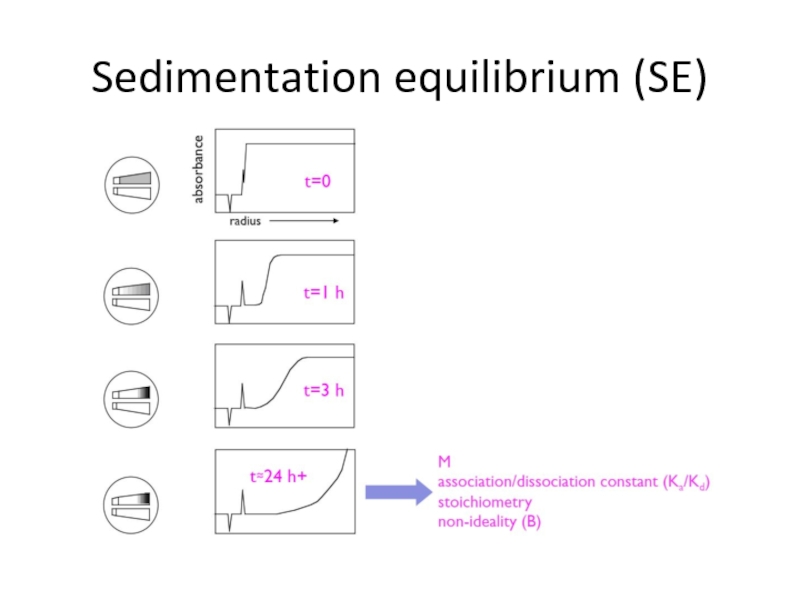
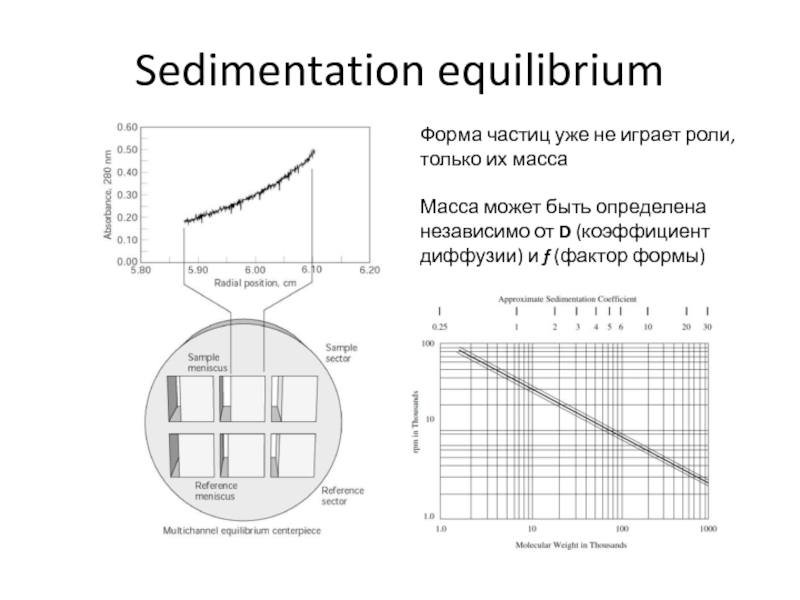
Слайд 53Sedimentation equilibrium
Форма частиц уже не играет роли, только их масса
Масса
может быть определена независимо от D (коэффициент диффузии) и f
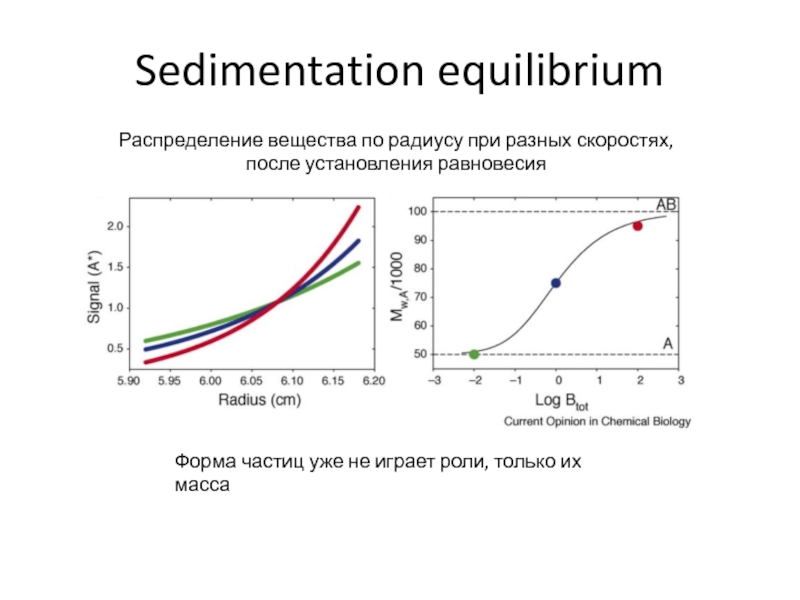
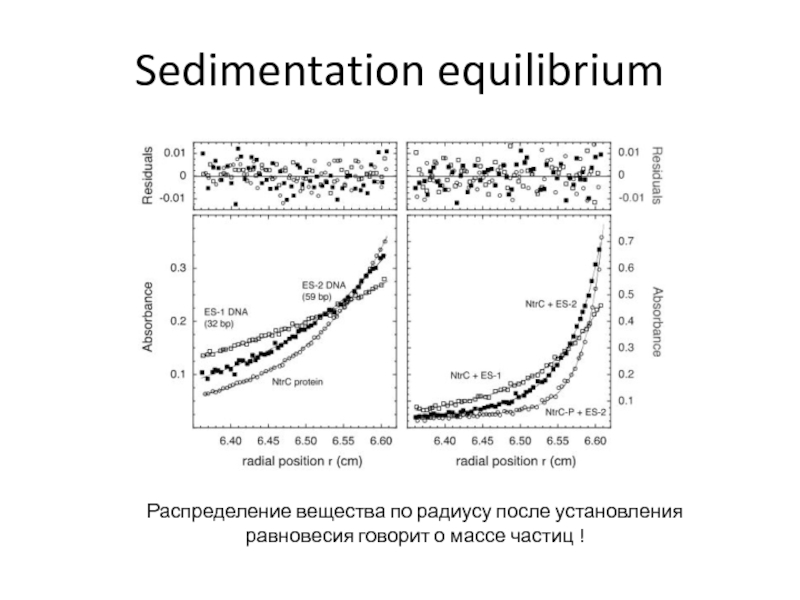
(фактор формы)Слайд 54Sedimentation equilibrium
Распределение вещества по радиусу при разных скоростях, после установления
равновесия
Форма частиц уже не играет роли, только их масса
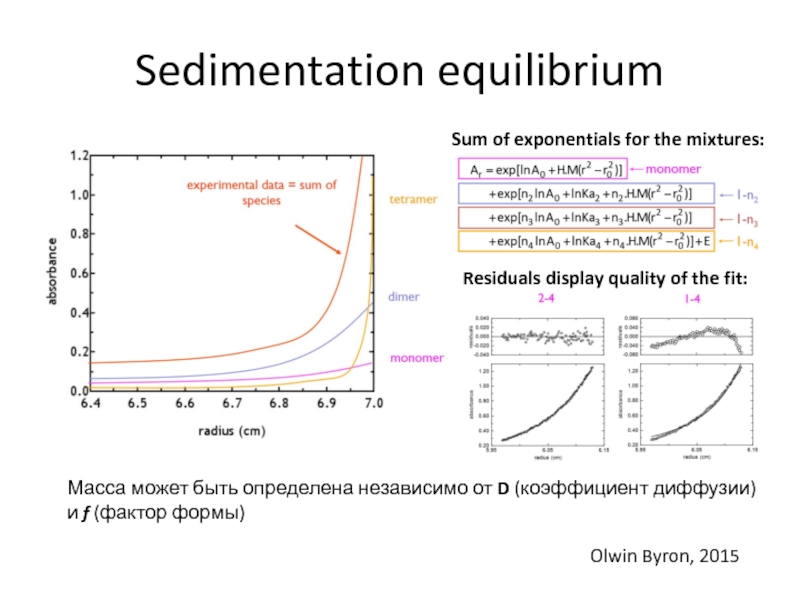
Слайд 55Sedimentation equilibrium
Масса может быть определена независимо от D (коэффициент диффузии)
и f (фактор формы)
Sum of exponentials for the mixtures:
Olwin Byron,
2015Residuals display quality of the fit:
Слайд 56Sedimentation equilibrium
Распределение вещества по радиусу после установления равновесия говорит о
массе частиц !
Слайд 57Что нам надо знать и что мы хотим узнать? Как
выбрать тип AUC?
SedFIT program input:
http://www.analyticalultracentrifugation.com/sedfit_help_model.htm
Слайд 58Плюсы и минусы AUC
Нет разбавления, широкий диапазон концентраций и состава
буфера
Разделяемые частицы могут отличаться по массе на 3 порядка
Определение размеров
частиц из первых принциповПревосходное разделение частиц по массе
(для сферических частиц ~M2/3)
Долгий эксперимент (часы)
Ограниченное число образцов за раз (low throughput)
Дорогостоящее оборудование (центрифуга+оптика)
https://www.yumpu.com/en/document/read/51005381/analytical-ultracentrifugation/17
Слайд 59Oligomeric structure of the small heat shock protein B6 in
the crowded media modelled by TMAO
SV analysis at 20° C
and rotor speed equal to 52000 rpm. Protein concentration of the samples was 0.3 mg/ml. Insert on panel A represents the analysis of purity and electrophoretic mobility of used samples of HspB6 (1), S16D (2) and pHspB6 (3) by native gel-electrophoresis. Insert on panel C shows c(M) distribution for pHspB6. Sedimentation coefficients and per cent of corresponding species are indicated at the corresponding peaks.+TMAO
-TMAO
B6
S16D
pB6
Слайд 60Сравнение размеров полноразмерного и укороченного белка
Исследование образования комплекса между двумя
белками
Ситуация, когда белки взаимодействуют, хорошо описывает данные SE
Ситуация, когда белки
НЕ взаимодействуют, дает сильные отклонения при фитингеСлайд 61AU-FDS – ультрацентрифугирование с флуоресцентной детекцией
Первое упоминание детектора для Beckman
Model E в 1976
Встроенный конфокальный флуориметр с мотором
Сильно взаимодействующие системы
(high-affinity)Исследование поведения одного компонента в сложной смеси
Преимущества: чувствительность и селективность
Недостатки: стоимость оборудования, нелинейность сигнала, необходимость флуоресцентного мечения или уникальных флуоресцентных свойств объекта, удаление свободной метки!
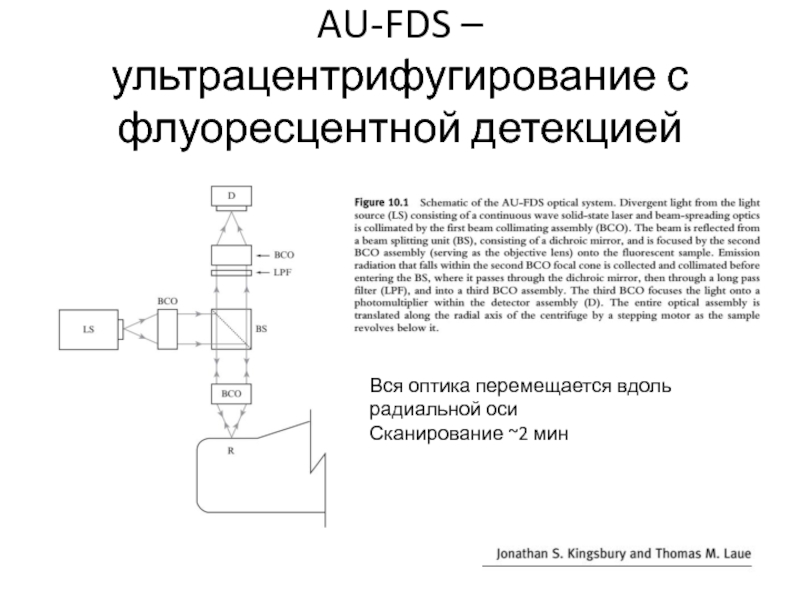
Слайд 62AU-FDS – ультрацентрифугирование с флуоресцентной детекцией
Вся оптика перемещается вдоль радиальной
оси
Сканирование ~2 мин
Слайд 63AU-FDS – ультрацентрифугирование с флуоресцентной детекцией
3,000 rpm
50,000 rpm
agg
oligomers
oligomers
Polling, S; Hatters,
DM; Mok, Y-F, Size analysis of polyglutamine protein aggregates using
fluorescence detection in an analytical ultracentrifuge., Methods Mol Biol, 2013, 1017 pp. 59-71Слайд 64AU-FDS – NUTS and BOLTS
Biological Online Tracer Sedimentation
Normal Use
Tracer Sedimentation
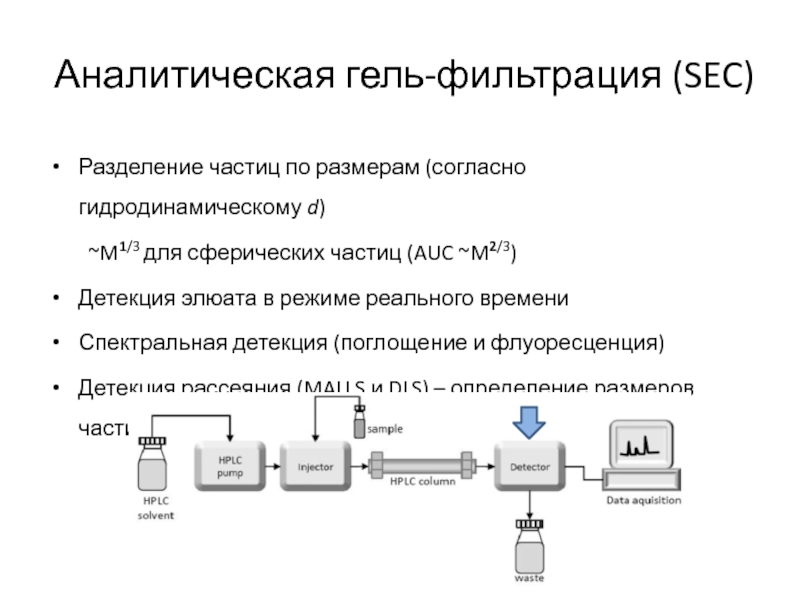
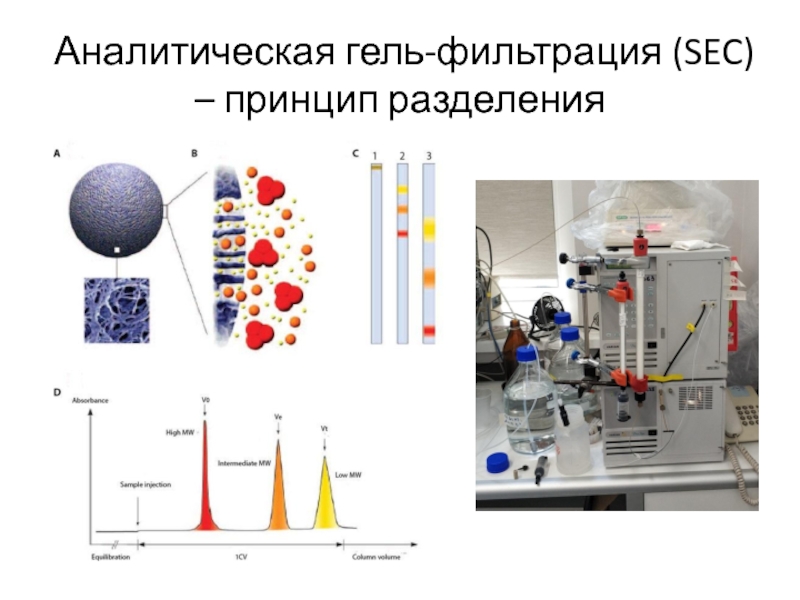
Слайд 68Аналитическая гель-фильтрация (SEC)
Разделение частиц по размерам (согласно гидродинамическому d)
~M1/3
для сферических частиц (AUC ~M2/3)
Детекция элюата в режиме реального времени
Спектральная
детекция (поглощение и флуоресценция)Детекция рассеяния (MALLS и DLS) – определение размеров частиц
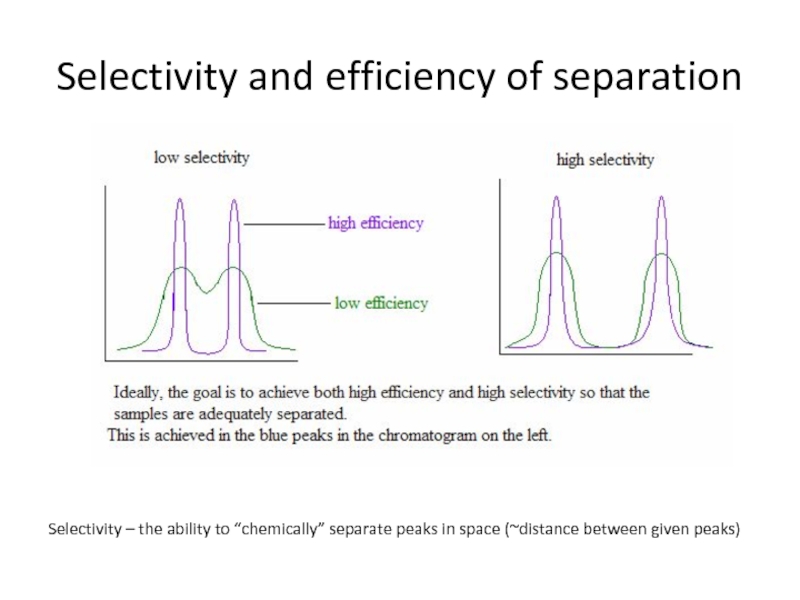
Слайд 70Selectivity and efficiency of separation
Selectivity – the ability to “chemically”
separate peaks in space (~distance between given peaks)
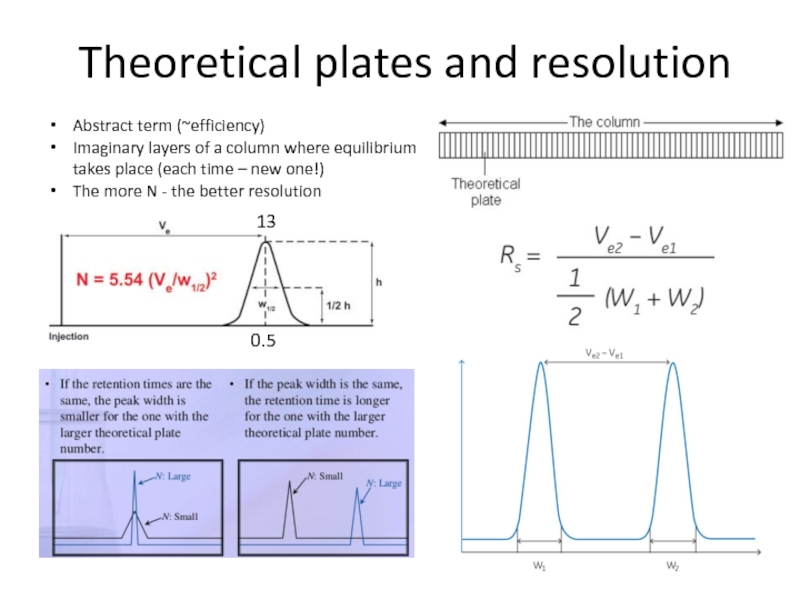
Слайд 71Theoretical plates and resolution
Abstract term (~efficiency)
Imaginary layers of a column
where equilibrium takes place (each time – new one!)
The more
N - the better resolution13
0.5
Слайд 72Theoretical plates and resolution
Abstract term (~efficiency)
Imaginary layers of a column
where equilibrium takes place (each time – new one!)
The more
N - the better resolution13
0.5
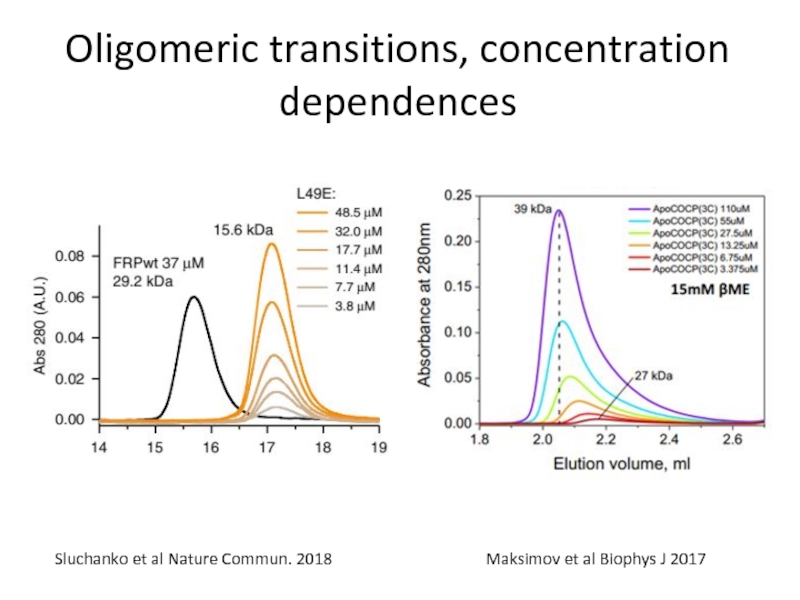
Слайд 78Oligomeric transitions, concentration dependences
Sluchanko et al Nature Commun. 2018
Maksimov et
al Biophys J 2017
Слайд 79Protein aggregation – depletion of the soluble, native protein
GluDH aggregation
at 50C and 0.2 mg/ml was followed by analytical SEC
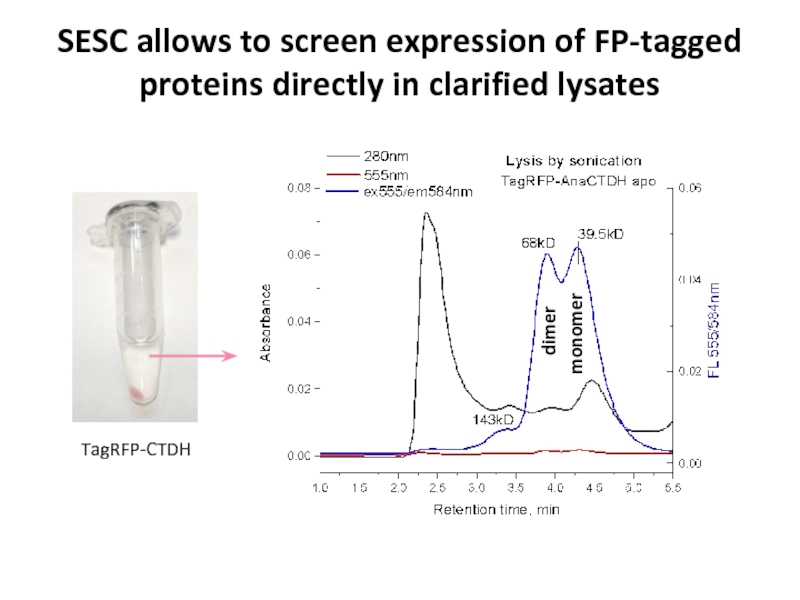
by loading supernatants after heat treatment and centrifugationСлайд 81SESC allows to screen expression of FP-tagged proteins directly in
clarified lysates
TagRFP-CTDH
dimer
monomer
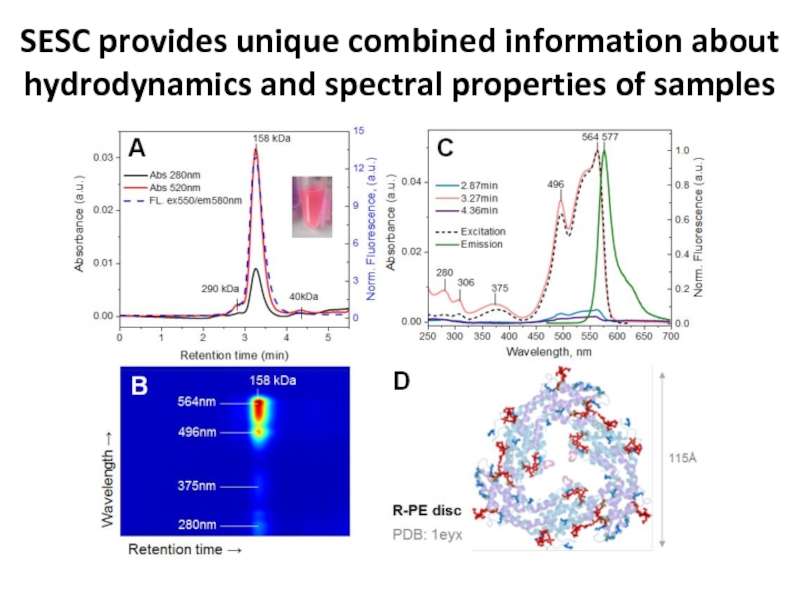
Слайд 83SESC provides unique combined information about hydrodynamics and spectral properties
of samples
Слайд 86SEC-MALLS
(Multi-Angle Laser Light Scattering)
Статическое светорассеяние, регистрируемое под разными
углами
Усредненно, не флуктуации во времени, как в DLS
Rayleigh equation:
Int.scat.light
660nm
изотропные частицы
Слайд 87SEC-MALLS
(Multi-Angle Laser Light Scattering)
Статическое светорассеяние, регистрируемое под разными
углами
Усредненно, не флуктуации во времени, как в DLS
Rayleigh equation:
Int.scat.light
660nm
анизотропные частицы
Слайд 90SEC-SAXS (small-angle X-ray scattering)
Sluchanko et al BBRC 2017
Wavelength ~1Å
This is
discarded
Only this is analyzed
Слайд 91Фракционирование в поле асимметричного потока (asymmetric flow field flow fractionation,
AF4)
Слайд 92Фракционирование в поле асимметричного потока (AF4)
Asymmetric flow field-flow fractionation –
спец. ячейка
Подключается к специальным насосам
Больший диапазон разделяемых частиц (+есть мембраны
с различными размерами пор)Более хрупкие ассоциаты
Совместимо с многопараметрической детекцией (MALLS, DAD, MS, etc.)
Слайд 96Примеры экспериментальных задач – какой метод(ы) оптимален?
Определить абсолютную молекулярную
массу исследуемого белка.
Охарактеризовать тетрамер-димерный переход для рекомбинантного белка (~15 точек).
Охарактеризовать
прочность стабильного димера с оцень низкой КдПроанализировать гидродинамический радиус и массу для тетрамера и гексамера в эквимолярной смеси.
Охарактеризовать морфологию и размеры фибрилл белка.
Оценить размеры частиц в смеси с массами, отличными на более чем 3 порядка.
Оценить массу флуоресцентного белка непосредственно в лизате клеток.
Быстро оценить частицы каких радиусов представлены в гетерогенном образце.
Получить максимальную информацию о размере, форме, массе частиц высокоочищенного белка одним методом.
Изучить кинетику агрегации и размер агрегатов для агрегирующего белка.
Наиболее точно определить массу крупного олигомера, состоящего из то ли 20 то ли 30 субъединиц (т.е. фактически определить их число в олигомере).
Определить размеры и морфологию вирусных частиц в препарате.