Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Содержание
- 1. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
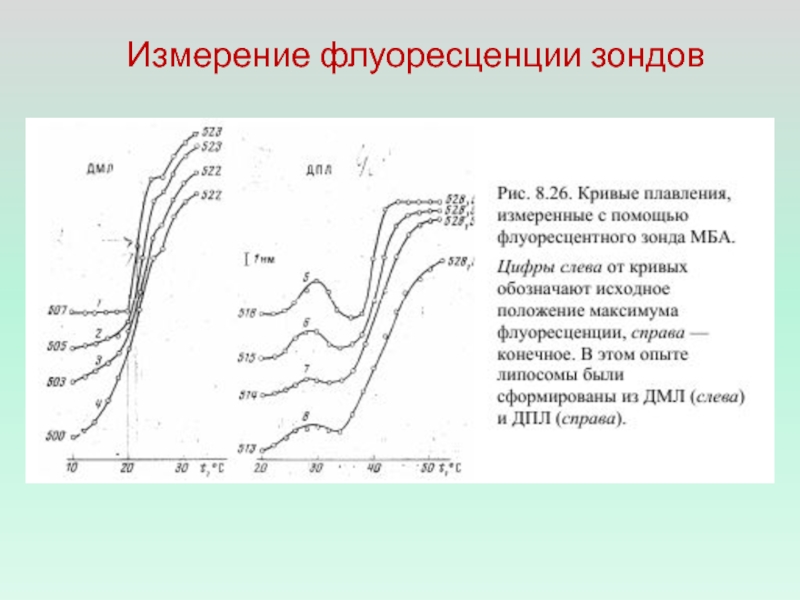
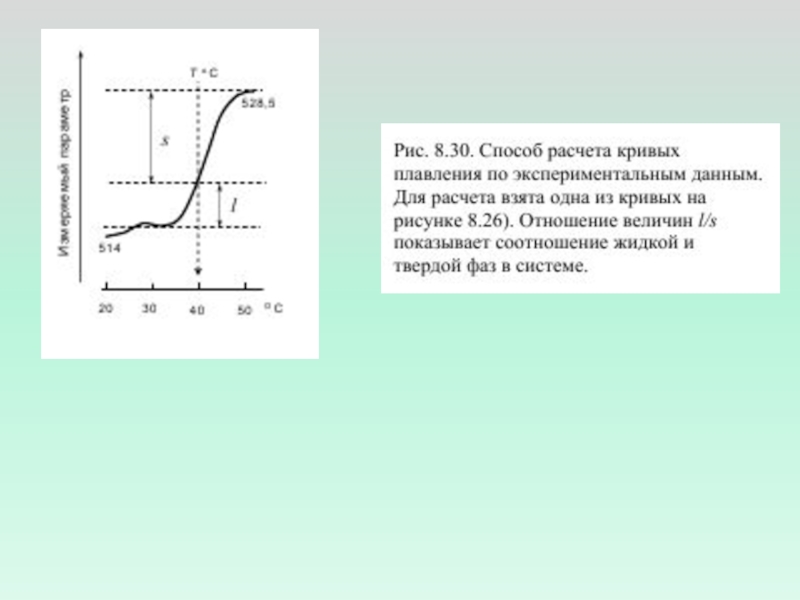
- 2. Измерение флуоресценции зондов
- 3. Слайд 3
- 4. Слайд 4
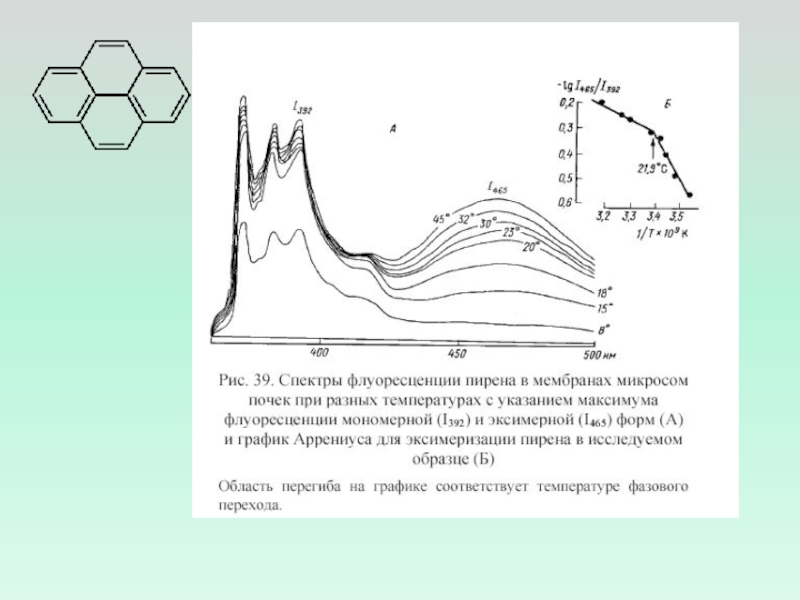
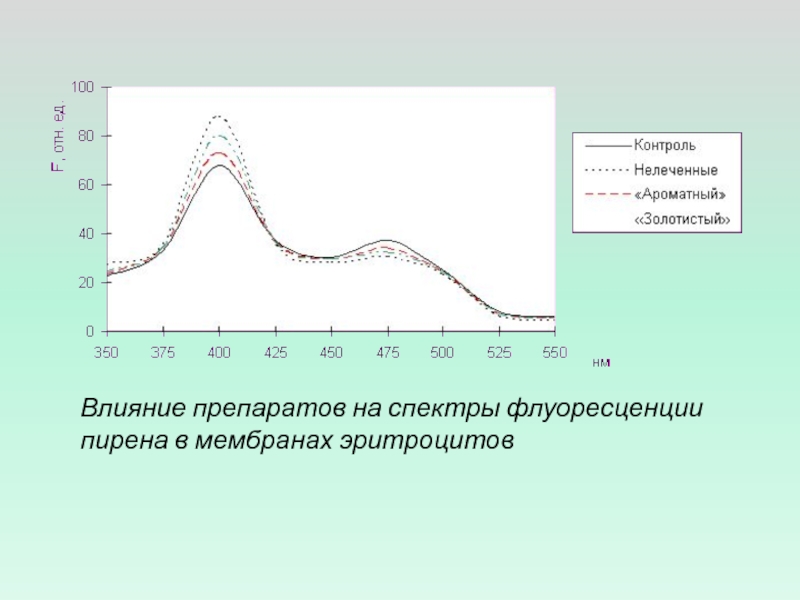
- 5. Влияние препаратов на спектры флуоресценции пирена в мембранах эритроцитов
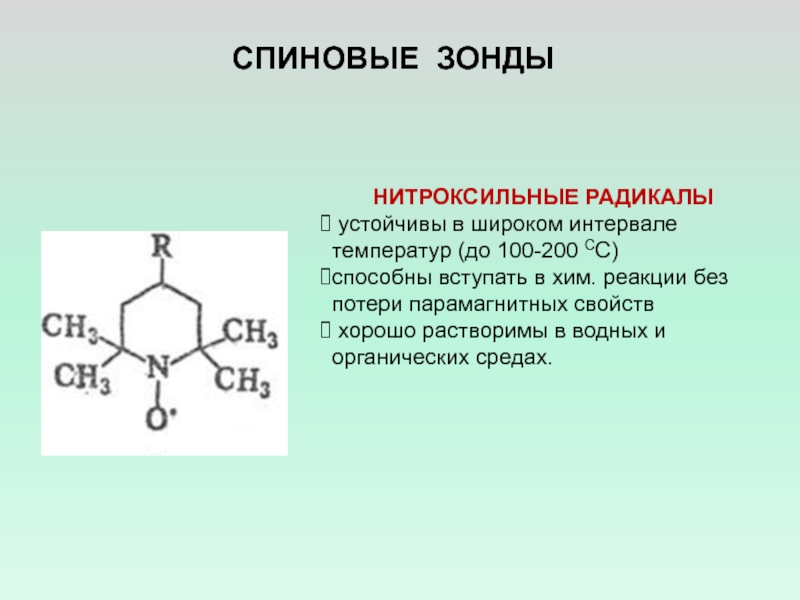
- 6. СПИНОВЫЕ ЗОНДЫНИТРОКСИЛЬНЫЕ РАДИКАЛЫ устойчивы в широком интервале
- 7. СПИНОВЫЙ ЗОНД ТЕМПО
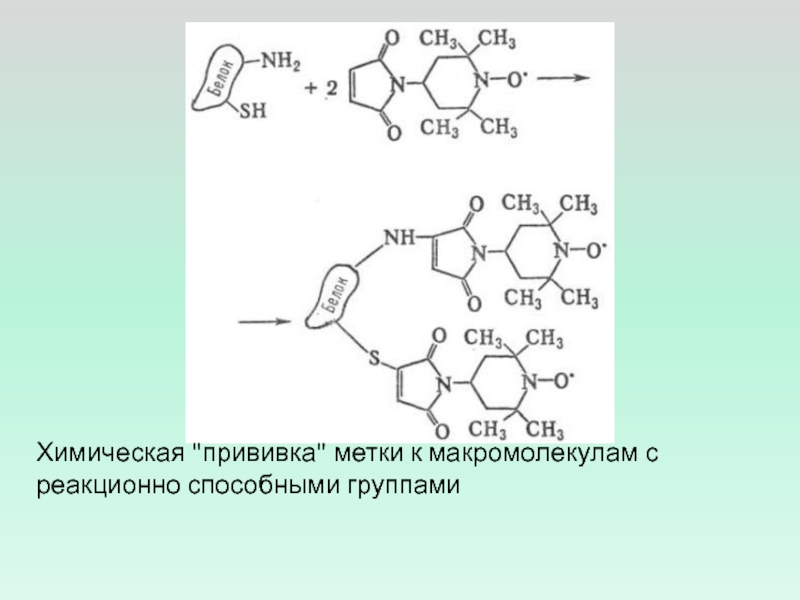
- 8. Химическая "прививка" метки к макромолекулам с реакционно способными группами
- 9. Реакции макромолекул с бирадикалами и спиновыми ловушками.
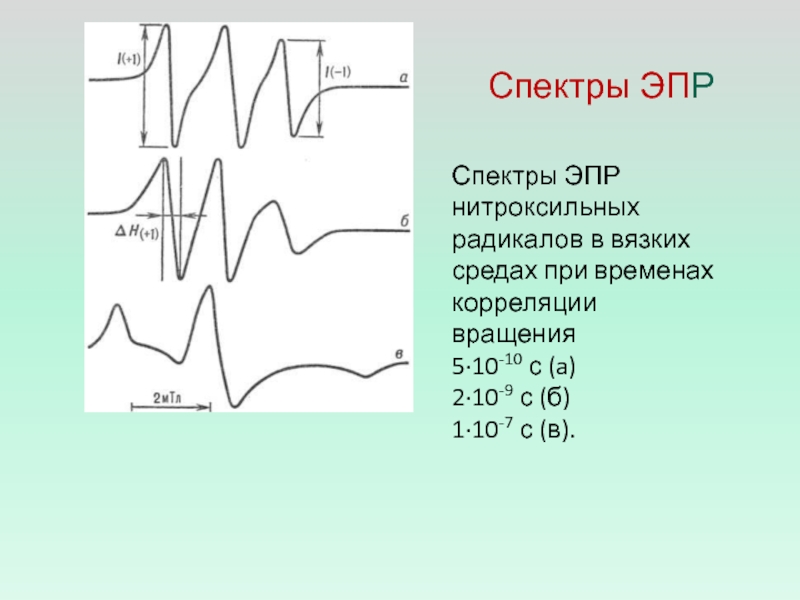
- 10. Спектры ЭПРСпектры ЭПР нитроксильных радикалов в вязких
- 11. Слайд 11
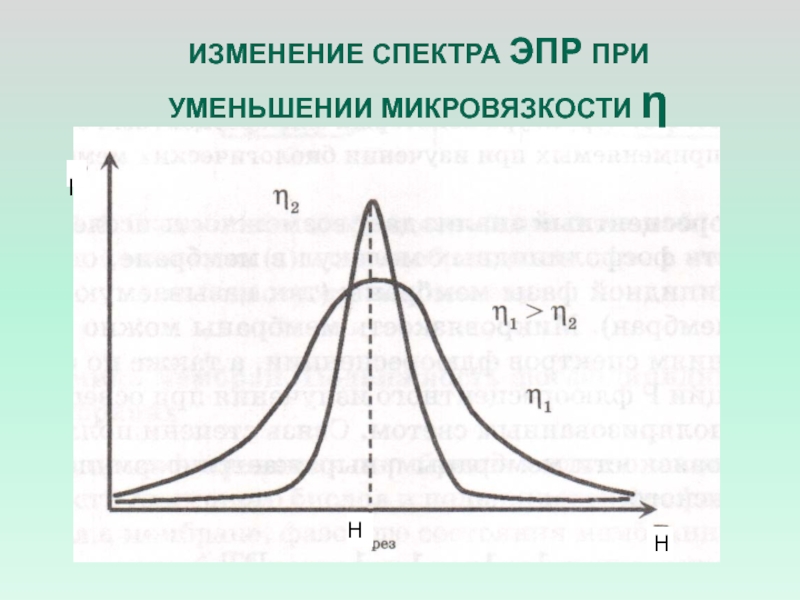
- 12. ИЗМЕНЕНИЕ СПЕКТРА ЭПР ПРИ УМЕНЬШЕНИИ МИКРОВЯЗКОСТИ ηННI
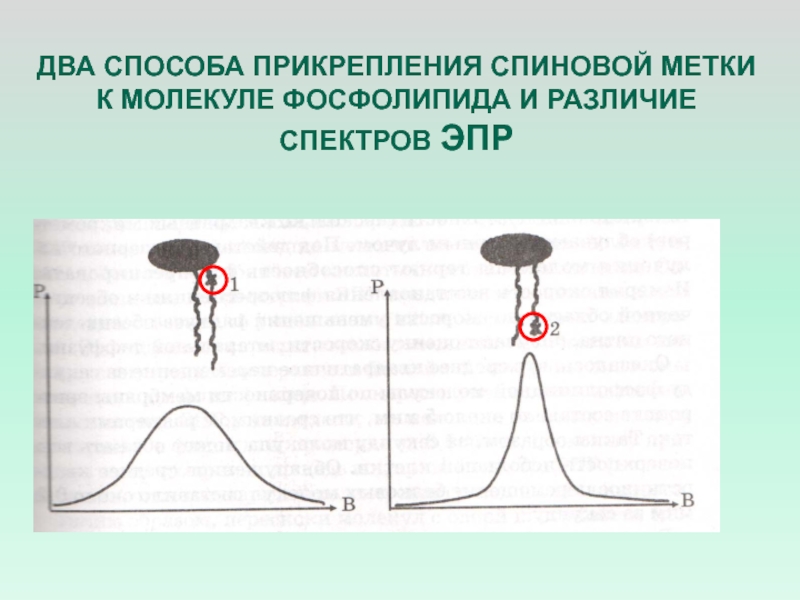
- 13. ДВА СПОСОБА ПРИКРЕПЛЕНИЯ СПИНОВОЙ МЕТКИ К МОЛЕКУЛЕ ФОСФОЛИПИДА И РАЗЛИЧИЕ СПЕКТРОВ ЭПР
- 14. Спектры 2Н-ЯМР димиристоилфофатидилхолина, дейтерированного по разным положениям ацильной цепи ЯМР
- 15. Величины подвижности Т1 для различных атомов углерода
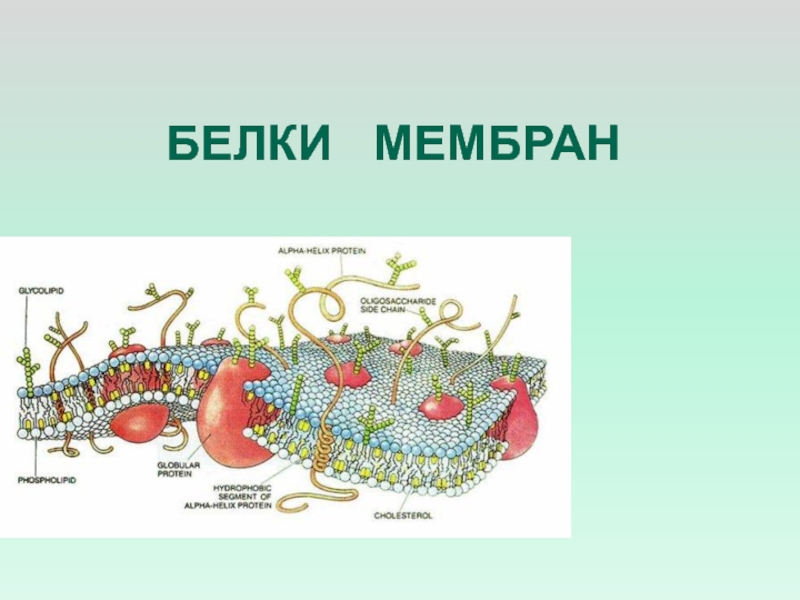
- 16. БЕЛКИ МЕМБРАН
- 17. 1.СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНЕ2. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ3.
- 18. СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНАХМЕМБРАНЫ СОДЕРЖАТ ОТ 20
- 19. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВоснована на прочности взаимодействия белка
- 20. ТОПОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ БЕЛКОВА- МОНОТОПИЧЕСКИЕ БЕЛКИБ – БИТОПИЧЕСКИЕВ - ПОЛИТОПИЧЕСКИЕ
- 21. Связывание белков с мембраной за счёт единичной трансмембранной альфа-спиралимножественных трансмембранных альфа-спиралейбета-складчатой структуры
- 22. БЕЛКИ МЕМБРАНИНТЕГРАЛЬНЫЕПЕРИФЕРИЧЕСКИЕБИОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ МЕНЯЮТ СВОЙ СТАТУС, ПРИКРЕПЛЯЯСЬ
- 23. ДЕЛЕНИЕ БЕЛКОВ НА ИНТЕГРАЛЬНЫЕ И ПЕРИФЕРИЧЕСКИЕ ОПРЕДЕЛЯЕТСЯСТРУКТУРОЙКОЛИЧЕСТВОМ И РАСПОЛОЖЕНИЕ ГИДРОФОБНЫХ ОСТАТКОВ
- 24. МЕМБРАННЫЕ БЕЛКИ СОСТОЯТ ИЗ ДВУХ ЧАСТЕЙ:УЧАСТКИ, БОГАТЫЕ
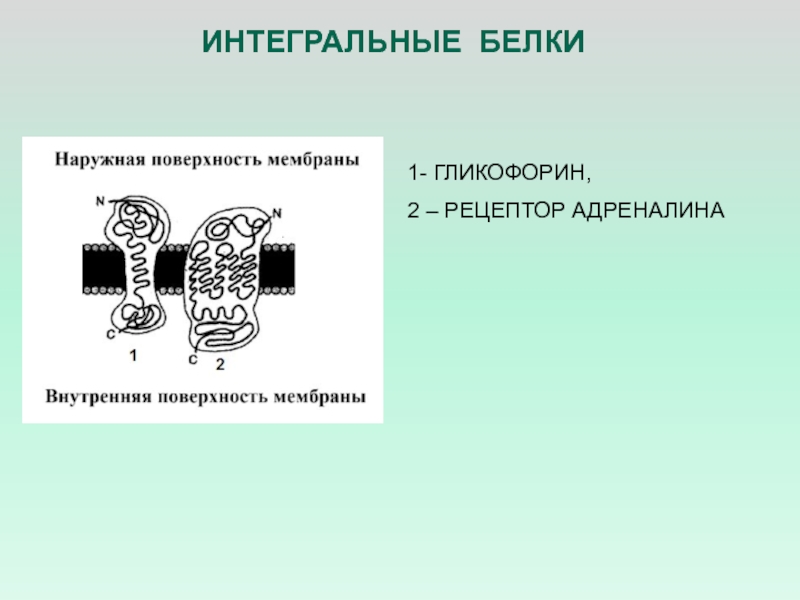
- 25. ИНТЕГРАЛЬНЫЕ БЕЛКИ 1- ГЛИКОФОРИН, 2 – РЕЦЕПТОР АДРЕНАЛИНА
- 26. ПРИМЕРЫ ИНТЕГРАЛЬНЫХ БЕЛКОВ, СОДЕРЖАЩИХ ОТ 1 ДО 12 ТРАНСМЕМБРАННЫХ ДОМЕНОВС БИСЛОЕМ КОНТАКТИРУЮТ НЕПОЛЯРНЫЕ УЧАСТКИ БЕЛКОВ
- 27. 1. КОЛИЧЕСТВО ГИДРОФИЛЬНЫХ АМИНОКИСЛОТ ПРИМЕРНО ТАКОЕ ЖЕ,
- 28. 2. В СТРУКТУРЕ ИНТЕГРАЛЬНЫХ БЕЛКОВ ЧЕТКО ВЫДЕЛЯЮТСЯ
- 29. амфипатической альфа-спирали, параллельной плоскости мембраны гидрофобной петли
- 30. 5 – БЕЛКИ, СВЯЗАННЫЕ С ИНТЕГРАЛЬНЫМИ БЕЛКАМИ,
- 31. Слайд 31
- 32. СИЛЫ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ С ЛИПИДНЫМ БИСЛОЕМЭЛЕКТРОСТАТИЧЕСКИЕ –
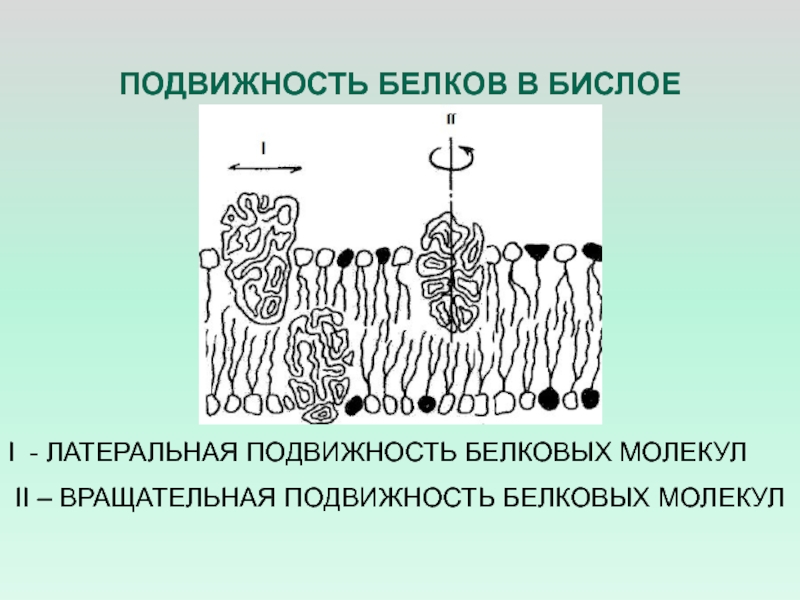
- 33. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕI - ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ II – ВРАЩАТЕЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
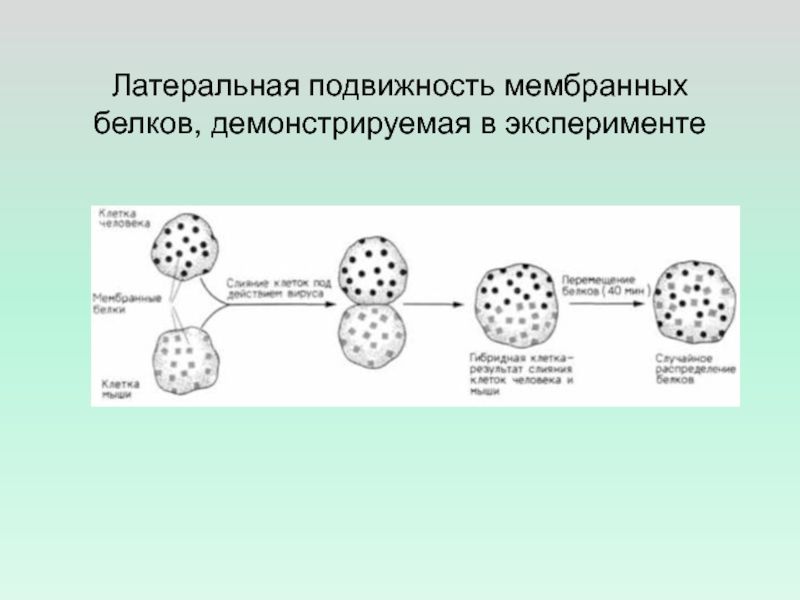
- 34. Латеральная подвижность мембранных белков, демонстрируемая в эксперименте
- 35. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ И ИХ ВЛИЯНИЕ
- 36. ЛАТЕРАЛЬНАЯ ДИФФУЗИЯ ИНТЕГРАЛЬНЫХ БЕЛКОВ ОГРАНИЧЕНА ИХ РАЗМЕРАМИ,
- 37. ИНТЕГРАЛЬНЫЕ БЕЛКИ СИЛЬНО ОГРАНИЧИВАЮТ ПОДВИЖНОСТЬ АННУЛЯРНЫХ ЛИПИДОВ.
- 38. Фазовый переход приводит к увеличению подвижности ацильных
- 39. МОДИФИКАЦИЯ БИСЛОЯ БЕЛКАМИВЫДЕЛЯЮТ 4 ОСНОВНЫХ ТИПА БЕЛОК-ЛИПИДНЫХ КОНТАКТОВ
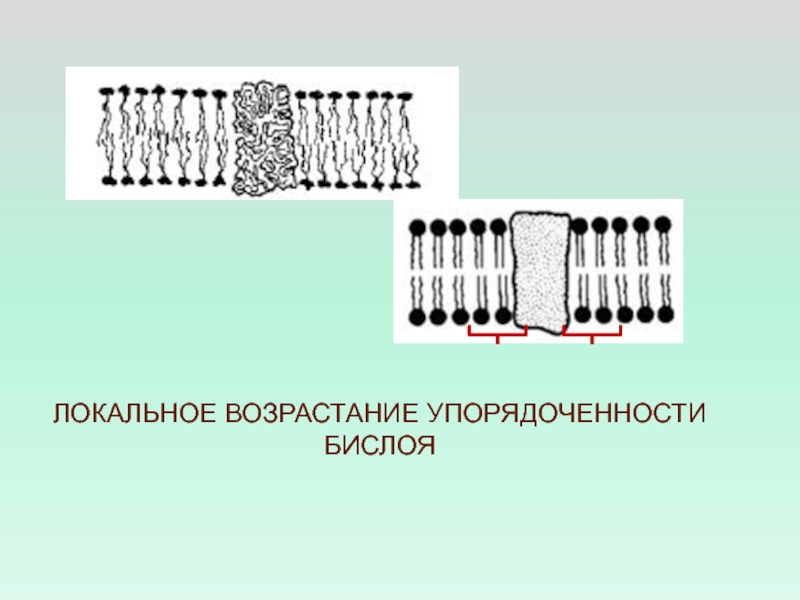
- 40. ЛОКАЛЬНОЕ ВОЗРАСТАНИЕ УПОРЯДОЧЕННОСТИ БИСЛОЯ
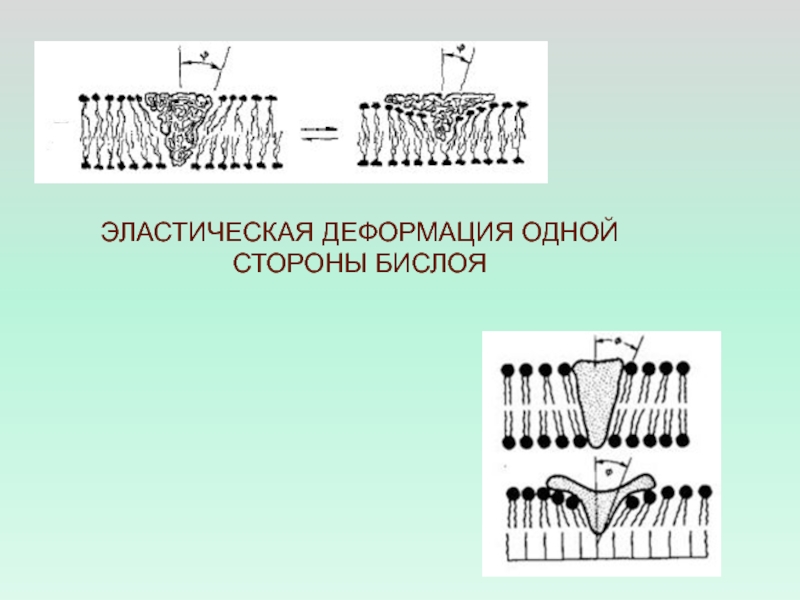
- 41. ЭЛАСТИЧЕСКАЯ ДЕФОРМАЦИЯ ОДНОЙ СТОРОНЫ БИСЛОЯ
- 42. РЕЗКОЕ ИЗМЕНЕНИЕ ГРАДИЕНТА КРИВИЗНЫ И ДЕФОРМАЦИЯ БИСЛОЯ
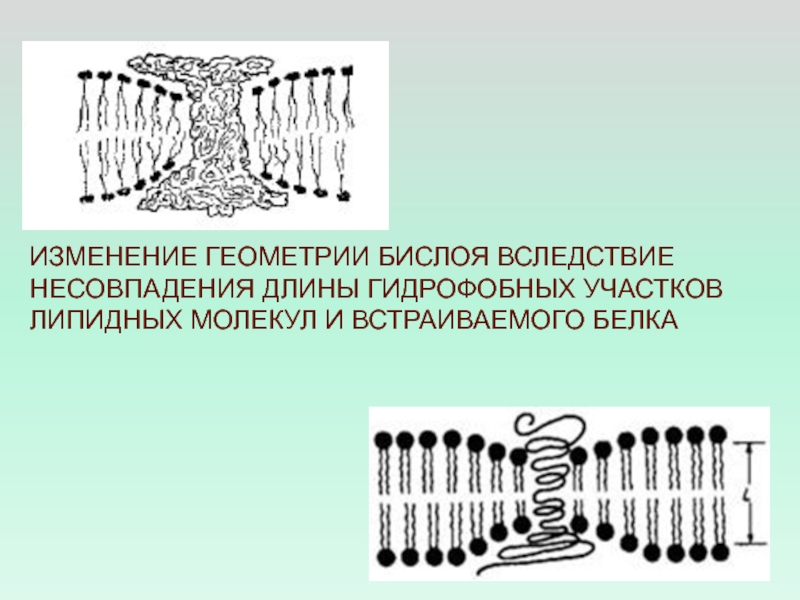
- 43. ИЗМЕНЕНИЕ ГЕОМЕТРИИ БИСЛОЯ ВСЛЕДСТВИЕ НЕСОВПАДЕНИЯ ДЛИНЫ ГИДРОФОБНЫХ УЧАСТКОВ ЛИПИДНЫХ МОЛЕКУЛ И ВСТРАИВАЕМОГО БЕЛКА
- 44. НЕКОТОРЫЕ ФУНКЦИИ БЕЛКОВ В МЕМБРАНЕ
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
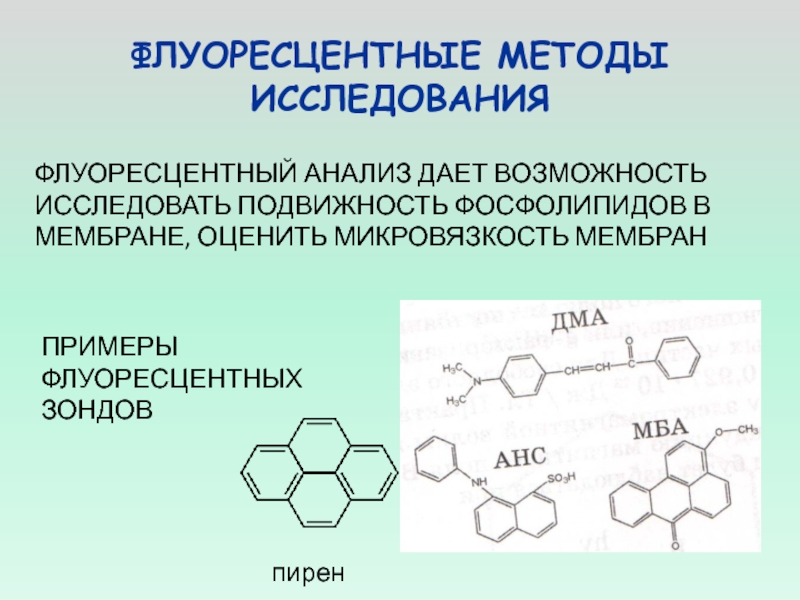
ФЛУОРЕСЦЕНТНЫЙ АНАЛИЗ ДАЕТ ВОЗМОЖНОСТЬ ИССЛЕДОВАТЬ ПОДВИЖНОСТЬ ФОСФОЛИПИДОВ В
МЕМБРАНЕ, ОЦЕНИТЬ МИКРОВЯЗКОСТЬ МЕМБРАН
Слайд 6СПИНОВЫЕ ЗОНДЫ
НИТРОКСИЛЬНЫЕ РАДИКАЛЫ
устойчивы в широком интервале температур (до 100-200
СС)
способны вступать в хим. реакции без потери парамагнитных свойств
хорошо растворимы в водных и органических средах.Слайд 9Реакции макромолекул с бирадикалами и спиновыми ловушками.
Спиновая ловушка -
соединение, образующее стабильные радикалы при взаимодействии с активными радикалами.
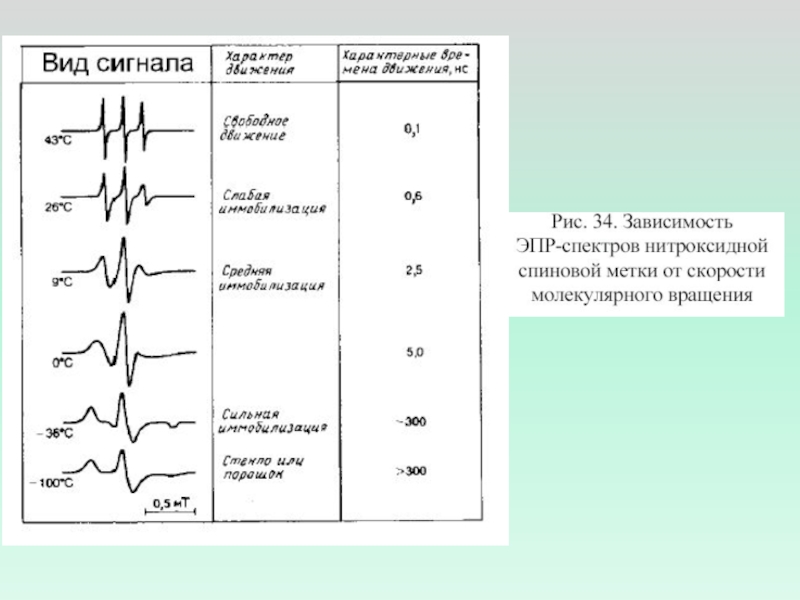
Слайд 10Спектры ЭПР
Спектры ЭПР нитроксильных радикалов в вязких средах при временах
корреляции вращения
5·10-10 с (a)
2·10-9 с (б)
1·10-7 с (в).
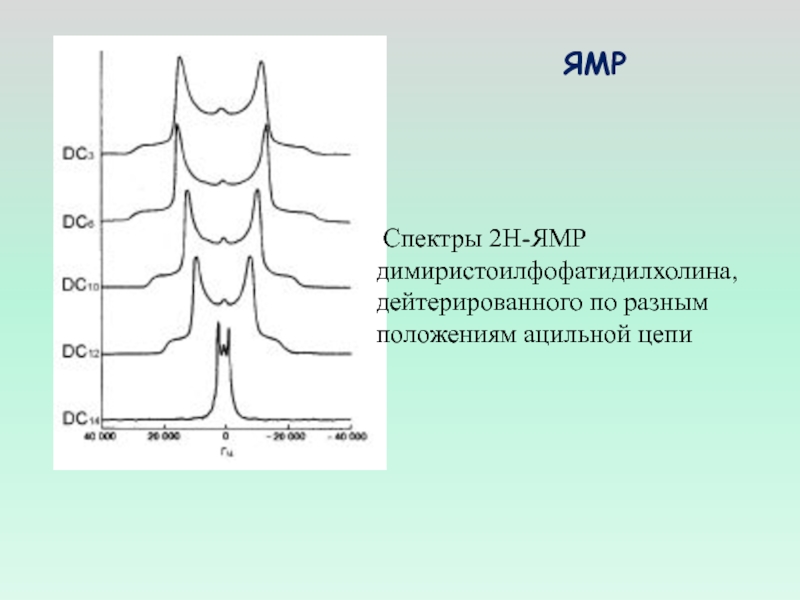
Слайд 14 Спектры 2Н-ЯМР
димиристоилфофатидилхолина,
дейтерированного по разным
положениям ацильной цепи
ЯМР
Слайд 15Величины подвижности Т1 для различных атомов углерода в молекуле фосфатидилхолина
в составе мембраны при температуре выше критической (рассчитаны по данным
ЯМР-спектроскопии)Слайд 171.СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНЕ
2. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ
3. ПОДВИЖНОСТЬ БЕЛКОВ В
МЕМБРАНЕ
4. БЕЛОК – ЛИПИДНЫЕ ВЗАИМОДЕЙСТВИЯ
5. ФУНКЦИИ МЕМБРАННЫХ БЕЛКОВ
Слайд 18СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНАХ
МЕМБРАНЫ СОДЕРЖАТ ОТ 20 ДО 80% БЕЛКА
ПО ВЕСУ. В РАЗНЫХ МЕМБРАНАХ СОДЕРЖАНИЕ БЕЛКА РАЗЛИЧНО.
В МЕМБРАНАХ МИТОХОНДРИЙ
БЕЛКА ДО 75%В МИЕЛИНОВОЙ ОБОЛОЧКЕ ОКОЛО 25%
Слайд 19КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ
основана на прочности взаимодействия белка с мембраной
Топологическая классификация
Биохимическая классификация
основана на локализации белка по отношению к липидному
бислою
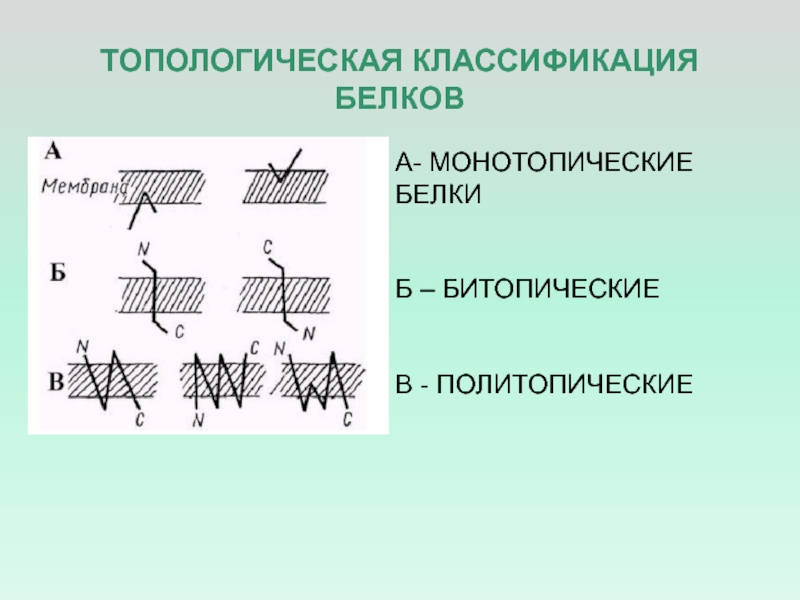
Слайд 20ТОПОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ БЕЛКОВ
А- МОНОТОПИЧЕСКИЕ БЕЛКИ
Б – БИТОПИЧЕСКИЕ
В - ПОЛИТОПИЧЕСКИЕ
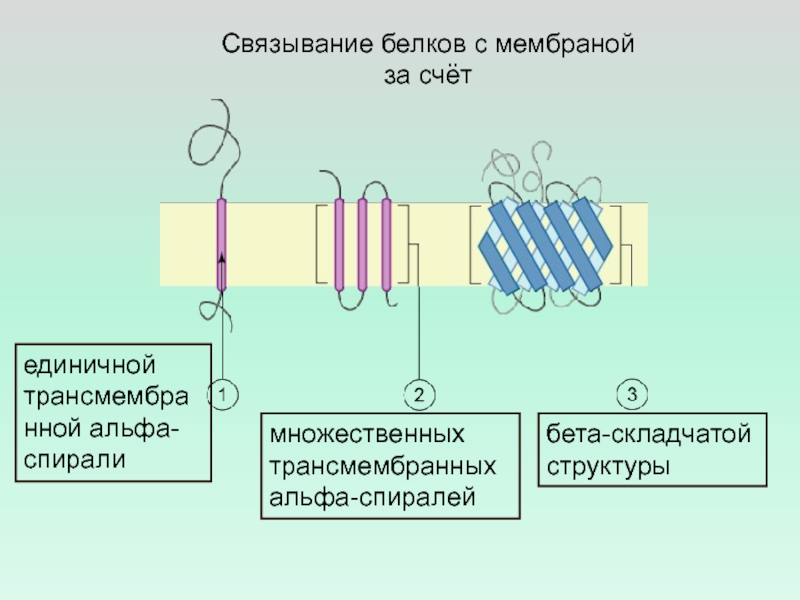
Слайд 21Связывание белков с мембраной за счёт
единичной трансмембранной альфа-спирали
множественных трансмембранных
альфа-спиралей
бета-складчатой структуры
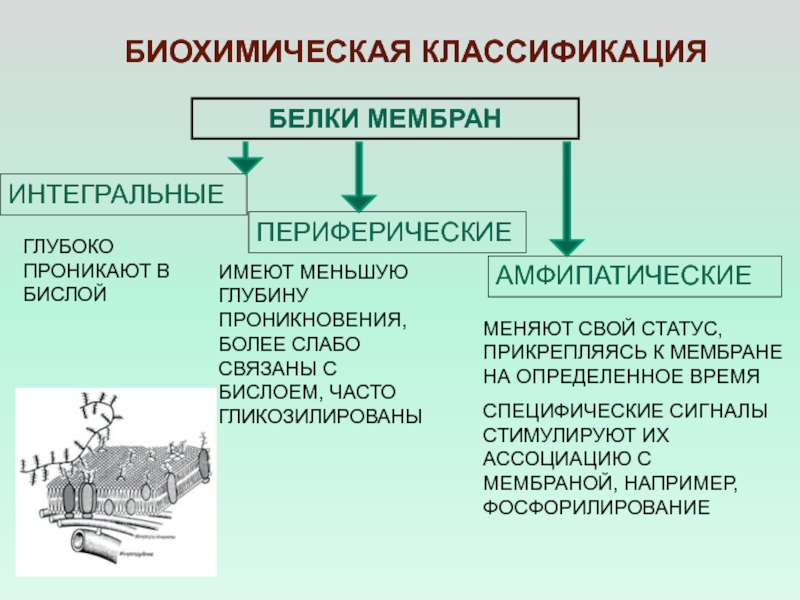
Слайд 22БЕЛКИ МЕМБРАН
ИНТЕГРАЛЬНЫЕ
ПЕРИФЕРИЧЕСКИЕ
БИОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ
МЕНЯЮТ СВОЙ СТАТУС, ПРИКРЕПЛЯЯСЬ К МЕМБРАНЕ НА
ОПРЕДЕЛЕННОЕ ВРЕМЯ
СПЕЦИФИЧЕСКИЕ СИГНАЛЫ СТИМУЛИРУЮТ ИХ АССОЦИАЦИЮ С МЕМБРАНОЙ, НАПРИМЕР,
ФОСФОРИЛИРОВАНИЕАМФИПАТИЧЕСКИЕ
ГЛУБОКО ПРОНИКАЮТ В БИСЛОЙ
ИМЕЮТ МЕНЬШУЮ ГЛУБИНУ ПРОНИКНОВЕНИЯ, БОЛЕЕ СЛАБО СВЯЗАНЫ С БИСЛОЕМ, ЧАСТО ГЛИКОЗИЛИРОВАНЫ
Слайд 23ДЕЛЕНИЕ БЕЛКОВ НА ИНТЕГРАЛЬНЫЕ И ПЕРИФЕРИЧЕСКИЕ ОПРЕДЕЛЯЕТСЯ
СТРУКТУРОЙ
КОЛИЧЕСТВОМ И РАСПОЛОЖЕНИЕ ГИДРОФОБНЫХ
ОСТАТКОВ
Слайд 24МЕМБРАННЫЕ БЕЛКИ СОСТОЯТ ИЗ ДВУХ ЧАСТЕЙ:
УЧАСТКИ, БОГАТЫЕ ПОЛЯРНЫМИ АМИНОКИСЛОТНЫМИ ОСТАТКАМИ,
ОБРАЩЕННЫЕ ВО ВНЕКЛЕТОЧНУЮ СРЕДУ ЧАСТО ГЛИКОЗИЛИРОВАНЫ, ЧТО УВЕЛИЧИВАЕТ ИХ РЕЗИСТЕНТНОСТЬ
К ПРОТЕОЛИЗУУЧАСТКИ, ОБОГАЩЕННЫЕ НЕПОЛЯРНЫМИ ОСТАТКАМИ АМИНОКИСЛОТ
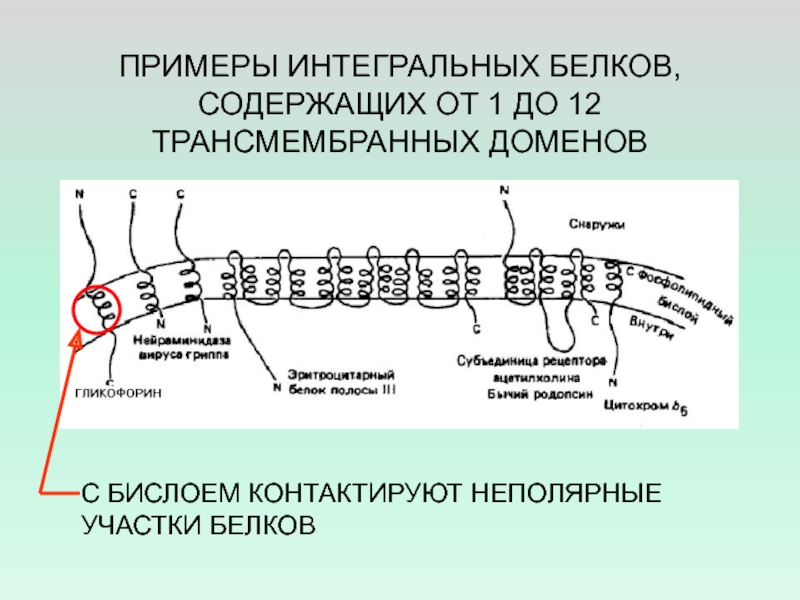
Слайд 26ПРИМЕРЫ ИНТЕГРАЛЬНЫХ БЕЛКОВ, СОДЕРЖАЩИХ ОТ 1 ДО 12 ТРАНСМЕМБРАННЫХ ДОМЕНОВ
С
БИСЛОЕМ КОНТАКТИРУЮТ НЕПОЛЯРНЫЕ УЧАСТКИ БЕЛКОВ
Слайд 271. КОЛИЧЕСТВО ГИДРОФИЛЬНЫХ АМИНОКИСЛОТ ПРИМЕРНО ТАКОЕ ЖЕ, КАК И В
ОБЫЧНЫХ ВОДОРАСТВОРИМЫХ БЕЛКАХ, НО В ВОДЕ ОНИ РАСТВОРЯЮТСЯ ОЧЕНЬ ПЛОХО.
ПРИЧИНА:ГИДРОФОБНЫЕ
АМИНОКИСЛОТНЫЕ ОСТАТКИ СКОНЦЕНТРИРОВАНЫ В ГИДРОФОБНЫЕ ДОМЕНЫ, А НЕ РАССЕЯНЫ ВДОЛЬ ПОЛИПЕПТИДНОЙ ЦЕПИ.НЕКОТОРЫЕ БЕЛКИ УВЕЛИЧИВАЮТ ГИДРОФОБНОСТЬ, КОВАЛЕНТНО СОЕДИНЯЯСЬ С ЛИПИДАМИ МЕМБРАН
ОСОБЕННОСТИ ИНТЕГРАЛЬНЫХ БЕЛКОВ
Слайд 282. В СТРУКТУРЕ ИНТЕГРАЛЬНЫХ БЕЛКОВ ЧЕТКО ВЫДЕЛЯЮТСЯ УЧАСТКИ, ОТВЕТСТВЕННЫЕ ЗА
ИХ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ.
ЭТИ УЧАСТКИ СОСТОЯТ ИЗ ПОЛЯРНЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ.
ДОМЕНЫ ИЗ
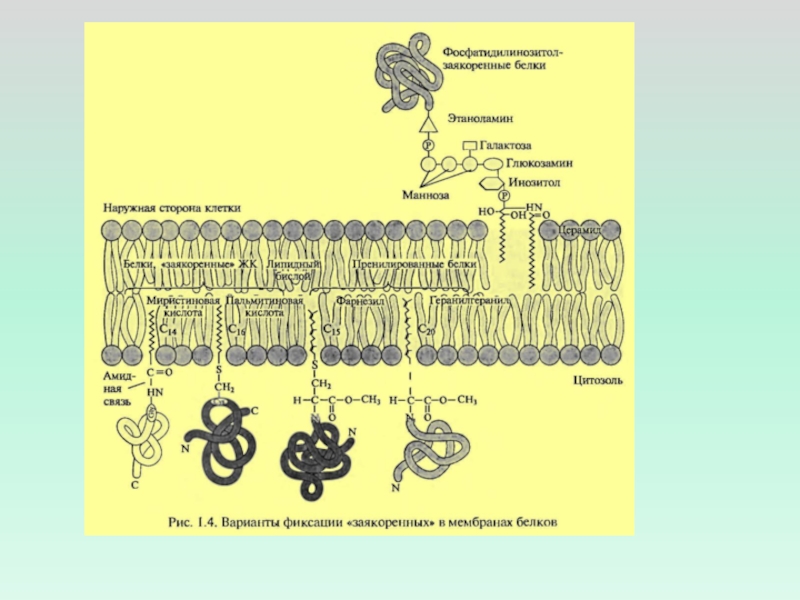
НЕПОЛЯРНЫХ ОСТАТКОВ ОБЕСПЕЧИВАЮТ СТРУКТУРНУЮ УСТОЙЧИВОСТЬ МОЛЕКУЛЫ, ЗАКРЕПЛЯЯ ЕЕ В ЛИПИДНОМ БИСЛОЕСлайд 29амфипатической альфа-спирали, параллельной плоскости мембраны
гидрофобной петли (ЦИТОХРОМ b5)
ковалентно
соединённого жирнокислотного остатка
электростатического взаимодействия (прямого или кальций-опосредованного) (ПРОТЕИНКИНАЗА С).
Связывание
поверхностных белков с мембраной за счёт ПОВЕРХНОСТНЫЕ БЕЛКИ
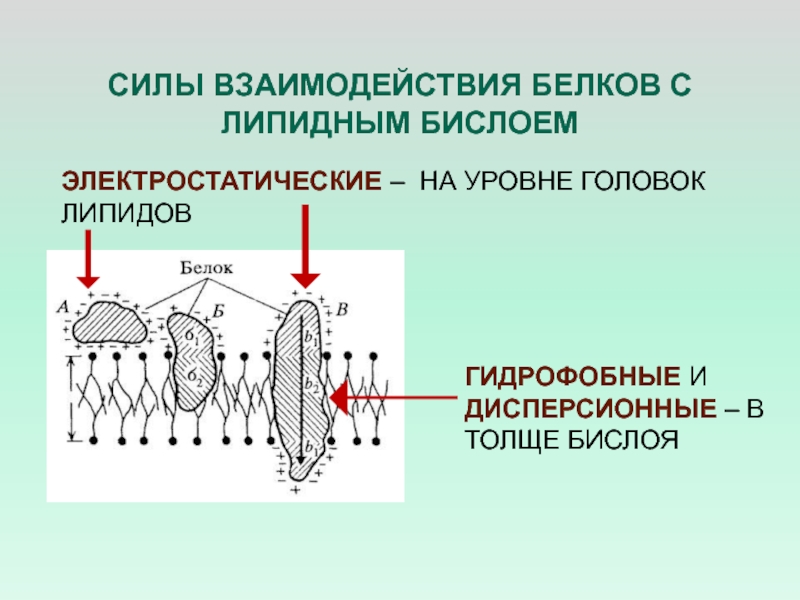
Слайд 32СИЛЫ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ С ЛИПИДНЫМ БИСЛОЕМ
ЭЛЕКТРОСТАТИЧЕСКИЕ – НА УРОВНЕ ГОЛОВОК
ЛИПИДОВ
ГИДРОФОБНЫЕ И ДИСПЕРСИОННЫЕ – В ТОЛЩЕ БИСЛОЯ
Слайд 33ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ
I - ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
II
– ВРАЩАТЕЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
Слайд 35ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ И ИХ ВЛИЯНИЕ НА ЛИПИДЫ МЕМБРАН
БОЛЕЕ
ПОДВИЖНЫМИ ОКАЗЫВАЮТСЯ ПЕРИФЕРИЧЕСКИЕ БЕЛКИ. ОНИ ОКАЗЫВАЮТ МЕНЬШЕЕ ВОЗДЕЙСТВИЕ НА ЖИРНОКИСЛОТНЫЕ
ЦЕПИ ЛИПИДОВСлайд 36ЛАТЕРАЛЬНАЯ ДИФФУЗИЯ ИНТЕГРАЛЬНЫХ БЕЛКОВ ОГРАНИЧЕНА ИХ РАЗМЕРАМИ, ВЗАИМОДЕЙСТВИЕМ С ДРУГИМИ
БЕЛКАМИ И ЭЛЕМЕНТАМИ ЦИТОСКЕЛЕТА
Времена вращательной релаксации для интегральных белков лежат
в диапазоне от 20 до 500 мксКоэффициент латеральной диффузии (вдоль бислоя) варьирует от 7.10-9 до 10-12см2.с-1.