Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фотобиология
Содержание
- 1. Фотобиология
- 2. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииФотобиология
- 3. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 4. Шкала электромагнитных колебанийФГОУ ВПО ЮФУ каф. биохимии и микробиологииОптическая область спектра
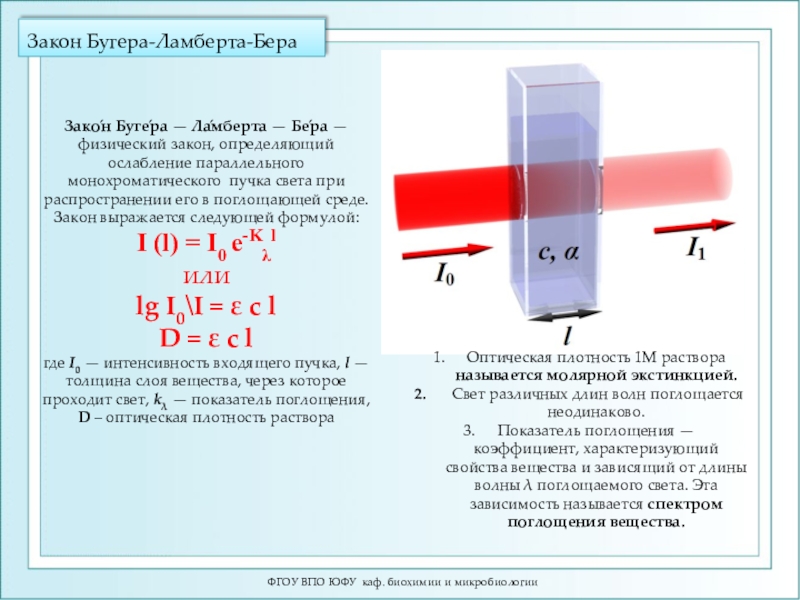
- 5. Закон Бугера-Ламберта-БераФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 6. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
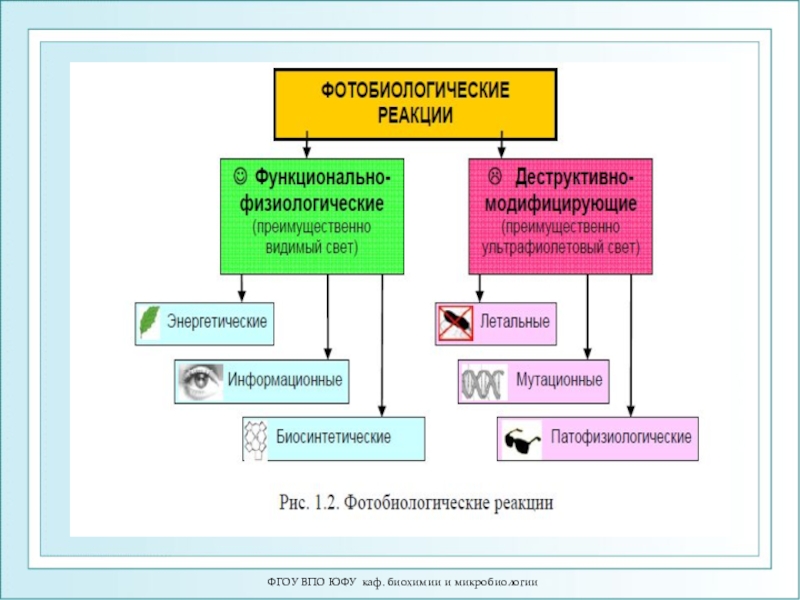
- 7. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииОсновные
- 8. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 9. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 10. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 11. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПоглощение
- 12. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииВзаимодействие
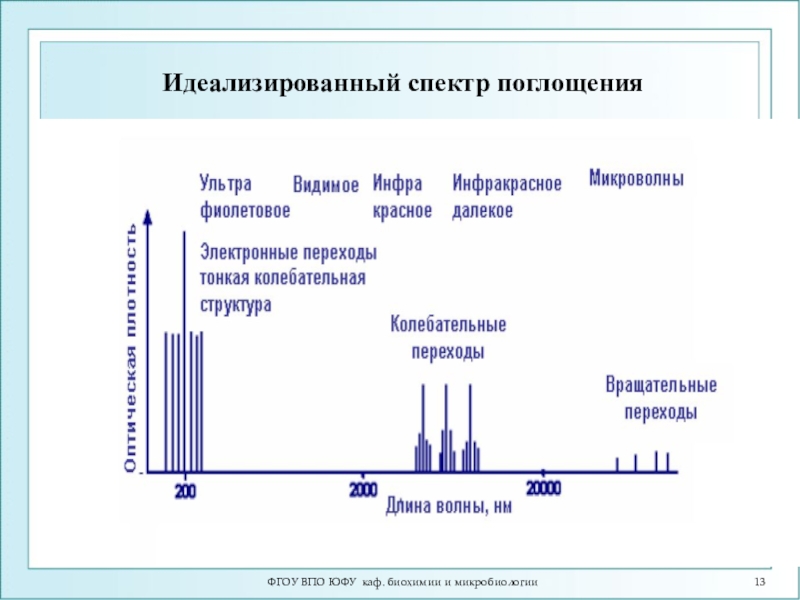
- 13. Идеализированный спектр поглощенияФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 14. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
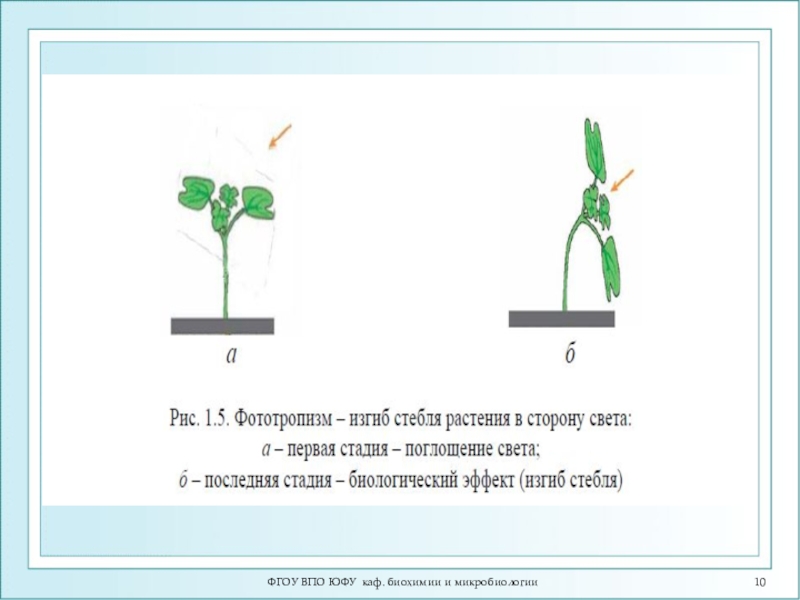
- 15. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииВсе
- 16. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПреобразование энергии возбужденных электронных состояний
- 17. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииТрансформация энергии электронного возбуждения (внутренняя конверсия)
- 18. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииИндуктивно-резонансный
- 19. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 20. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПри
- 21. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииОсновные типы фотохимических реакций1.Фотораспад2.Фотоперегруппировка Фотоизомеризация Фототаутомеризация
- 22. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии3.
- 23. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 24. Люминесценция – свечение атомов, ионов, молекул, возникающее
- 25. Характеристики люминесцирующих молекулСпектр возбуждения люминесценции - зависимость
- 26. Классификация видов фотолюминесценцииПо длительности свечения2. По способу возбуждения
- 27. Классификация фотолюминесценции по длительности свечения
- 28. Диаграмма ЯблонскогоФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 29. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
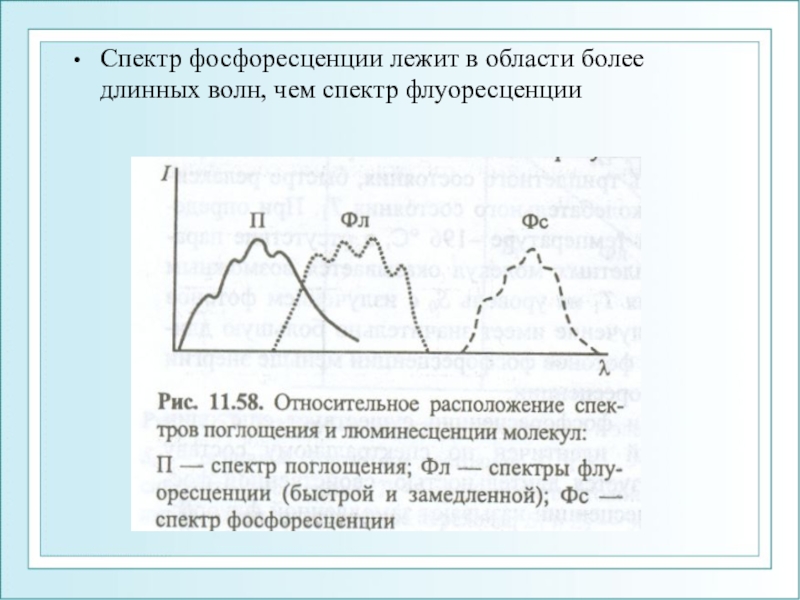
- 30. Спектр фосфоресценции лежит в области более длинных волн, чем спектр флуоресценции
- 31. Классификация люминесценции по способу возбужденияФотолюминесценцияТермолюминесценцияЭлектролюминесценцияСонолюминесценцияТриболюминесценцияХемилюминесценцияБиолюминесценцияФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 32. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииЗаконы
- 33. 2.Правило Каши – спектр флуоресценции (и фосфоресценции)
- 34. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии3.Закон
- 35. 4.Закон зеркальной симметрии (правило Левшина)
- 36. Cпектрофлуориметр фирмы Horiba Fluoromax - 4
- 37. Хемилюминесценция (ХЛ) – это свечение, сопровождающее биохимические
- 38. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 39. Виды хемилюминесценции (ХЛ) в живых системахМитогенетическое излучениеСверхслабое
- 40. Эмпирические правила ХЛ1.Спектр хемилюминесценции подобен спектру фосфоресценции,
- 41. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 42. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПри
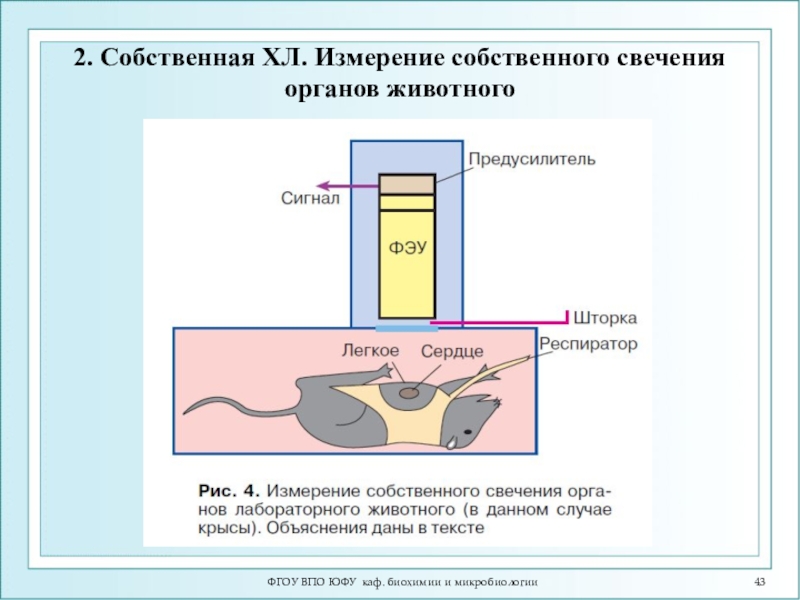
- 43. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии2. Собственная ХЛ. Измерение собственного свечения органов животного
- 44. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии1)
- 45. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииРеакции, сопровождающиеся сверхслабым свечением
- 46. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 47. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииТипы
- 48. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииЛюциферины живых организмовЛюциферин светляковлюциферин дождевых червейцелентеразинваргулинлюциферин улиткилюциферин грибов
- 49. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии2.1. Адениннуклеотидный тип БЛ - биолюминесценция жуков-светляков
- 50. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииКаракатицаКаракатицаНочесветкаУдильщик2.2.
- 51. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииСибирский биолюминесцентный червь Fridericia heliota и структура люциферина F. heliota.
- 52. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии2.3.
- 53. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 54. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПроблема,
- 55. Экворин – апопротеин + целентеразин (189 АК,
- 56. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииШимомура
- 57. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииОсама
- 58. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииСтруктура
- 59. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 60. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 61. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииСкульптурная композиция, посвящённая GFP (Вашингтон, США).
- 62. GFP – флуоресцентная метка для изучения экспрессии клеточных белковФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 63. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииРазноцветные GFP-подобные бели коралловых полипов
- 64. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииВизуализация различных компонент живых клеток с помощью флуоресцентных белков.
- 65. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииКлеточный
- 66. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 67. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПоросенок
- 68. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииФлуоресцентное
- 69. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПространственные
- 70. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 71. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииНаправленный
- 72. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 73. Биолюминесцентный имиджинг (БИ)БИ основан на реакции окисления
- 74. 4. Активированная ХЛ Химические активаторы
- 75. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииБиофизика
- 76. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииМеханизм зрительного восприятия. Строение глаза.
- 77. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииСтроение сетчатки и зрительной клетки-фоторецептора - палочки
- 78. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииМеханизм зрительного восприятия. Строение палочки.
- 79. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииМеханизм зрительного восприятия. Строение глаза и сетчатки .
- 80. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 81. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПространственная структура зрительного родопсина
- 82. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииЛауреаты
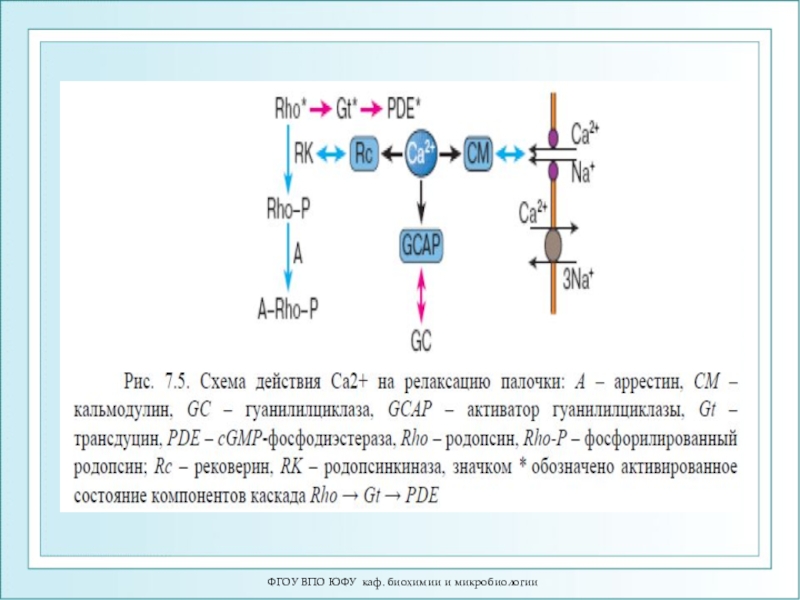
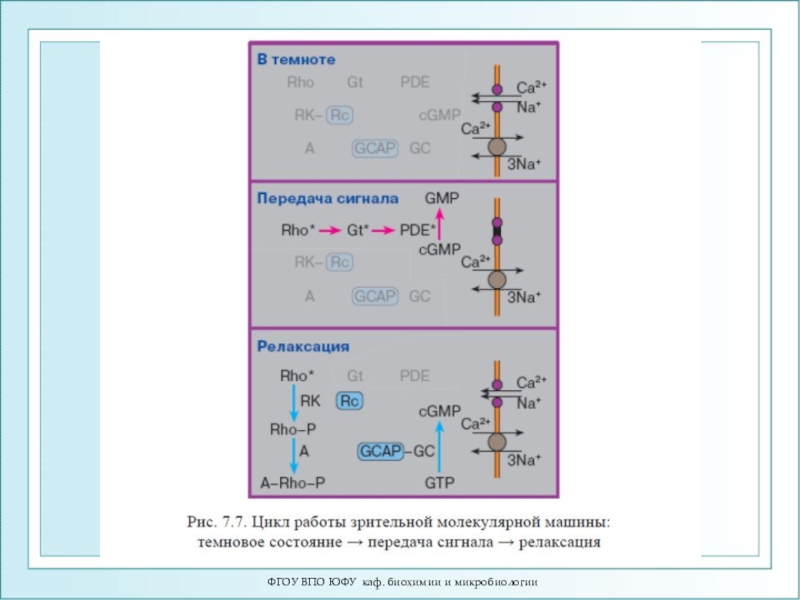
- 83. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииМеханизм
- 84. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииЦикл фотопревращений родопсина.
- 85. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 86. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
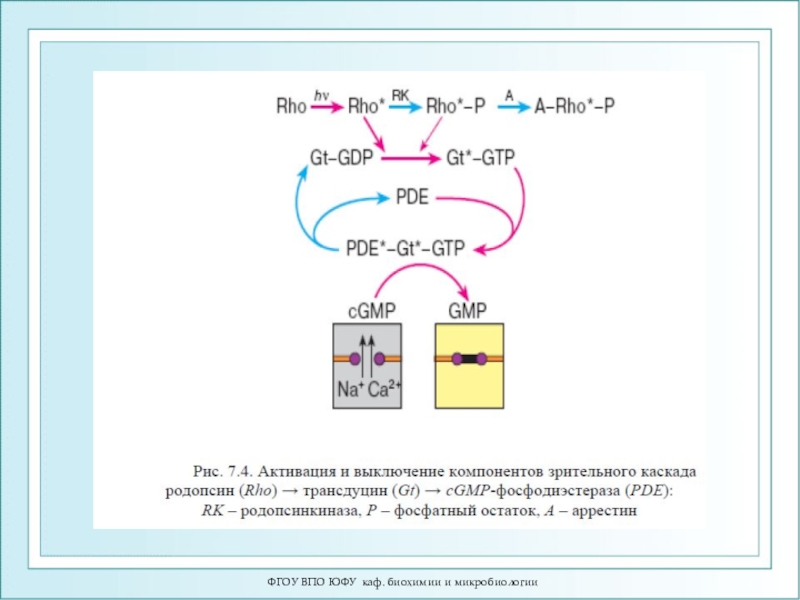
- 87. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииСхема активации зрительного каскада
- 88. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 89. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 90. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 91. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 92. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 93. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПурпурная
- 94. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииПруды на юге Мертвого моря с галобактериями
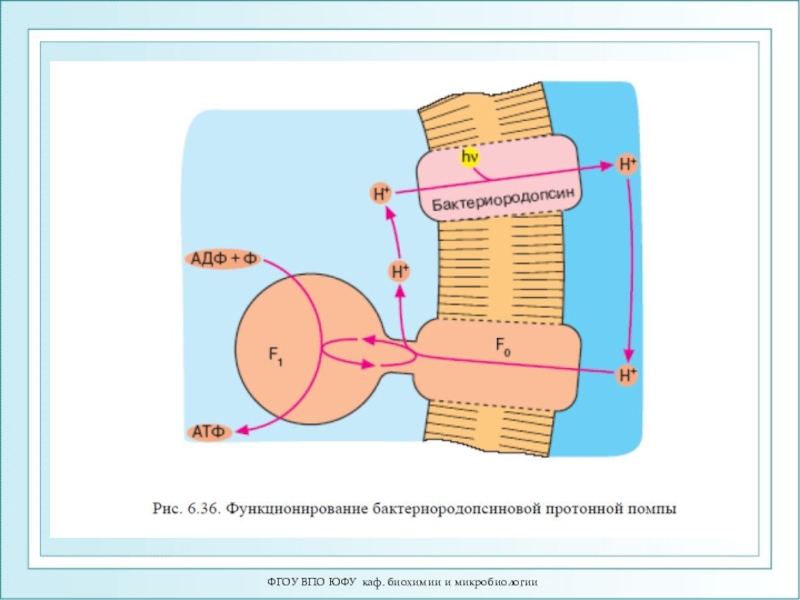
- 95. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииБактериородопсин
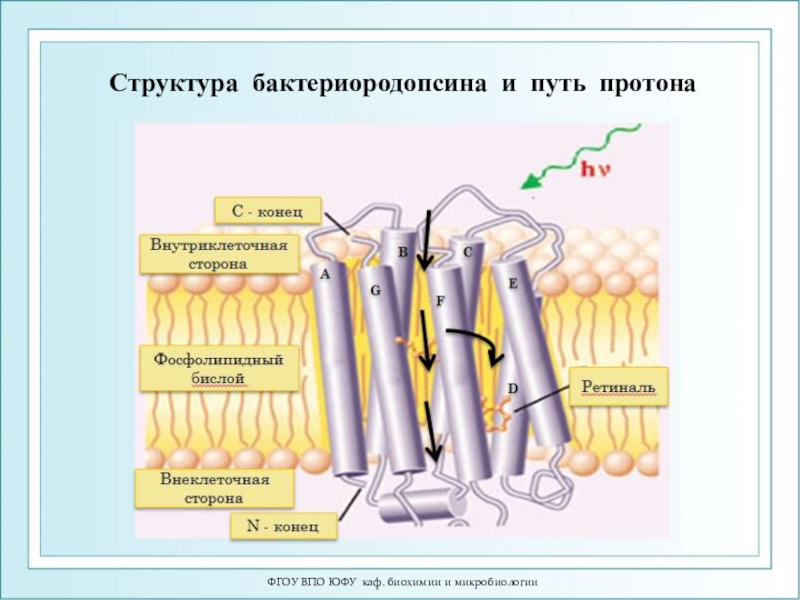
- 96. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииСтруктура бактериородопсина и путь протона
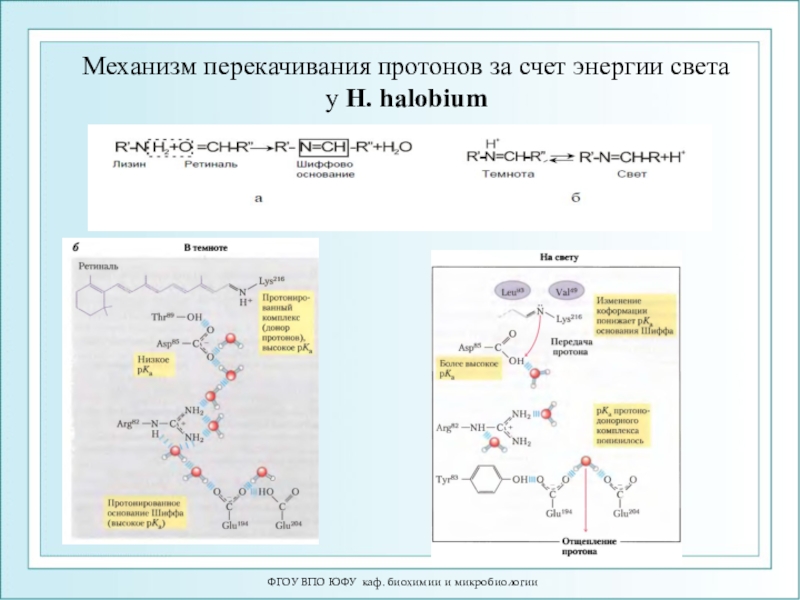
- 97. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииМеханизм
- 98. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 99. ФГОУ ВПО ЮФУ каф. биохимии и микробиологииТехнические
- 100. Роль синглетного кислорода 1О2
- 101. Фотодинамические болезни1. Порфирии – клинические расстройства, связанные
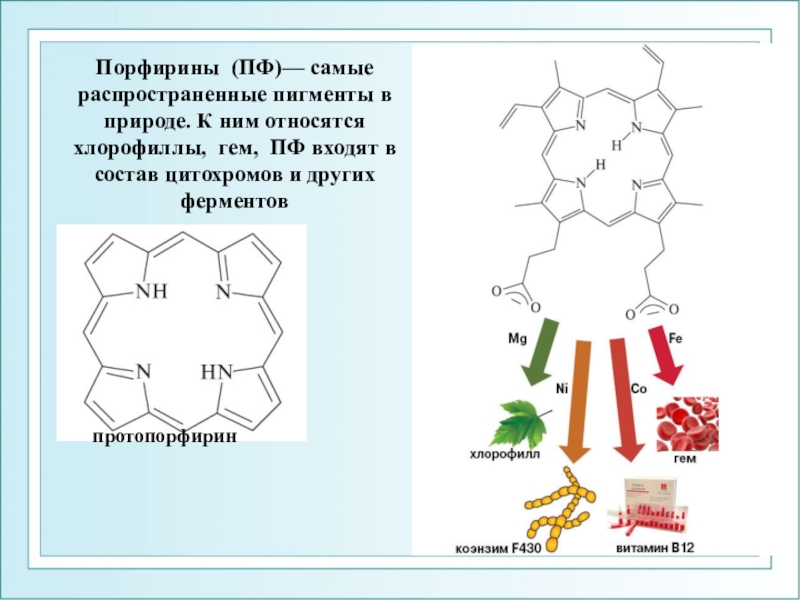
- 102. протопорфиринПорфирины (ПФ)— самые распространенные пигменты в природе.
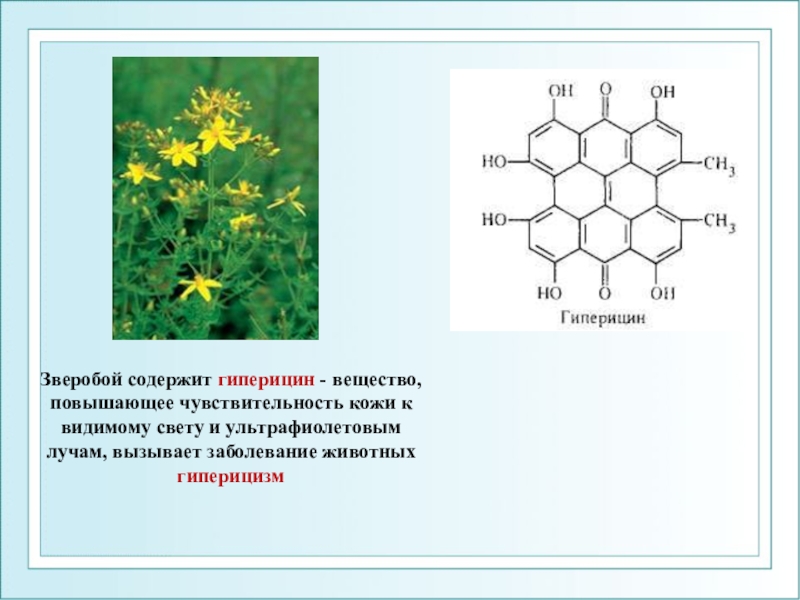
- 103. Зверобой содержит гиперицин - вещество, повышающее чувствительность
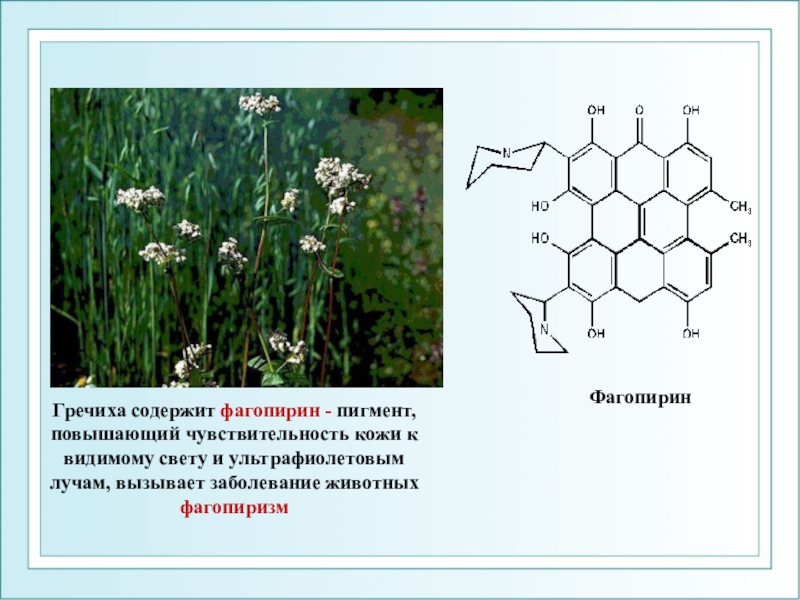
- 104. ФагопиринГречиха содержит фагопирин - пигмент, повышающий чувствительность
- 105. Церкоспороз листьев (сероватая пятнистость) – поражение растения
- 106. Фотодинамическая терапия (ФДТ) – новый способ лечения
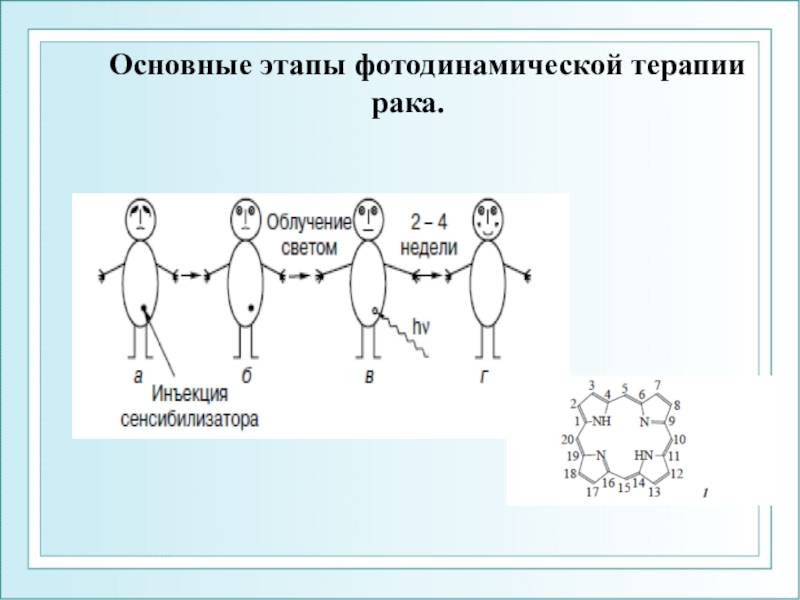
- 107. Основные этапы фотодинамической терапии рака.
- 108. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 109. Летальные реакцииПриводят к гибели организма УФ-излучением. В
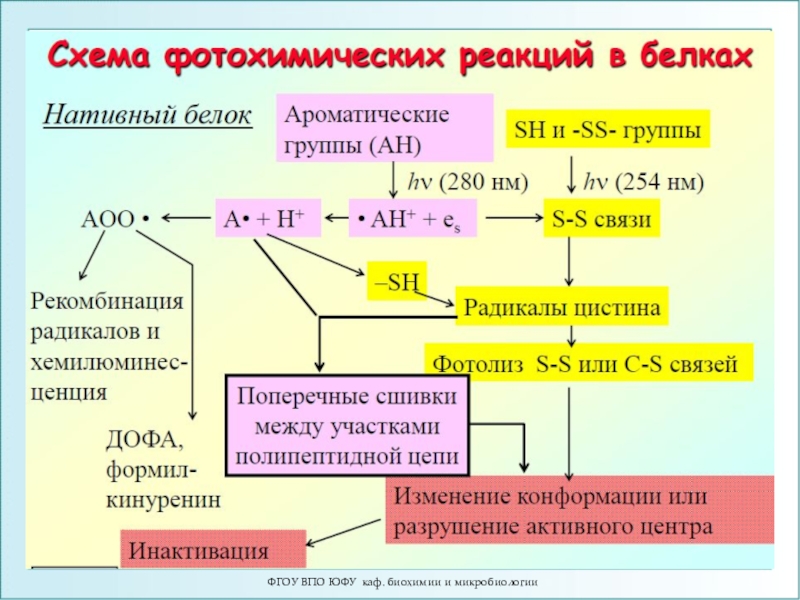
- 110. Фотодеструктивные процессы1.Действие УФ-излучения на белковые системы1.1. Фотоионизация
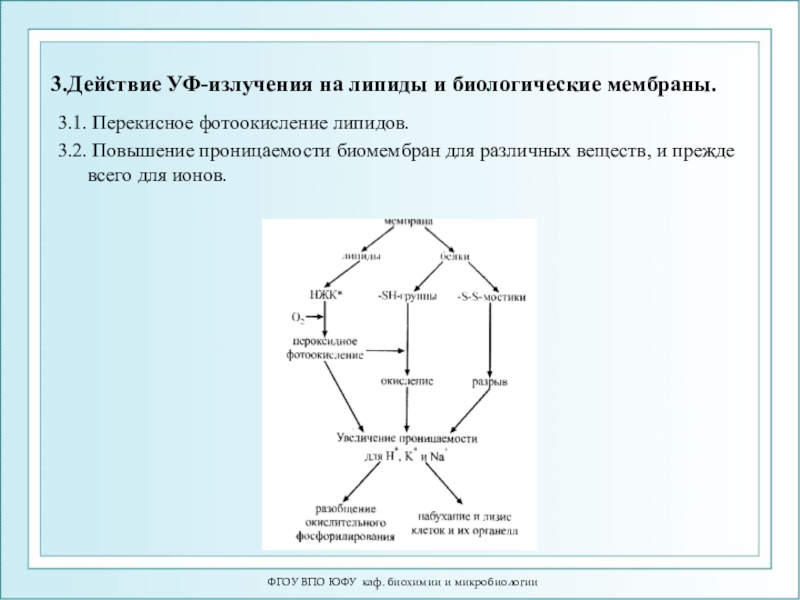
- 111. 3.Действие УФ-излучения на липиды и биологические мембраны.
- 112. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
- 113. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Шкала электромагнитных колебаний
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Оптическая область
спектра
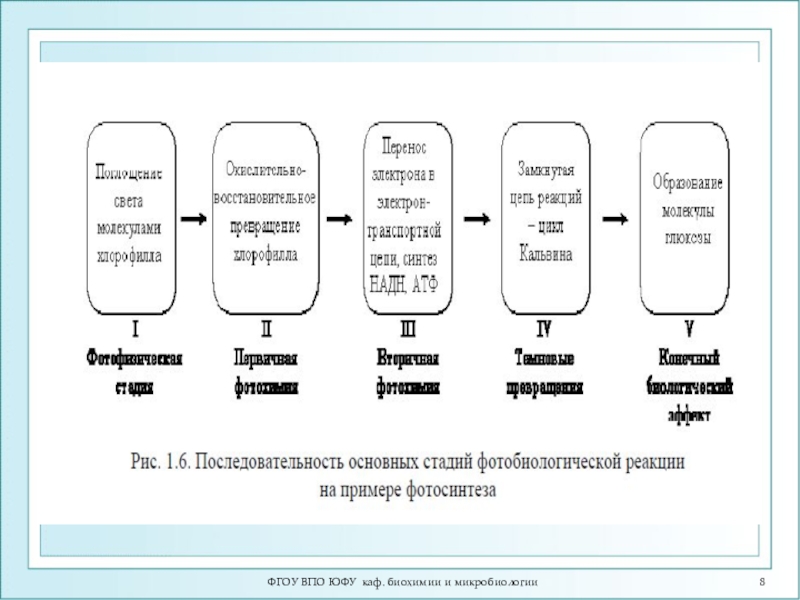
Слайд 7ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Основные стадии фотобиологического процесса
1.Фотофизическая
(поглощение кванта света, размен и миграция энергии)
2.Первичная фотохимическая (образование первичного
фотопродукта)3.Вторичная фотохимическая (образование стабильного продукта)
4.Темновые реакции (цепь биохимических реакций или перестройки клеточных структур)
5.Биологический эффект (физиологический ответ на действие света)
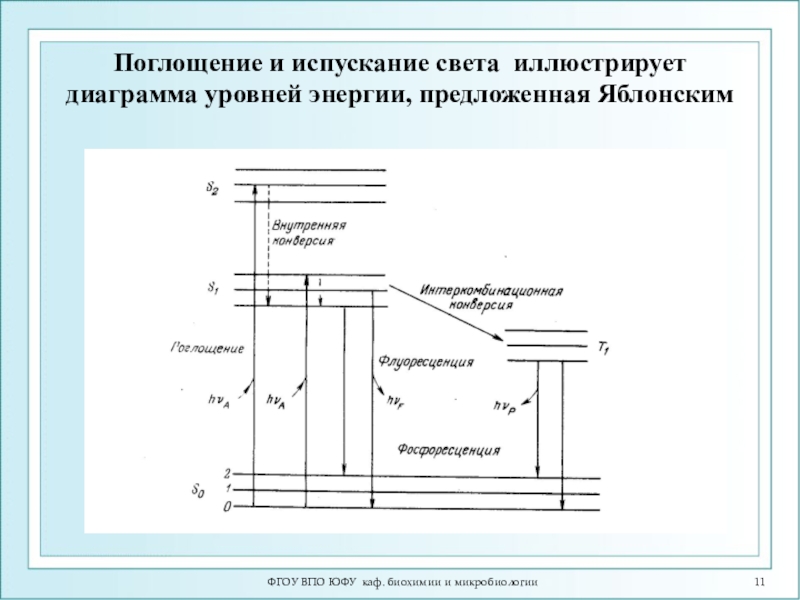
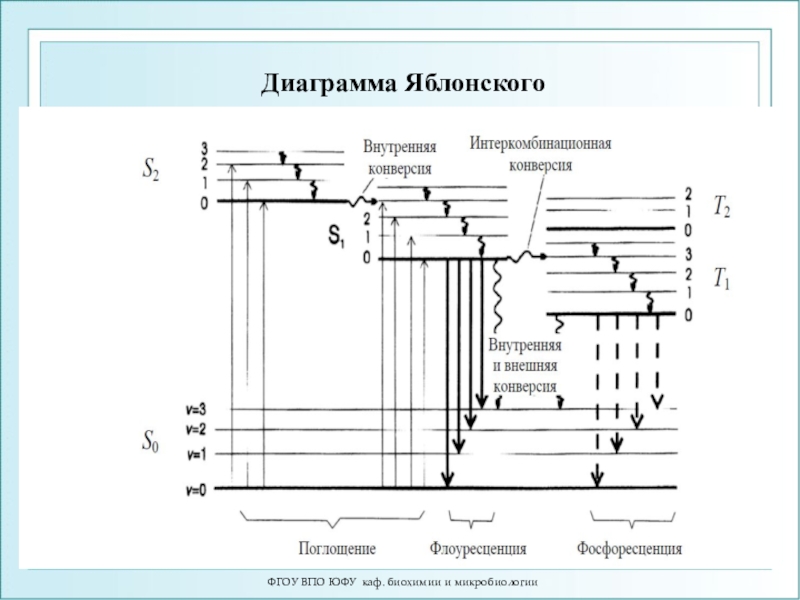
Слайд 11ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Поглощение и испускание света
иллюстрирует диаграмма уровней энергии, предложенная Яблонским
Слайд 12ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Взаимодействие молекул с фотонами
Возбуждение
молекулы →переход электрона из основного состояния в возбужденное с большей
энергией →переход в основное состояние + hν. Энергия молекуля складывается из 3 частей:Различают два главных состояния электронных оболочек:
1) синглетное основное и воезбужденное состояние (все спины электронов антипараллельны, неспаренные электроны отсутствуют) и
2) триплетное основное и возбужденное состояние (спины электронов параллельны, имеются неспаренные электроны).
Основное состояние для большинства веществ - синглетное, за исключением кислорода, для которого основное состояние – триплетное.
Емол = Ее + Екол + Евр
Ее >> Екол >> Евр
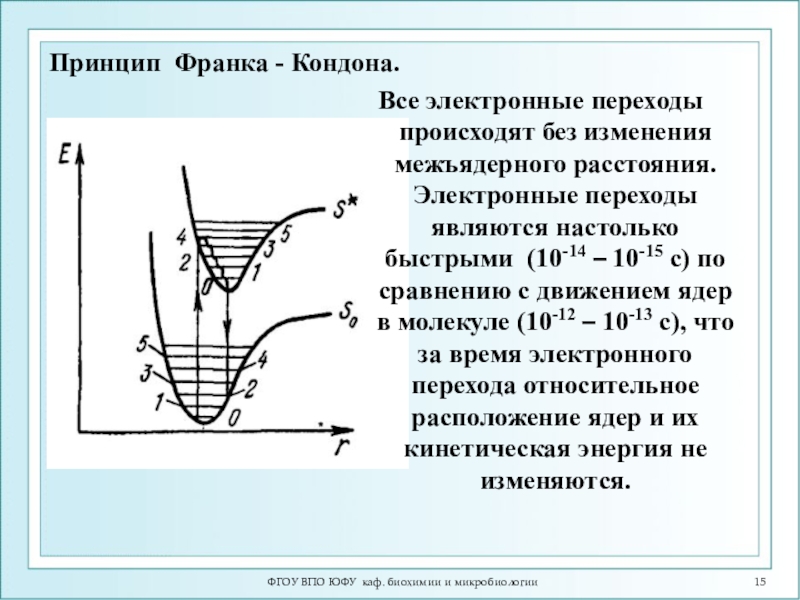
Слайд 15ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Все электронные переходы происходят
без изменения межъядерного расстояния. Электронные переходы являются настолько быстрыми (10-14
– 10-15 с) по сравнению с движением ядер в молекуле (10-12 – 10-13 с), что за время электронного перехода относительное расположение ядер и их кинетическая энергия не изменяются.Принцип Франка - Кондона.
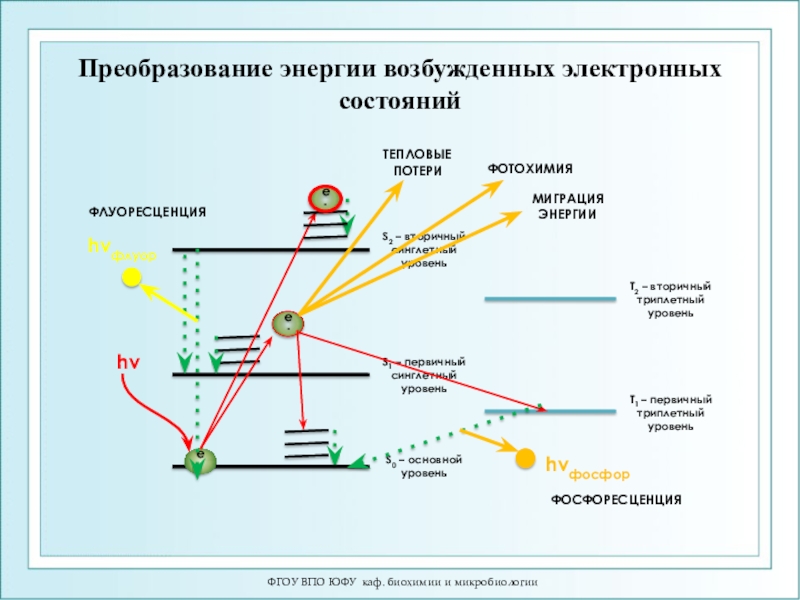
Слайд 16ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Преобразование энергии возбужденных электронных
состояний
Слайд 17ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Трансформация энергии электронного возбуждения
(внутренняя конверсия)
Слайд 18ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
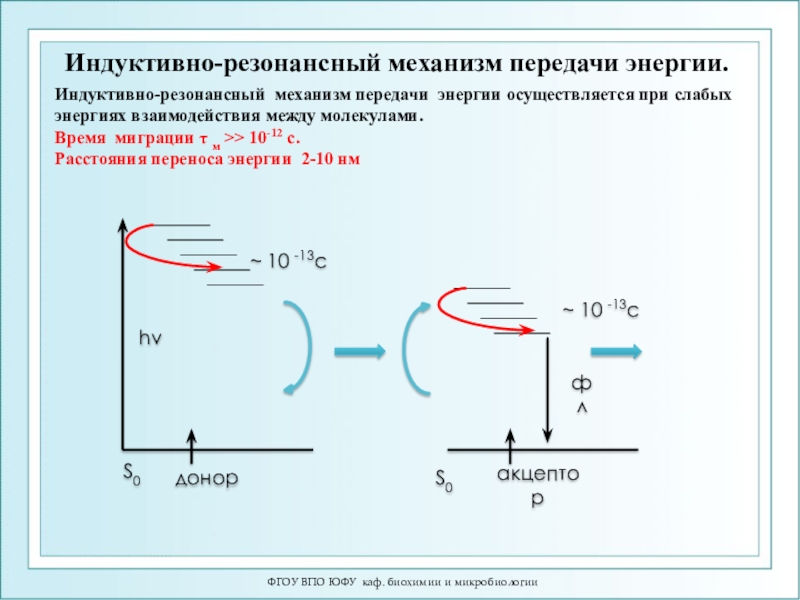
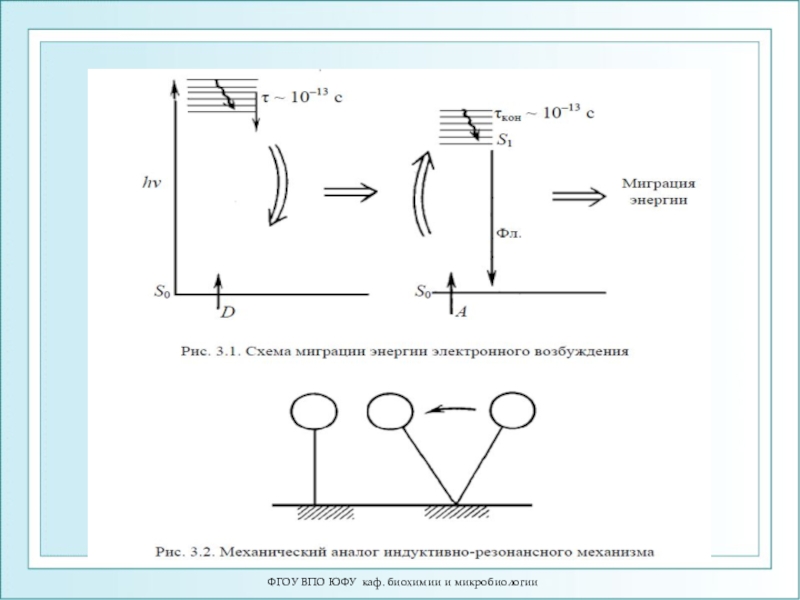
Индуктивно-резонансный механизм передачи энергии.
Индуктивно-резонансный
механизм передачи энергии осуществляется при слабых энергиях взаимодействия между молекулами.
Время миграции τ м >> 10-12 с.
Расстояния переноса энергии 2-10 нм
Слайд 20ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
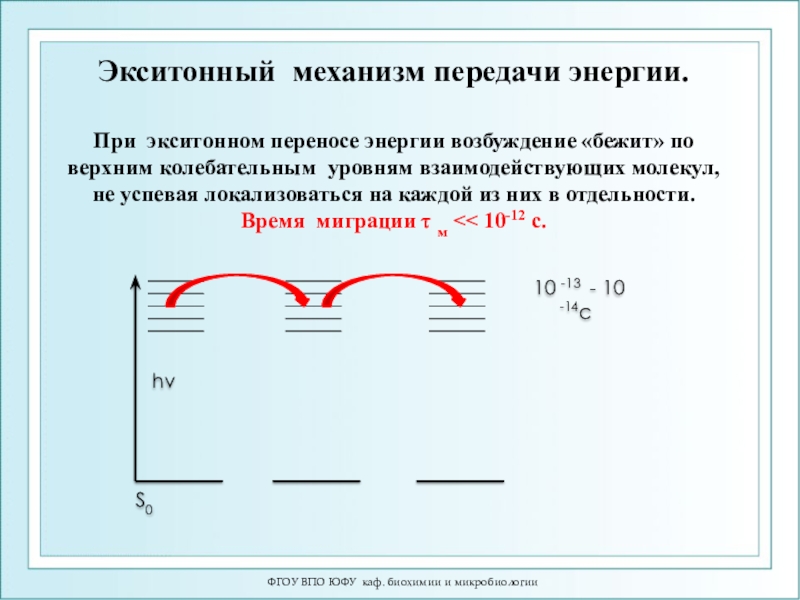
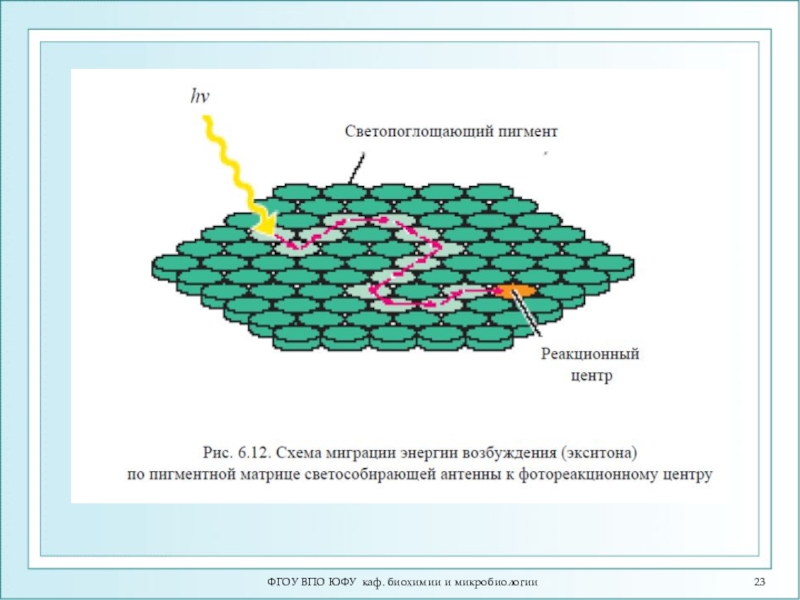
При экситонном переносе энергии
возбуждение «бежит» по верхним колебательным уровням взаимодействующих молекул, не успевая
локализоваться на каждой из них в отдельности.Время миграции τ м << 10-12 с.
Экситонный механизм передачи энергии.
Слайд 21ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
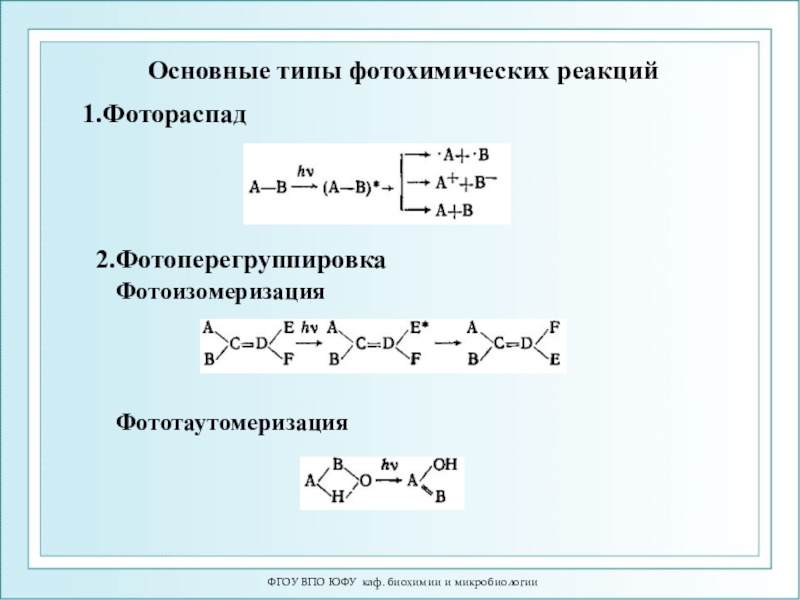
Основные типы фотохимических реакций
1.Фотораспад
2.Фотоперегруппировка
Фотоизомеризация
Фототаутомеризация
Слайд 22ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
3. Фотоприсоединение
Фотодимеризация
А* + А = (А*….А) = А2
Фотогидратация А* + Н2О = НАОН
4. Фотоперенос электронов
Фотоокисление А* + В = А+ + Х-
Фотовосстановление А* + С = А- + С+ 5.
5. Фотоперенос протона
фотоприсоединение Н+ А + ВН =АН+ + В-
фотоотдача Н+ АН+ + В = А- + Н+В
6. Фотогидролиз
А-В → А-В* + Н2О → АН + ВОН
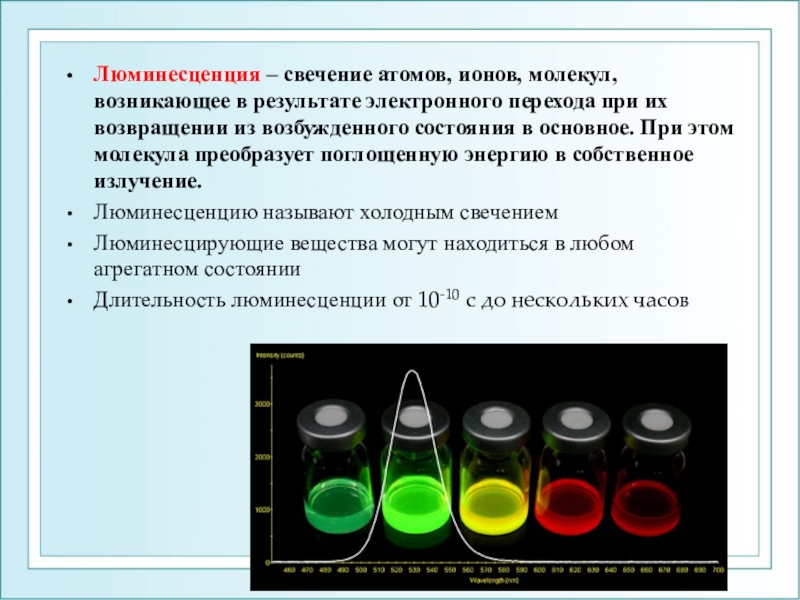
Слайд 24Люминесценция – свечение атомов, ионов, молекул, возникающее в результате электронного
перехода при их возвращении из возбужденного состояния в основное. При
этом молекула преобразует поглощенную энергию в собственное излучение.Люминесценцию называют холодным свечением
Люминесцирующие вещества могут находиться в любом агрегатном состоянии
Длительность люминесценции от 10-10 с до нескольких часов
Слайд 25Характеристики люминесцирующих молекул
Спектр возбуждения люминесценции - зависимость интенсивности люминесценции I
от длины волны возбуждающего света
Спектр люминесценции - зависимость интенсивности люминесценции
от длины волны люминесценции I = f(λ); I = f(v)
Время жизни люминесценции – время, за которое интенсивность излучения уменьшится в е раз, поскольку затухание люминесценции происходит по закону: It = I0 e-t/τ
t - время люминесценции
τ – время затухания люминесценции
Слайд 27Классификация фотолюминесценции по длительности свечения
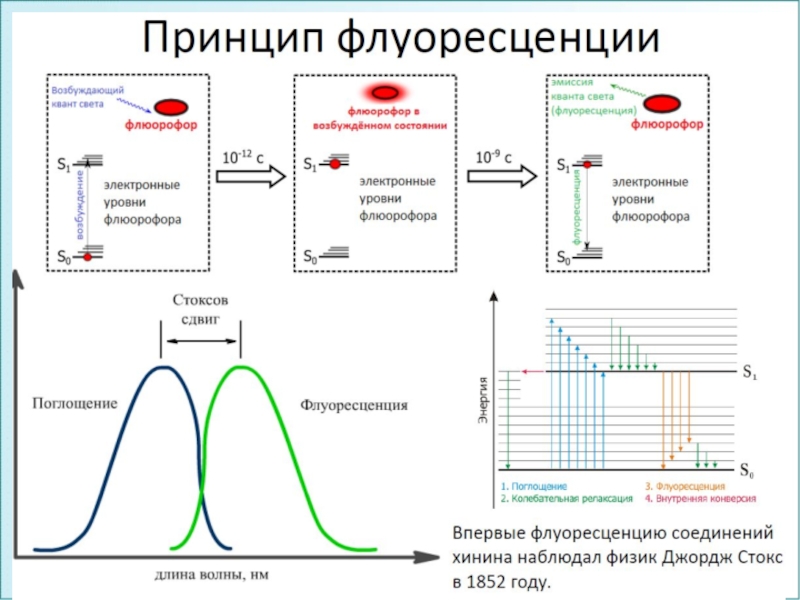
1.Флуоресценция (~10-8 c)
– вид фотолюминесценции, при котором молекула переходит в основное состояние
S0 из короткоживущего возбужденного состояния S*. Наблюдается сразу же после поглощения квантов света и быстро затухает в результате столкновений излучающей молекулы с другими молекулами в растворе.2.Фосфоресценция (10-3 с - секунды) – вид фотолюминесценции, при котором молекула переходит в основное состояние S0 из относительно долгоживущего возбужденного состояния S* → Т* → S0, называется послесвечением. Для фосфоресценции характерны большая длина волны излучения, меньшая интенсивность.
Слайд 31Классификация люминесценции по способу возбуждения
Фотолюминесценция
Термолюминесценция
Электролюминесценция
Сонолюминесценция
Триболюминесценция
Хемилюминесценция
Биолюминесценция
ФГОУ ВПО ЮФУ каф. биохимии и
микробиологии
Слайд 32ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Законы люминесценции
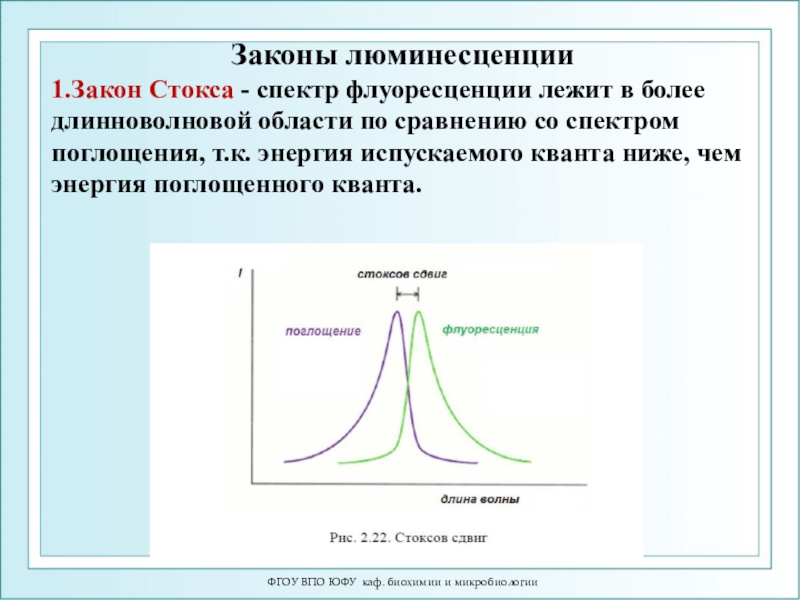
1.Закон Стокса -
спектр флуоресценции лежит в более длинноволновой области по сравнению со
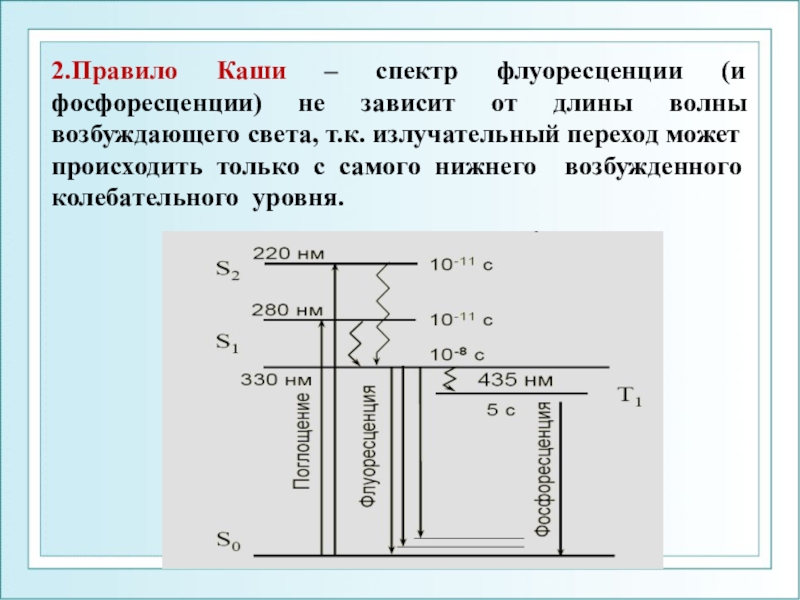
спектром поглощения, т.к. энергия испускаемого кванта ниже, чем энергия поглощенного кванта.Слайд 332.Правило Каши – спектр флуоресценции (и фосфоресценции) не зависит от
длины волны возбуждающего света, т.к. излучательный переход может происходить только
с самого нижнего возбужденного колебательного уровня.Слайд 34ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
3.Закон Вавилова – квантовый
выход флуоресценции (Q) не зависит от длины волны возбуждающего света,
т.к. излучательный переход может происходить только с самого нижнего возбужденного колебательного уровня.Квантовый выход Q. - отношение числа излучаемых квантов к числу поглощенных квантов светового потока.
Q (φ) = N/ No
N – количество излучаемых квантов
No – количество поглощенных квантов
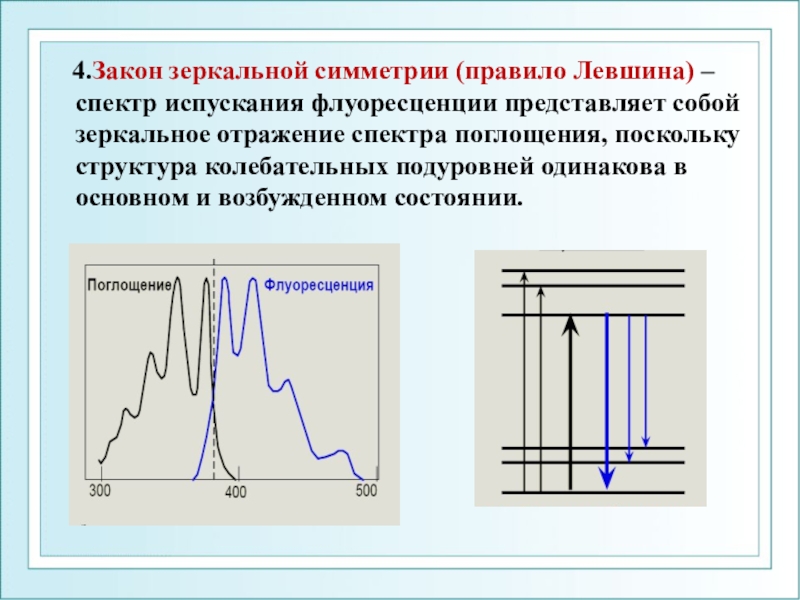
Слайд 35 4.Закон зеркальной симметрии (правило Левшина) – спектр испускания
флуоресценции представляет собой зеркальное отражение спектра поглощения, поскольку структура колебательных
подуровней одинакова в основном и возбужденном состоянии.Слайд 37Хемилюминесценция (ХЛ) – это свечение, сопровождающее биохимические реакции
Процесс хемилюминесценции включает
2 стадии:
Образование продукта в возбужденном состоянии (хемилюминесцентная реакция)
А + В → Р*2. Испускание кванта света (люминесценция)
Р* → Р + фотон
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 39Виды хемилюминесценции (ХЛ) в живых системах
Митогенетическое излучение
Сверхслабое свечение (собственная хемилюминесценция
СХЛ) клеток и тканей
Биолюминесценция (БЛ)
Активированная хемилюминесценция (АХЛ)
ФГОУ ВПО ЮФУ каф.
биохимии и микробиологииСлайд 40Эмпирические правила ХЛ
1.Спектр хемилюминесценции подобен спектру фосфоресценции, а не спектру
флуоресценции.
2. Абсолютная величина квантового выхода в хемилюминесцентных реакциях имеет
невысокие значения.3. Энергия испускаемого фотона равна сумме энтальпии реакции и энергии активации люминесценции (правило Одюбера).
hν = Eа + ∆H
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 41ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
1.Митогенетическое излучение
В 1923 году А.Гурвич
обнаружил митогенетическое излучение делящихся клеток и определил его диапазон -
область ультра-фиолетового излучения(λ = 180-300 нм). Создал концепцию морфогенетического поля организма, которое создает и поддерживает в живых системах специфическую молекулярную упорядоченность.
Слайд 42ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
При помощи биологических объектов
возможно производить индукцию митозов на расстоянии, т. е. можно увеличивать
количество митозов в биологическом объекте без непосредственного соприкосновения.Слайд 43ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
2. Собственная ХЛ. Измерение
собственного свечения органов животного
Слайд 44ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
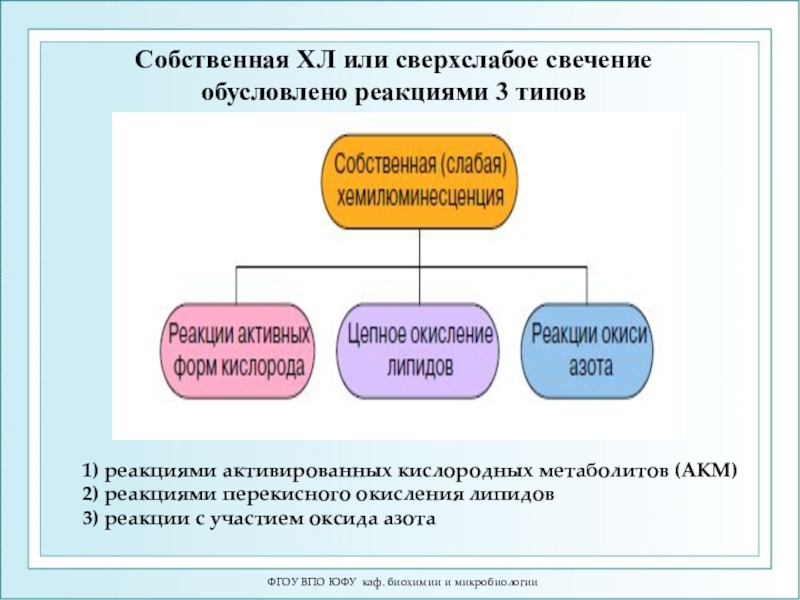
1) реакциями активированных кислородных
метаболитов (АКМ) 2) реакциями перекисного окисления липидов 3) реакции с участием оксида
азотаСобственная ХЛ или сверхслабое свечение обусловлено реакциями 3 типов
Слайд 46ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
3.Биолюминесценция (БХЛ)— способность живых
организмов светиться, которая достигается самостоятельно или с помощью симбионтов.
Это
видимое глазом свечение, связанное со специфическими ферментативными реакциями, при которых освобождающаяся энергия выделяется в виде света. Специфический фермент называется люциферазой, а его субстрат – люциферином.БХЛ была открыта в 1887 г. Р. Дюбуа, который показал, что за БХЛ отвечают 2 фракции: 1)низкомолекулярная, устойчивая к нагреванию - люциферин; 2) белковая, инактивирующаяся при нагревании, - люцифераза.
Люциферины окисляются в присутствии люциферазы с образованием оксилюциферина и фотона.
Слайд 47ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Типы биолюминесценции (БЛ):
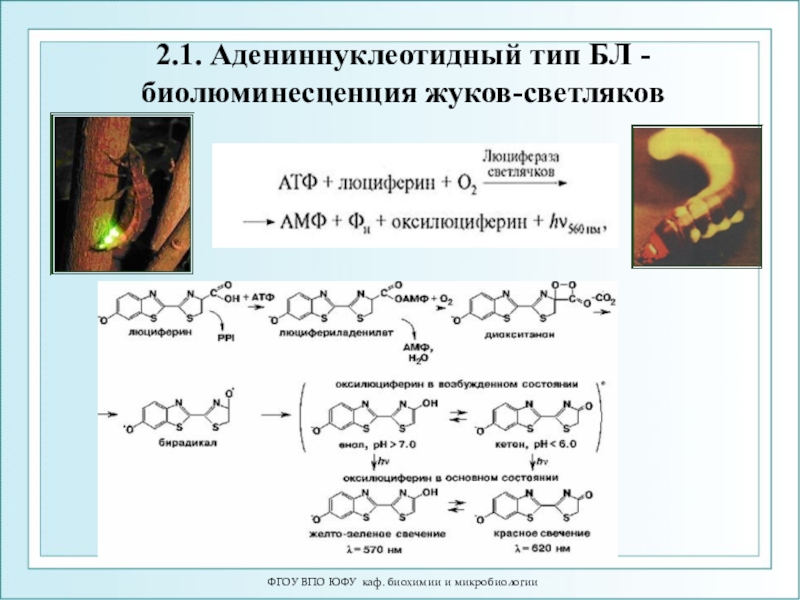
2.1.Адениннуклеотидная
ЛН2 +
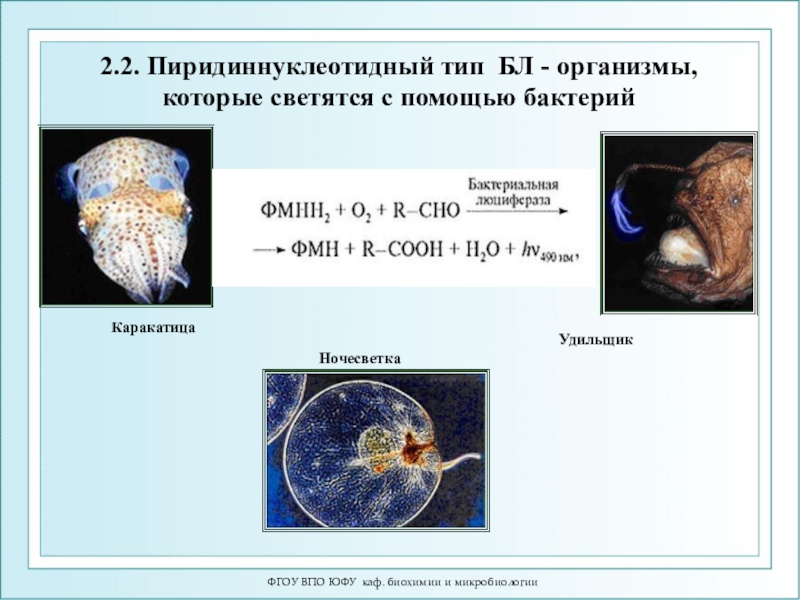
АТФ + О2 → оксиЛ* +АМФ + СО2 + Н2О
+ hν↑ (λ=560 нм) 2.2.Пиридиннуклеотидная RCHO + O2 + НАДН2 + ФМН2 → RCOOH + Н2О + НАДН+ + ФМН + hν↑ (λ=490 нм) 2.3.Фотопротеины Целентеразин + Ca2+ = Целентерамид* + CO2 = Целентеразин + hν (469 нм)Слайд 48ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
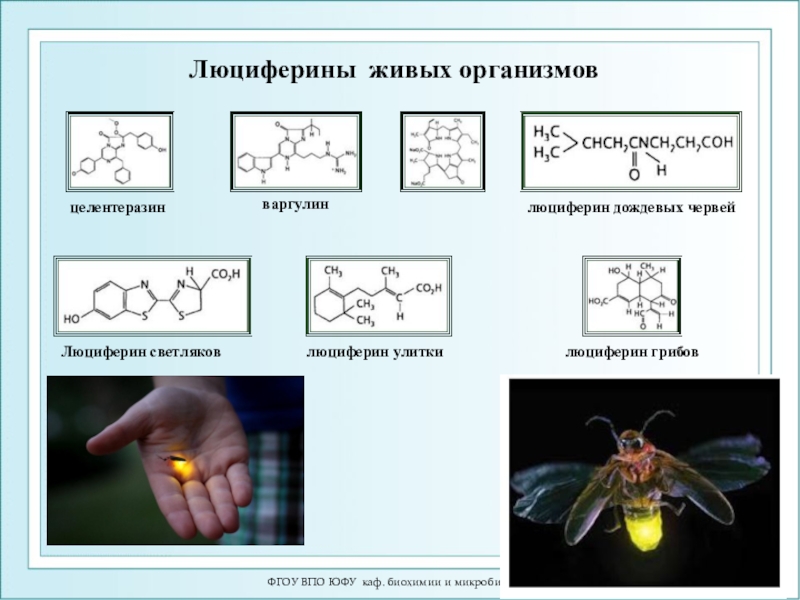
Люциферины живых организмов
Люциферин светляков
люциферин
дождевых червей
целентеразин
варгулин
люциферин улитки
люциферин грибов
Слайд 49ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
2.1. Адениннуклеотидный тип БЛ
- биолюминесценция жуков-светляков
Слайд 50ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Каракатица
Каракатица
Ночесветка
Удильщик
2.2. Пиридиннуклеотидный тип БЛ
- организмы, которые светятся с помощью бактерий
Слайд 51ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
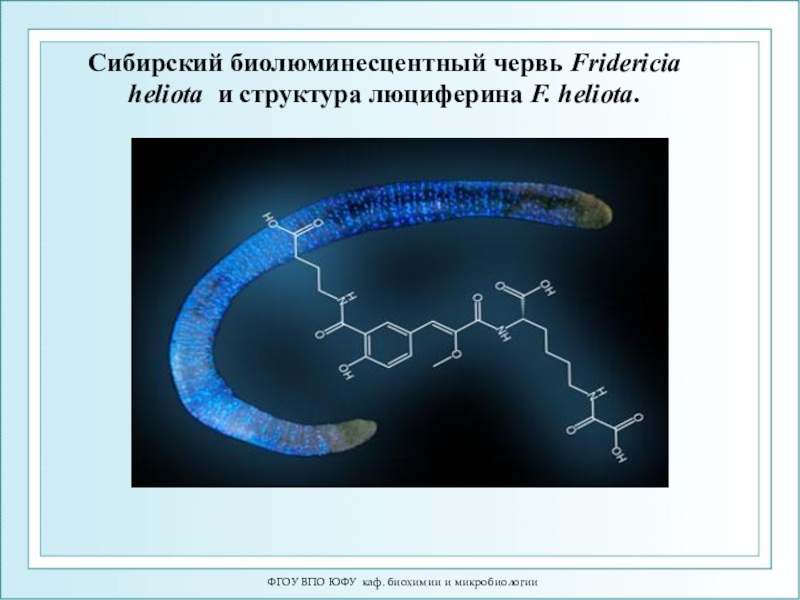
Сибирский биолюминесцентный червь Fridericia heliota
и структура люциферина F. heliota.
Слайд 52ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
2.3. Фотопротеины - биолюминесценция
медузы эквореи
Экворин — люминесцентный белок из медузы эквореи (Aequorea victoria) и некоторых других морских
организмов. Впервые выделен в 1961—1962 годах американскими учеными Джонсоном и Шимомурой. Состоит из белковой части (апопротеин) и простетической группы целентеразина Люминесцирует в присутствии ионов кальция.целентеразин
Слайд 53ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Фотопротеины
Исследование биолюминесцентной системы
медузы Aequorea victoria Осама Шимомурой привели к открытию 2 белков
– Са-регулируемого фотопротеина экворина и зеленого флуоресцирующегобелка (GFP).
Биолюминесценция экворина инициируется ионами Са и не зависит от кислорода. Фотопротеин состоит из апопротеина и простетической группы –целентеразина (имидазолпиразина).
Слайд 54ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Проблема, с которой всегда сталкиваются
специалисты по биолюминесценции, — получение достаточного количества биомассы для выделения и
исследования веществ, участвующих в реакции. Характерно в этом смысле описание сбора материала на биостанции Фрайди Харбор, которое дал Шимомура в своей нобелевской лекции: «Мы начинали собирать медуз в шесть утра, а в восемь - часть нашей группы принималась отрезать кольца (краевые участки зонтика медузы, наиболее ярко светящиеся). Всю вторую половину дня мы проводили, экстрагируя экворин из колец. Потом мы снова собирали медуз с семи до девяти вечера, на завтра. Наша лаборатория выглядела как фабрика по переработке медуз, и пахло в ней медузами».Слайд 55Экворин – апопротеин + целентеразин (189 АК, 22 кДа) Целентеразин +
Ca2+ = Целентерамид* + CO2 = Целентеразин + hν (469
нм) Экворин с простетической группой целентеразином, используется как индикатор присутствия ионов Са2+ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 56ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Шимомура обнаружил, что выделенный
из медузы и очищенный экворин in vitro излучает синий свет,
в то время как живая медуза светится зелёным. Дальнейшие исследования показали, что за зелёное свечение ответственен другой белок — GFP (green fluorescent protein — зелёный флуоресцентный белок), флуоресцирующий зелёным светом под действием голубого излучния экворина.Слайд 57ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Осама Шимомура
Нобелевскую премию по
химии 2008 года получили О.Шимомура, М.Чалфи, Р.Тсьен «за открытие зелёного
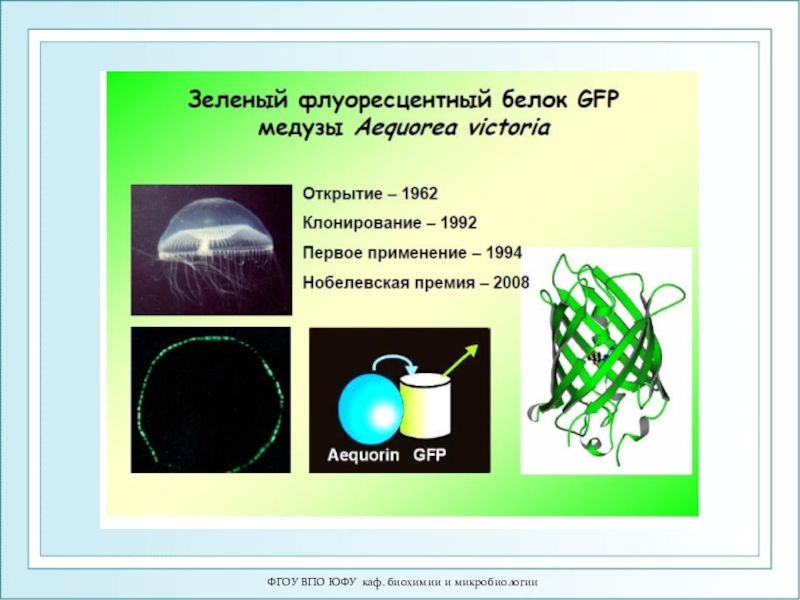
флуоресцирующего белка и за разработку новых методов исследований на его основе»Зелёный флуоресцирующий белок (green fluorescent protein, GFP) впервые обнаружили в 1962 году в организме медузы Aequorea victoria.
Медуза Aequorea victoria (а) обитает в Тихом океане, у западного побережья Северной Америки. Её биолюми-несцентные органы расположены по краю «зонтика» (б, в).
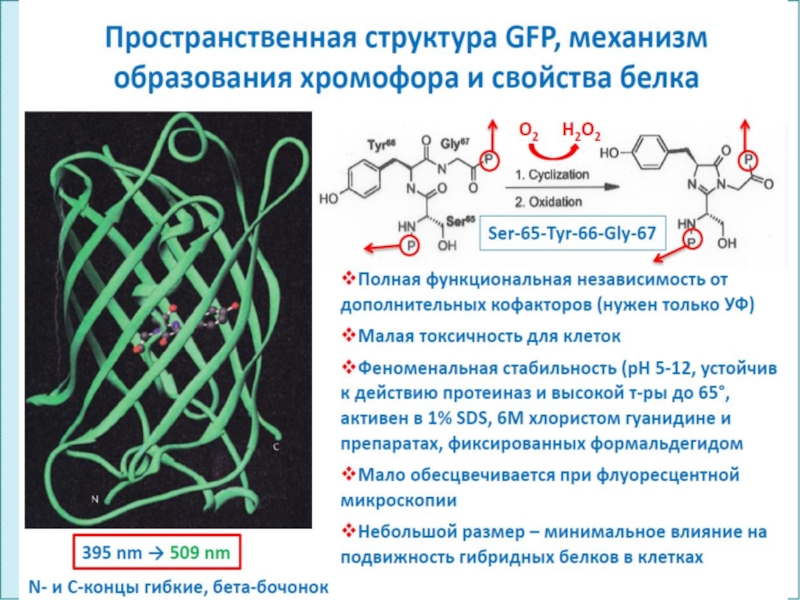
Зелёный флуоресцирующий белок состоит из 238 аминокислот (27 кДа). Аминокислотная цепочка свёрнута в форме «бочки». Внутри расположена хромофорная группа, которая поглощает синий свет, а излучает зелёный.
Слайд 58ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
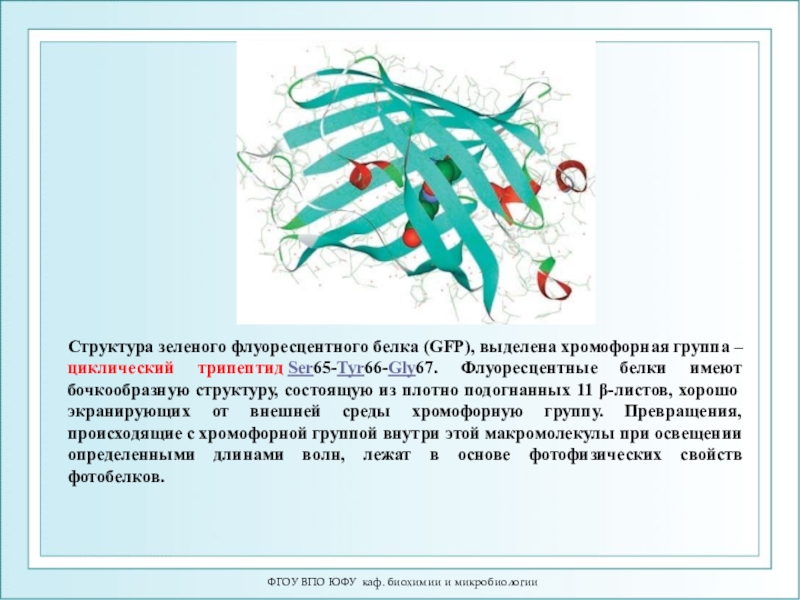
Структура зеленого флуоресцентного белка
(GFP), выделена хромофорная группа – циклический трипептид Ser65-Tyr66-Gly67. Флуоресцентные белки имеют
бочкообразную структуру, состоящую из плотно подогнанных 11 β-листов, хорошо экранирующих от внешней среды хромофорную группу. Превращения, происходящие с хромофорной группой внутри этой макромолекулы при освещении определенными длинами волн, лежат в основе фотофизических свойств фотобелков.Слайд 61ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Скульптурная композиция, посвящённая GFP
(Вашингтон, США).
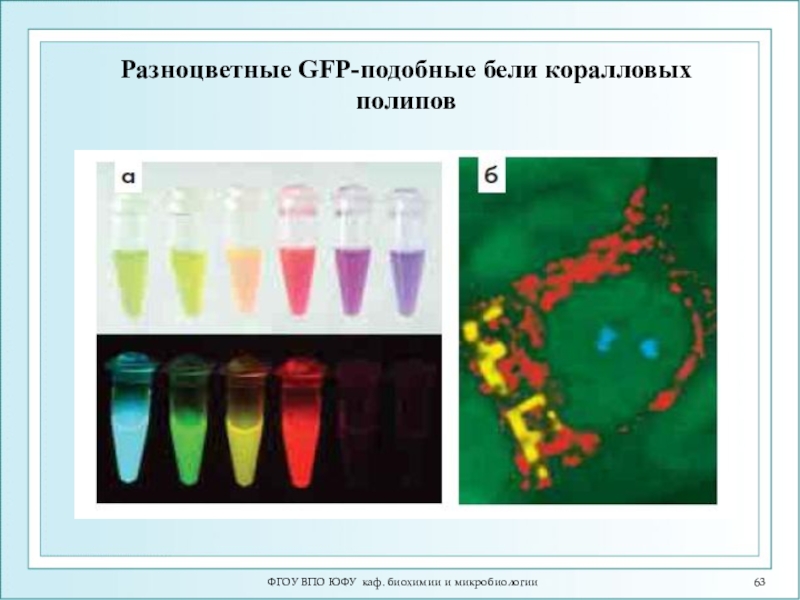
Слайд 62GFP – флуоресцентная метка для изучения экспрессии клеточных белков
ФГОУ ВПО
ЮФУ каф. биохимии и микробиологии
Слайд 64ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
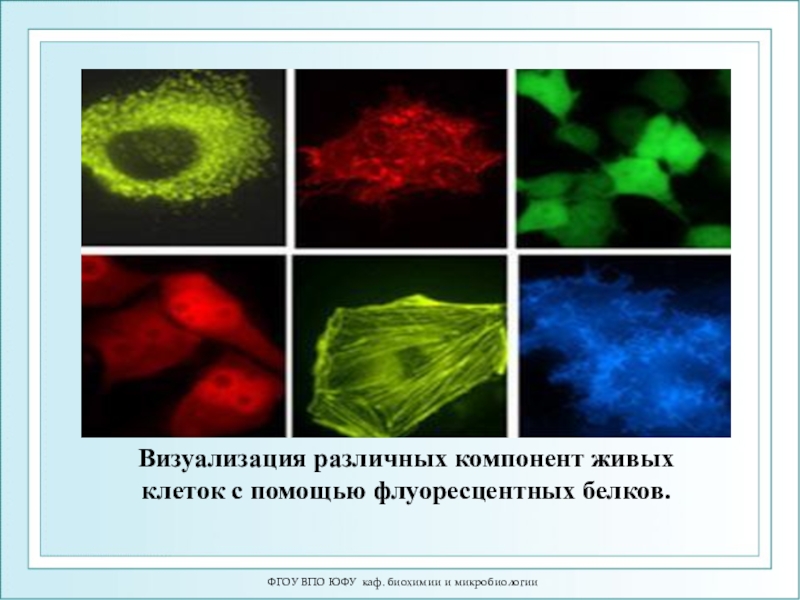
Визуализация различных компонент живых
клеток с помощью флуоресцентных белков.
Слайд 65ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Клеточный белок актин, меченный
красным флуоресцирующим белком (RFP), выглядит под флуоресцентным микроскопом как изящная
пирамидка.Только что синтезированный в клетке рецепторный белок LAMP2 светится голубым, аппарат Гольджи — зелёным, а рецепторные белки дают красную флуоресценцию.
Внутри клетки на фоне зелёного свечения клеточной цитоплазмы видны красные нити белка тубулина.
Слайд 66ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Американские ученые создали котов, невосприимчивых к кошачьему вирусу иммунодефицита
(ВИК). Чтобы посмотреть, насколько ген, обеспечивающий невосприимчивость, активен в разных клетках животного, исследователи добавили к нему ген флуоресцирующего белка, благодаря которому генно-инженерные коты в ультрафиолетовых лучах светятся зеленым светом.С помощью вирусного вектора внедрили в ДНК кошачьей яйцеклетки ген противовирусного фактора макаки TRIMCyp, снабжающего клетки устойчивостью к вирусу иммунодефицита. Чтобы проверить, не используя сложных инструментальных методик, насколько этот ген будет активен в различных тканях трансгенных животных, ученые добавили к нему ген зеленого флуоресцирующего белка медузы Aequorea victoria.
Зеленые кошки не болеют СПИДом
Слайд 67ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
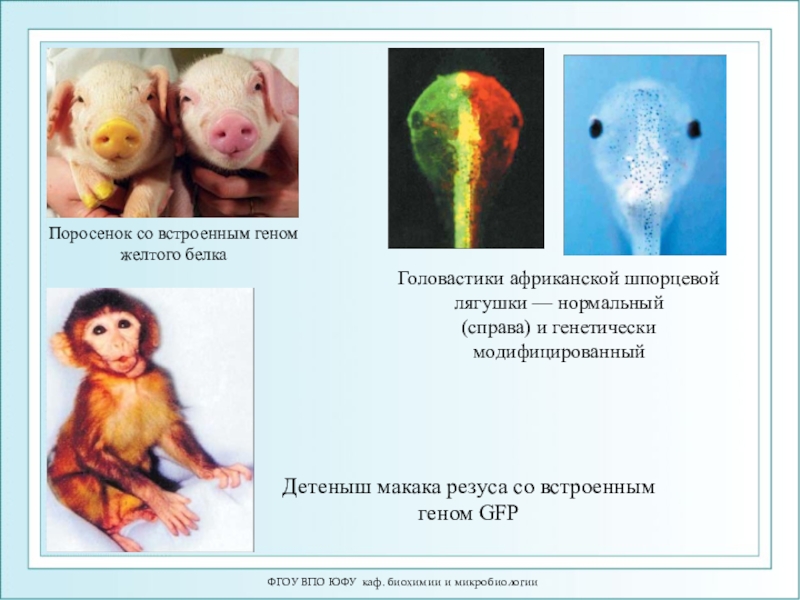
Поросенок со встроенным геном
желтого белка
Головастики африканской шпорцевой лягушки — нормальный
(справа) и генетически модифицированный
Детеныш
макака резуса со встроенным геном GFP Слайд 68ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
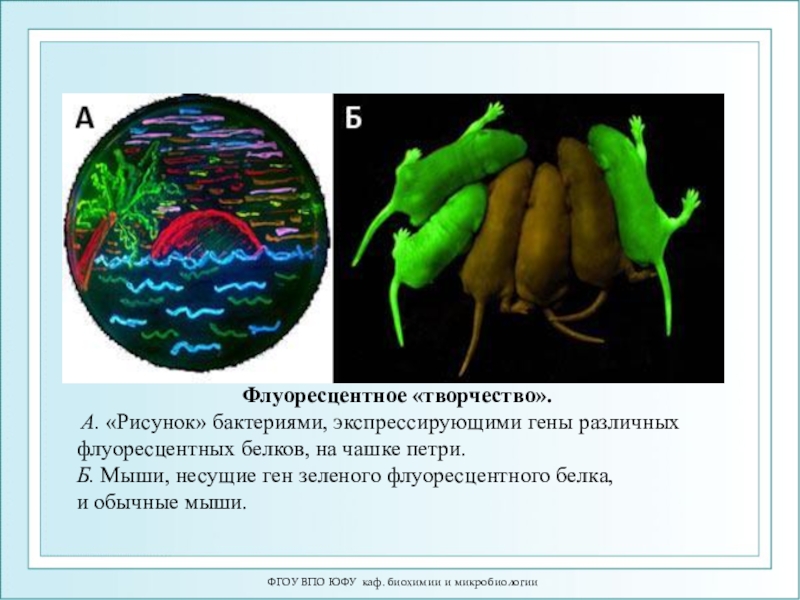
Флуоресцентное «творчество».
А. «Рисунок» бактериями, экспрессирующими
гены различных флуоресцентных белков, на чашке петри.
Б. Мыши, несущие ген зеленого флуоресцентного
белка, и обычные мыши.Слайд 69ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
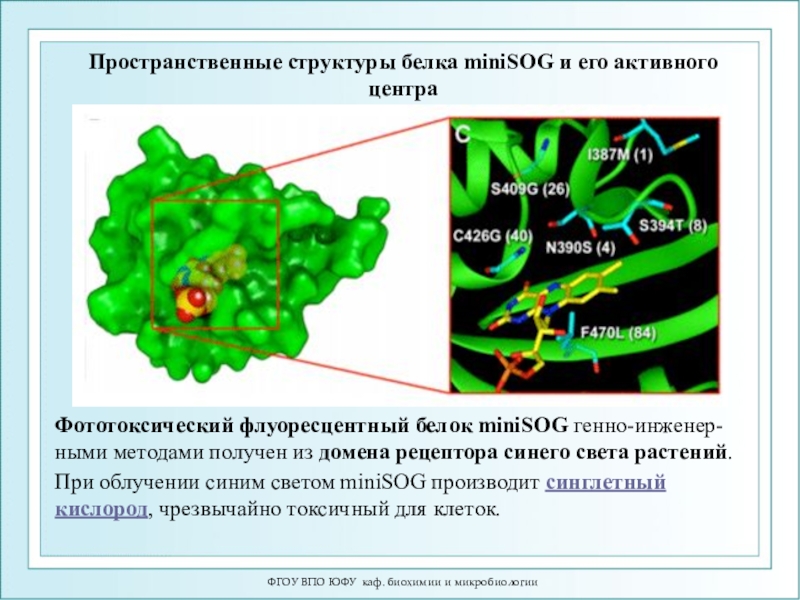
Пространственные структуры белка miniSOG
и его активного центра
При облучении синим светом miniSOG производит синглетный кислород,
чрезвычайно токсичный для клеток. Фототоксический флуоресцентный белок miniSOG генно-инженер-ными методами получен из домена рецептора синего света растений.
Слайд 70ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
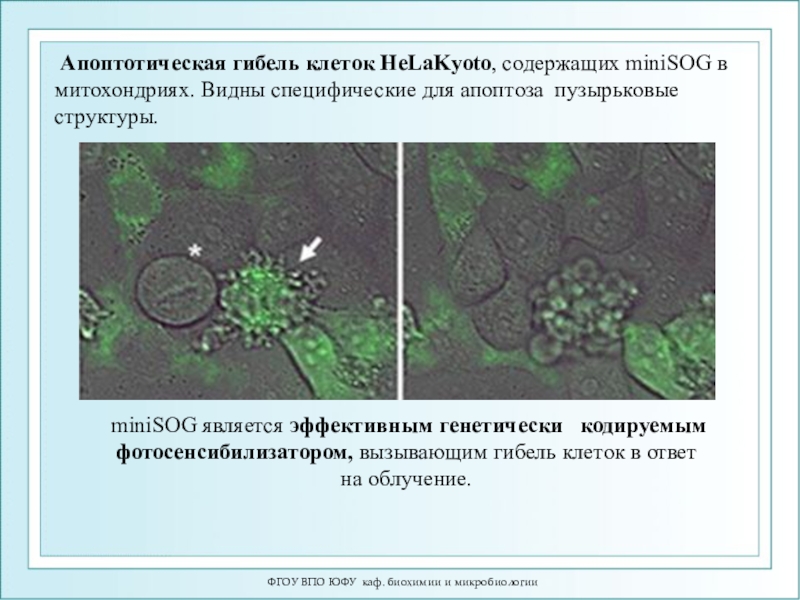
Апоптотическая гибель клеток
HeLaKyoto, содержащих miniSOG в митохондриях. Видны специфические для апоптоза пузырьковые
структуры. miniSOG является эффективным генетически кодируемым фотосенсибилизатором, вызывающим гибель клеток в ответ на облучение.
Слайд 71ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
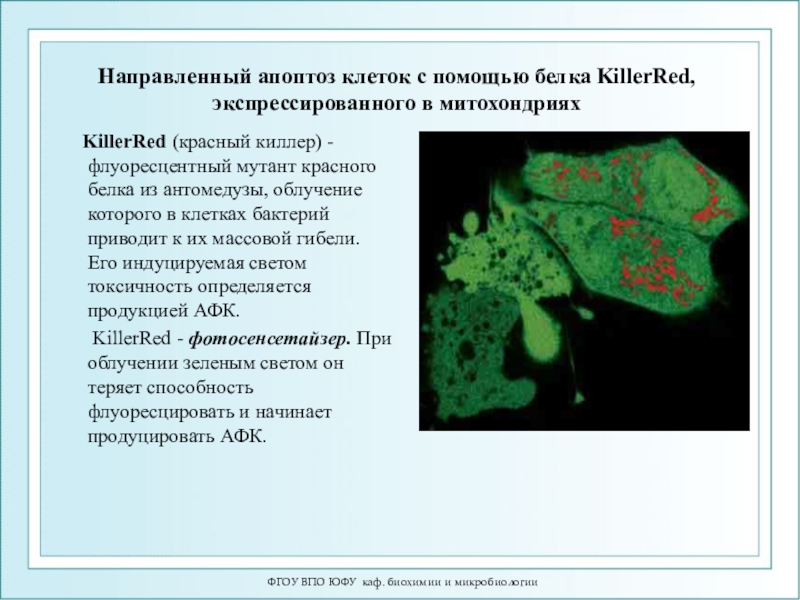
Направленный апоптоз клеток с
помощью белка KillerRed, экспрессированного в митохондриях
KillerRed (красный
киллер) - флуоресцентный мутант красного белка из антомедузы, облучение которого в клетках бактерий приводит к их массовой гибели. Его индуцируемая светом токсичность определяется продукцией АФК. KillerRed - фотосенсетайзер. При облучении зеленым светом он теряет способность флуоресцировать и начинает продуцировать АФК.
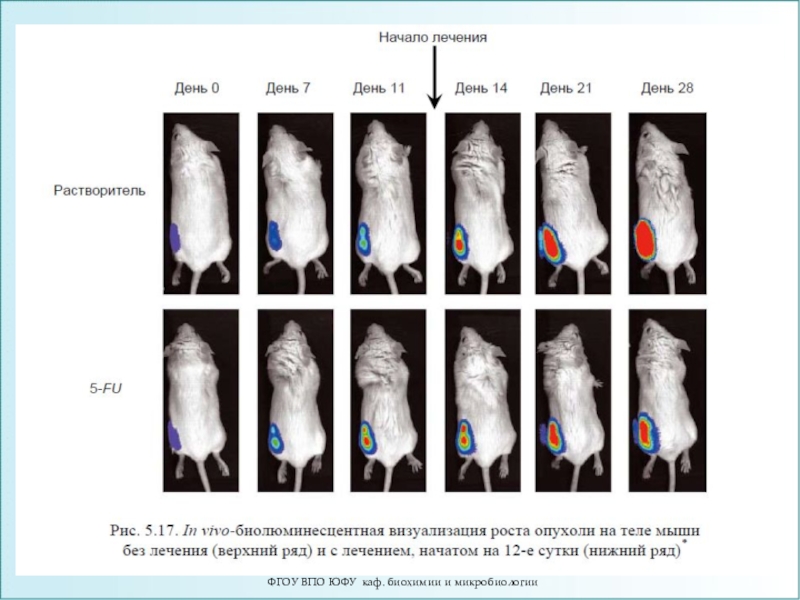
Слайд 73Биолюминесцентный имиджинг (БИ)
БИ основан на реакции окисления люциферазой субстрата, которая
сопровождается испусканием кванта света.
ДНК, кодирующую люциферазу, встраивают в геном
целевых клеток, а субстрат вводится системно.БИ с использованием маркера luc2 - быстрый, крайне чувствительный и неинвазивный метод исследования, в том числе и онкологических процессов.
Продемонстрирована возможность изучения :
- генной экспрессии,
- активности клеточных рецепторов,
- путей сигнальной передачи,
- процессинга РНК,
- белок-белковых взаимодействий,
- жизнедеятельности стволовых клеток,
- процесса апоптоза
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
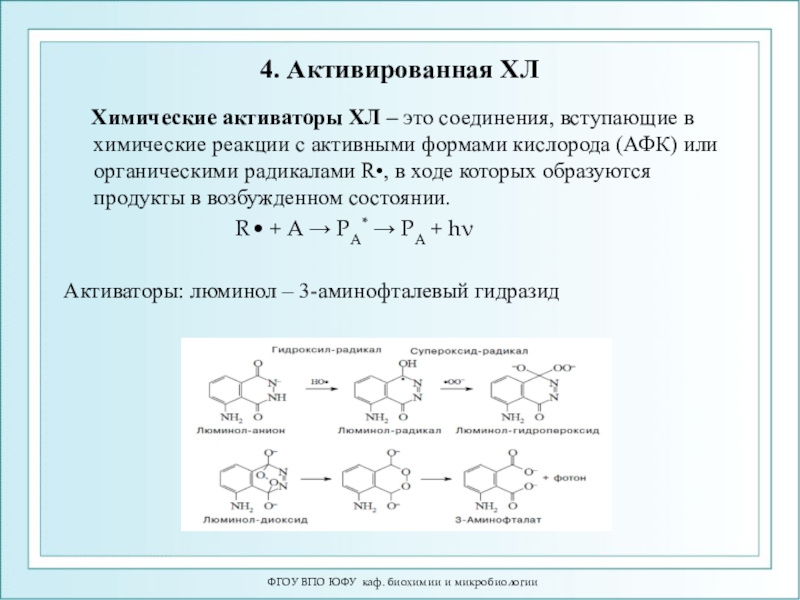
Слайд 744. Активированная ХЛ
Химические активаторы ХЛ – это
соединения, вступающие в химические реакции с активными формами кислорода (АФК)
или органическими радикалами R•, в ходе которых образуются продукты в возбужденном состоянии.R• + А → РА* → РА + hν
Активаторы: люминол – 3-аминофталевый гидразид
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 75ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
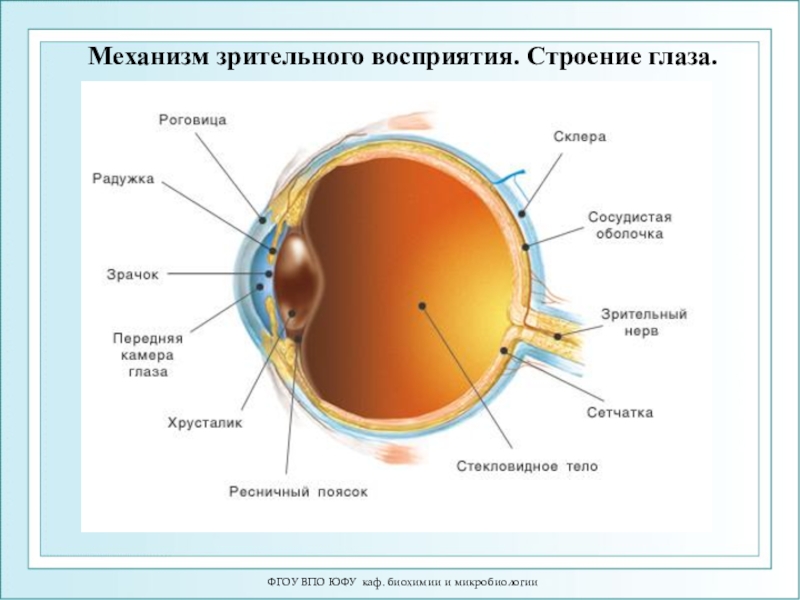
Биофизика зрительного восприятия
1877 г.
- Франц Болл открыл зрительный пурпур – родопсин сетчатки глаза,
наблюдая выцветание сетчатки лягушки при освещении.1967 г. – Джордж Уолд - Нобелевская премия по физиологии и медицине «за открытия, связанные с первичными физиологическими и химическими зрительными процессами»
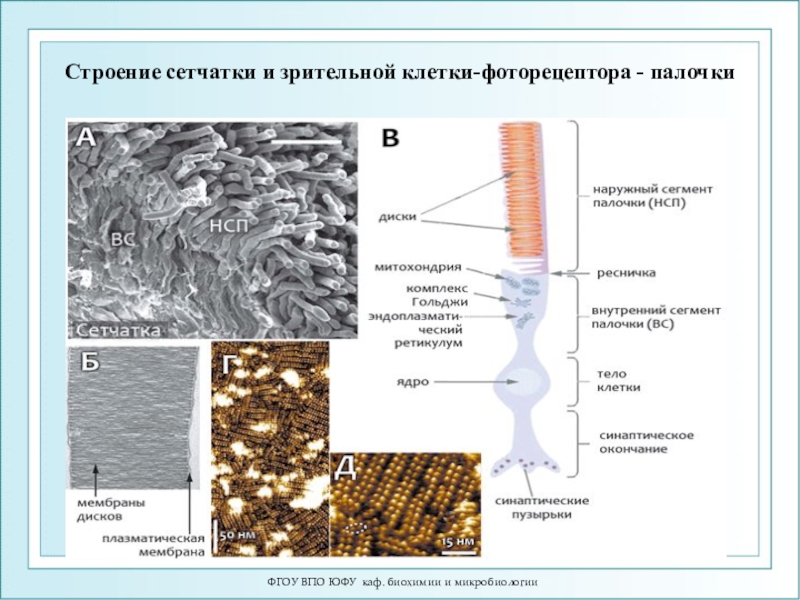
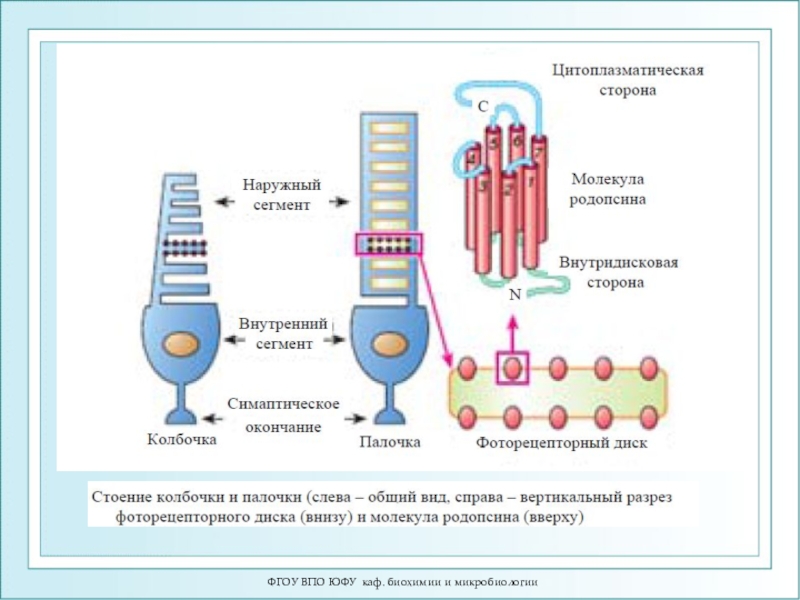
Слайд 77ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Строение сетчатки и зрительной
клетки-фоторецептора - палочки
Слайд 78ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
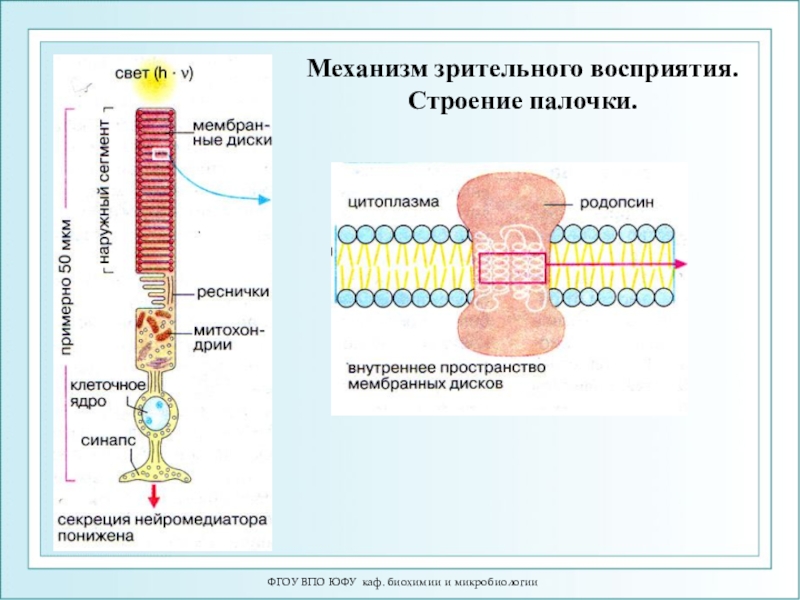
Механизм зрительного восприятия. Строение
палочки.
Слайд 79ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
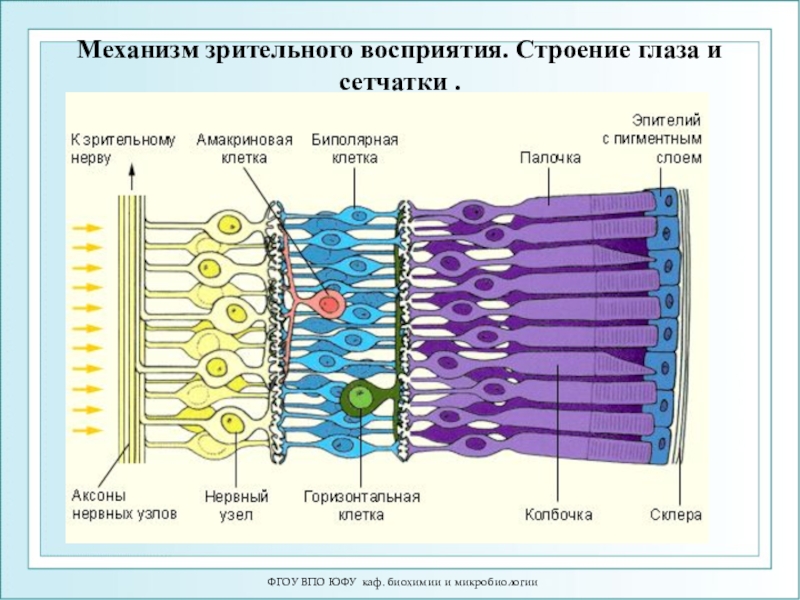
Механизм зрительного восприятия. Строение
глаза и сетчатки .
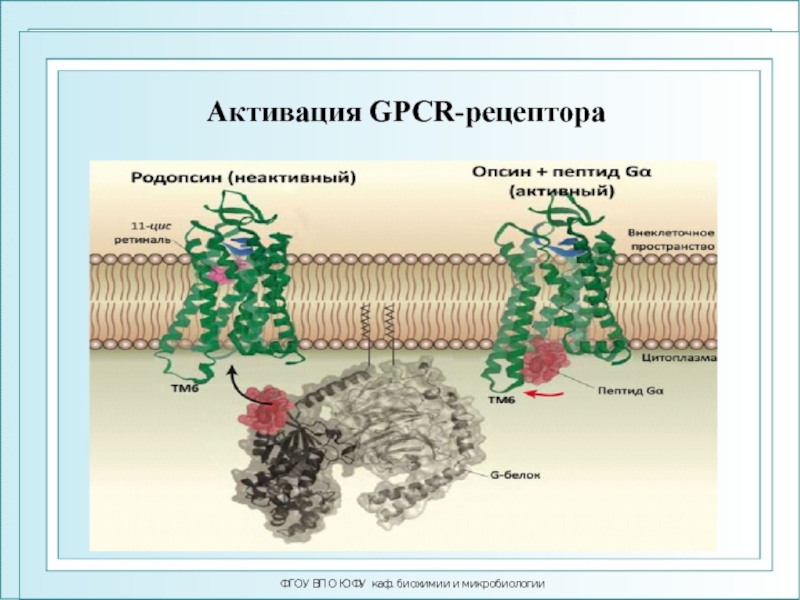
Слайд 82ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Лауреаты Нобелевской премии 2012
г. по химии «за раскрытие подробной схемы того, как работают
рецепторы, связанные с G-белками (GPCRs)»Роберт Лефковиц
Брайан Кобилка
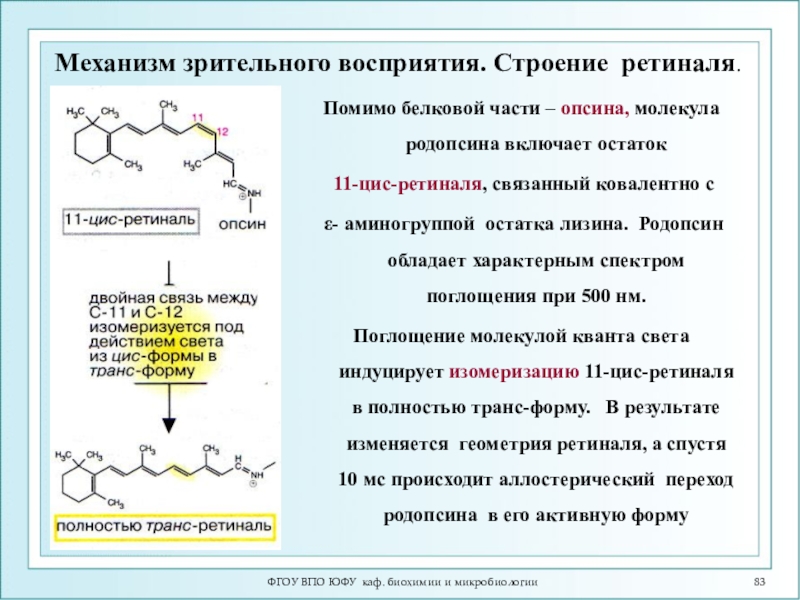
Слайд 83ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
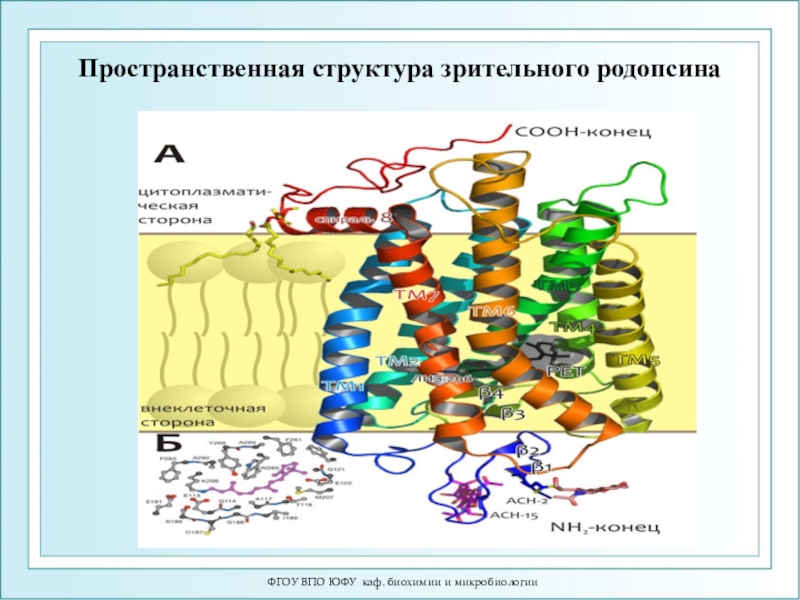
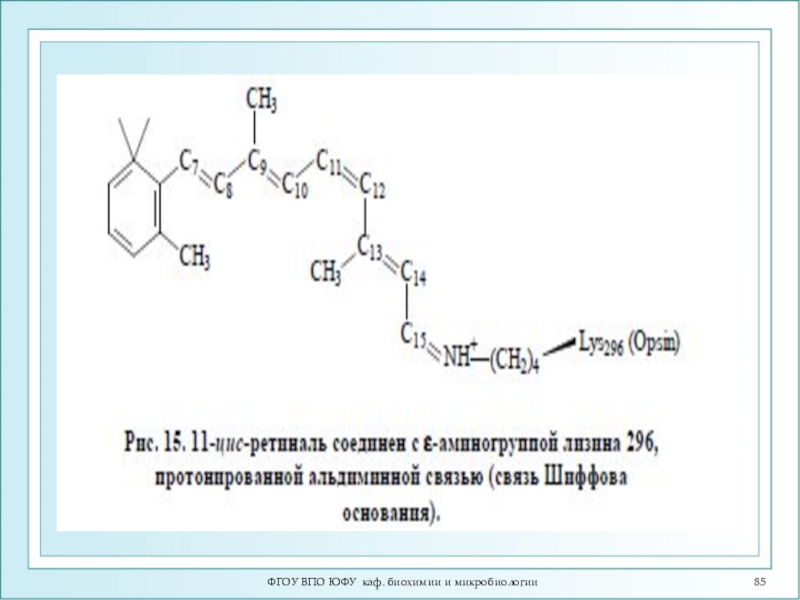
Механизм зрительного восприятия. Строение
ретиналя.
Помимо белковой части – опсина, молекула родопсина включает остаток
11-цис-ретиналя, связанный ковалентно сε- аминогруппой остатка лизина. Родопсин обладает характерным спектром поглощения при 500 нм.
Поглощение молекулой кванта света индуцирует изомеризацию 11-цис-ретиналя в полностью транс-форму. В результате изменяется геометрия ретиналя, а спустя 10 мс происходит аллостерический переход родопсина в его активную форму
Слайд 93ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
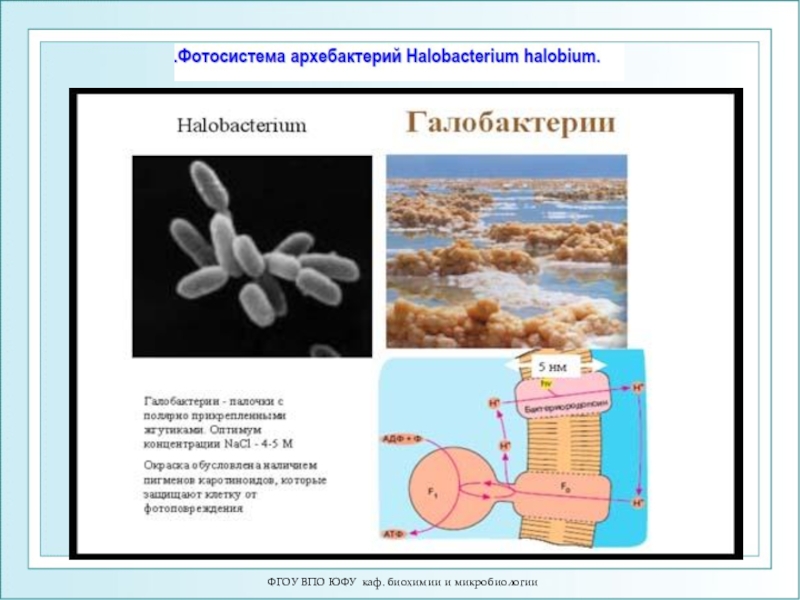
Пурпурная мембрана и бактериородопсин
Светозависимый
синтез
АТФ в клетках H. halobium
В 1971 году В.
Стоккениус и Д. Остер-хельт выделили из галофильных бактерий Halobacterium halobium хромопротеид интенсивного пурпурного цвета.В качестве хромофорной части группы бактериородопсин содержит 13-цис и транс-ретиналь. Бактериородопсин выполняет роль светозависимого протонного насоса, создающего градиент ионов водорода, энергия которых используется для синтеза АТФ
Слайд 95ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Бактериородопсин в мембране (а
- вид вдоль мембраны, б - вид на мембрану сверху).
Цилиндрами показаны семь спиралей этого белка. Показаны и соединяющие эти спирали петли, а также (голубым цветом) молекула ретиналя, прикрепленная внутри бактериородопсина.Слайд 97ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Механизм перекачивания протонов за
счет энергии света
у H. halobium
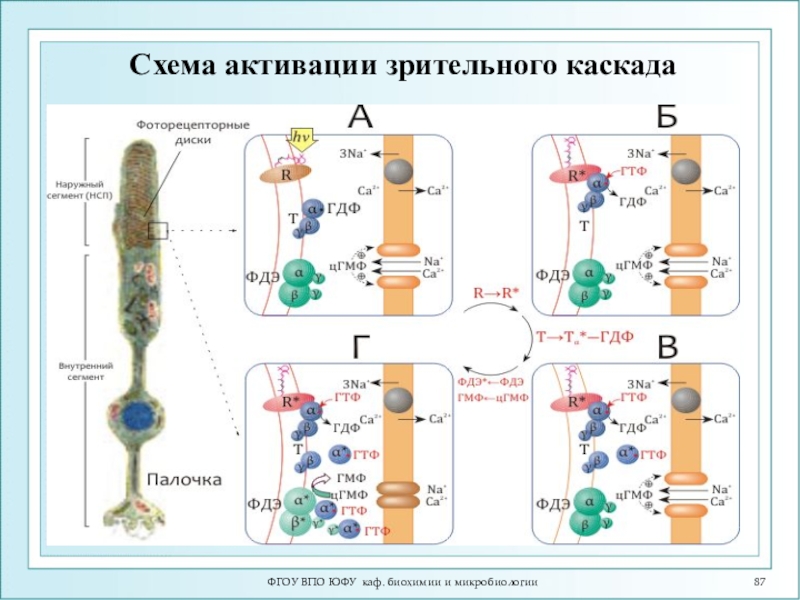
Слайд 99ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Технические приложения бактериородопсина (проекты):
протонный
транспорт:
генерация АТФ в реакторах;
опреснение морской воды;
генерация электрической энергии из света;
фотоэлектрические
применения:ультрабыстрая световая детекция;
искусственная сетчатка;
детекция подвижности;
фотохромные применения:
хранение информации:
2D-носители;
3D-носители;
голографические носители;
различные применения:
детекция радиации;
биосенсорные приложения.
Слайд 100Роль синглетного кислорода 1О2
1.
Важный путь образования 1О2 – фотодинамические реакции с участием пигментов
- сенсибилизаторов.Токсичность пигментов и красителей, которая появляется на свету и в присутствии кислорода, называется фотодинамическим действием.
2.Вызывает развитие фотодинамических болезней человека, животных, растений (гиперицизм, фагопиризм, порфирии, церкоспороз).
3.Создание новых медицинских технологий - фотодинамическая терапия рака (Т.Догерти, 1970); внутривенное лазерное облучение крови (ВЛОК).
Фотосенсибилизаторы - это вещества, которые способны "усиливать" действие света за счет передачи его энергии другим веществам и тем самым запускать цепь различных физических и химических процессов.
Слайд 101
Фотодинамические болезни
1. Порфирии – клинические расстройства, связанные с нарушениями в
синтезе гема, что приводит к появлению необычно большого количества фотосенсибилизаторов
- порфиринов в крови, тканях и моче.
Важнейшие симптомы: сверхчувствительность кожи к свету - эритемы, язвы, желудочно-кишечные расстройства, боли, онемения мускулов. Некоторые формы порфирии поражают ЦНС (недостаток производного порфирина витамина В12 ), диапазон проявлений: от раздражительности и мрачности до полной психической ненормальности.
Слайд 102протопорфирин
Порфирины (ПФ)— самые распространенные пигменты в природе. К ним относятся хлорофиллы,
гем, ПФ входят в состав цитохромов и других ферментов
Слайд 103Зверобой содержит гиперицин - вещество, повышающее чувствительность кожи к видимому
свету и ультрафиолетовым лучам, вызывает заболевание животных гиперицизм
Слайд 104Фагопирин
Гречиха содержит фагопирин - пигмент, повышающий чувствительность кожи к видимому
свету и ультрафиолетовым лучам, вызывает заболевание животных фагопиризм
Слайд 105Церкоспороз листьев (сероватая пятнистость) – поражение растения грибром р.Cercospora (содержит
белок церкоспорин, запускающий реакцию фотосенсибилизации и образование АФК).
Слайд 106Фотодинамическая терапия (ФДТ) – новый способ лечения некоторых видов рака
- активно развивается во многих странах мира
Принцип метода: опухолевые клетки
разрушаются под действием активных форм кислорода, которые образуются в фотохимической реакции фотосенсибилизации.Необходимые условия ФДТ :
свет определенной длины волны,
Фотосенсибилизатор (ФС), избирательно накапливающийся в опухолевых клетках,
кислород.
ФС переносит энергию света на кислород, благодаря чему последний переходит в возбужденное синглетное состояние и вызывает разрушение опухолевых клеток.
Слайд 109Летальные реакции
Приводят к гибели организма УФ-излучением. В случае микроорганизмов различают
бактериостатический (клетки живут, но не размножаются) и бактерицидный (клетки гибнут)
эффекты.Фотодинамический эффект – сенсибилизация организма к действию видимого света в присутствии красителя и кислорода. Данный эффект был открыт Оскаром Раабом, студентом профессора Херманна фон Таппайнера в Мюнхенском Фармакологическом и нституте в 1888 г. Суть открытия Рааба состояла в том, что, когда интенсивность света в поле микроскопа была достаточно большой, окрашенные акридином или другими флуоресцирующими красителями клетки парамеции прекращают движение и погибают, причем спектр действия этого эффекта соответствует спектрам поглощения красителей.
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 110Фотодеструктивные процессы
1.Действие УФ-излучения на белковые системы
1.1. Фотоионизация ароматических аминокислот с
образованием катион-радикала и сольватированного электрона. При распаде катион-радикала возникает нейтральный
радикал.АН + hν = АН* = AH+• + esolv
AH+• = A• + H+
1.2. Фотолиз цистина с разрывом S-S связей и возникновение радикала цистеина – тиильного радикала (CS•)
2.Действие УФ-излучения на нуклеиновые кислоты
2.1. Образование фотодимеров тимина, урацила, цитозина и смешанных димеров.
2. 2. Реакция гидратации урацила и цитозина.
2.3. Разрывы полинуклеотидной цепи ДНК.
2.4. Образование внутримолекулярных ковалентных сшивок между двумя комплементарными цепями ДНК в растворе.
2.5. Фотоденатурация ДНК.
2.6. Индукция сшивок нуклеиновая кислота-белок в составе РНП и ДНП.
ФГОУ ВПО ЮФУ каф. биохимии и микробиологии
Слайд 1113.Действие УФ-излучения на липиды и биологические мембраны.
3.1. Перекисное фотоокисление
липидов.
3.2. Повышение проницаемости биомембран для различных веществ, и прежде всего
для ионов. ФГОУ ВПО ЮФУ каф. биохимии и микробиологии