Слайд 1Дополнительные главы ОРГАНИЧЕСКОЙ ХИМИИ
Алов Евгений Михайлович
д.х.н., профессор
Слайд 2Рекомендуемая литература
1. Травень, В.Ф. Органическая химия: Учебник для вузов в
2-х томах. – М.: Академкнига, 2004. - Т. 1. –
727 с., Т.2. – 582 с.
2. Шабаров, Ю.С. Органическая химия: Учебник для вузов в 2-х кн. – М.: Химия, 1996. – Т. 1. – 496 с., Т.2. – 352 с.
3. Нейланд, О.Я. Органическая химия: Учеб. для хим. спец. вузов. – М.: Высш. шк., 1990. – 751 с.
Слайд 3Перечень пособий, методических указаний к проведению учебных занятий и самостоятельной
работы студентов
Углеводороды. Галогенпроизводные углеводородов. Учебное пособие/ И.С. Колпащикова, Е.Р. Кофанов,
Е.М. Алов. Яросл. гос. тех. ун-т. - Ярославль, 2007. - 247 с.
Полифункциональные органические соединения. Учебное пособие/ И.С. Колпащикова, А.Ф. Бетнев, Е.М. Алов. Яросл. гос. тех. ун-т. - Ярославль, 2006. - 136 с.
Методические указания к лабораторному практикуму по органической химии для студентов химико-технологического факультета. Ч. I . Учебное пособие/ Басаев Р.М., Колпащикова И.С., Кофанов Е.Р., Обухова Т.А.. - Яросл. политехн. ин-т, Ярославль.: 1999. - 32 с.
Методические указания к лабораторному практикуму по органической химии Ч.2. Учебное пособие/ Басаев Р.М., Колпащикова И.С., Кофанов Е.Р., Обухова Т.А. - Яросл. гос. тех. ун-т. - Ярославль, 1997. - 23 с.
Номенклатура органических соединений : учеб. пособие/ М.С. Белышева, И. С. Колпащикова, В. В. Плахтинский ; Яросл. гос. техн. ун-т. - Ярославль, 2009. - 76 с.
Сборник задач по органической химии : учеб. пособие / И. С. Колпащикова, А. Ф. Бетнев, Е. М. Алов ; Яросл. гос. техн. ун-т. - Ярославль, 2010. - 206 с.

Слайд 4Дополнительная литература
Органикум (практикум по органической химии) т.1 и т.2
"Мир",1980 г.
А.А.Терней, Современная органическая химия, т. 1,2, «Мир», Москва,
1981 г.
Р.Моррисон, Р.Бойд, Органическая химия, «Мир», Москва, 1974 г.
Дж.Робертс, М.Кассерио, Основы органической химии, «Мир», Москва, 1978 г.
5. Справочно-информационная система «Химический ускоритель», http://www.reakor.ru/leos/index.php
6. On-Line Learning Center for "Organic Chemistry" (Francis A. Carey), http://www.mhhe.com/physsci/chemistry/carey5e/
7. Химический навигатор-поиск по химии, http://chemnavigator.hotbox.ru
Слайд 5СТРУКТУРА КУРСА
2 семестр
Лекции
26 ч
Лабораторные занятия 58 ч
Самостоятельная работа 96
Расчетно-графическое задание 1
Диф. зачет +
Слайд 6Галогенпроизводные углеводородов
Слайд 7Галогенпроизводные углеводородов
Галогенопроизводными называются производные углеводородов, в которых один или несколько
атомов водорода заменены атомами галогена.
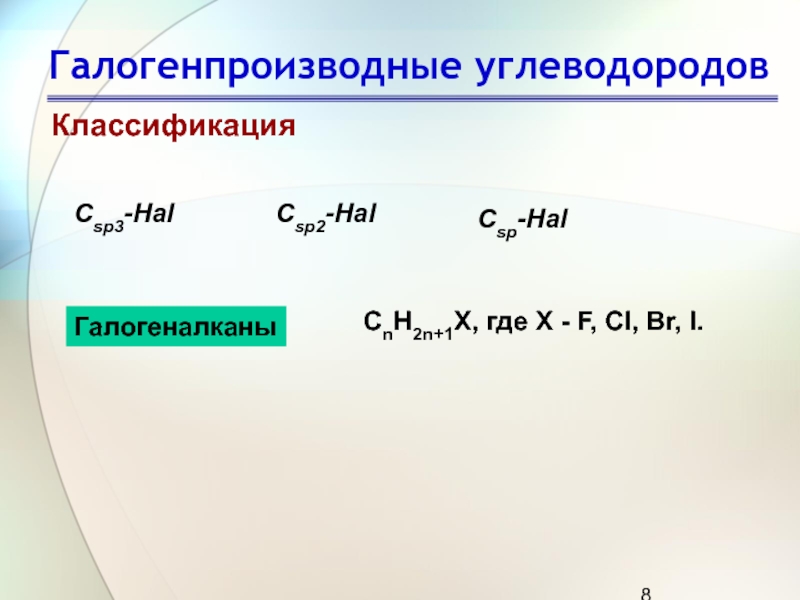
Слайд 8Галогенпроизводные углеводородов
Классификация
Сsp3-Hal
Сsp2-Hal
Сsp-Hal
СnH2n+1Х, где X - F, Cl, Br, I.
Галогеналканы
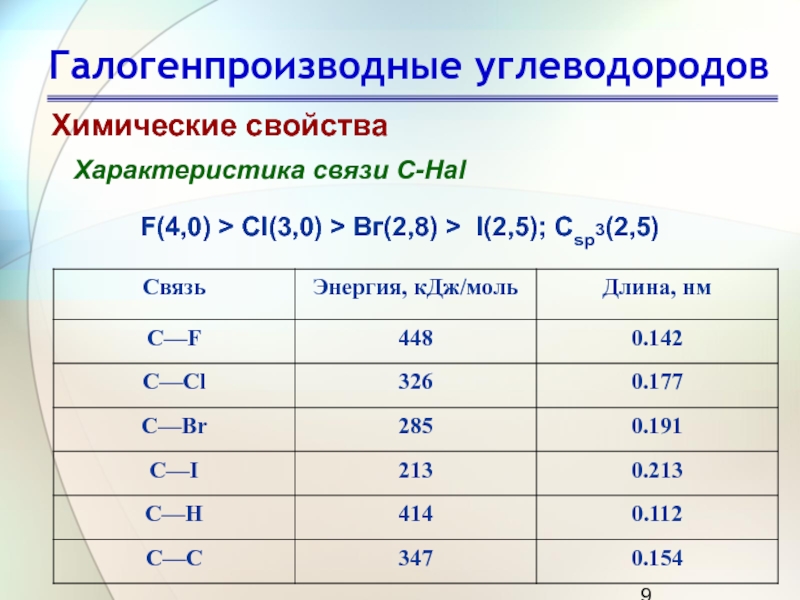
Слайд 9Галогенпроизводные углеводородов
Химические свойства
Характеристика связи C-Hal
F(4,0) > Сl(3,0) > Вг(2,8) >
I(2,5); Сsp3(2,5)
Слайд 10Галогенпроизводные углеводородов
Химические свойства
Характеристика связи C-Hal
Слайд 11Галогенпроизводные углеводородов
Химические свойства
Характеристика связи C-Hal
Вследствие высокой электроотрицательности галогена связь
галоген - углерод является сильно полярной Сδ+→Хδ−. Галоген, связанный с
электронодефицитным углеродом, можно легко заменить на частицу, богатую электронами, - нуклеофил Nu («ядро любящий»).
Нуклеофил - частица, имеющая пару электронов, которую она может отдать атому, несущему целый или частичный положительный заряд.
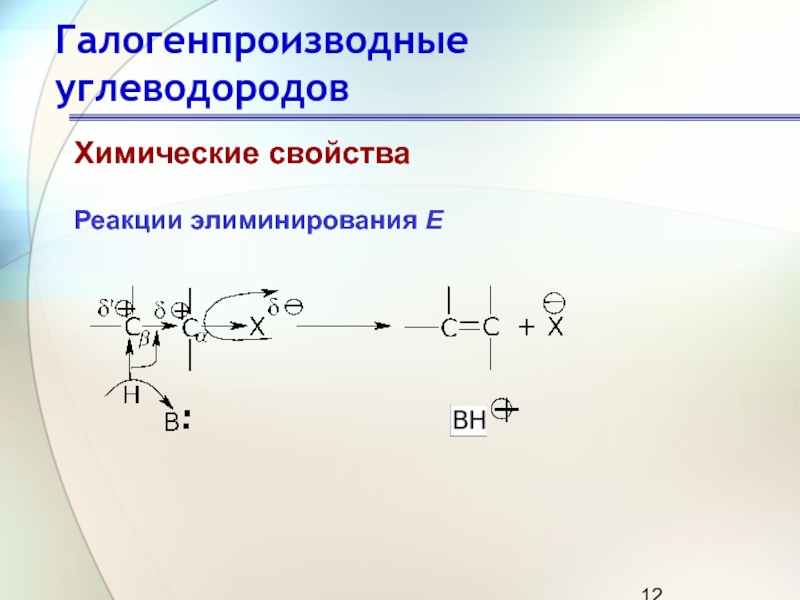
Слайд 12Галогенпроизводные углеводородов
Химические свойства
Реакции элиминирования Е
Слайд 13Галогенпроизводные углеводородов
Химические свойства
Реакции нуклеофильного замещения - SN
Слайд 14Галогенпроизводные углеводородов
Химические свойства
Реакции нуклеофильного замещения
Реакции, в результате которых в молекуле
исходного соединения происходит замещение атома или группы атомов на другой
нуклеофил, называют реакциями нуклеофильного замещения. Эти реакции обозначают SN. (от англ. substitution nucleophilic).
Слайд 15Галогенпроизводные улеводородов
Реакции нуклеофильного замещения
Слайд 16Галогенпроизводные улеводородов
Реакции нуклеофильного замещения
Слайд 17
Бимолекулярное нуклеофильное замещение (SN2)
Галогенпроизводные углеводородов
Скорость реакции.
v = k
[R-Hal]·[Nu]
Концентрация нуклеофильного реагента.
Растворитель.
а) достаточно хорошая растворимость реагентов,
б) лучшая сольватация переходного состояния по сравнению с
исходными соединениями,
в) предотвращение побочных реакций.
Термин «бимолекулярное замещение» означает, что в стадии,
определяющей скорость реакции, участвуют две частицы.
Слайд 18Галогенпроизводные углеводородов
Реакции нуклеофильного замещения SN2
Слайд 19Галогенпроизводные углеводородов
Реакции нуклеофильного замещения SN2
При столкновении реагирующих частиц начинает образовываться
связь углерод-кислород, а связь углерод-бром растягивается, атом углерода переходит в
sp2-состояние. В этом состоянии атом углерода связан сразу с пятью атомами. Три атома водорода и углерод лежат в одной плоскости, а группы НО- и Br- располагаются на прямой, перпендикулярной этой плоскости. Реакция заканчивается отщеплением иона брома и образованием ковалентной связи углерод-кислород, атом углерода опять становится тетраэдрическим
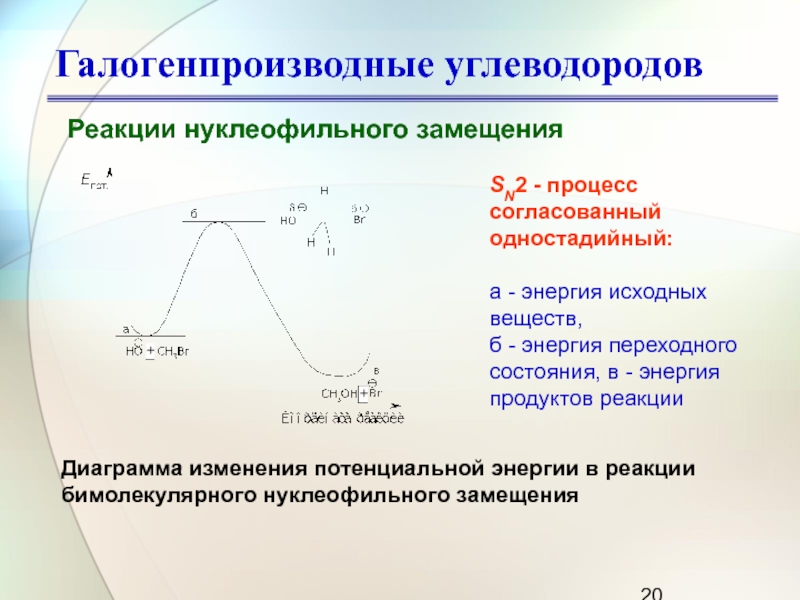
Слайд 20Галогенпроизводные углеводородов
Реакции нуклеофильного замещения
Диаграмма изменения потенциальной энергии в реакции
бимолекулярного
нуклеофильного замещения
SN2 - процесс согласованный одностадийный:
а - энергия исходных
веществ,
б - энергия переходного состояния, в - энергия продуктов реакции
Слайд 21Галогенпроизводные углеводородов
Химические свойства
Реакции нуклеофильного замещения
Скорость реакции нуклеофильного замещения зависит от
следующих факторов:
- нуклеофильной реакционной способности реагента;
- основности нуклеофильного реагента;
- концентрации
реагента;
- величины положительного заряда на атакуемом атоме углерода в субстрате;
- энергии связи и характера уходящей группы;
-строения радикалов, связанных с атакуемым атомом углерода;
- природы растворителя.
Слайд 22Выбор растворителя диктуется следующими условиями:
а) достаточно хорошая растворимость реагентов,
б) лучшая сольватация переходного состояния по сравнению с исходными соединениями,
в) предотвращение побочных реакций.
Сольватация это взаимодействие молекул растворенного вещества (или их ассоциатов) с молекулами растворителя. Это влияет на все физические и физико-химические процессы, протекающие в растворах, в т.ч. определяет скорость реакций в растворах и их механизм. Сольватация в водных средах часто называют гидратацией.
1. Растворитель
Слайд 23Сольватация состоит в том, что молекула растворенного вещества оказывается окруженной
сольватной оболочкой, состоящей из более или менее тесно связанных с
ней молекул растворителя. В результате сольватации образуются сольваты – молекулярные образования постоянного или переменного состава. Выделяют неспецифическую и специфическую сольватацию. Неспецифическая сольватация обусловлена ван-дер-ваальсовыми взаимодействиями, специфическая сольватация проявляется вследствие электростатического взаимодействия, координационных и водородных связей.
1. Растворитель
Слайд 24Галогенпроизводные углеводородов
Нуклеофил - анион
Влияние полярности растворителя на скорость SN2:
повышение полярности
растворителя стабилизирует исходную систему в большей степени, чем АК, энергия
активации увеличивается, скорость реакции уменьшается.
1. Растворитель
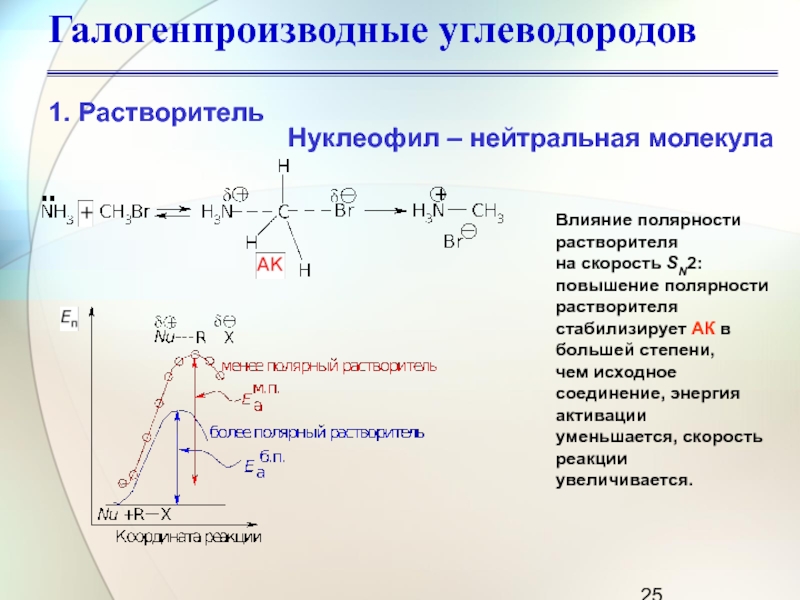
Слайд 25Галогенпроизводные углеводородов
Нуклеофил – нейтральная молекула
Влияние полярности растворителя
на скорость SN2:
повышение
полярности растворителя стабилизирует АК в большей степени,
чем исходное соединение,
энергия
активации уменьшается, скорость
реакции увеличивается.
1. Растворитель
Слайд 26Апротонные биполярные растворители: растворители с высокой
диэлектрической проницаемостью, но не
способные к образованию
водородных связей
Галогенпроизводные углеводородов
1. Растворитель
Слайд 27Водородная связь обусловленная электростатическим
притяжением и ковалентным взаимодействием между
протонированным
водородом одной молекулы
и электроотрицательным атомом второй молекулы.
Водородные связи имеют
энергию 20-40 кДж/моль.
Галогенпроизводные углеводородов
1. Растворитель
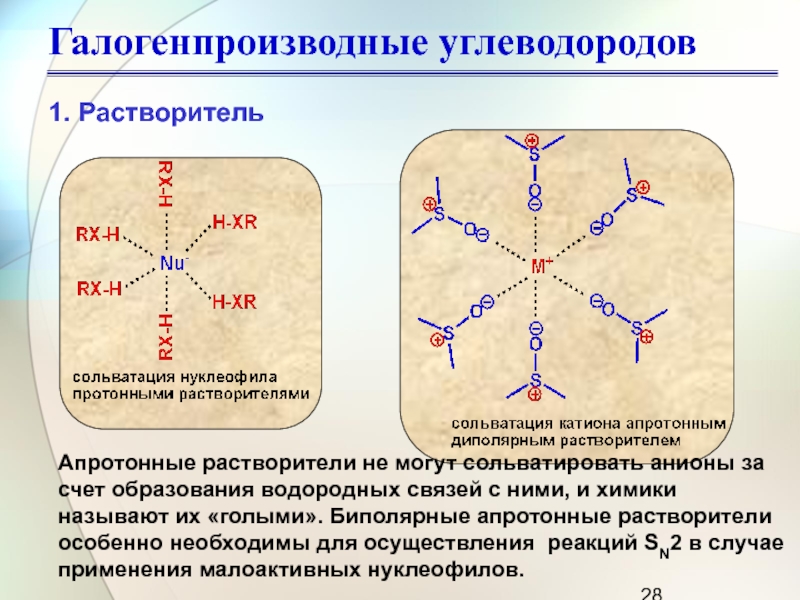
Слайд 28Апротонные растворители не могут сольватировать анионы за счет образования водородных
связей с ними, и химики называют их «голыми». Биполярные апротонные
растворители особенно необходимы для осуществления реакций SN2 в случае применения малоактивных нуклеофилов.
Галогенпроизводные углеводородов
1. Растворитель
Слайд 29Галогенпроизводные углеводородов
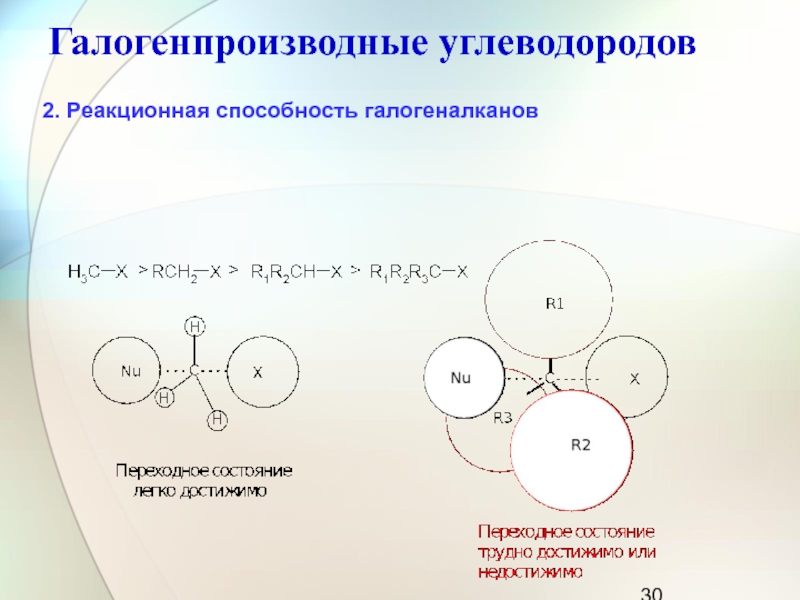
2. Реакционная способность галогеналканов
При рассмотрении реакционной способности галогеналканов
в реакциях нуклеофильного замещения следует изучать влияние двух факторов: пространственного
(стерического) и электронного. В случае бимолекулярного нуклеофильного замещения наиболее важную роль играет стерический фактор. По мере увеличения объема заместителей у атома углерода -реакционного центра возможность достижения активированного комплекса уменьшается
Слайд 30Галогенпроизводные углеводородов
2. Реакционная способность галогеналканов
Слайд 31
Сильные основания являются обычно «плохими» уходящими группами, слабые основания –
«хорошими» уходящими группами.
Наилучшими уходящими группами являются анионы - сопряженные основания
сильных кислот, так как они являются очень слабыми основаниями (отрицательный заряд распределен).
В этом ряду сила основания увеличивается, а способность быть хорошей уходящей группой уменьшается.
3. Уходящая группа
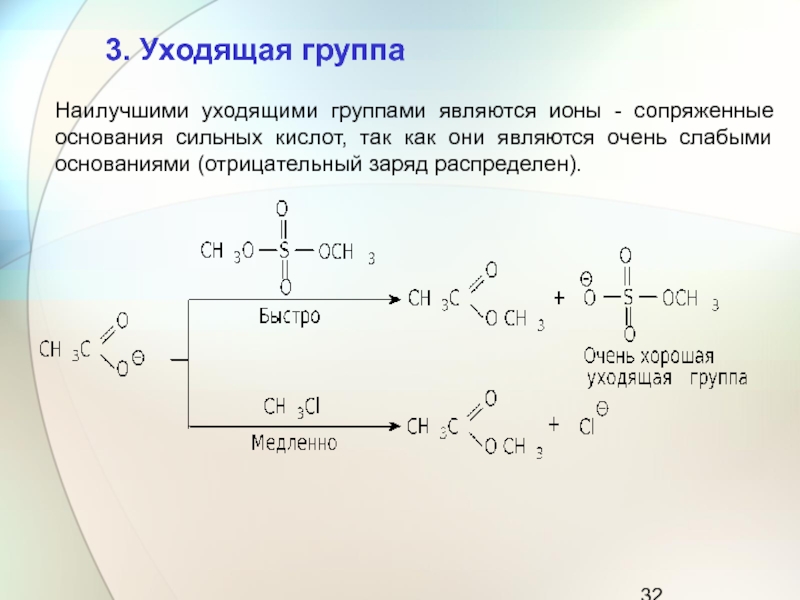
Слайд 32
Наилучшими уходящими группами являются ионы - сопряженные основания сильных кислот,
так как они являются очень слабыми основаниями (отрицательный заряд распределен).
3.
Уходящая группа
Слайд 33Галогенпроизводные углеводородов
Под нуклеофильной реакционной способностью (нуклеофильной силой) принято понимать способность
реагента (аниона или нейтральной молекулы) образовывать за счет неподеленной пары
p-электронов одного из входящих в него атомов ковалентную связь с имеющим дефицит электронной плотности атомом углерода в органической молекуле (субстрате).
4. Сила нуклеофила
Слайд 34
Под основностью понимают способность основания (нуклеофила) связываться с протоном, т.е.
сродство нуклеофила к протону. Под нуклеофильностью понимают способность реагента (аниона
или нейтральной молекулы) образовывать за счет неподеленной электронной пары ковалентную связь с имеющим дефицит электронной плотности атомом углерода в субстрате.
4. Сила нуклеофила
Слайд 35
Обычно, чем выше основность, тем выше нуклеофильность. Так, нуклеофильность уменьшается
с уменьшением основности в рядах
4. Сила нуклеофила
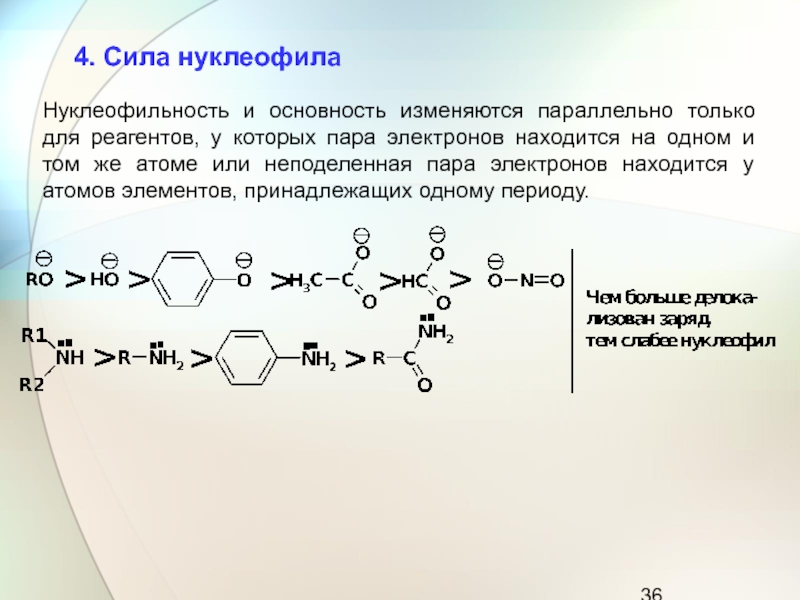
Слайд 36
Нуклеофильность и основность изменяются параллельно только для реагентов, у которых
пара электронов находится на одном и том же атоме или
неподеленная пара электронов находится у атомов элементов, принадлежащих одному периоду.
4. Сила нуклеофила
Слайд 37
Легкополяризуемые ионы, слабее удерживающие электроны на внешней электронной оболочке, обладают
высокой нуклеофильностью и в ионизирующих протонных и в апротонных диполрных
растворителях. Когда размер атома увеличивается, действие его ядра на периферические электроны уменьшается, в результате чего они становятся более легко поляризуемыми и более склонными к образованию связей. Нуклеофильность же слабополяризуемых, но более основных (прочнее удерживающих протон ионов (например, F-, CH3COO-) очень сильно возрастает при переходе от ионизирующих протонных растворителей к апротонным растворителям.
Чем меньше размер иона, тем выше электронная плотность и тем больше его нуклеофильная сила
4. Сила нуклеофила
Слайд 38
Однако в протонных растворителях этот ряд инвертируется: нуклеофильность аниона тем
выше, чем больше размер иона.
Такой порядок изменения нуклеофильности в протонном
растворителе объясняется тем, что анионы разного размера в протонном растворителе в различной степени сольватированы за счет образования водородных связей: анион малого размера с концентрированным зарядом сольватируется сильнее и оказываются как бы блокированными, чем анион большего размера, в котором отрицательный заряд распределен в большей степени.
4. Сила нуклеофила
Слайд 39
Нуклеофильность некоторых реагентов
4. Сила нуклеофила
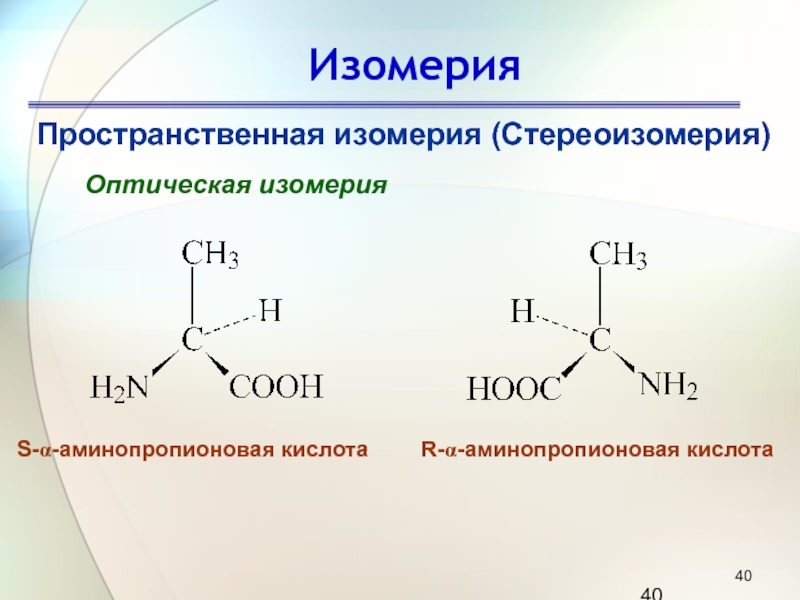
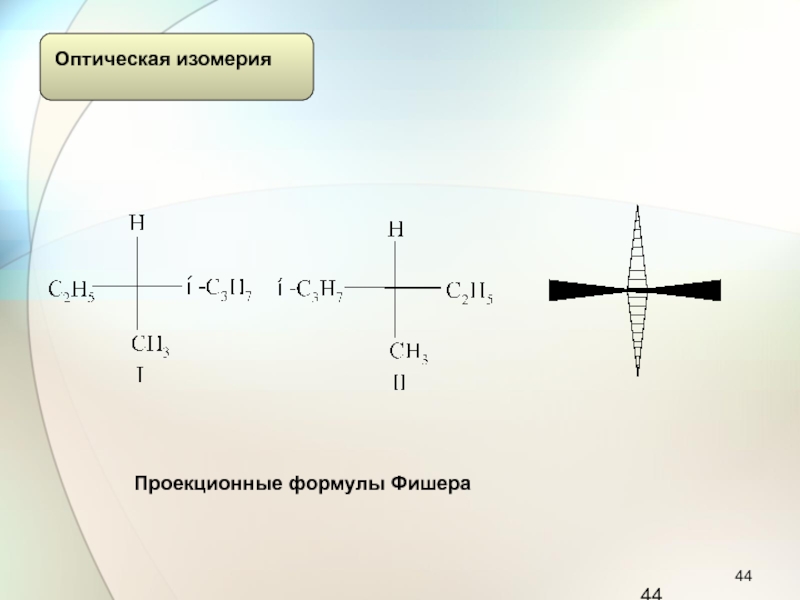
Слайд 40Изомерия
Пространственная изомерия (Стереоизомерия)
Оптическая изомерия
S-α-аминопропионовая кислота
R-α-аминопропионовая кислота
Слайд 41Изомерия
Пространственная изомерия (Стереоизомерия)
Оптическая изомерия
S-α-аминопропионовая кислота
R-α-аминопропионовая кислота
Изомерия — одно из наиболее
своеобразных проявлений специфики и особенности органической химии
Слайд 42Изомерия
Два соединения: предмет и его зеркальное изображение (I и II),
несовместимые друг с другом, называются энантиомерами (от греческого “энантио” -
противоположный).
.
Свойство соединения существовать в виде энантиомеров называется хиральностью (от греческого “хирос” - рука), а само соединение - хиральным
Молекула, в которой при атоме углерода находятся две или более одинаковых групп, имеет плоскость симметрии и, следовательно, не обладает хиральностью, поскольку молекула и ее зеркальное изображение идентичны. Такие молекулы называются ахиральными.
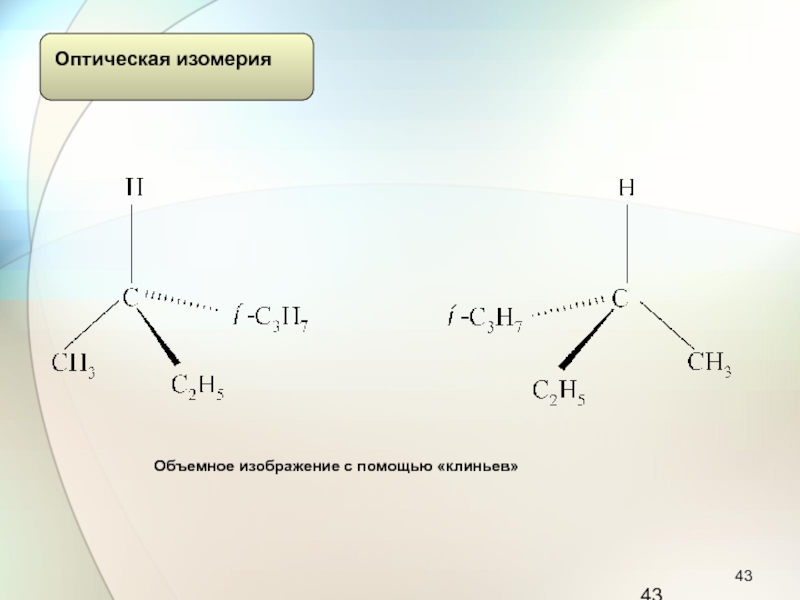
Слайд 43Объемное изображение с помощью «клиньев»
Слайд 45Отличить один энантиомер от другого можно по знаку вращения плоскополяризованного
света. Энантиомеры вращают плоскость поляризованного света на один и тот
же угол, но в разные стороны: один – по часовой стрелке, другой – на такой же угол, но против часовой стрелки.
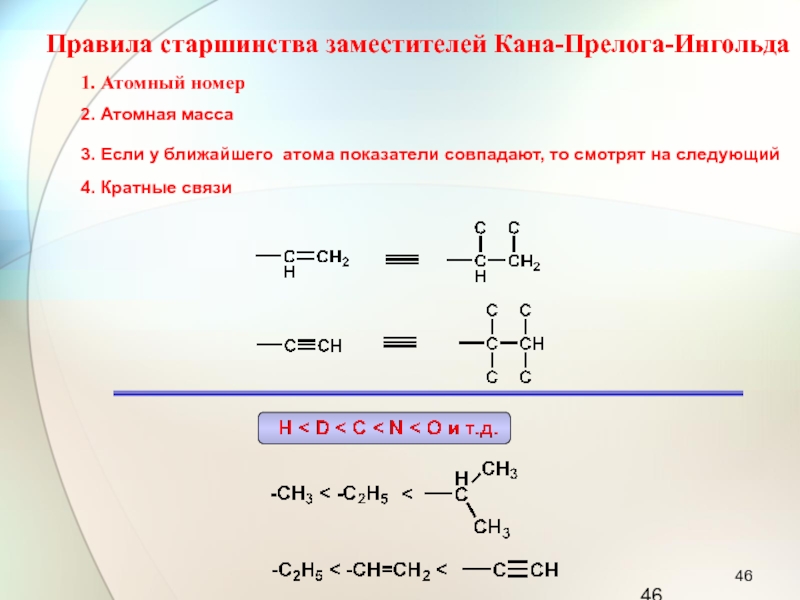
Слайд 462. Атомная масса
3. Если у ближайшего атома показатели совпадают, то
смотрят на следующий
4. Кратные связи
Правила старшинства заместителей Кана-Прелога-Ингольда
1. Атомный номер
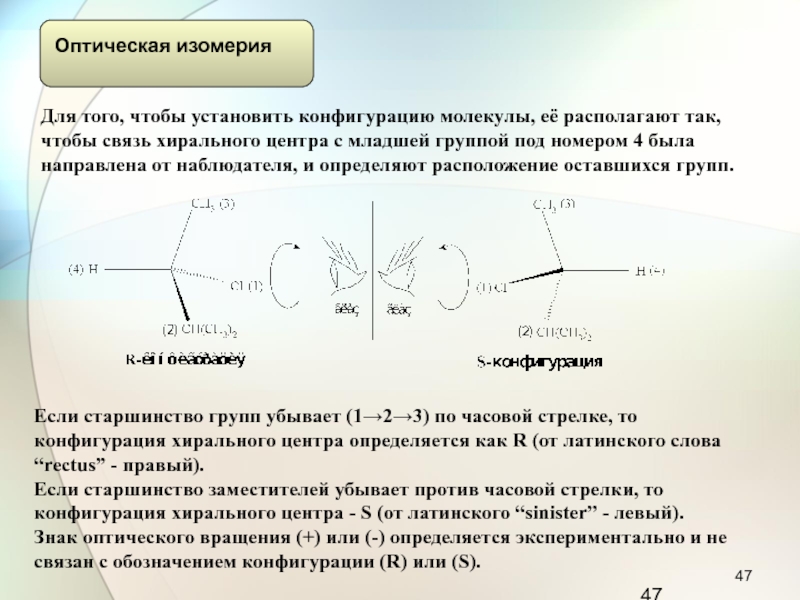
Слайд 47Для того, чтобы установить конфигурацию молекулы, её располагают так, чтобы
связь хирального центра с младшей группой под номером 4 была
направлена от наблюдателя, и определяют расположение оставшихся групп.
Если старшинство групп убывает (1→2→3) по часовой стрелке, то конфигурация хирального центра определяется как R (от латинского слова “rectus” - правый).
Если старшинство заместителей убывает против часовой стрелки, то конфигурация хирального центра - S (от латинского “sinister” - левый).
Знак оптического вращения (+) или (-) определяется экспериментально и не связан с обозначением конфигурации (R) или (S).
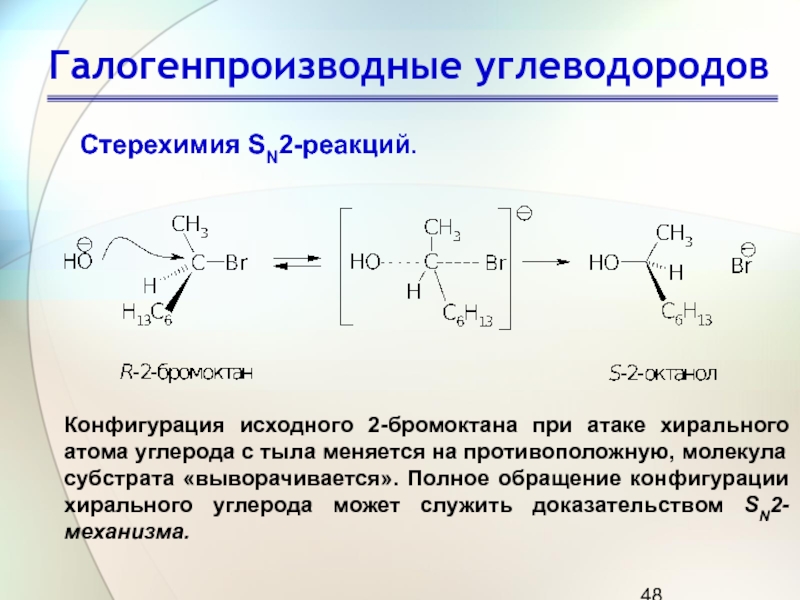
Слайд 48Галогенпроизводные углеводородов
Конфигурация исходного 2-бромоктана при атаке хирального атома углерода с
тыла меняется на противоположную, молекула субстрата «выворачивается». Полное обращение конфигурации
хирального углерода может служить доказательством SN2-механизма.
Стерехимия SN2-реакций.
Слайд 49Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Скорость реакции. В медленной стадии,
определяющей скорость реакции, принимает участие только одна молекула, поэтому механизм
называют мономолекулярным замещением. Скорость реакции зависит от концентрации галогеналкана и определяется по формуле r = k[R-Hal].
Слайд 50Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Cтадии процесса. Реакция протекает в
две стадии. Первая стадия - гетеролитический разрыв связи углерод-галоген -
медленная
Слайд 51Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Вторая стадия - образовавшийся карбокатион
практически мгновенно взаимодействует с нуклеофилом - молекулой воды.
В отличие
от механизма SN2 разрыв связи С-Х и образование новой связи С-Nu протекает не одновременно, а последовательно.
Слайд 52Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Энергетическая диаграмма реакции изображает изменение
потенциальной энергии в ходе двух стадийного мономолекулярного замещения.
Слайд 53Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Перегруппировка. В медленной стадии реакции
образуется карбокатион - частица, способная к перегруппировке.
Слайд 54Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Растворитель. Переходное состояние SN1-реакции более
полярно, чем исходное состояние. Увеличение полярности растворителя способствует большей сольватации
переходного состояния по сравнению с сольватацией исходного соединения. Энергия активации уменьшается, скорость реакции увеличивается.
Слайд 55Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Растворитель.
При проведении SN1-реакции используют
протонные растворители с высокой диэлектрической проницаемостью, способные образовывать водородные связи.
Слайд 56Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Растворитель.
В растворителе, имеющем высокую
диэлектрическую проницаемость, легче протекает ионизация галогеналкана, но, в отличие от
апротонных растворителей, в протонном - сольватируется не только карбокатион, но и ион галогена, образуя с ним водородные связи.
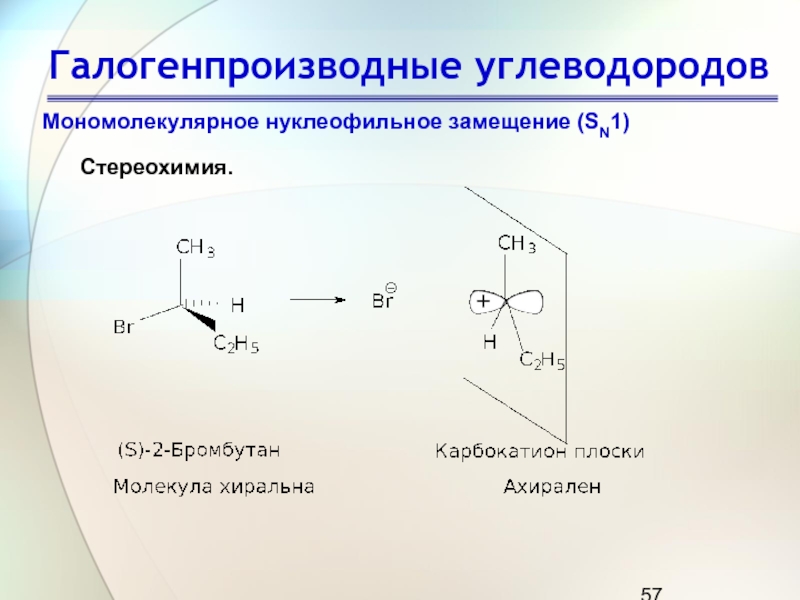
Слайд 57Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Стереохимия.
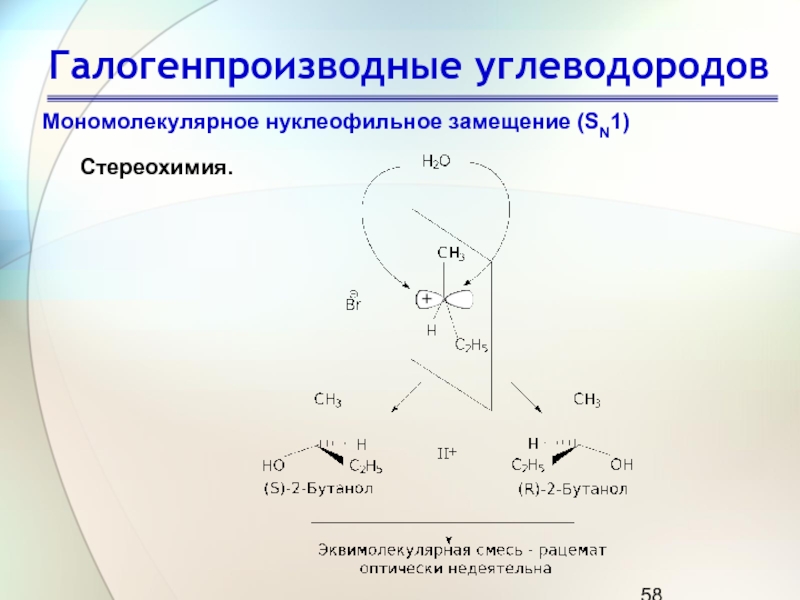
Слайд 58Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Стереохимия.
Слайд 59Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Формирование карбокатиона в реакции SN1
происходит через образование нескольких форм ионных пар различного строения.
Тесная ионная
пара – ионы расположены рядом и находятся в клетке растворителя. СРИП – ионы, разделенные хотя бы одной молекулой растворителя.
Слайд 60Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Нуклеофил может взаимодействовать с любой
из приведенных частиц. При взаимодейсивии Nu с RX реакция протекает
в соответствии с механизмом SN2. Механизм SN1 реализуется, когда субстрат диссоциирует и Nu атакует карбокатион (СИ). Это два предельных случая нуклеофильного замещения: обращение конфигурации (инверсия) или рацемизация. Взаимодействия ТИП + Nu и
СРИП + Nu приводят к частичной рацемизации (или частичному обращению конфигурации, что то же самое).
Слайд 61Галогенпроизводные углеводородов
Мономолекулярное нуклеофильное замещение (SN1)
Реакционная способность. Главным фактором, определяющим
реакционную способность в SN1-реакции, является электронный фактор - устойчивость образующегося
в медленной стадии реакции карбокатиона. Чем устойчивее карбокатион, тем легче он образуется, тем быстрее протекает замещение.
Слайд 62Галогенпроизводные углеводородов
Реакции нуклеофильного замещения
Слайд 63Галогенпроизводные углеводородов
Реакции нуклеофильного замещения
Влияние условий реакции на соотношение двух механизмов.
Слайд 64Галогенпроизводные углеводородов
Химические свойства
Реакции элиминирования
Под влиянием электроотрицательного галогена связанный с ним
атом углерода (Сα) приобретает некоторый положительный заряд, на соседнем атоме
(Сβ) также возникает заряд, но меньший. Тем не менее под влиянием частично заряженного β-углерода находящийся около него водород становится кислым и под действием сильного основания может отщепиться в виде протона (δ⊕>δ′⊕).
Слайд 65Галогенпроизводные углеводородов
Реакции элиминирования
В ходе реакции элиминирования от молекулы галогеналкана отщепляются
два фрагмента: ион галогена( уходящая группа) от Сα и протон
- от соседнего атома углерода Сβ. Такой тип реакций называется β-элиминированием.
Слайд 66Галогенпроизводные углеводородов
Бимолекулярное отщепление Е2
Основание С2Н5О атакует атом водорода при
Сβ, подает ему пару электронов и начинает образовывать с ним
связь, связь Сβ-Н ослабевает, пара электронов, связывавшая углерод и водород, освобождается и атакует атом галогена с тыла., одновременно растягивается связь Сα -Х (процесс согласованный). Возникает активированный комплекс: атомы углерода Сα и Сβ переходят из sp3-гибридного состояния в состояние, близкое к sp2-состоянию, освобождающаяся пара электронов затрачивается на образование π-связи. Затем связи углерод- водород и углерод-галоген разрываются, атомы углерода переходят в sp2-состояние, образуется π-связь.
Слайд 67Галогенпроизводные углеводородов
Бимолекулярное отщепление Е2
Cкорость реакции зависит от концентрации галогеналкана и
основания и определяется по формуле r= k [R-X] [С2Н5O -].
Энергетическая
диаграмма реакции
Слайд 68Галогенпроизводные углеводородов
Бимолекулярное отщепление Е2
Для проведения реакции Е2 требуются сильные основания.
В ряду оснований их эффективность изменяется в соответствии с их
силой
ӨNH2 > ӨOC2H5 > ӨOH > ӨOCOCH3
Это следует учитывать, в случае сильно основных агентов преимущественно протекает реакция Е2, в случае слабоосновных - SN2. Отщепление преобладает над замещением при повышенных температурах.
Слайд 69Галогенпроизводные углеводородов
Бимолекулярное отщепление Е2
В галогеналкане R-X cкорость отщепления возрастает в
ряду:
I ˉ > Br ˉ > Cl ˉ
> F ˉ.
Реакционная способность галогеналканов в реакциях Е2
Такое увеличение реакционной способности галогеналканов при переходе от первичных к третичным обусловлено увеличением устойчивости образующихся алкенов.
Слайд 70Галогенпроизводные углеводородов
Стереохимия Е2.
Связи, разрывающиеся в активированном комплексе реакций Е2,
должны быть в транс положении по отношению друг к другу.
Это стереоэлектронное требование к процессам, протекающим по механизмам Е2, т.е. необходимость определенной пространственной ориентации электронных орбиталей заместителей, участвующих в отщеплении.
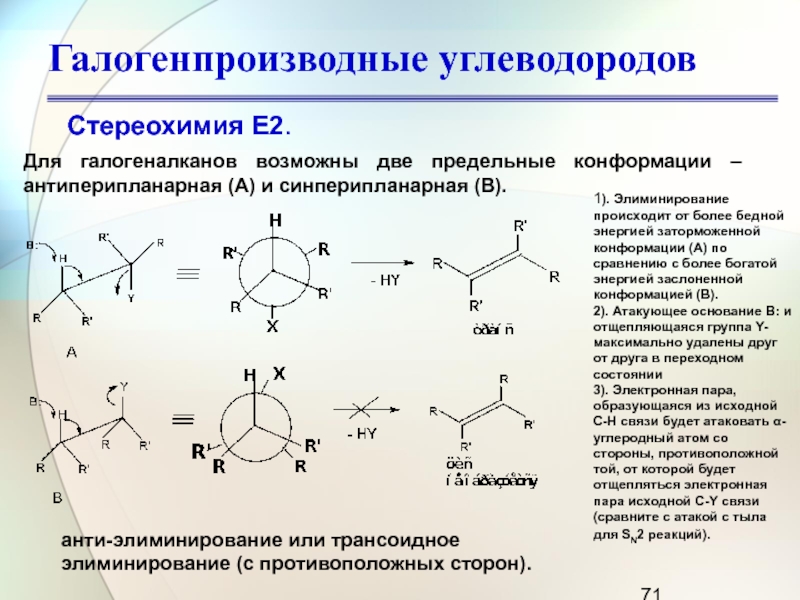
Слайд 71Галогенпроизводные углеводородов
Стереохимия Е2.
Для галогеналканов возможны две предельные конформации –
антиперипланарная (А) и синперипланарная (В).
1). Элиминирование происходит от более
бедной энергией заторможенной конформации (А) по сравнению с более богатой энергией заслоненной конформацией (В).
2). Атакующее основание В: и отщепляющаяся группа Y- максимально удалены друг от друга в переходном состоянии
3). Электронная пара, образующаяся из исходной С-Н связи будет атаковать α-углеродный атом со стороны, противоположной той, от которой будет отщепляться электронная пара исходной С-Y связи (сравните с атакой с тыла для SN2 реакций).
анти-элиминирование или трансоидное элиминирование (с противоположных сторон).
Слайд 72Галогенпроизводные углеводородов
Стереохимия Е2.
соотношение цис- и транс-изомеров 1:6
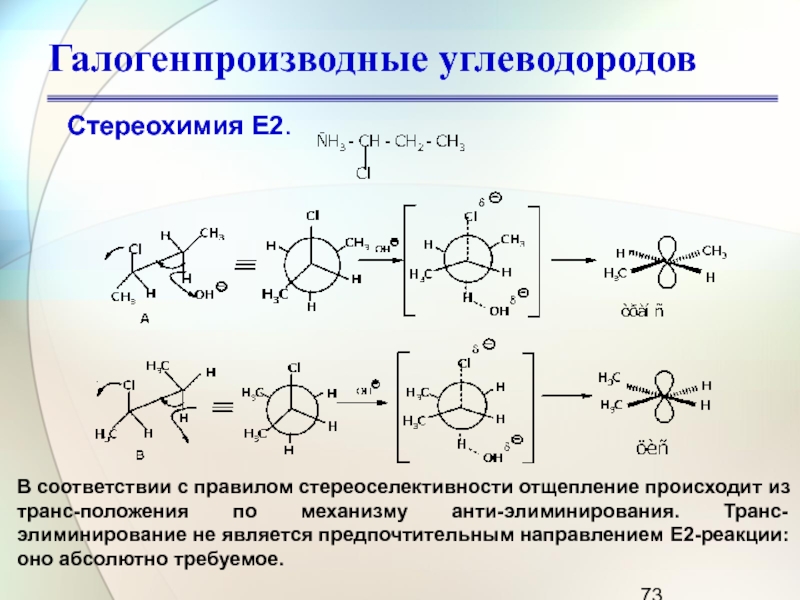
Слайд 73Галогенпроизводные углеводородов
Стереохимия Е2.
В соответствии с правилом стереоселективности отщепление происходит
из транс-положения по механизму анти-элиминирования. Транс-элиминирование не является предпочтительным направлением
Е2-реакции: оно абсолютно требуемое.
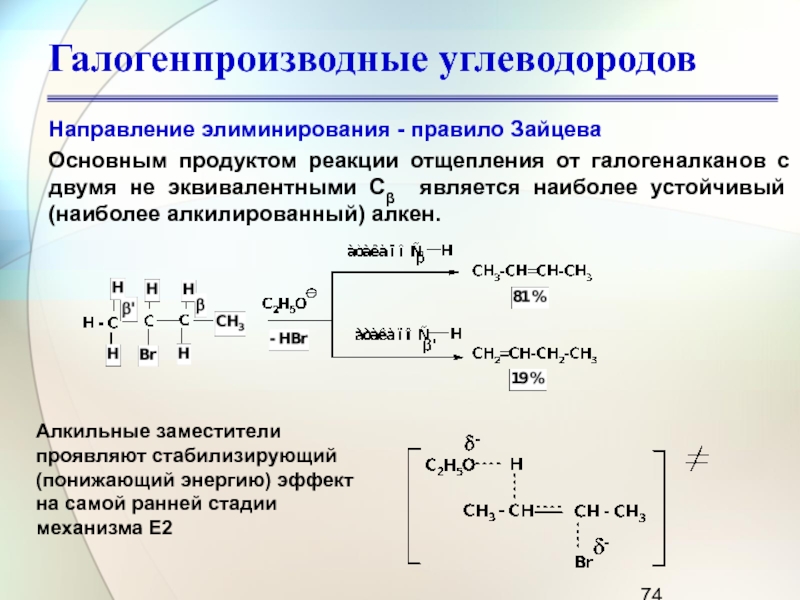
Слайд 74Галогенпроизводные углеводородов
Направление элиминирования - правило Зайцева
Основным продуктом реакции отщепления
от галогеналканов с двумя не эквивалентными Сβ является наиболее устойчивый
(наиболее алкилированный) алкен.
Алкильные заместители проявляют стабилизирующий (понижающий энергию) эффект на самой ранней стадии механизма Е2
Слайд 75Галогенпроизводные углеводородов
Александр Михайлович
Зайцев
1841 - 1910
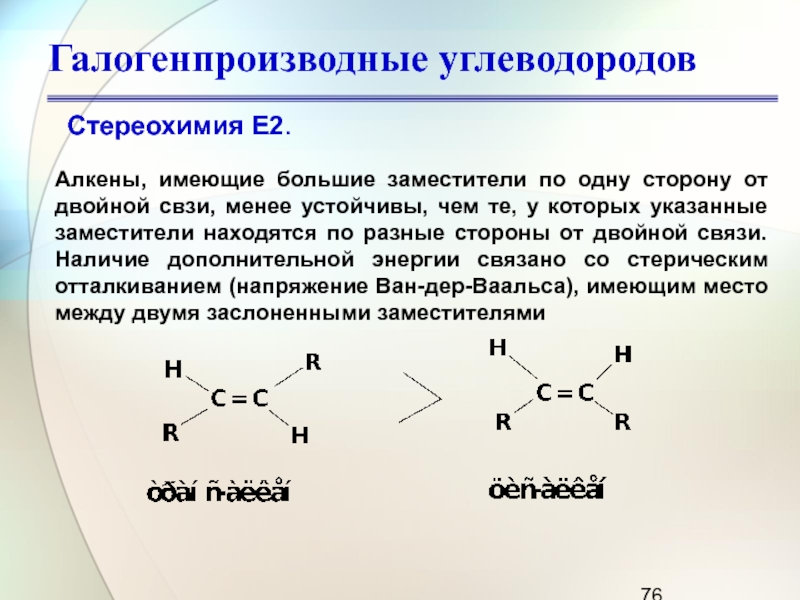
Слайд 76Галогенпроизводные углеводородов
Алкены, имеющие большие заместители по одну сторону от двойной
свзи, менее устойчивы, чем те, у которых указанные заместители находятся
по разные стороны от двойной связи. Наличие дополнительной энергии связано со стерическим отталкиванием (напряжение Ван-дер-Ваальса), имеющим место между двумя заслоненными заместителями
Стереохимия Е2.
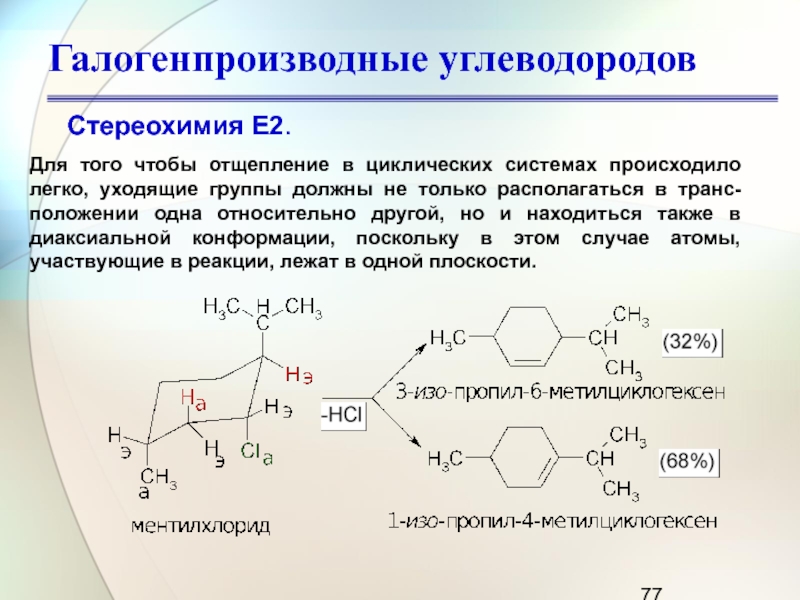
Слайд 77Галогенпроизводные углеводородов
Стереохимия Е2.
Для того чтобы отщепление в циклических системах
происходило легко, уходящие группы должны не только располагаться в транс-положении
одна относительно другой, но и находиться также в диаксиальной конформации, поскольку в этом случае атомы, участвующие в реакции, лежат в одной плоскости.
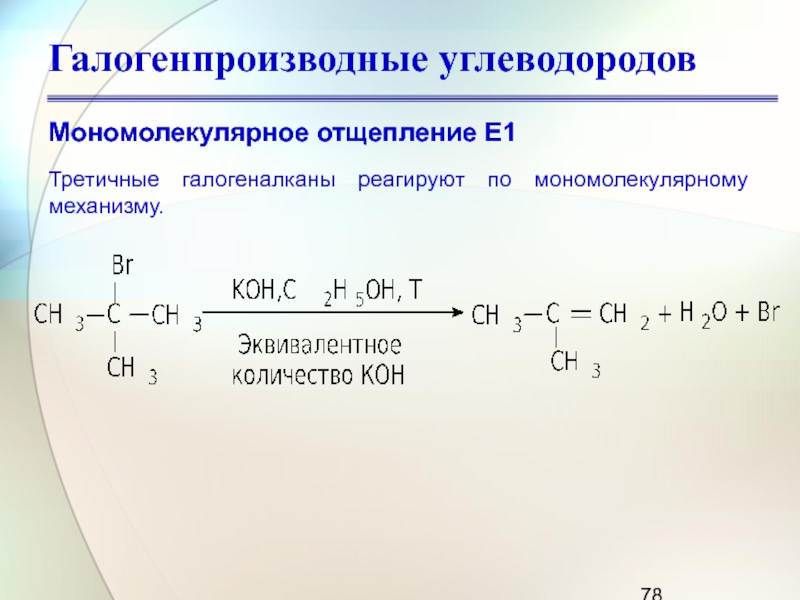
Слайд 78Галогенпроизводные углеводородов
Мономолекулярное отщепление Е1
Третичные галогеналканы реагируют по мономолекулярному механизму.
Слайд 79Галогенпроизводные углеводородов
Мономолекулярное отщепление Е1
Первая стадия аналогична первой стадии мономолекулярного нуклеофильного
замещения
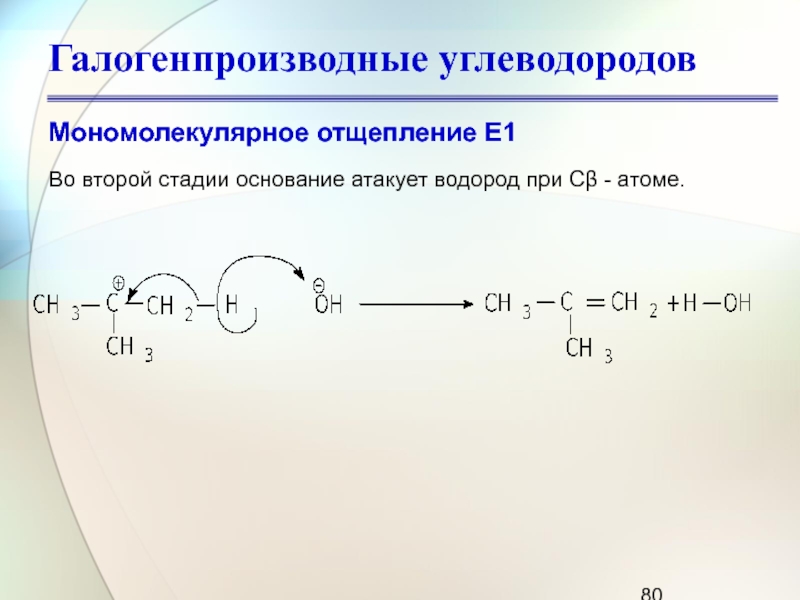
Слайд 80Галогенпроизводные углеводородов
Мономолекулярное отщепление Е1
Во второй стадии основание атакует водород при
Сβ - атоме.
Слайд 81Галогенпроизводные углеводородов
Мономолекулярное отщепление Е1
Реакционная способность
Слайд 82Галогенпроизводные углеводородов
Мономолекулярное отщепление Е1
Перегруппировки
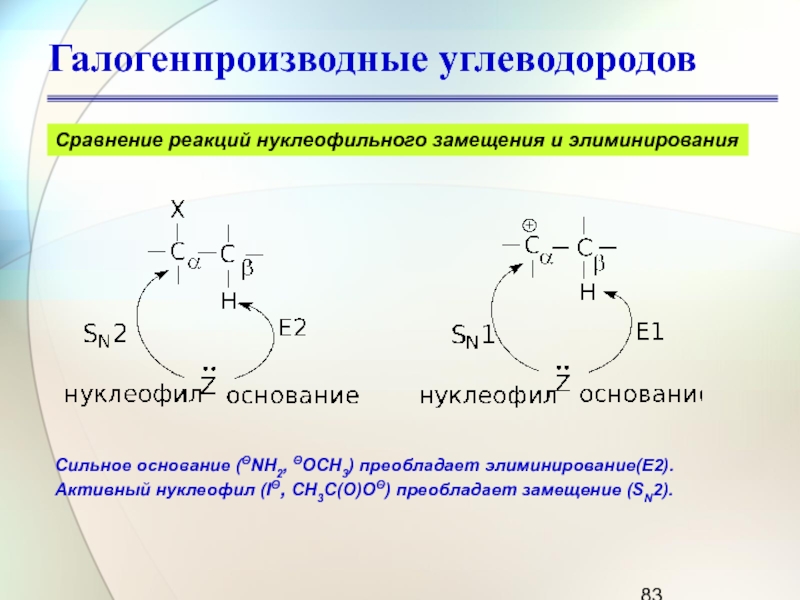
Слайд 83Галогенпроизводные углеводородов
Сравнение реакций нуклеофильного замещения и элиминирования
Сильное основание (ΘNH2, ΘOCH3)
преобладает элиминирование(Е2).
Активный нуклеофил (IΘ, CH3C(O)OΘ) преобладает замещение (SN2).
Слайд 84Галогенпроизводные углеводородов
Сравнение реакций нуклеофильного замещения и элиминирования
Реакции элиминирования и нуклеофильного
замещения в этом случае являются конкурирующими. При переходе от первичных
ко вторичным и далее третичным галогеналканам элиминирование происходит все в большей степени.
Cильные основания в большей степени способствуют элиминированию. Выход продуктов элиминирования увеличивается за счет продуктов замещения также с повышением температуры.
Слайд 85Галогенпроизводные углеводородов
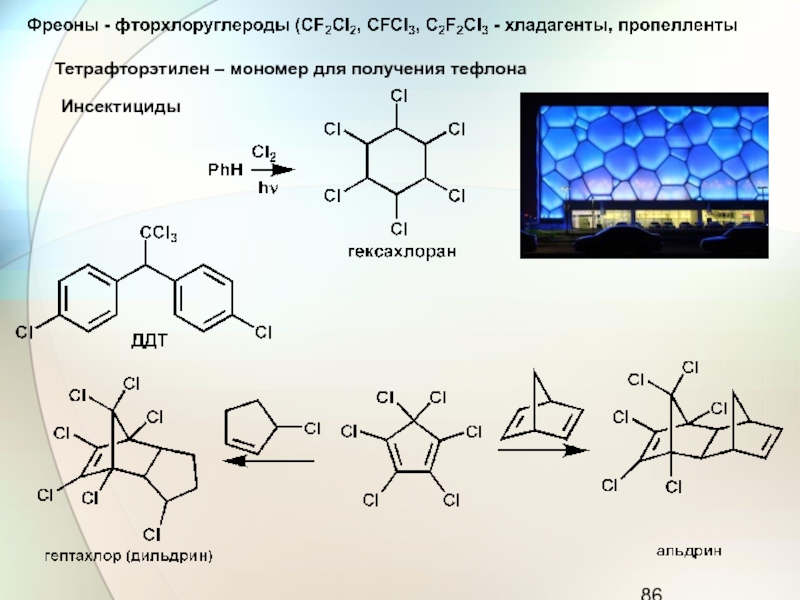
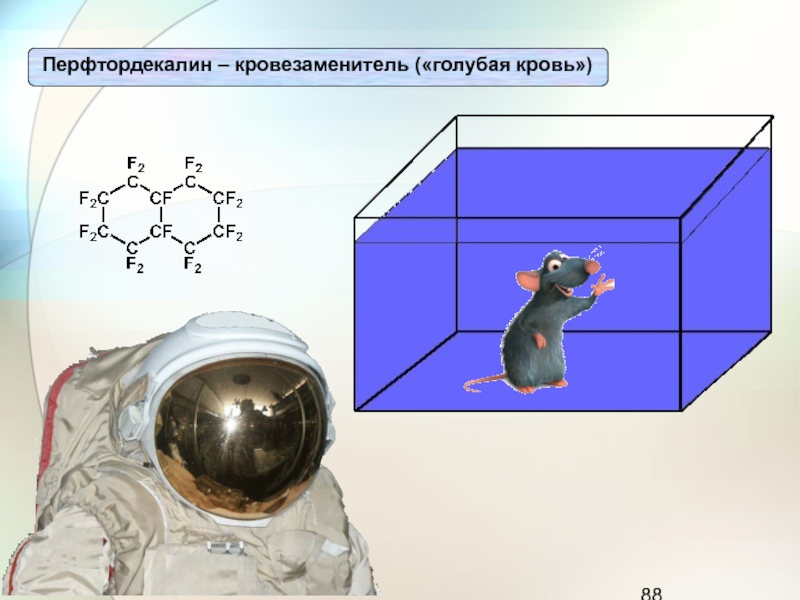
Слайд 86Тетрафторэтилен – мономер для получения тефлона
Инсектициды
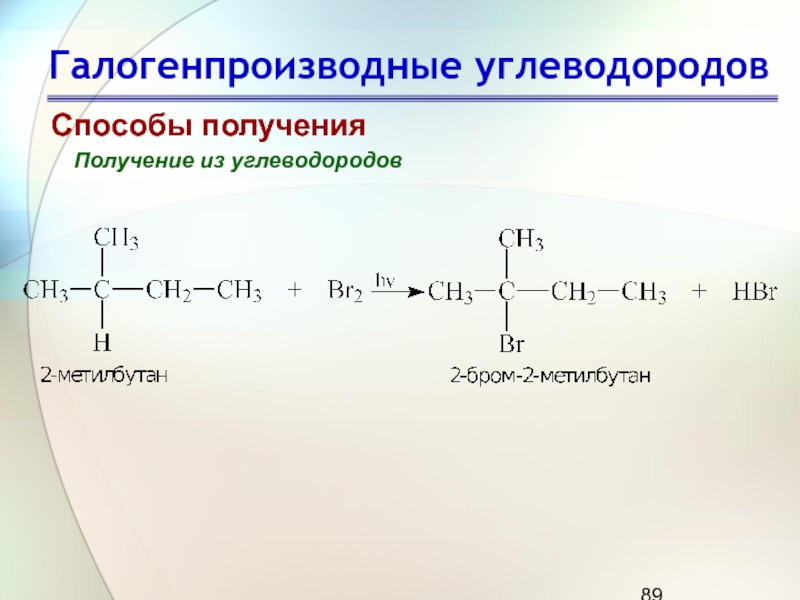
Слайд 89Галогенпроизводные углеводородов
Способы получения
Получение из углеводородов
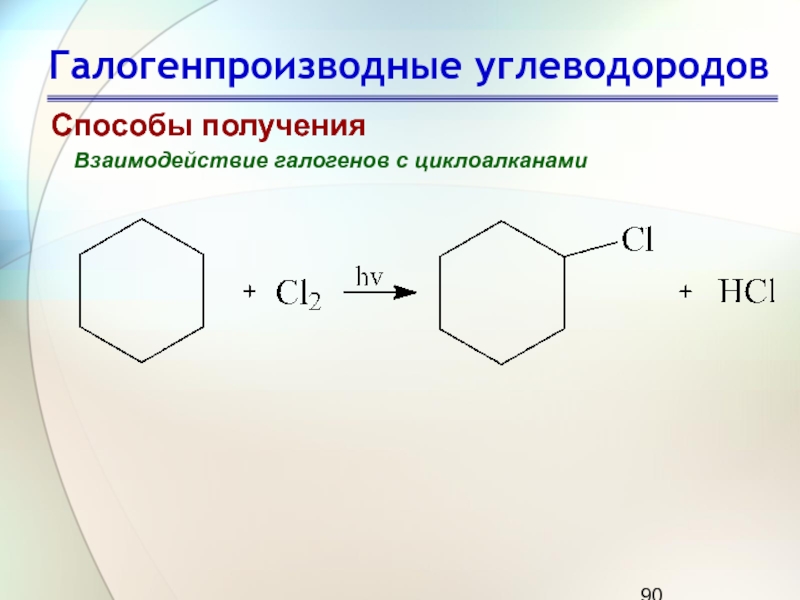
Слайд 90Галогенпроизводные углеводородов
Способы получения
Взаимодействие галогенов с циклоалканами
Слайд 91Галогенпроизводные углеводородов
Способы получения
Взаимодействие галогенов с алкенами и алкинами
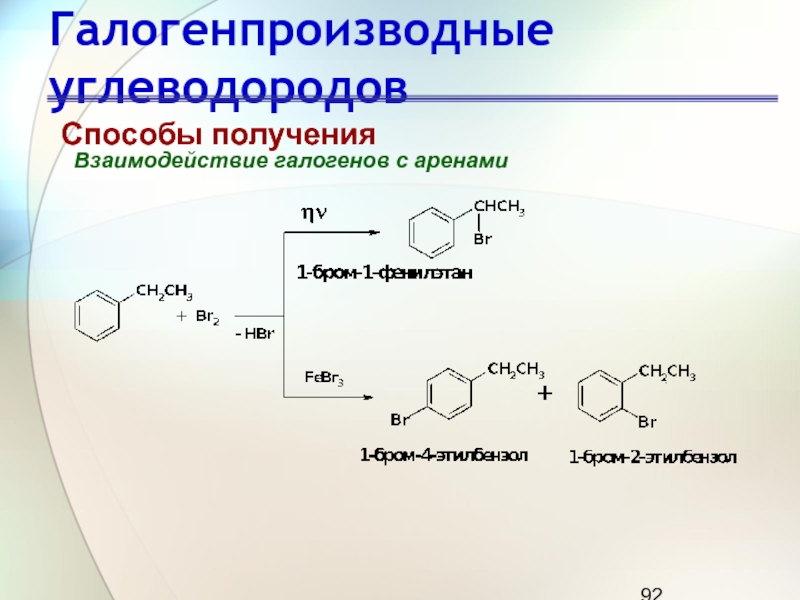
Слайд 92Галогенпроизводные углеводородов
Способы получения
Взаимодействие галогенов с аренами
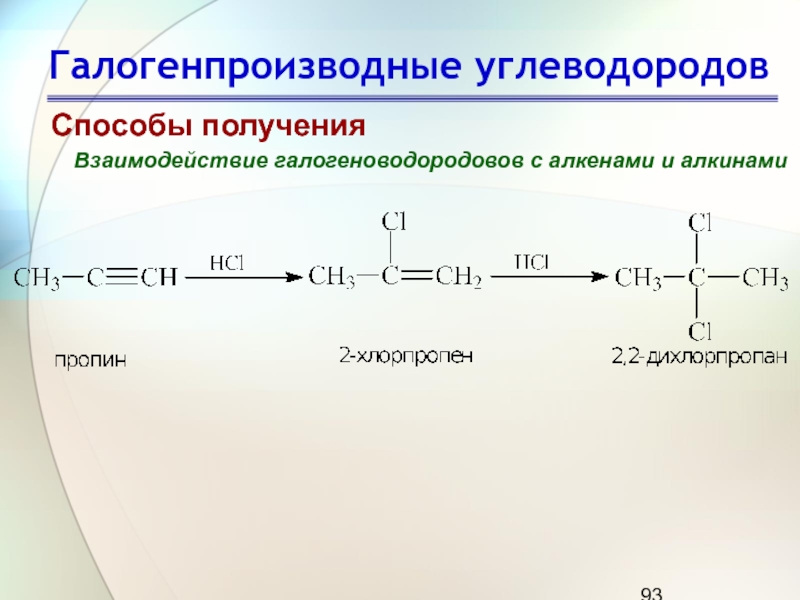
Слайд 93Галогенпроизводные углеводородов
Способы получения
Взаимодействие галогеноводородовов с алкенами и алкинами
Слайд 94Галогенпроизводные углеводородов
Способы получения
Взаимодействие спиртов с галогеноводородами
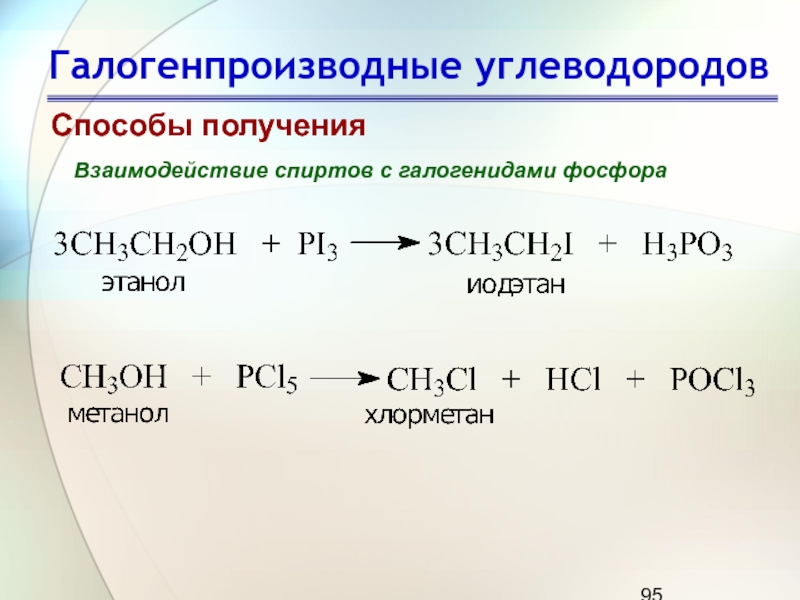
Слайд 95Галогенпроизводные углеводородов
Способы получения
Взаимодействие спиртов с галогенидами фосфора
Слайд 96Галогенпроизводные углеводородов
Способы получения
Взаимодействие спиртов с тионилхлоридом
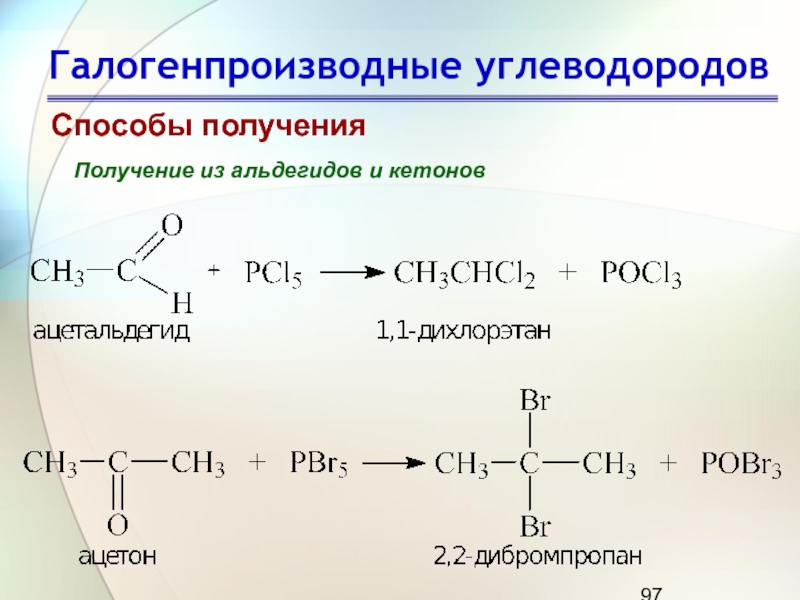
Слайд 97Галогенпроизводные углеводородов
Способы получения
Получение из альдегидов и кетонов













![Галогеналканы Бимолекулярное нуклеофильное замещение (SN2) Галогенпроизводные углеводородовСкорость реакции. v = k [R-Hal]·[Nu] Бимолекулярное нуклеофильное замещение (SN2) Галогенпроизводные углеводородовСкорость реакции. v = k [R-Hal]·[Nu] Концентрация нуклеофильного реагента. Растворитель. а) достаточно](/img/thumbs/12a06f3a2eae481fbbed9cf5936c662b-800x.jpg)