Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гомогенные системы или что мы должны знать о гомогенных растворах в курсе
Содержание
- 1. Гомогенные системы или что мы должны знать о гомогенных растворах в курсе
- 2. Ионная сила раствора – мера интенсивности электрического
- 3. Например, для раствора NaCl с концентрацией 0,001 моль/л,
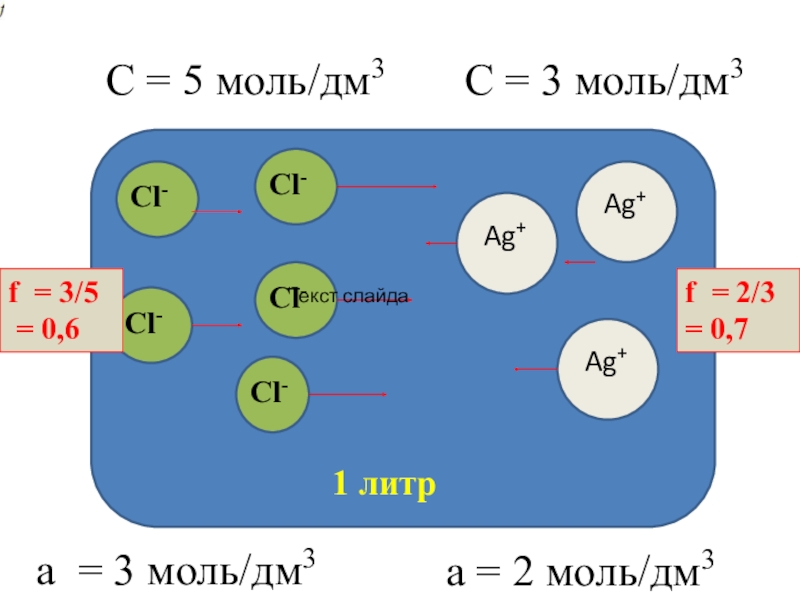
- 4. 1 литрСl-Сl-Сl-Сl-Сl-C = 5 моль/дм3Ag+Ag+Ag+С = 3
- 5. Слайд 5
- 6. Закон действующих масс и гомогенные системы
- 7. Закон действующих масс ‒ основной закон для
- 8. Пример: для реакции аА + вВ =
- 9. Можно рассмотреть практически любую реакцию, лежащую в
- 10. Закон действующих масс в 1864–1867 гг. установили норвежские
- 11. ЗДМ применим к процессам диссоциацииДиссоциировать могут как
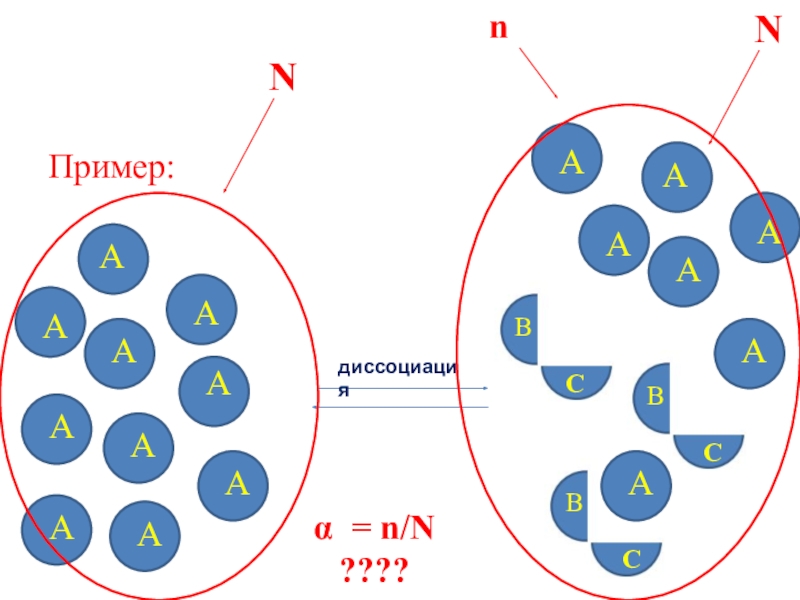
- 12. Пример:ААААААААААдиссоциацияВСВСВСАААААААNNnα = n/N ????
- 13. При исследовании большого числа электролитов было установлено, что ЗДМ применим только к слабым электролитам
- 14. Ионное произведение воды
- 15. Ионное произведение воды· (-1)
- 16. Например, для раствора НCl с концентрацией 0,001 моль/л,
- 17. Например, для раствора СН3СOOH с концентрацией 0,001 моль/л,
- 18. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВУЮЩИХ МАСС К КИСЛОТНО-ОСНОВНЫМ
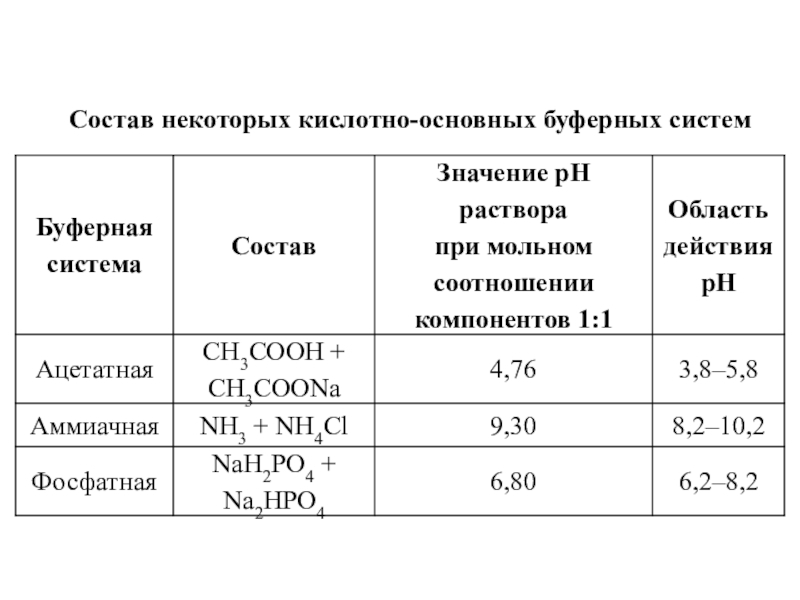
- 19. Состав некоторых кислотно-основных буферных систем
- 20. Механизм действия буферных системПример: при добавлении
- 21. Механизм действия буферных системЕсли добавить избыток
- 22. Вычисление рН буферных растворов Вычисление pH буферных растворов, образованных слабой кислотой и ее солью
- 23. Вычисление рН буферных растворов Вычисление pH буферных растворов, образованных слабым основанием и ее солью
- 24. Буферная емкость – предельное количество сильной кислоты
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Гомогенные системы или что мы должны знать о гомогенных растворах в курсе
аналитической химии
Слайд 2Ионная сила раствора – мера интенсивности электрического поля, создаваемого ионами.
Равна полусумме произведений концентрации ионов на их заряд в квадрате:
где Сi
– молярная концентрация отдельного иона, моль/л;Zi – заряд иона.
Слайд 3Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют
два вида однозарядных ионов Na+ и Cl-, с концентрациями также
равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:NaCl
Na+
+
Cl-
0,001 моль/дм3
0,001
моль/дм3
0,001
моль/дм3
Слайд 41 литр
Сl-
Сl-
Сl-
Сl-
Сl-
C = 5 моль/дм3
Ag+
Ag+
Ag+
С = 3 моль/дм3
а = 3
моль/дм3
а = 2 моль/дм3
f = 2/3 = 0,7
f = 3/5
= 0,6Текст слайда
Слайд 7Закон действующих масс ‒ основной закон для химического равновесия
Значит
и один из ведущих в
аналитической химии!!!!
Закон: при постоянстве давления
и температуры отношение концентраций продуктов реакции и исходных веществ – число постоянное и не зависит от исходных концентрацийСлайд 8Пример: для реакции аА + вВ = сС + dD
математическим
выражением закона действующих масс для химического равновесия является равенство:
Математическое выражение
закона действующих масс, согласно которому в состоянии химического равновесия константа равновесия химической реакции равна отношению произведения продуктов реакции к произведению концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентамСлайд 9Можно рассмотреть практически любую реакцию, лежащую в основе химического анализа,
или вспомогательную, – все будут описаны с точки зрения ЗДМ.
Например, реакция нейтрализации, широко применяемая в титриметрическом анализе: CH3COOH + NaOH = CH3COONa + HOH. Известно, что на практике выполняется следующее соотношение:Слайд 10Закон действующих масс в 1864–1867 гг. установили норвежские ученые: математик и
физико-химик Като Максимилиан Гультберг и физико-химик и минеролог Петер Вааге
Слайд 11ЗДМ применим к процессам диссоциации
Диссоциировать могут как слабые электролиты, так
и сильные.
Cилу электролита характеризует cтепень диссоциации (α):
Величина α показывает,
какая часть молекул (n) от их общего количества (N) распадается на ионы. Выражается в долях или процентах:α = n/N
В зависимости от величины α различают сильные электролиты (α > 0,3), средние (0,03 < α < 0,3) и слабые (α < 0,03).
Слайд 13При исследовании большого числа электролитов было установлено, что ЗДМ применим только к слабым
электролитам
Слайд 16Например, для раствора НCl с концентрацией 0,001 моль/л, в котором присутствуют
два вида однозарядных ионов Н+ и Cl-, с концентрациями также
равными 0,001 моль/л, рН вычисляют следующим образом:НCl
Н+
+
Cl-
0,001 моль/дм3
0,001
моль/дм3
0,001
моль/дм3
рН = - lg[H+] = -lg0,001 = 3
Сильный электролит!
Слайд 17Например, для раствора СН3СOOH с концентрацией 0,001 моль/л, в котором присутствуют
два вида однозарядных ионов Н+ и СН3СOO-, с концентрациями НЕ
равными 0,001 моль/л, рН вычисляют следующим образом:СН3СOOH
Н+
+
СН3СOO-
0,001 моль/дм3
Х
моль/дм3
Х
моль/дм3
Выражение константы диссоциации будет выглядеть следующим образом:
Слабый электролит!
[Н+] = [СН3СOO-] = Х
= 1,8 · 10-5
Х = 1,3·10-4
рН = - lg[H+] = -lg 1,3·10-4 = 3,9
Слайд 18ПРИМЕНЕНИЕ ЗАКОНА
ДЕЙСТВУЮЩИХ МАСС К КИСЛОТНО-ОСНОВНЫМ БУФЕРНЫМ СИСТЕМАМ
Буферные растворы
– это растворы, поддерживающие определенное значение какого-либо параметра при изменении
состава.Кислотно-основными буферными называют растворы, рН которых практически не изменяется от добавления к ним небольших количеств сильной кислоты или основания и при разведении.
Простейшими буферными растворами являются смеси слабых кислот с их солями и слабых оснований с их солями.