Слайд 1Государственное бюджетное образовательное учреждение высшего профессионального образования
«Пермская государственная фармацевтическая
академия»
Министерства здравоохранения
Российской федерации
г.Пермь,2019
Работу выполнили:
Гоголева Екатерина;
Лаврентьева Анна
Организация работы с
непригодными
для медицинского использования лекарственными средствами
Слайд 2Министерство здравоохранения Республики Беларусь, управление фармацевтической инспекции и организации лекарственного
обеспечения, УО «Витебский государственный медицинский университет»
Слайд 3Содержание:
Подготовительный этап
Цель
Область применения
Используемые сокращения
Нормативные ссылки
Порядок работы
Ответственность
Связь с другими стандартными процедурами
Документальное
оформление
Квалификация исполнителей
Обоснование
3
Приложения
Слайд 4Цель:
Минимизация рисков попадания в гражданский оборот недоброкачественных, фальсифицированных, контрафактных товаров
аптечного ассортимента.
4
Слайд 5Обоснование:
В действующих нормативных правовых актах отсутствует понятие
«непригодные для медицинского
использования лекарственные средства», однако приведены понятия фальсифицированного, недоброкачественного, контрафактного лекарственного
средства и иных ЛП ,подлежащих изъятию из обращения.
Контрафактное лекарственное средство – лекарственное средство, находящееся в обороте с нарушением гражданского законодательства.
Фальсифицированное лекарственное средство – лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе.
Недоброкачественное лекарственное средство - лекарственное средство, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа.
5
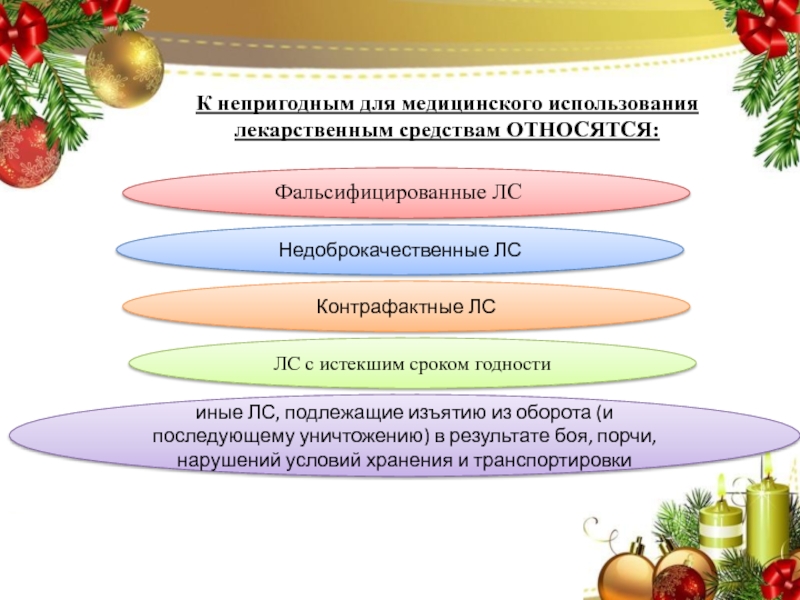
Слайд 6К непригодным для медицинского использования лекарственным средствам ОТНОСЯТСЯ:
Фальсифицированные ЛС
Недоброкачественные ЛС
Контрафактные
ЛС
ЛС с истекшим сроком годности
иные ЛС, подлежащие изъятию из оборота
(и последующему уничтожению) в результате боя, порчи, нарушений условий хранения и транспортировки
Слайд 7Область применения:
Организация работы с непригодными для медицинского использования лекарственными средствами
с момента поступления в аптечную организацию до списания.
6
Слайд 8Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации»
от 21.11.2011 № 323-ФЗ;
Федеральный закон «Об обращении лекарственных средств» от
12.04.2010 № 61-ФЗ;
Приказ Минздравсоцразвития РФ от 23.08.2010 №706н (ред. от 28.12.2010) «Об утверждении Правил хранения лекарственных средств»;
Приказ Минздрава России от 31.08.2016 №647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения»;
Приказ Минздрава России от 31.08.2016 № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения»;
Постановление Правительства Российской Федерации от 3 сентября 2010 г. №674 «Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств»;
Постановление Правительства РФ от 12.12.2015 №1360 «Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий»;
Постановление Правительства РФ от 22 декабря 2011 г. № 1081 «О лицензировании фармацевтической деятельности»;
Федеральный закон «О защите прав потребителей» №2300-1 от 07.02.1992 ( ред. от 18.07.2019);
Нормативные ссылки:

Слайд 9
Федеральный закон от 31 декабря 2014 г. №532-ФЗ «О
внесении изменений в отдельные законодательные акты Российской Федерации в части
противодействия обороту фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и фальсифицированных биологически активных добавок»;
Федеральный закон «О техническом регулировании» от 27 декабря 2002 г. №184-ФЗ;
Приказ Минздрава России №403н от 11.07.2017 Об утверждении правил отпуска лекарственных препаратов для медицинского применения;
Постановление Правительства РФ от 19.01.1998 № 55 (ред. от 28.01.2019) «Об утверждении Правил продажи отдельных видов товаров, перечня товаров длительного пользования, на которые не распространяется требование покупателя о безвозмездном предоставлении ему на период ремонта или замены аналогичного товара, и перечня непродовольственных товаров надлежащего качества, не подлежащих возврату или обмену на аналогичный товар других размера, формы, габарита, фасона, расцветки или комплектации»;
Приказ Министерства здравоохранения РФ от 13.12.2012г. № 1040н «Об утверждении Положения о территориальном органе Федеральной службы по надзору в сфере здравоохранения»;
Приказ Федеральной службы по надзору в сфере здравоохранения и социального развития от 08.02.2006 № 255-Пр/06 «О предоставлении территориальными Управлениями Росздравнадзора информации о недоброкачественных и фальсифицированных ЛС»

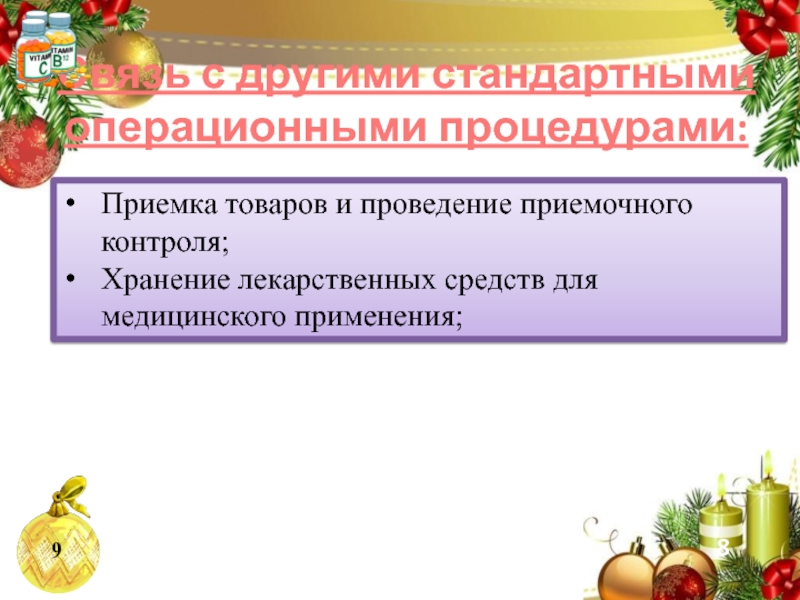
Слайд 10Приемка товаров и проведение приемочного контроля;
Хранение лекарственных средств для медицинского
применения;
Связь с другими стандартными операционными процедурами:
8
Слайд 11Используемые сокращения:
★АО – аптечная организация;
★ЛП - лекарственный препарат
(ы);
★МОЛ - материально-ответственное лицо;
★НПА - нормативный правовой акт (ы);
★НМИЛС -
непригодные для медицинского использования лекарственные средства;
★ ФЛС- фальсифицированные лекарственные средства;
★ НЛС – недоброкачественные лекарственные средства;
★ КЛС – контрафактные лекарственные средства;
9
10
Слайд 12Квалификация исполнителей:
наличие документа, подтверждающее высшее или среднее фармацевтическое образование;
сертификат специалиста/свидетельство
об аккредитации;
уверенное пользование программой Кверти-склад.
11
Слайд 13Ответственность:
Персонал аптечной организации несет ответственность в пределах своей компетенции:
доведение
до сведения работников СОП;
назначение уполномоченного по качеству;
утверждение состава комиссии
по приемке товара;
обеспечение наличия компьютерной системы, позволяющех осуществлять операции, связанные с товародвижением и выявлением фальсифицированных, контрафактных и недоброкачественных ЛП;
Руководитель аптечной организации/ индивидуальный предприниматель:
Слайд 14Уполномоченный по качеству аптечной организации:
контроль соблюдения СОП (не реже
1 раза в месяц; создание журнала проверок);
своевременное приведение СОП в
соответствующей с действующими нормативными документами(1 раз в месяц просматривать нормативно-правовую базу);
своевременное устранение факторов, препятствующих выполнению СОП (мониторинг ЛП с ограниченным сроком годности);
ежедневный мониторинг писем на сайте Росздравнадзора о забракованных и
фальсифицированных лекарственных препаратах, подлежащих
приостановлению в реализации, изъятию (возврату, уничтожению);
работа по внесению полученных сведений в базу данных (в папку)- ежедневно уполномоченный по качеству распечатывает письма по НМИЛС, подшивает в папку);
Слайд 15обеспечение передачи отчетов по результатам проведенной
работы в ТО Росздравнадзора (форма
свободная);
организация и контроль учета лекарственных препаратов
с ограниченным сроком годности,
в соответствии с СОП;
организация упорядоченного хранения документов по качеству, их
архивирование;
Уполномоченный по качеству аптечной организации:
Слайд 16личное выполнение требований СОП;
соблюдение персоналом аптечной организации СОП;
назначение ответственного за
организацию работы с непригодными для медицинского использования лекарственными средствами;
Руководитель структурного
подразделения:
Провизоры и фармацевты:
Продажа фальсифицированных ЛС, недоброкачественных ЛС, контрафактных ЛС является грубым нарушением лицензионных требований и условий при осуществлении фармацевтической деятельности и влечет за собой ответственность, установленную законодательством Российской Федерации. В случае выявления в реализации предписанных к изъятию либо к приостановлению реализации ЛП ущерб будет возмещаться за счет виновных лиц. За непрофессиональное выполнение должностных обязанностей , связанных с появлением НМИЛС (в связи с неправильным размещением на места хранения ЛП), сотрудники несут полную материальную ответственность.
1. УК РФ (статья 238.1; статья 327.2)
2. КОАП РФ (статья 6.33.)
Слайд 17ПОРЯДОК ОСУЩЕСТВЛЕНИЯ ОРГАНИЗАЦИОННЫХ МЕРОПРИЯТИЙ В АПТЕЧНОЙ ОРГАНИЗАЦИИ ПО ПРЕДОТВРАЩЕНИЮ ИСПОЛЬЗОВАНИЯ
НЕПРИГОДНЫХ ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В СООТВЕТСТВИИ С ПРАВИЛАМИ
НАДЛЕЖАЩЕЙ АПТЕЧНОЙ ПРАКТИКИ (НАП)
Качество ЛС должно обеспечиваться и контролироваться при осуществлении процессов на каждом этапе их обращения.
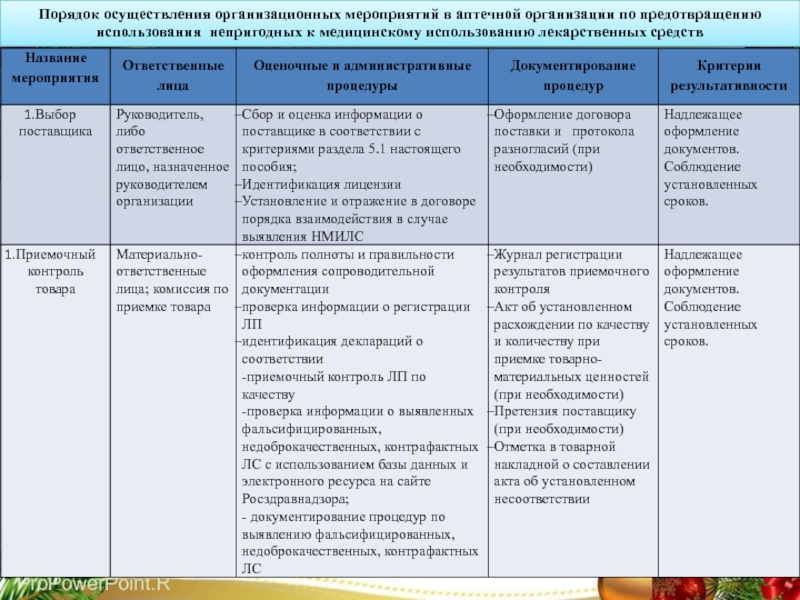
Слайд 18Создание системы противодействия поступления в аптеку фальсифицированных и недоброкачественных ЛП:
Для
организации работы по предотвращению поступления и использования НМИЛС необходимо проведение
следующих организационных мероприятий:
Назначение руководителем лица, ответственного за внедрение и обеспечение системы качества и определение его функциональных обязанностей.
Назначение приказом руководителя субъекта розничной торговли ответственного лица за работу с фальсифицированными, недоброкачественными, контрафактными товарами аптечного ассортимента.
Выделение обозначенных зон или отдельных помещений:
Регламентация процедуры приемочного контроля и других производственных операций, соблюдение требований нормативных актов по приемке и хранению ЛС.
приемки лекарственных препаратов;
хранения лекарственных препаратов, требующих специальных условий;
хранения выявленных фальсифицированных, недоброкачественных, контрафактных ЛП;
для карантинного хранения лекарственных препаратов.
оперативное отслеживание информации по качеству,
своевременное информирование персонала,
изъятие из обращения и передача на уничтожение НМИЛС,
разработка СОП.
Организация системы регулярного обучения и аттестации персонала по вопросам обеспечения качества с целью поддержания необходимого уровня их профессиональной квалификации.
Организация учета и документального оформления движения непригодных к медицинскому использованию ЛП.
Постоянный контроль правильности отражения информации по качеству в соответствующей документации.
Организация внутреннего контроля (аудита) соблюдения условий хранения, сроков годности ЛП, сохранения качества ЛС, организации работы с НМИЛС.

Слайд 19В процессе регулирования предупреждения и выявления в аптеке НМИЛС можно
выделить несколько этапов:
Слайд 20а) соответствие поставщика требованиям действующего законодательства Российской Федерации о лицензировании
отдельных видов деятельности;
б) деловая репутация поставщика на фармацевтическом рынке, исходя
из наличия фактов отзыва фальсифицированных, недоброкачественных, контрафактных товаров аптечного ассортимента, неисполнение им принятых договорных обязательств, предписаний уполномоченных органов государственного контроля о фактах нарушения требований законодательства Российской Федерации;
в) востребованность товаров аптечного ассортимента, предлагаемых поставщиком для дальнейшей реализации, соответствие качества товаров аптечного ассортимента требованиям законодательства Российской Федерации;
г) соблюдение поставщиком требований, установленных правилами НАП, к оформлению документации, наличие документа с перечнем деклараций о соответствии продукции установленным требованиям, протокола согласования цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов;
д) соблюдение поставщиком температурного режима при транспортировке термолабильных лекарственных препаратов, в том числе иммунобиологических лекарственных препаратов;
е) предоставление поставщиком гарантии качества на поставляемые товары аптечного ассортимента.
Выбор поставщика, заключение договора
Согласно правилам НАП, руководителем субъекта розничной торговли должен быть утвержден порядок отбора и оценки поставщиков товаров аптечного ассортимента с учетом критериев, оказывающих влияние на обеспечение качества товаров:

Слайд 21Мероприятия на стадии выбора поставщика
✔Идентификация лицензии поставщика на фармацевтическую деятельность
(на официальном сайте http://www.roszdravnadzor.ru/services/licenses);
✔При заключении договора установить ограничения по
фактическому остаточному сроку годности ЛС на дату поставки и порядок действий при нарушении этого условия;
✔В соответствии с правилами НАП, предусмотреть сроки принятия поставщиком претензии по качеству продукции, а также возможность возврата фальсифицированных недоброкачественных, контрафактных товаров аптечного ассортимента поставщику, если информация об этом поступила после приемки товара и оформления соответствующих документов.
В этой связи в договоре необходимо прописать порядок взаимодействия поставщика и покупателя в случае выявления в процессе реализации ЛП, признанных в установленном порядке фальсифицированными, недоброкачественными, либо контрафактными ЛС.
✔Осуществлять контроль наличия соответствующей документации по поставке ЛС, в том числе проверку правильности оформления всех сопроводительных документов.
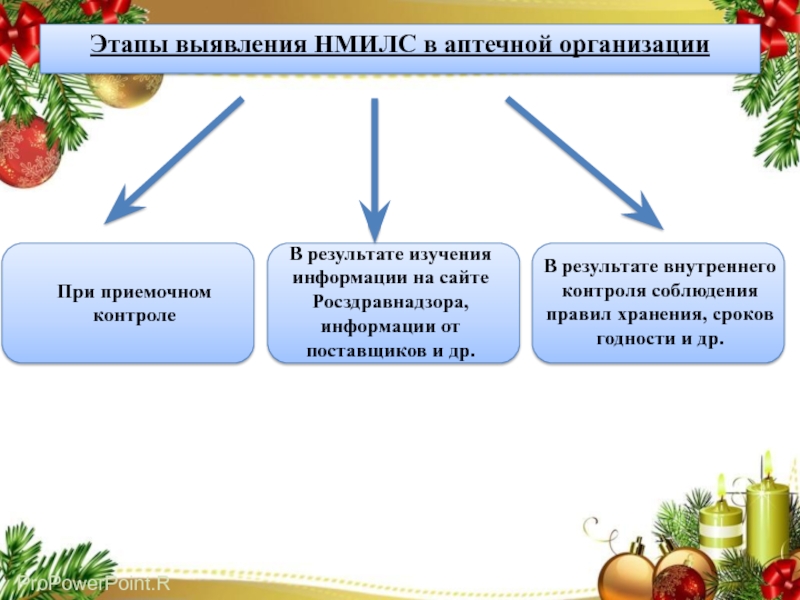
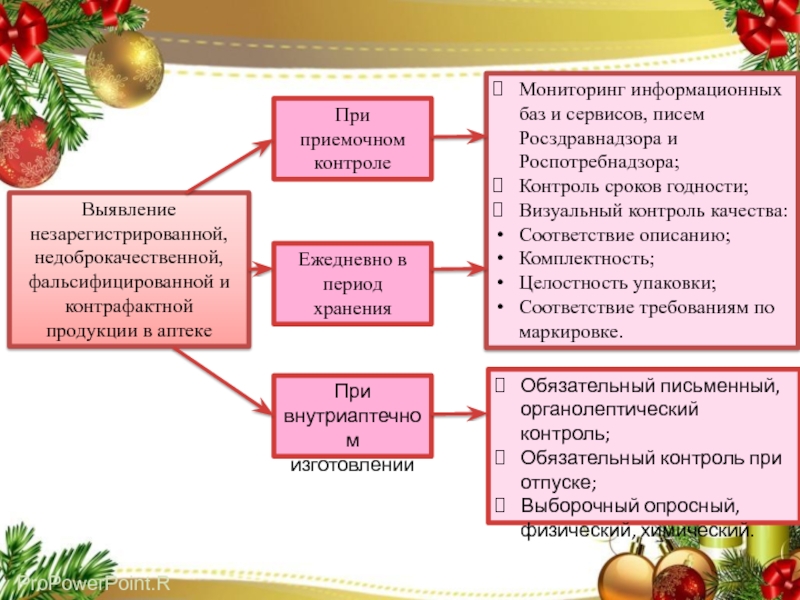
Слайд 22Этапы выявления НМИЛС в аптечной организации
При приемочном контроле
В результате изучения
информации на сайте Росздравнадзора, информации от поставщиков и др.
В результате
внутреннего контроля соблюдения правил хранения, сроков годности и др.
Слайд 23Выявление незарегистрированной, недоброкачественной, фальсифицированной и контрафактной продукции в аптеке
При приемочном
контроле
Ежедневно в период хранения
При внутриаптечном изготовлении
Мониторинг информационных баз и сервисов,
писем Росздравнадзора и Роспотребнадзора;
Контроль сроков годности;
Визуальный контроль качества:
Соответствие описанию;
Комплектность;
Целостность упаковки;
Соответствие требованиям по маркировке.
Обязательный письменный, органолептический контроль;
Обязательный контроль при отпуске;
Выборочный опросный, физический, химический.
Слайд 24Мероприятия по предотвращению поступления в аптечную организацию фальсифицированных, недоброкачественных, контрафактных
ЛП при приемке товаров
Контроль документации:
проверка наличия и правильности оформления сопроводительных
документов;
проверка сведений о регистрации ЛП (на сайте ГРЛС);
проверка наличия информации, либо документов, подтверждающих качество ЛС (деклараций о соответствии) в соответствии с действующими НД; идентификация деклараций о соответствии на сайте Росаккредитации,
Организация приемочного контроля с проведением экспертизы ЛП
контроль поступающих лекарственных средств на соответствие установленным требованиям по показателям «Описание», «Упаковка», «Маркировка»;
проверка наличия защитных элементов упаковки, отличительных признаков фальсификации у лекарственных средств «группы риска» по фальсификации
Проведение информационно-аналитического мониторинга и скрининга качества ЛП
проверка информации о выявленных фальсифицированных, недоброкачественных, контрафактных ЛС на сайте Росздравнадзора;
Размещение товара по местам хранения, организация хранения в соответствии с указанием производителя и установленными требованиями, размещение выявленных НМИЛС в специально выделенные зоны

Слайд 26В помещениях и (или) зонах должны поддерживаться температурные режимы хранения
и влажность, соответствующие условиям хранения, указанным в нормативной документации, составляющей
регистрационное досье лекарственного препарата, инструкции по медицинскому применению лекарственного препаратов и на упаковке лекарственного препарата.
Лекарственные препараты, в отношении которых субъектом обращения лекарственных препаратов не принято решение о дальнейшем обращении, или лекарственные препараты, обращение которых приостановлено, а также возвращенные субъекту обращения лекарственных препаратов лекарственные препараты должны быть помещены в отдельное помещение (зону) или изолированы с применением системы электронной обработки данных, обеспечивающей разделение.
Лекарственные препараты, в отношении которых субъектом обращения лекарственных препаратов принято решение о приостановлении применения или об изъятии из обращения, а также фальсифицированные, недоброкачественные и контрафактные лекарственные препараты должны быть изолированы и размещены в специально выделенном помещении (зоне).
Предпринятые меры изоляции указанных лекарственных препаратов должны гарантировать исключение их попадания в обращение.
Что касается карантинной зоны, то она предназначена для изолированного размещения ЛП, обращение которых приостановлено, либо не принято решение об их дальнейшем обращении.

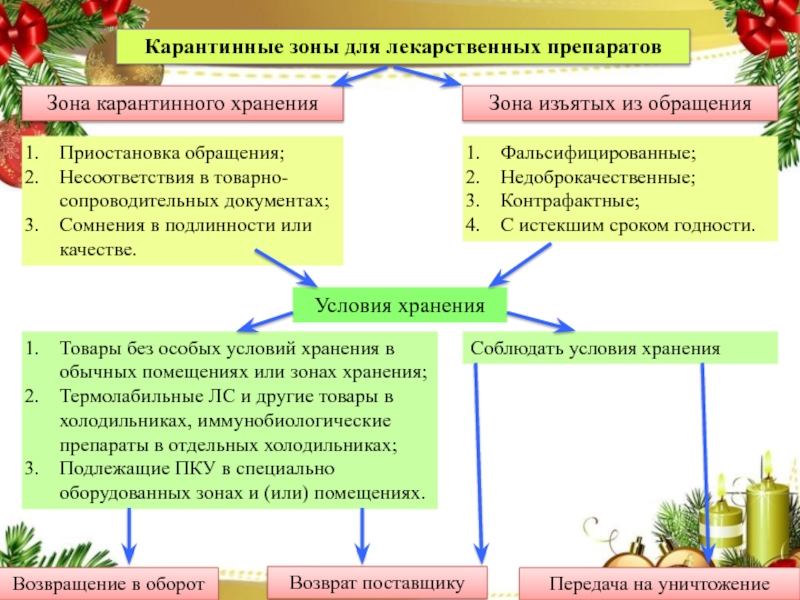
Слайд 27Карантинные зоны для лекарственных препаратов
Зона карантинного хранения
Зона изъятых из обращения
Приостановка
обращения;
Несоответствия в товарно-сопроводительных документах;
Сомнения в подлинности или качестве.
Фальсифицированные;
Недоброкачественные;
Контрафактные;
С истекшим сроком
годности.
Условия хранения
Товары без особых условий хранения в обычных помещениях или зонах хранения;
Термолабильные ЛС и другие товары в холодильниках, иммунобиологические препараты в отдельных холодильниках;
Подлежащие ПКУ в специально оборудованных зонах и (или) помещениях.
Соблюдать условия хранения
Возвращение в оборот
Возврат поставщику
Передача на уничтожение
Слайд 28Перемещение ЛП
Из карантинной зоны препарат может быть перемещен:
в зону хранения фальсифицированных,
недоброкачественных, контрафактных, с истекшим сроком годности лекарств, возвращен поставщику либо возвращен
в дальнейший оборот.
Если лекарственные препараты подготовлены на уничтожение, их необходимо поместить в емкость любого цвета, кроме красного и желтого, промаркировать емкость (постановление Главного государственного санитарного врача от 09.12.2010 № 163 «Об утверждении СанПиН 2.1.7.2790–10 „Санитарно-эпидемиологические требования к обращению с медицинскими отходами“».
Из зоны хранения фальсифицированных и прочих недоброкачественных ЛС:
можно передать только на уничтожение: организации со специальной лицензией или поставщику.
Передача поставщику возможна:
если ЛП был забракован при приемочном контроле
если в договоре с поставщиком прописано условие о возврате товаров, признанных недоброкачественными, фальсифицированными, контрафактными после поступления в аптеку и передачи прав собственности
Слайд 30Анализ информации о выявленных НМИЛС
руководителем организации из числа сотрудников организации
назначается уполномоченное лицо, в обязанности которого входит ежедневное проведение
сбора и анализа информации о выявленных НМИЛС
основные источники информации о выявленных НМИЛС :
решения Росздравнадзора
сведения о НМИЛС, полученные от поставщиков / владельцев/ производителей
уполномоченное лицо формирует базу данных (перечень) выявленных НМИЛС, где должна быть отражена информация, необходимая для идентификации ЛС с целью проведения проверки наличия НМИЛС
1
Слайд 32
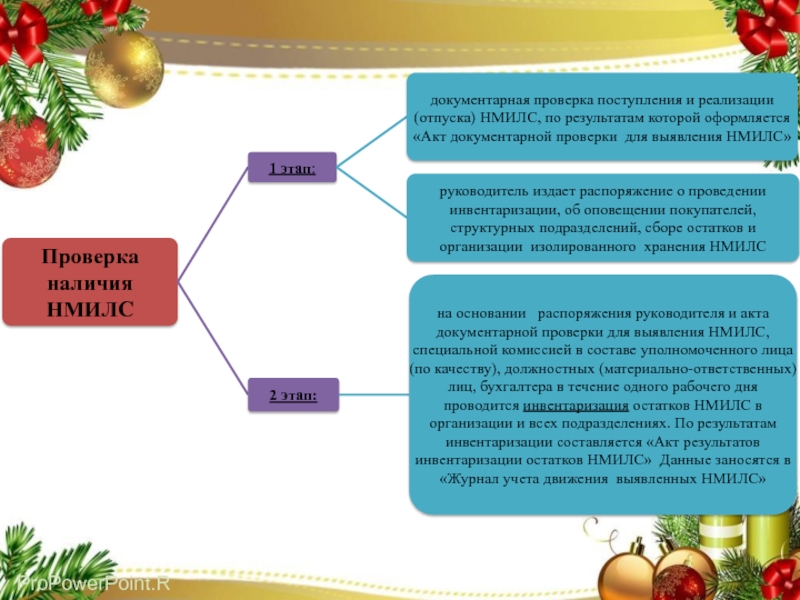
Сбор, изолированное хранение НМИЛС
На основании распоряжения руководителя должностным лицом организации
незамедлительно осуществляется оповещение покупателей, структурных подразделений о выявленных НМИЛС и
в течение 3-10 дней осуществляется сбор НМИЛС.
Прием НМИЛС оформляется возвратной накладной и «Актом приемки-передачи остатков НМИЛС»
НМИЛС размещаются в помещении (зоне) изолированного хранения и регистрируются в «Журнале регистрации операций по сбору остатков НМИЛС»
НМИЛС (ЛС с истекшим сроком годности, а также утратившие качество в результате нарушения условий хранения, транспортировки), выявленные в результате внутренних проверок, размещаются в помещении (зоне) изолированного хранения и регистрируются отдельно от остальных НМИЛС.
По результатам инвентаризации, внутренних проверок, сбора нереализованных (неиспользованных) остатков НМИЛС руководитель организации издает распоряжение об изъятии НМИЛС из товарного запаса, и передаче для уничтожения (возврата поставщику/ владельцу/производителю).
1
Слайд 33Передача НМИЛС для уничтожения (возврат поставщику/ владельцу/производителю
Размещенные
в помещении (зоне) изолированного хранения НМИЛС упаковываются, маркируются уполномоченным лицом
организации и в срок, не превышающий 7-14 дней
передаются для уничтожения в организацию, имеющую лицензию на осуществление деятельности по сбору, транспортированию, обработке, утилизации, обезвреживанию, размещению отходов I - V классов опасности
возвращаются поставщику/владельцу/ производителю ЛС для принятия дальнейших действий по изъятию НМИЛС из гражданского оборота
Слайд 34Выявление иных НМИЛС в результате внутреннего контроля
Для выявления ЛС с
истекшим сроком годности, а также утративших качество в результате нарушения
условий хранения, транспортировки и др., на основании распоряжения руководителя в организации и всех подразделениях не реже одного раза в месяц проводится внутренняя плановая/внезапная проверка уполномоченным по качеству лицом (должностным лицом организации),
По результатам оформляется «Акт обследования для выявления НМИЛС» с занесением данных в «Журнал учета выявленных НМИЛС»
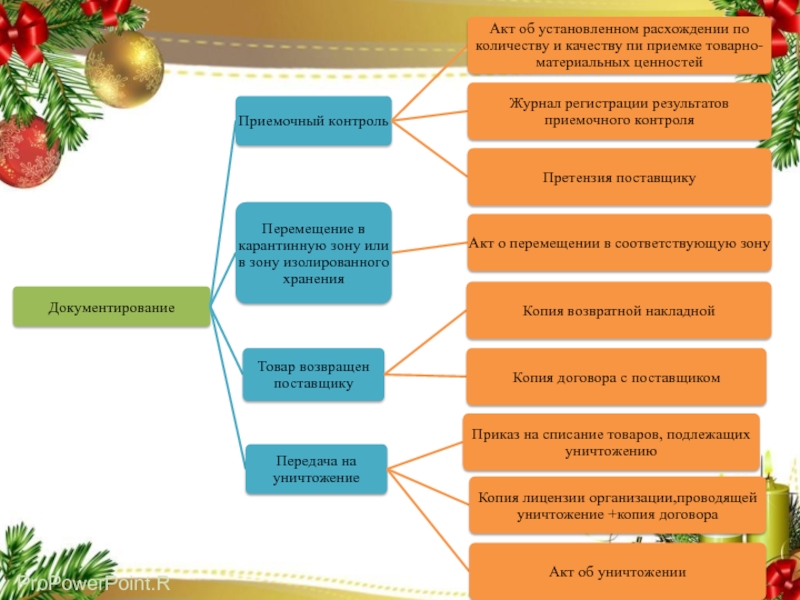
Слайд 35Документирование выявленных несоответствий при приемке товаров
В случае несоответствия товаров аптечного
ассортимента условиям договора, данным сопроводительных документов, выявления при приемке боя,
порчи, недостачи товаров, обнаружения недоброкачественных, фальсифицированных и контрафактных товаров.
Оформляются:
Акт об установленном расхождении по количеству и качеству при приемке товарно-материальных ценностей в 2-х экземплярах с подписями всех членов приемной комиссии, который является юридическим основанием для предъявления претензии поставщику.
Претензия поставщику в письменном виде с подписью руководителя аптечной организации. В ней отражается предмет претензии, ожидаемые действия поставщика по устранению установленных расхождений при приемке товара, указывается, в какой срок поставщик должен рассмотреть претензию и ответить на нее.
Журнал регистрации результатов приемочного контроля, где нужно указать выявленные несоответствия при приемке товара с указанием наименования ЛП, серии и срока годности, количества, причины несоответствия, ФИО ответственного и подпись
Слайд 36При выявлении фактов наличия НМИЛС (в т.ч. с истекшим сроком
годности), приостанавливается их реализация, проводится инвентаризация нереализованных остатков НМИЛС; документарная
проверка отпуска серий данных ЛС в подразделения АО/организациям; извещается руководитель АО. По результатам проверки оформляется акт и издается распоряжение руководителя об оповещении покупателей, структурных подразделений, сборе остатков и организации изолированного хранения ЛС с истекшим сроком годности. Критерием результативности процесса является отсутствие ЛС с истекшим сроком годности, надлежащее оформление документов.
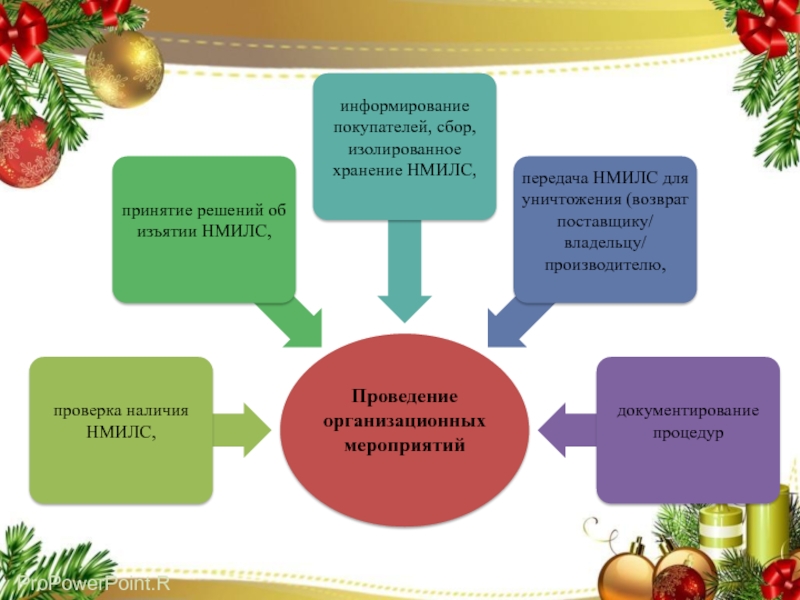
Функции аптечной организации, порядок осуществления процессов по организации работы с НМИЛС (анализ информации о выявленных НМИЛС, проверка наличия НМИЛС, принятие решений об изъятии НМИЛС, информирование покупателей, сбор, изолированное хранение НМИЛС, передача НМИЛС для уничтожения (возврат поставщику/ владельцу/ производителю, документирование процедур) изложены в разделе 1 настоящего пособия.
Порядок осуществления организационных мероприятий в аптечной организации по предотвращению использования непригодных к медицинскому использованию лекарственных средств представлен в таблице 1.
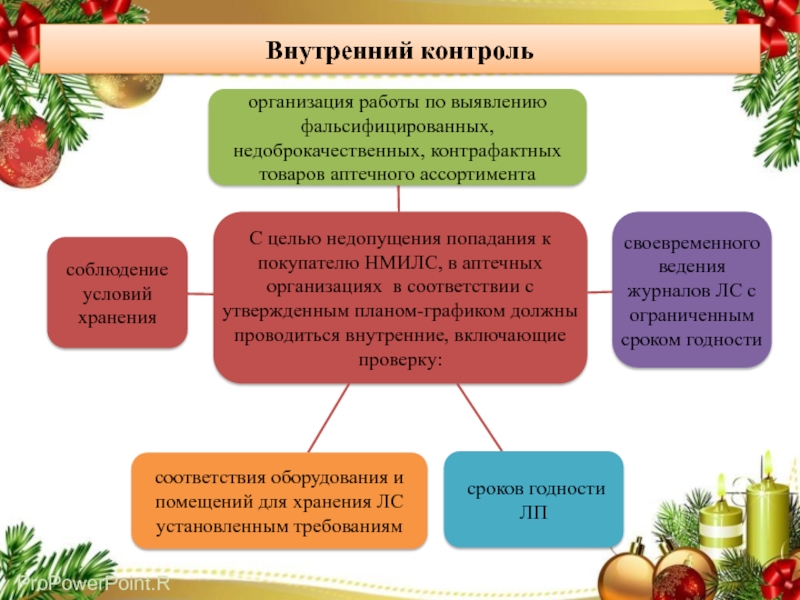
Внутренний контроль соблюдения условий хранения, сроков годности ЛП, сохранения качества ЛС
С целью недопущения попадания к покупателю НМИЛС, в аптечных организациях в соответствии с утвержденным планом-графиком должны проводиться внутренние аудиты (самоинспектирование), включающие проверку организации работы по выявлению фальсифицированных, недоброкачественных, контрафактных товаров аптечного ассортимента; проверку своевременного ведения журналов ЛС с ограниченным сроком годности, проверку соответствия оборудования и помещений для хранения ЛС установленным требованиям, соблюдение условий хранения ЛС.
На основании распоряжения руководителя АО о проведении плановой/внезапной проверки, ответственное лицо, назначенное руководителем, проводит соответствующую проверку.

Слайд 37Целесообразно информационные письма распечатывать и хранить в отдельной папке.
Информационно-аналитический
мониторинг и скрининг качества ЛП с использованием базы данных о
качестве ЛП
Обязательной частью мероприятий аптечной организации по предотвращению использования фальсифицированных, недоброкачественных, контрафактных лекарственных препаратов является проверка информационных писем Росздравнадзора о приостановлении реализации, изъятии из обращения и или отзыве ЛП производителем.
Проверку целесообразно осуществлять на сайте Росздравнадзора http://www.roszdravnadzor.ru/drugs/qualitycontrol) путем анализа содержания информационных писем, в которых содержится информация о выявлении недоброкачественных, либо фальсифицированных ЛС и предписывается порядок действий, которые следует предпринять субъектам обращения ЛС.
Слайд 401. Ответственный уполномоченный по качеству в аптечной организации ежедневно в
начале рабочего дня просматривает письма для выявления в обращении фальсифицированных,
недоброкачественных лекарственных препаратов. Сравнивает лекарственные препараты, имеющиеся в наличии, с препаратами, указанными в письме по серии и производителю.
П
Порядок работы по выявлению лекарственных препаратов по письмам Росздравнадзора:
16
При их обнаружении незамедлительно сообщить руководителю организации об изъятии из обращения и перемещении в соответствующую карантинную зону.
Слайд 412. При наличии лекарственного препарата обозначенного в письме как фальсифицированное
лекарственное средство уполномоченный по качеству сравнивает его с указанными в
письме Росздравнадзора отличительными признаками фальсификации. При их обнаружении лекарственное средство изымаем из обращения и перемещаем в зону хранения фальсифицированных, недоброкачественных, контрафактных и с истекшим сроком годности лекарственных препаратов.
Слайд 423.При наличии лекарственного препарата, указанного в письме как фальсифицированное лекарственное
средство, но с другими сериями, которые не указаны в информации
Росздравнадзора, также проверить по отличительным признакам фальсификации. При их обнаружении препарат изымаем из обращения и перемещаем в зону карантинного хранения лекарственных препаратов (статус которых не определен).
Слайд 434. Лекарственные препараты, указанные в п.1,2, и 3 cдаются в
аккредитованную организацию для проведения мероприятий по проверке качества.
При получении
заключения о соответствии требованиям нормативной документации лекарственные препараты, указанные в п.3 подлежат дальнейшему обороту.
При получении заключения о несоответствии требованиям нормативной документации лекарственные препараты, указанные в п.3 перемещаем в зону хранения фальсифицированных, недоброкачественных, контрафактных и с истекшим сроком годности лекарственных препаратов. Выявленные фальсифицированные лекарственные препараты в дальнейшем подлежат уничтожению в установленном порядке в аккредитованной организации на основании договора.
Слайд 445. При наличии лекарственного препарата обозначенного в письме недоброкачественные лекарственные
препараты уполномоченный по качеству сравнивает его с указанными в письме
Росздравнадзора отличительными признаками фальсификации. При их обнаружении лекарственное средство изымаем из обращения и перемещаем в зону хранения фальсифицированных, недоброкачественных, контрафактных и с истекшим сроком годности лекарственных препаратов.
Слайд 456. При наличии лекарственного препарата обозначенного в письме недоброкачественные лекарственные
препараты, вся серия которого подлежит изъятию из обращения, уполномоченный по
качеству изымает лекарственный препарат этой серии и перемещает в зону карантинного хранения лекарственных препаратов или в зону карантинного хранения лекарственных препаратов, требующих специальных условий (статус которых не определен).
Слайд 467. При наличии лекарственного препарата обозначенного в письме недоброкачественные лекарственные
препараты, партия которого подлежит изъятию из обращения, уполномоченный по качеству
изымает лекарственный препарат этой серии и перемещает в зону карантинного хранения лекарственных препаратов или в зону карантинного хранения лекарственных препаратов, требующих специальных условий (статус которых не определен).
27
Слайд 474. Лекарственные препараты, указанные в п.5,6, и 7 при подтверждении
Росздравнадзором несоответствия качества лекарственных препаратов требованиям нормативной документации, подлежат возврату
поставщику на основании договора. При возобновлении реализации лекарственных средств Росздравнадзором, лекарственные препараты, указанные в п.6 и 7 возвращаются в оборот.
28
Слайд 48Порядок работы по выявлению недоброкачественных лекарственных средств, не обозначенных письмами
Росздравнадзора:
1. При выявлении лекарственных препаратов, пришедших в негодность, изымают их
из обращения и перемещают в зону хранения фальсифицированных, недоброкачественных, контрафактных и с истекшим сроком годности лекарственных препаратов. Лекарственные препараты уничтожаются в установленном порядке аккредитованной организацией на основании договора.
29
Слайд 492. Лекарственные препараты, вызывающие сомнение в их качестве, перемещают в
зону карантинного хранения (статус которых не определен), образцы лекарственных препаратов
сдаются на анализ в аккредитованною лабораторию. При получении заключения о несоответствии требованиям нормативной документации лекарственный препарат подлежит уничтожению в установленном порядке в аккредитованной организации на основании договора, в случае соответствия – возвращается в оборот.
Слайд 503. При отсутствии полного комплекта сопроводительных документов лекарственные препараты перемещаем
в зону карантинного хранения лекарственных препаратов (статус которых не определен).
После получения недостающих документов лекарственные препараты возвращают в оборот.
Слайд 5128
Порядок работы по выявлению лекарственных средств с истекающим сроком годности:
1.
Уполномоченные по качеству и ответственные в подразделениях принимают меры по
сохранности лекарственных препаратов и соблюдению сроков годности лекарственных препаратов.
2. Во всех подразделениях за три месяца до истечения срока годности лекарственные препараты заносят в «Журнал учета лекарственных средств с ограниченным сроком годности».
Слайд 523. При наличии нескольких серий одного наименования лекарственного препарата в
первую очередь используется лекарственный препарат, срок годности которого истекает раньше.
4.
В день окончания срока годности лекарственные препараты перемещают в зону хранения фальсифицированных, недоброкачественных, контрафактных и с истекшим сроком годности лекарственных препаратов, которые затем подлежат уничтожению в установленном порядке в аккредитованной организации на основании договора.
Слайд 53Документальное оформление:
1. Комиссией в течение двух рабочих дней составляется «Акт
о перемещении фальсифицированных, забракованных и недоброкачественных лекарственных препаратов» в двух
экземплярах:
-первый экземпляр остается в карантинной зоне с лекарственными препаратами;
-второй экземпляр находится у уполномоченного по качеству или ответственного лица.
Копию акта направляют в территориальное управление Росздравнадзора.
Слайд 542.При отзыве лекарственного препарата и возврата поставщику оформляют возвратную накладную
в трех экземплярах:
-первый экземпляр с лекарственными препаратами направляется поставщику;
-второй экземпляр
передается в бухгалтерию;
-третий экземпляр остается у материально-ответственного лица.
Копию возвратной накладной направляют в территориальное управление Росздравнадзора.
Слайд 553.При уничтожении лекарственных препаратов и возврата поставщику оформляют возвратную накладную
в трех экземплярах:
-первый экземпляр с лекарственными препаратами направляется поставщику;
-второй экземпляр
передается в бухгалтерию;
-третий экземпляр остается у материально-ответственного лица.
Копию возвратной накладной направляют в территориальное управление Росздравнадзора.
Слайд 56Порядок осуществления организационных мероприятий в аптечной организации по предотвращению использования
непригодных к медицинскому использованию лекарственных средств
Слайд 60Приложение №1
УТВЕРЖДАЮ
__________________________________
_______________
должность, подпись руководителя организации расшифровка подписи
«_____» ______________ 20 __г.
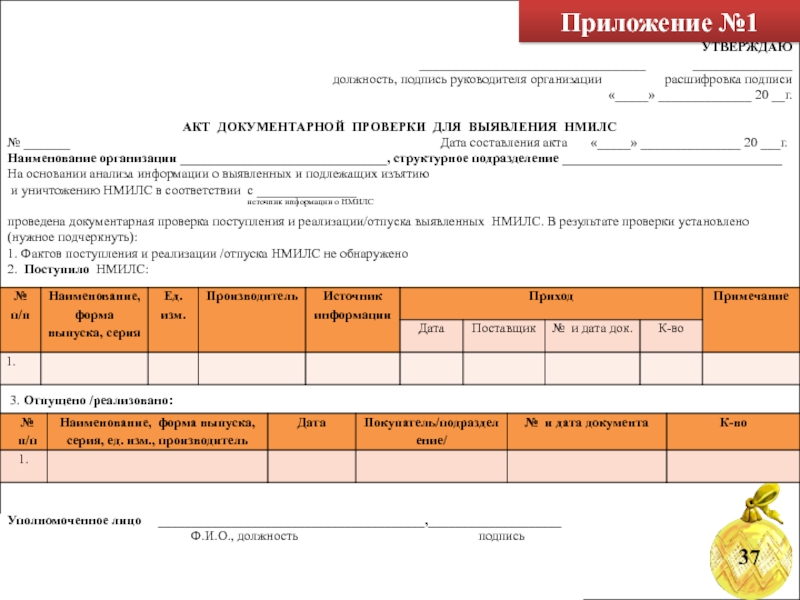
АКТ ДОКУМЕНТАРНОЙ ПРОВЕРКИ ДЛЯ ВЫЯВЛЕНИЯ НМИЛС
№ _______ Дата составления акта «_____» _______________ 20 ___г.
Наименование организации _______________________________, структурное подразделение _________________________________
На основании анализа информации о выявленных и подлежащих изъятию
и уничтожению НМИЛС в соответствии с _______________
источник информации о НМИЛС
проведена документарная проверка поступления и реализации/отпуска выявленных НМИЛС. В результате проверки установлено (нужное подчеркнуть):
1. Фактов поступления и реализации /отпуска НМИЛС не обнаружено
2. Поступило НМИЛС:
3. Отпущено /реализовано:
Уполномоченное лицо ________________________________________,____________________
Ф.И.О., должность подпись
Слайд 61УТВЕРЖДАЮ
__________________________________ _______________
должность, подпись
руководителя организации расшифровка
подписи
«_____» ______________ 20 __г.
АКТ РЕЗУЛЬТАТОВ ИНВЕНТАРИЗАЦИИ ОСТАТКОВ НМИЛС
№_______ Дата составления акта «_____»_________ 20 ___г.
Наименование организации ____________________________________
Структурное подразделение ____________________________________
Комиссия в составе: председателя _______________________________
(Ф.И.О., должность)
членов комиссии:______________________________________________
(Ф.И.О., должности)
в соответствии с распоряжением № __ от «_____» _________ 20 ___г. провела инвентаризацию остатков, выявленных по результатам документарной проверки НМИЛС
*На ЛС, подлежащие предметно-количественному учету, составляется отдельный акт на каждую номенклатурную позицию
**Данные проставляются из акта документарной проверки НМИЛС
В результате инвентаризации установлено (нужное подчеркнуть):
Остатков НМИЛС не выявлено
Выявлены остатки НМИЛС, в т.ч.
______________________________________ в количестве _____________ (___) ед.
наим., форма вып., серия, производитель цифрами, прописью
______________________________________ в количестве ___________ __(___) ед.
наим., форма вып., серия, производитель цифрами, прописью
Председатель _______________ ___________________________
подпись расшифровка подписи
Члены комиссии ______________ ___________________________
подпись расшифровка подпидси
Приложение №2

Слайд 62УТВЕРЖДАЮ
__________________________________ _______________
должность, подпись
руководителя организации расшифровка
подписи
«_____» ______________ 20 __г.
АКТ ОБСЛЕДОВАНИЯ ДЛЯ ВЫЯВЛЕНИЯ НМИЛС
№ _______ «_____» _______________ 20 __г.
Наименование организации ________________________________________________________
Структурное подразделение ________________________________________________________
Уполномоченное лицо ___________________________________________________________
(Ф.И.О., должность)
На основании____________________проведена _____________________ проверка условий хранения и использования ЛС с целью выявления НМИЛС
( лановая, внезапная)
(с истекшим сроком годности, утративших качество в результате нарушения условий хранения, транспортировки и др. причинам).
В результате проверки установлено (нужное подчеркнуть):
1. НМИЛС не выявлено
2. Выявлены ЛС промышленного производства, в т.ч.
2.1 С истекшим сроком годности: _____________ , форма выпуска ______ ед. изм. ______серия _________ производитель___________к-во _________________
( наименование ЛС) (цифрами и прописью)
2.2 Утратившие качество ЛС: _____________ , форма выпуска ______ ед. изм. ______серия _________ производитель___________к-во _________________
( наименование ЛС) (цифрами и прописью)
2.3 Хранившиеся с нарушением установленных требований: _______ , форма выпуска ___ ед. изм. __серия _____ производитель_____к-во _________________
( наименование ЛС) (цифрами и прописью)
3. Выявлены НМИЛС аптечного изготовления: ___________________ ______________________________________________
(наименование ЛС, лек.форма , ед. изм., объем)
к-во ______________________ причина непригодности__________________________________
(цифрами и прописью)
Уполномоченное лицо ________________________________,______________
( Ф.И.О., должность ) (подпись)
Приложение №3

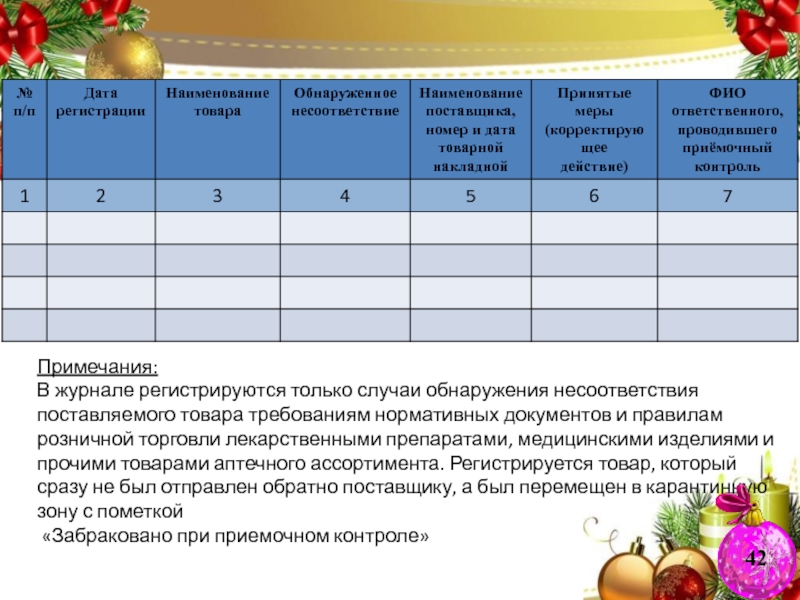
Слайд 63Приложение №4
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ__________________________________________
СТРУКТУРНОЕ ПОДРАЗДЕЛЕНИЕ___________________________________________
ЖУРНАЛ
регистрации результатов приемочного контроля
Начат_________________20__г.
Окончен_______________20__г.
ООО «Витамин»
Слайд 648.1. Сверить соответствие наименования поступивших детских товаров, наименования производителей, сроки
годности, номер партии (если есть) в сопроводительных документах и на
упаковках.
8.2. Проверить наличие (отсутствие) информации о несоответствии принимаемых детских товаров на сайте Роспотребнадзора http://rospotrebnadzor.ru/
Если в базе данных Роспотребнадзора (другой информационной базе) имеется информация, что обращение данной продукции приостановлено, то детские товары разместить в зоне карантинного хранения (термолабильные разместить в зоне карантинного хранения в холодильнике №__) с оформлением «Акта об установленном расхождении по количеству и качеству при приемке товарно-материальных ценностей» (акт другой формы). Уведомить территориальное Управление Роспотребнадзора о поступлении данной продукции для детей, а также уведомить поставщика.
Если в базе данных Роспотребнадзора отсутствует информация, что обращение данной продукции приостановлено, или что данная продукция изъята из обращения, то продолжается приемочный контроль.
8.3. Убедиться в факте государственной регистрации на поисковом сервере по реестрам Роспотребнадзора : http://fp.crc.ru или на сайте Евразийской Экономической Комиссии: http://www.eurasiancommission.org/ru в Едином реестре Свидетельств о государственной регистрации Таможенного Союза следующих товаров для детей: соски молочные, соски-пустышки из латекса, резины или силиконовые; посуда, столовые приборы для детей до 3-х лет (чашки, блюдца, поильники, тарелки, миски, ложки, вилки, бутылочки и другие аналогичные изделия для пищевых продуктов); изделия санитарно – гигиенические разового пользования (подгузники, трусы, пеленки, гигиенические ватные палочки); щетки зубные, щетки зубные электрические с питанием от химических источников тока, массажеры для десен и другие аналогичные изделия для детей до 3-х лет.
8.4. Проверить соответствие маркировки предметов и средств, предназначенных для ухода за новорожденными и детьми, не достигшими возраста трех лет требованиям статьи 9 Технического регламента Таможенного союза 007/2011 «О безопасности продукции, предназначенной для детей и подростков» и статьи 6 Технического регламента Таможенного союза 005/2011 «О безопасности упаковки» (Приложение 7).
8.5. Проверить наличие сведений о декларациях о соответствии или о сертификатах соответствия на детские товары в реестре (другом документе) поставщика (Приложение 8).
8.6. При соответствии детской продукции по количеству и качеству, правильности оформления сопроводительных документов ввести информацию о приходе товаров в учетную программу.
8.7. Разместить товары по местам хранения.
Примечания:
В журнале регистрируются только случаи обнаружения несоответствия поставляемого товара требованиям нормативных документов и правилам розничной торговли лекарственными препаратами, медицинскими изделиями и прочими товарами аптечного ассортимента. Регистрируется товар, который сразу не был отправлен обратно поставщику, а был перемещен в карантинную зону с пометкой
«Забраковано при приемочном контроле»
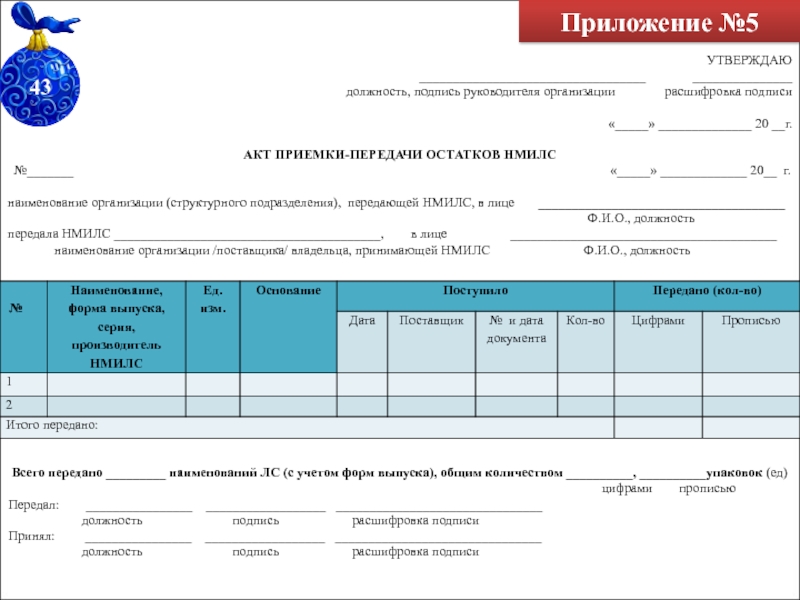
Слайд 65Приложение №5
УТВЕРЖДАЮ
__________________________________ _______________
должность,
подпись руководителя организации
расшифровка подписи
«_____» ______________ 20 __г.
АКТ ПРИЕМКИ-ПЕРЕДАЧИ ОСТАТКОВ НМИЛС
№_______ «_____» _____________ 20__ г.
наименование организации (структурного подразделения), передающей НМИЛС, в лице _____________________________________
Ф.И.О., должность передала НМИЛС ________________________________________, в лице ________________________________________
наименование организации /поставщика/ владельца, принимающей НМИЛС Ф.И.О., должность
Всего передано _________ наименований ЛС (с учетом форм выпуска), общим количеством __________, __________упаковок (ед)
цифрами прописью
Передал: ________________ __________________ _______________________________
должность подпись расшифровка подписи
Принял: ________________ __________________ _______________________________
должность подпись расшифровка подписи
Слайд 66Приложение №6
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ__________________________________________
СТРУКТУРНОЕ ПОДРАЗДЕЛЕНИЕ___________________________________________
ЖУРНАЛ
УЧЕТА РЕГИСТРАЦИИ ОПЕРАЦИЙ ПО СБОРУ ОСТАТКОВ НМИЛС
Начат_________________20__г.
Окончен_______________20__г.
ООО «Витамин»
Слайд 68Приложение №7
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ__________________________________________
СТРУКТУРНОЕ ПОДРАЗДЕЛЕНИЕ___________________________________________
ЖУРНАЛ
УЧЕТА ВЫЯВЛЕННЫХ НЕПРИГОДНЫХ ДЛЯ МЕДИЦИНСКОГО ИСОЛЬЗОВАНИЯ ЛЕКАРСТВЕННЫХ
СРЕДСТВ
Начат_________________20__г.
Окончен_______________20__г.
ООО «Витамин»
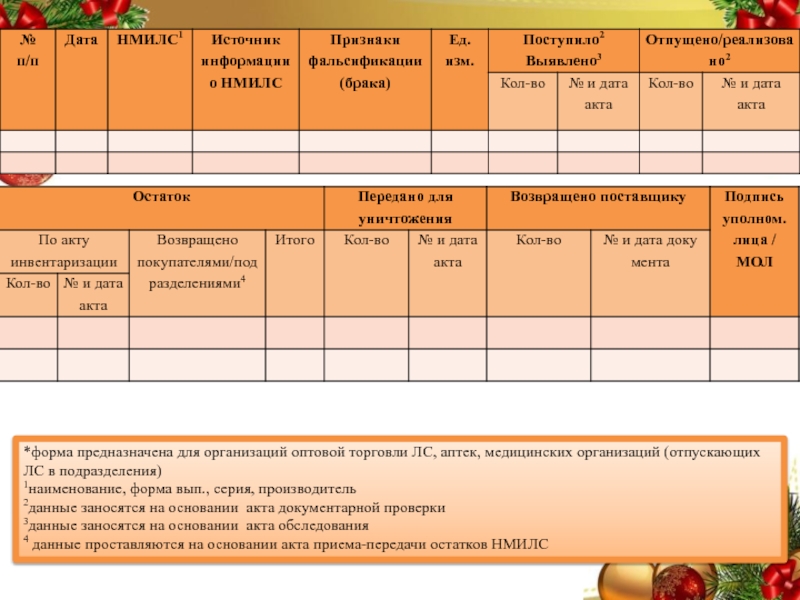
Слайд 69*форма предназначена для организаций оптовой торговли ЛС, аптек, медицинских организаций
(отпускающих ЛС в подразделения)
1наименование, форма вып., серия, производитель
2данные заносятся
на основании акта документарной проверки
3данные заносятся на основании акта обследования
4 данные проставляются на основании акта приема-передачи остатков НМИЛС
Слайд 70Приложение №8
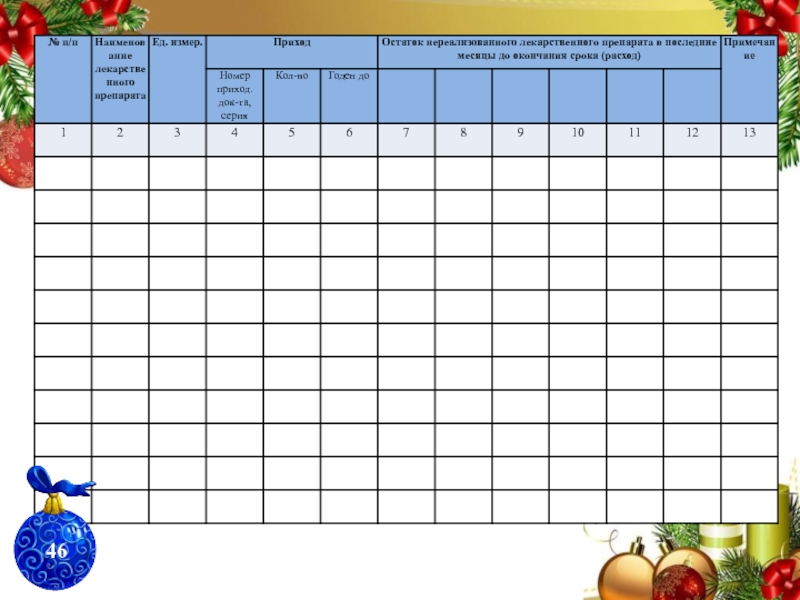
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ__________________________________________
СТРУКТУРНОЕ ПОДРАЗДЕЛЕНИЕ___________________________________________
ЖУРНАЛ
УЧЕТА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
С ОГРАНИЧЕННЫМ СРОКОМ ГОДНОСТИ
Начат_________________20__г.
Окончен_______________20__г.
ООО
«Витамин»