Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ГЗ Луганский государственный медицинский университет Кафедра медицинской
Содержание
- 1. ГЗ Луганский государственный медицинский университет Кафедра медицинской
- 2. ВВЕДЕНИЕ В БИОХИМИЮ ПОЛОСТИ РТА Полость рта занимает
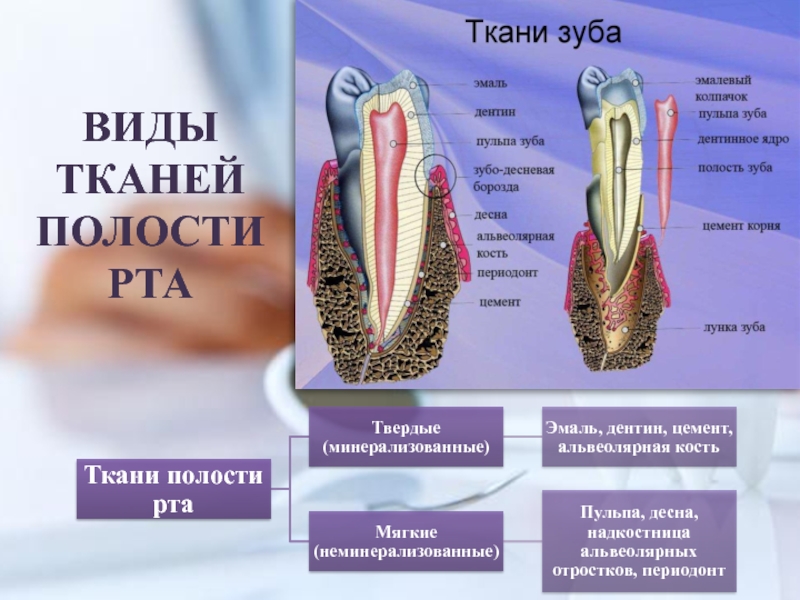
- 3. ВИДЫ ТКАНЕЙ ПОЛОСТИ РТА
- 4. МЕЖКЛЕТОЧНЫЙ МАТРИКСЭто комплекс органических и неорганических компонентов,
- 5. ОСНОВНЫЕ КОМПОНЕНТЫ МЕЖКЛЕТОЧНОГО МАТРИКСА
- 6. Является наиболее распространённым белком млекопитающих, основной структурный
- 7. ТИПЫ КОЛЛАГЕНОВ
- 8. Структурной единицей коллагенового волокна является молекула тропоколлагена.
- 9. ЭТАПЫ СИНТЕЗА И СОЗРЕВАНИЯ КОЛЛАГЕНА Синтез и созревание
- 10. 1. Синтез полипептидных цепей коллагенаПолипептидные цепи коллагена
- 11. Гидроксилирование пролина необходимо для стабилизации тройной спирали
- 12. 5. Образование тропоколлагенаВ межклеточном матриксе концевые N-и
- 13. СХЕМА СИНТЕЗА КОЛЛАГЕНА
- 14. КАТАБОЛИЗМ КОЛЛАГЕНА Со временем коллаген разрушается, хотя
- 15. РЕГУЛЯЦИЯ ОБМЕНА КОЛЛАГЕНА Синтез коллагена регулируется разными
- 16. НАРУШЕНИЯ ОБМЕНА КОЛЛАГЕНАЛюбые нарушения синтеза коллагена в
- 17. НЕКОЛЛАГЕНОВЫЕ БЕЛКИ ЭЛАСТИН Эластин –
- 18. Синтез эластина начинается в фибробластах с образованием
- 19. НАРУШЕНИЯ СТРУКТУРЫ ЭЛАСТИНА При снижении или отсутствии
- 20. ГЛИКОЗАМИНОГЛИКАНЫ И ПРОТЕОГЛИКАНЫ Это обусловлено тем, что
- 21. ФУНКЦИИ ПРОТЕОГЛИКАНОВ И ГЛИКОЗАМИНОГЛИКАНОВЯвляются структурными компонентами межклеточного
- 22. СТРУКТУРА РАЗЛИЧНЫХ КЛАССОВ ГЛИКОЗАМИНОГЛИКАНОВГАГ представляют собой длинные
- 23. ОСОБЕННОСТИ ОБМЕНА ГАГСинтез гликозаминогликановПолисахаридные цепи ГАГ связаны
- 24. СТРОЕНИЕ И ВИДЫ ПРОТЕОГЛИКАНОВ Это основной протеогликан
- 25. ФИБРОНЕКТИН Фибронектин – это гликопротеин экстрацеллюлярного матрикса,
- 26. ЛАМИНИНЛаминин – это гликопротеин, наиболее распространенный в
- 27. Спасибо за внимание!
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ГЗ «Луганский государственный медицинский университет» Кафедра медицинской химии ВВЕДЕНИЕ В БИОХИМИЮ ЗУБОВ.
Слайд 2ВВЕДЕНИЕ В БИОХИМИЮ ПОЛОСТИ РТА
Полость рта занимает сравнительно небольшой объем
в организме. Это начальный отдел пищеварительного тракта, состоящий из различных
видов тканей. Костная ткань зубных лунок, прилегающие участки десны и периодонт, связанные с тканями зуба, составляют пародонт. В ротовую полость открываются протоки слюнных желез.Гомеостаз полости рта во многом определяется структурно-функциональным состоянием тканей и микроорганизмов ротовой полости.
Фундаментальные и прикладные исследования последнего десятилетия в области стоматологии расширили представления о биохимических аспектах твердых тканей зуба, слюны, десневой жидкости, метаболических особенностях жизнедеятельности микроорганизмов и ксенобиотиков в норме и патологии.
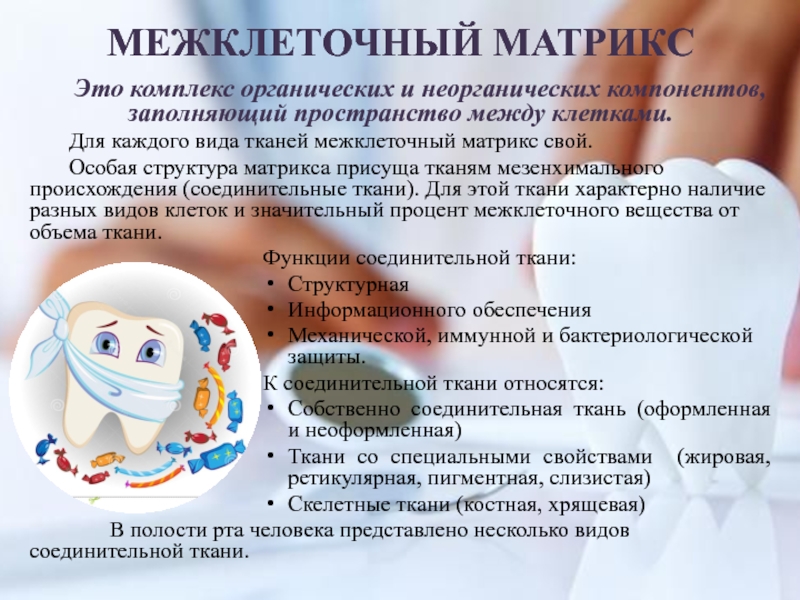
Слайд 4МЕЖКЛЕТОЧНЫЙ МАТРИКС
Это комплекс органических и неорганических компонентов, заполняющий пространство между
клетками.
Для каждого вида тканей межклеточный матрикс свой.
Особая структура матрикса
присуща тканям мезенхимального происхождения (соединительные ткани). Для этой ткани характерно наличие разных видов клеток и значительный процент межклеточного вещества от объема ткани. Функции соединительной ткани:
Структурная
Информационного обеспечения
Механической, иммунной и бактериологической защиты.
К соединительной ткани относятся:
Собственно соединительная ткань (оформленная и неоформленная)
Ткани со специальными свойствами (жировая, ретикулярная, пигментная, слизистая)
Скелетные ткани (костная, хрящевая)
В полости рта человека представлено несколько видов соединительной ткани.
Слайд 6Является наиболее распространённым белком млекопитающих, основной структурный белок межклеточного матрикса.
Составляет 25 – 33% общего количества белка в организме (6%
массы тела), образует основу сухожилий, костей, кожи, зубов и хрящей.Всего выделяют 20 типов коллагена. Однако в полости рта распространены следующие:
КОЛЛАГЕН
Все типы коллагенов в зависимости от структуры делятся на:
Фибриллообразующие
Ассоциированные с фибриллами коллагена
Нефибриллярные (сетевидные)
Микрофибриллы
Заякоренные фибриллы.
Основная масса коллагенов полости рта относится к фибриллообразующим.
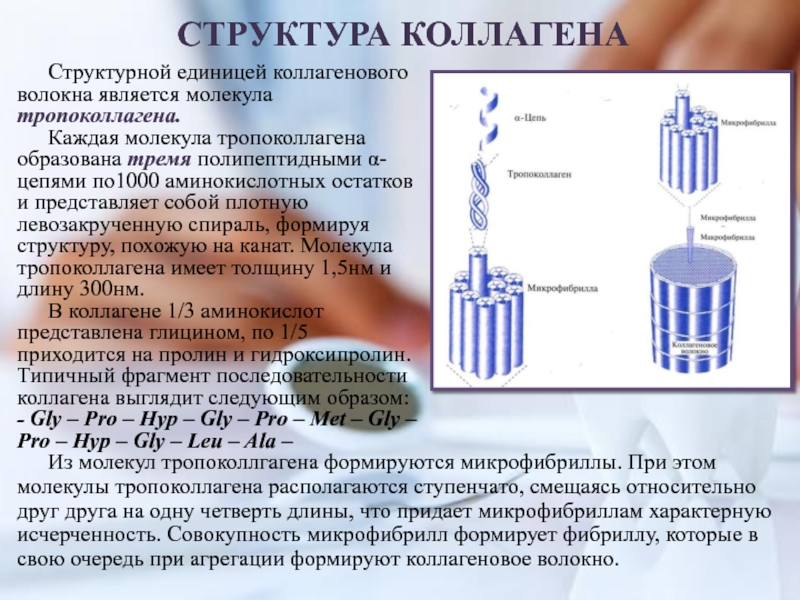
Слайд 8Структурной единицей коллагенового
волокна является молекула тропоколлагена.
Каждая молекула тропоколлагена
образована тремя полипептидными α-цепями по1000 аминокислотных остатков и представляет собой
плотную левозакрученную спираль, формируя структуру, похожую на канат. Молекула тропоколлагена имеет толщину 1,5нм и длину 300нм.В коллагене 1/3 аминокислот представлена глицином, по 1/5 приходится на пролин и гидроксипролин. Типичный фрагмент последовательности коллагена выглядит следующим образом:
- Gly – Pro – Hyp – Gly – Pro – Met – Gly – Pro – Hyp – Gly – Leu – Ala –
СТРУКТУРА КОЛЛАГЕНА
Из молекул тропоколлгагена формируются микрофибриллы. При этом молекулы тропоколлагена располагаются ступенчато, смещаясь относительно друг друга на одну четверть длины, что придает микрофибриллам характерную исчерченность. Совокупность микрофибрилл формирует фибриллу, которые в свою очередь при агрегации формируют коллагеновое волокно.
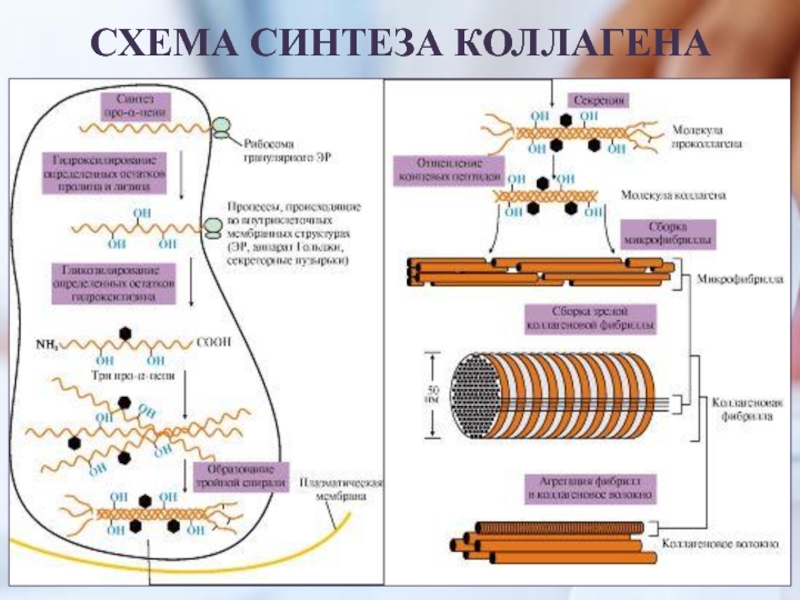
Слайд 9ЭТАПЫ СИНТЕЗА И СОЗРЕВАНИЯ КОЛЛАГЕНА
Синтез и созревание коллагена – сложный
многоэтапный процесс,
начинающийся в клетке, а завершающийся в межклеточном
матриксе.
Синтез и созревание коллагена включают в себя целый
ряд этапов и посттрансляционных изменений:
Синтез полипептидных цепей (внутриклеточный этап)
Гидроксилирование пролина и лизина с образованием гидроксипролина (Hyp) и гидроксилизина (Hyl);
Гликозилирование гидроксилизина;
Частичный протеолиз – отщепление «сигнального» пептида, а
также N- и С-концевых пропептидов;
5. Образование тройной спирали
тропоколлагена.
Слайд 101. Синтез полипептидных цепей коллагена
Полипептидные цепи коллагена синтезируются на рибосомах
гранулированного ЭПС в виде предшественников – препро-α-цепей. У этих цепей
на N-конце имеется «сигнальный» пептид из 100 аминокислот. Функция сигнального пептида – поступление пептидных цепей в полость ЭПР, после чего он сразу отщепляется.2. Гидроксилирование пролина и лизина
Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается.
Гидроксилирования осуществляется ферментами оксигеназами: пролина – пролил-4-гидроксилазы, лизина – лизил-5-гидроксилазы.
Необходимыми компонентами этой реакции являются α-кетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2 , второй атом О2 при этом включается в сукцинат, образовавшийся при декарбоксилировании
α-кетоглутарата, а из карбоксильной группы α-кетоглутарата образуется СО2. Витамин С нужен для поддержания железа в составе гидроксилаз пролина и лизина в форме Fe 2+.
Слайд 11Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена. ОН-группы гидроксипролина
(Hyp) участвуют в образовании водородных связей. А гидроксилирование лизина важно
для последующего образованияковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
3. Гликозилирование гидроксилизина
После гидроксилирования в молекулу проколлагена вводятся углеводные группы (чаще всего галактоза или галактозилглюкоза). Это происходит под действием ферментов гликозилтрансфераз. Гликозилирование начинается в коллагене ещё до начала спирализации, а завершается после образования тройной спирали.
4. Образование проколлагена и его секреция в межклеточное пространство
После гидроксилирования и гликозилирования каждая про-α-цепь соединяется водородными связями с двумя другими про-α-цепями, образуя тройную спираль проколлагена. Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
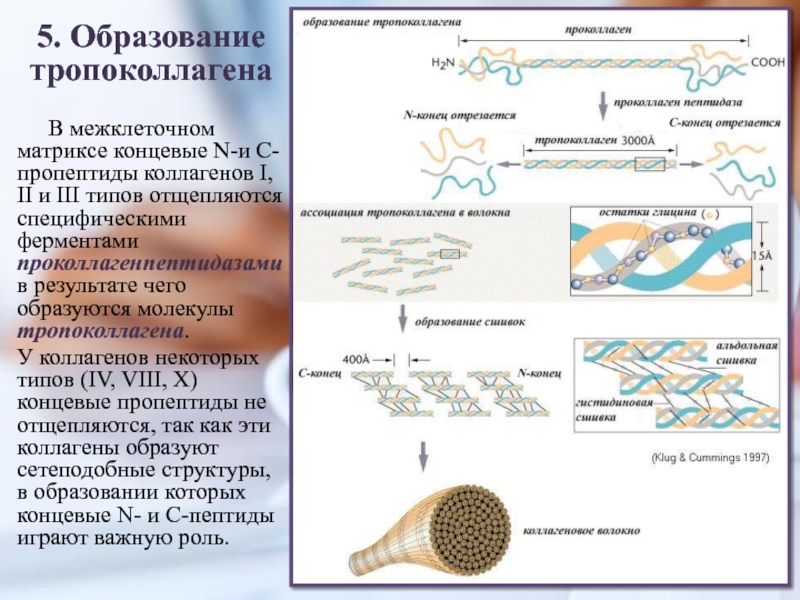
Слайд 125. Образование тропоколлагена
В межклеточном матриксе концевые N-и С-пропептиды коллагенов I,
II и III типов отщепляются специфическими ферментами проколлагенпептидазамив результате чего
образуются молекулы тропоколлагена.У коллагенов некоторых типов (IV, VIII, X) концевые пропептиды не отщепляются, так как эти коллагены образуют сетеподобные структуры, в образовании которых концевые N- и С-пептиды играют важную роль.
Слайд 14КАТАБОЛИЗМ КОЛЛАГЕНА
Со временем коллаген разрушается, хотя его относят к медленно
обменивающимся белкам (период полураспада составляет недели или месяцы).
Разрушение коллагеновых волокон
осуществляется как активными формами кислорода, так и ферментативно.Главный фермент его распада – коллагеназа. Она перерезает тройную спираль коллагена на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина).
Она синтезируется клетками соединительной ткани, прежде всего, фибробластами и макрофагами. Является металлозависимым ферментом (в активном центре содержит Zn2+).
Плазмин, калликреин и катепсин В повышают активность коллагеназы.
Образующиеся фрагменты коллагена растворимы в воде, далее они спонтанно денатурируются, становятся доступными для действия других протеолитическж ферментов (пептидгидролаз).
Слайд 15РЕГУЛЯЦИЯ ОБМЕНА КОЛЛАГЕНА
Синтез коллагена регулируется разными способами.
По принципу отрицательной
обратной связи сам коллаген и N-npo-пептиды после своего отщепления тормозят
его дальнейшее образование.Аскорбиновая кислота стимулирует синтез коллагена и протеогликанов, а также деление фибробластов.
Гормональная регуляция:
Глюкокортикоиды тормозят синтез коллагена за счет снижения уровня мРНК проколлагена и ингибирования гидроксилаз. Недостаточное гидроксилирование остатков пролина и лизина повышает чувствительность коллагена к действию коллагеназы и неспецифических протеаз. Это проявляется уменьшением толщины дермы, а также атрофией кожи в местах продолжительного парентерального введения этих гормонов.
Половые гормоны. Синтез коллагена кожи усиливается под действием эстрогенов. Поэтому у женщин в менопаузе снижается содержание коллагена в дерме.
Слайд 16НАРУШЕНИЯ ОБМЕНА КОЛЛАГЕНА
Любые нарушения синтеза коллагена в первую очередь проявляется
изменением со стороны зубочелюстной системы в виде кровоточивости десен, подвижности
и выпадения зубов, множественного кариеса.Подобные явления наблюдаются при врожденном дефиците фермента лизилгидроксилазы (синдром Элерса-Данло-Русакова, тип 4).
Высокая растворимость молекул коллагена отмечается при врожденном дефекте лизилоксидазы (синдром Элерса-Данло, тип 5).
При нарушении обмена меди (синдром Менкеса) неправильно образуются поперечные сшивки между микрофибриллами коллагена, что приводит к ухудшению механических свойств связок периодонта, состояния тканей периодонта, вялости кожных покровов, дефектам скелета.
При сахарном диабете нарушаются процессы гликозилирования проколлагеновых α-цепей. Развивается тяжелая форма пародонтита, плохо поддающаяся лечению. У детей, рожденных от матерей с инсулинзависимым СД выявляется системная гипоплазия твердых тканей зуба.
При появлении антител к белкам базальной мембраны (синдром Гудпасчера) или при мутациях гена, кодирующего α-цепи коллагена IV типа (синдром Альпорта) нарушаются структуры базальной мембраны. Наряду с поражениями почек и других внутренних органов у пациентов наблюдаются некариозные поражения твердых тканей зуба (гипоплазия эмали, уменьшение объема и нарушения структуры дентина) и дистрофические изменения мягких тканей полости рта.
При снижении активности ферментов, отщепляющих N- и C-концевые пептиды в проколлагене (синдром Элерса-Данло-Русакова, тип 7) нарушается образование тропоколлагена и нормальных коллагеновых фибрилл.
Для исследования обмена коллагена в моче и плазме крови определяют концентрацию гидроксипролина, пролина, количества продуктов деградации коллагена I типа – N- и С-телопептида. О нарушении созревания коллагена свидетельствует рост количества пролина в плазме крови.
Слайд 17НЕКОЛЛАГЕНОВЫЕ БЕЛКИ
ЭЛАСТИН
Эластин – уникальный белок, главным свойством которого является
возможность растягиваться в несколько раз по сравнению с исходной длиной,
сохраняя при этом свою прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки.В его составе содержится около 27% глицина, 19% аланина, 10% валина, 17% лейцина. Наличие большого количества гидрофобных радикалов препятствует образованию стабильной вторичной и третичной структуры, за счет чего в матриксе молекулы эластина принимают различную конформацию.
Волокна эластина построены из небольших шарообразных молекул, соединенных в волокнистые тяжи за счет множественных поперечных сшивок. В образовании этих сшивок участвуют остатки лизина двух, трёх или четырёх пептидных цепей. Структуры, образующиеся при этом, называются десмозинами (десмозин или изодесмозин).
Слайд 18Синтез эластина начинается в фибробластах с образованием предшественника тропоэластина. В
межклеточной жидкости тропоэластин окисляется ферментом лизилоксигедазой с образованием десмозина, который
формирует поперечные сшивки. После этого эластин приобретает свою конечную внеклеточную водонерастворимую форму, которая характеризуется высокой стабильностью и очень низкой скоростью обмена.Расщепление эластина осуществляется ферментом эластазой, которая активна в слабощелочной среде (рН 7,5). Она расщепляет также протеогликаны, гемоглобин, коллаген, иммуноглобулины.
Ингибитором эластазы является белок α-антитрипсин.
ЭЛАСТИН
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности.
Слайд 19НАРУШЕНИЯ СТРУКТУРЫ ЭЛАСТИНА
При снижении или отсутствии образования десмозинов поперечные сшивки
образуются в недостаточном количестве или не образуются вообще. Это приводит
к снижению предела прочности тканей на разрыв и появлению таких нарушений, как истончённость, вялость, растяжимость. Клинически это может проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой лёгких.Причины нарушений структуры эластина:
снижение активности лизилоксидазы, вызванное дефицитом меди или пиридоксина;
дефицит лизилоксидазы при наследственных заболеваниях;
синдром Менкеса – нарушение всасывания меди.
В тканях десны эластаза не активна. При развитии воспалительного процесса увеличивается количество полиморфноядерных лейкоцитов, которые становятся источником эластазы. Увеличение количества фермента отмечается на фоне снижения уровня α-антитрипсина. Это приводит к деструкции эластичных волокон при гингивите и пародонтите.
Слайд 20ГЛИКОЗАМИНОГЛИКАНЫ И ПРОТЕОГЛИКАНЫ
Это обусловлено тем, что гликозаминогликаны (ГАГ) могут связывать
большие количества воды, в результате чего межклеточное вещество приобретает желеобразный
характер.Гликозаминогликаны (мукополисахариды) - линейные отрицательно заряженные гетерополисахариды, которые обнаруживаются в слизистых секретах (мукозах) и придают этим секретам вязкие, смазочные свойства.
Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани. Белки в протеогликанах (ПГ) представлены одной полипептидной цепью разной молекулярной массы. Боковые цепи ГАГ состоят из повторяющихся сульфатированных дисахаридных субъединиц: хондроитина, дерматана, кератана или гепарана. Полисахаридные компоненты у разных протеогликанов разные.
Протеогликаны – высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%).
Слайд 21ФУНКЦИИ ПРОТЕОГЛИКАНОВ И ГЛИКОЗАМИНОГЛИКАНОВ
Являются структурными компонентами межклеточного матрикса;
Специфически взаимодействуют с
коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
Все ПГ
и ГАГ, могут присоединять воду, а также большое количество катионов (Na+ , K+ , Са2+ ) и таким образом формировать тургор различных тканей;ПГ и ГАГ играют роль молекулярного сита в межклеточном матриксе и они препятствуют распространению патогенных микроорганизмов;
Гиалуроновая кислота и ПГ выполняют рессорную функцию в суставных хрящах;
Гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
Кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
Гепарин является естественным антикоагулянтом;
Гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических пузырьков.
Слайд 22СТРУКТУРА РАЗЛИЧНЫХ КЛАССОВ ГЛИКОЗАМИНОГЛИКАНОВ
ГАГ представляют собой длинные неразветвлённые цепи гетерополисахаридов,
построенные из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является
гексуроновая кислота, вторым мономером – производное аминосахара (глюкозамина или галактозамина). Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата.В настоящее время известна структура шести основных классов ГАГ.
Слайд 23ОСОБЕННОСТИ ОБМЕНА ГАГ
Синтез гликозаминогликанов
Полисахаридные цепи ГАГ связаны ковалентными связями с
белком, который называется коровым (сердцевинным). Полисахаридные цепи ГАГ синтезируются путём
последовательного присоединения моносахаридов, донорами которых лужат соответствующие нуклеотид-сахара. Реакции синтеза ГАГ катализируют ферменты семейства трансфераз. Аминосахара синтезируются из глюкозы. Глюкокортикоиды и половые гормоны тормозят синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов в органах-мишенях.Распад гликозаминогликанов
Из внеклеточного пространства гликозаминогликаны поступают в клетку по механизму эндоцитоза и заключаются в эндоцитозные пузырьки, которые затем сливаются с лизосомами. Разрушение полисахаридных цепей в ГАГ осуществляется экзо- и эндогликозидазами и сульфатазами, к которым относят гиалуронидазу, глюкуронидазу, галактозидазу, идуронидазу и др.
Нарушения обмена гликозаминогликанов
Мукополисахаридозы – наследственные тяжёлые заболевания, характеризующиеся избыточным накоплением ГАГ в тканях, проявляющиеся значительными нарушениями в умственном развитии детей, поражениями сосудов, помутнением роговицы, деформациями скелета, увеличению органов, содержащих большие количества внеклеточного матрикса, уменьшением продолжительности жизни. В основе мукополисахаридозов лежат наследственные дефекты синтеза гидролаз, участвующих в разрушении гликозаминогликанов.
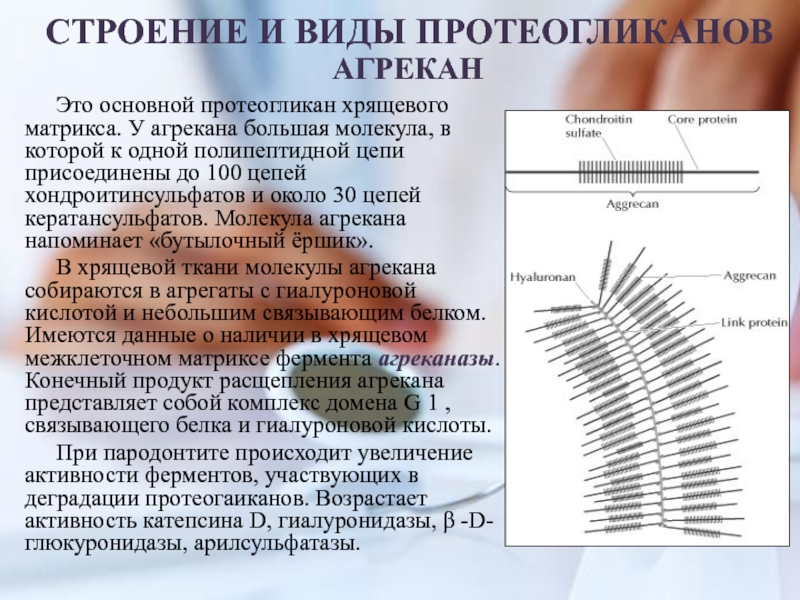
Слайд 24СТРОЕНИЕ И ВИДЫ ПРОТЕОГЛИКАНОВ
Это основной протеогликан хрящевого матрикса. У агрекана
большая молекула, в которой к одной полипептидной цепи присоединены до
100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. Молекула агрекана напоминает «бутылочный ёршик».В хрящевой ткани молекулы агрекана собираются в агрегаты с гиалуроновой кислотой и небольшим связывающим белком. Имеются данные о наличии в хрящевом межклеточном матриксе фермента агреканазы. Конечный продукт расщепления агрекана представляет собой комплекс домена G 1 , связывающего белка и гиалуроновой кислоты.
При пародонтите происходит увеличение активности ферментов, участвующих в деградации протеогаиканов. Возрастает активность катепсина D, гиалуронидазы, β -D-глюкуронидазы, арилсульфатазы.
АГРЕКАН
Слайд 25ФИБРОНЕКТИН
Фибронектин – это гликопротеин экстрацеллюлярного матрикса, который синтезируется большинством клеток
соединительной ткани.
Состоит из двух сходных субъединиц, каждая из которых содержит
по девять различных функциональных областей, в том числе два фибронектин-связывающих сайта, два гепарин-связывающих сайта и по одному связывающему сайту для желатина, коллагена, ДНК и клеточных поверхностей. Рецептор фибронектина – интегрин, встроен в клеточную мембрану. Внутри клетки интегрин взаимодействует с актиновыми филаментами цитоскелета, а снаружи соединяется с фибронектином. В свою очередь фибронектин образует связи с коллагеном и ГАГ(гепарансульфат). Таким образом, фибронектин участвует в интеграции межклеточного матрикса и в адгезии клеток соединительной ткани. Фибронектин участвует в адгезии клеток, контролирует их морфологию и архитектуру поверхности, а также формирует фибриллы внеклеточного матрикса. При заживлении ран фибронектин образует пути для миграции клеток.
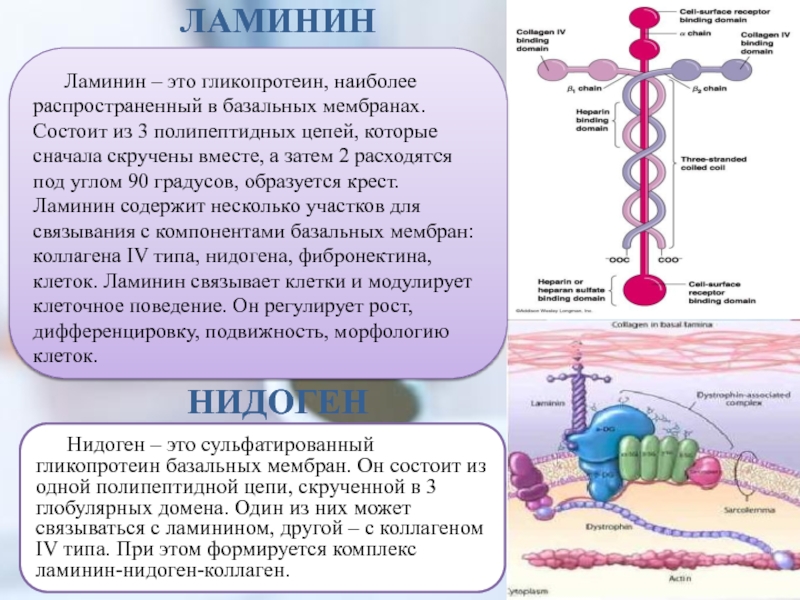
Слайд 26ЛАМИНИН
Ламинин – это гликопротеин, наиболее распространенный в базальных мембранах. Состоит
из 3 полипептидных цепей, которые сначала скручены вместе, а затем
2 расходятся под углом 90 градусов, образуется крест. Ламинин содержит несколько участков для связывания с компонентами базальных мембран: коллагена IV типа, нидогена, фибронектина, клеток. Ламинин связывает клетки и модулирует клеточное поведение. Он регулирует рост, дифференцировку, подвижность, морфологию клеток.Нидоген – это сульфатированный гликопротеин базальных мембран. Он состоит из одной полипептидной цепи, скрученной в 3 глобулярных домена. Один из них может связываться с ламинином, другой – с коллагеном IV типа. При этом формируется комплекс ламинин-нидоген-коллаген.
НИДОГЕН