Слайд 2вопросы
1.Введение. Научная картина мира
2.Предмет познания и важнейшие особенности химический науки
2.1. Алхимия как предыстория химии. Эволюция
химической науки
2.2.Специфика химии как науки
2.3. Важнейшие особенности современной химии
3. Концептуальные системы химии
3. 1. Понятие о химическом элементе
3. 2. Современная картина химических знаний
3. 2. 1. Учение о составе вещества
3. 2. 2. Органогены
3. 2. 3. Учение о химических процессах
4. Антропогенный химизм и его влияние на среду обитания
5. Выводы
Слайд 3
Введение. Научная картина мира
Каждый человек пытается познать этот мир
и осознать свое место в нем. Чтобы познать мир, человек
из частных знаний о явлениях и закономерностях природы пробует создать общее – научная картина мира
-основные идеи наук о природе
-принципы
-закономерности
не оторванные друг от друга, а составляющие единство знаний о природе, определяющие стиль научного мышления на данном этапе развития науки и культуры человечества
Слайд 4
Ученые выделяют разные картины мира и предлагают свои критерии классификации
«Мир»
- действительность, реальность (объективная), бытие, природа и человек
Ученые подразделяют картины
мира
на научную, философскую, концептуальную, наивную и художественную
В наше время в состав общей НКМ
входят ее части различной степени универсальности:
Физическая КМ (ФКМ)
Астрономическая (АКМ)
Биологическая (БКМ)
Химическая (ХКМ)
Слайд 5Научная картина мира - особая форма теоретического знания, репрезентирующая предмет
исследования науки соответственно определенному этапу ее исторического развития, посредством которой
интегрируются и систематизируются конкретные знания, полученные в различных областях научного поиска. (Новейший философский словарь)
Научная картина мира (НКМ) — система представлений о свойствах и закономерностях действительности (реально существующего мира), построенная в результате обобщения и синтеза научных понятий и принципов, а также методология получения научного знания»(интернет-словарь «Википедия»)
Научная картина мира - это множество теорий в совокупности описывающих известный человеку природный мир, целостная система представлений об общих принципах и законах устройства мироздания
Слайд 6
Исторические типы
Их принято персонифицировать по именам трех ученых сыгравших наибольшую
роль в происходивших изменениях
1. Аристотелевская (VI-IV века до нашей
эры) в результате этой научной революции возникла сама наука, произошло отделение науки от других форм познания и освоения мира, созданы определенные нормы и образцы научного знания. Наиболее полно эта революция отражена в трудах Аристотеля. Он утвердил своеобразный канон организации научного исследования (история вопроса, постановка проблемы, аргументы за и против, обоснование
решения), дифференцировал само знание, отделив науки о
природе от математики и метафизики
Слайд 72. Ньютоновская научная революция (XVI-XVIII века)
Ее исходным пунктом считается переход
от геоцентрической
модели мира к гелиоцентрической, этот переход был
обусловлен
серией открытий, связанных с именами
Н. Коперника, Г. Галилея, И. Кеплера, Р. Декарта, И. Ньютон сформулировал базовые принципы новой научной картины
мира в общем виде
3. Эйнштейновская революция (рубеж XIX-XX веков)
Ее обусловила серия открытий (открытие сложной
структуры атома, явление радиоактивности, дискретного
характера электромагнитного излучения и т.д.). В итоге
была подорвана, важнейшая предпосылка механистической
картины мира – убежденность в том, что с помощью
простых сил действующих между неизменными объектами
можно объяснить все явления природы
Слайд 8Химия — раздел естествознания, исследующий свойства вещества и их превращения
Основной
проблемой химии является получение веществ с заданными свойствами
химия
неорганическая
органическая
исследует свойства химических
элементов и их простых соединений: щелочи, кислоты, соли
изучает сложные соединения на основе углерода - полимеры, в том числе, созданные человеком: газы, спирты, жиры, сахара
Слайд 9Основные периоды развития химии
1. Период алхимии - с древности до
XVI в. нашей эры
Характеризуется поисками философского камня, эликсира долголетия, алкагеста
(универсального растворителя)
2. Период в течение XVI - XVIII веков
Созданы теории Парацельса, теории газов Бойля, Кавендиша и др., теория флогистона Г. Шталя и теория химических элементов Лавуазье.
Совершенствовалась прикладная химия, связанная с развитием металлургии, производства стекла и фарфора, искусства перегонки жидкостей и т.д. К концу XVIII века произошло упрочение химии как науки, независимой от других естественных наук
Слайд 103. Первые шестьдесят лет XIX века
Характеризуется возникновением и развитием атомной
теории Дальтона, атомно-молекулярной теории Авогадро и формированием основных понятий химии:
атом, молекула и др
4. С 60-х годов XIX века до наших дней
Разработаны периодическая классификация элементов, теория ароматических соединений и стереохимия, электронная теория материи и т.д
Расширился диапазон составных частей химии, как неорганическая химия, органическая химия, физическая химия, фармацевтическая химия, химия пищевых продуктов, агрохимия, геохимия, биохимия и т.д
Слайд 11АЛХИМИЯ
«Алхимия» — это арабизированное греческое слово, которое понимается как
«сок растений»
3 типа:
греко-египетская
арабская
западно-европейская
Слайд 12Родина алхимии - Египет
Философская теория Эмпедокла о четырех элементах Земли
(вода, воздух, земля, огонь) Согласно ей различные вещества на Земле
различаются только по характеру сочетания этих элементов. Эти четыре элемента могут смешиваться в однородные вещества
Важнейшей проблемой алхимии считался поиск философского камня
Улучшили процесс очистки золота путем купеляции (нагревая богатую золотом руду со свинцом и селитрой)
Выделение серебра путем сплавления руды со свинцом
Получила развитие металлургия обыкновенных металлов
Известен процесс получения ртути
Слайд 13АРАБСКАЯ АЛХИМИЯ
Центром арабской алхимии стал Багдад.
Персидский алхимик Джабир ибн
Хайям описал
нашатырный спирт
технологию приготовления свинцовых белил
способ перегонки уксуса
для получения уксусной кислоты
развил учение о нумерологии, связав арабские буквы с названиями веществ.
Он предположил, что внутреннюю сущность каждого металла всегда раскрывают два из шести свойств.
Например, свинец — холодный и сухой, золото — теплое и влажное. Горючесть он ассоциировал с серой, а «металличность» с ртутью, «идеальным металлом».
Согласно учению Джабира, сухие испарения, конденсируясь в земле, дают серу, мокрые — ртуть. Сера и ртуть, соединясь затем в различных отношениях, и образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото.
Таким образом, он заложил основы ртутно-серной теории. .
Слайд 14ЗАПАДНОЕВРОПЕЙСКАЯ АЛХИМИЯ
Монах-доминиканец Альберт фон Больштедт (1193-1280) – Альберт Великий
детально описал свойства мышьяка, высказывал мнение о том, что металлы
состоят из ртути, серы, мышьяка и нашатыря.
Британский философ ХII в. – Роджер Бэкон (около 1214 - после 1294). возможный изобретатель пороха; писал о потухании веществ без доступа воздуха, писал о способности селитры взрываться с горящим углем.
испанский врач Арнальдо де Виллановы (1240-1313) и Раймунд Луллия (1235-1313). попытки получить философский камень и золото (неудачно), изготовили бикарбонат калия.
итальянский алхимик кардинал Джованни Фиданца
(1121-1274) – Бонавентура получил раствор нашатыря в азотной кислоте.
самый видный из алхимиков был испанцем, жил в XIV веке - Гебера описал серную кислоту и как образуется азотная кислота, отметил свойство царской водки воздействовать на золото, считавшееся до тех пор неподдающимся изменению
Слайд 15ЗАПАДНОЕВРОПЕЙСКАЯ АЛХИМИЯ
Василий Валентин (XIV в.)
открыл серный эфир, соляную кислоту, многие
соединения мышьяка и сурьмы, описал способы получения сурьмы и ее
медицинское применение
Теофраст фон Гогенгейм (Парацельс) (1493-1541)
основатель ятрохимии – медицинской химии,
достиг некоторого успеха в борьбе с сифилисом,
одним из первых разрабатывал лекарственные средства для борьбы с умственными расстройствами, ему приписывают
открытие эфира.
Слайд 16
Специфика химии как науки
«Химия - наука, изучающая свойства и превращения
веществ, сопровождающиеся изменением их состава и строения».
Изучает
природу и
свойства различных химических связей, энергетику химических реакций, реакционную способность веществ, свойства катализаторов.
основанием химии выступает двуединая проблема - получение веществ с заданными свойствами (на достижение ее направлена производственная деятельность человека) и выявление способов управления свойствами вещества (на реализацию этой задачи направлена научно-исследовательская работа ученых). Эта же проблема является одновременно и системообразующим началом химии.
Слайд 17Важнейшие особенности современной химии
1.В химии появляются многочисленные самостоятельные научные дисциплины
(химическая термодинамика, химическая кинетика, электрохимия, термохимия, радиационная химия, фотохимия, плазмохимия,
лазерная химия).
2. Химия активно интегрируется с остальными науками, результатом чего было появление
биохимии (изучают химические процессы в живых организмах), молекулярной биологии,
космохимии (изучает химический состав вещества во Вселенной, его распространенность и распределение по отдельным космическим телам),
геохимии (закономерности поведения химических элементов в земной коре),
биогеохимии (изучает процессы перемещения, распределения, рассеяния и концентрации химических элементов в биосфере при участии организмов. Основоположником биогеохимии является В. И. Вернадский).
Слайд 183. В химии появляются принципиально новые методы исследования (рентгеновский структурный
анализ, масс-спектроскопия, радиоспектроскопия и др.)
Химия способствовала интенсивному развитию некоторых направлений
человеческой деятельности.
Например, хирургии химия дала три главных средства, благодаря которым современные операции стали безболезненными и вообще возможными:
1) введение в практику эфирного наркоза, а затем и других наркотических веществ;
2)использование антисептических средств для предупреждения инфекции;
3)получение новых, не имеющихся в природе аллопластических материалов-полимеров.
Слайд 19В химии большинство химических соединений (96%) - это органические соединения.
В их основе лежат 18 элементов (наибольшее распространение имеют всего
6 из них).
Химические связи этих элементов прочны (энергоемки) и лабильны.
Углерод как никакой другой элемент отвечает этим требованиям. Он совмещает в себе химические противоположности, реализуя их единство.
В развитии химии происходит строго закономерное, последовательное появление концептуальных систем. При этом вновь появляющаяся система опирается на предыдущую и включает ее в себя в преобразованном виде.
Таким образом, система химии - единая целостность всех химических знаний, которые появляются и существуют не отдельно друг от друга, а в тесной взаимосвязи, дополняют друг друга и объединяются в концептуальные системы знаний, которые находятся между собой в отношениях иерархии.
Слайд 20Концептуальные системы химии
Понятие о химическом элементе
Р. Бойль положил начало современному
представлению о химическом элементе как о простом теле, переходящем без
изменения из состава одного сложного тела в другое.
Основоположником системного освоения химических знаний явился Д. И. Менделеев. В 1869 г. открыл периодический закон и разработал Периодическую систему химических элементов, в которой основной характеристикой элементов являются атомные веса.
В современном представлении периодический закон выглядит следующим образом:
«Свойства простых веществ, а также формы и
свойства соединений элементов находятся в
периодической зависимости от величины заряда
ядра атома (порядкового номера)»
Слайд 21Расположение химических элементов в порядке возрастания атомной массы привело к
выявлению периодической зависимости: химические свойства повторяются через каждые семь элементов
на восьмой.
По химическим свойствам выделились 4 группы:
- металлы: К, Мg, Na, Fe – очень активны, легко соединяются с другими веществами, образуя соли, щелочи;
- неметаллы: S, Se, Si, Cl – значительно менее активны; в соединениях образуют кислоты;
- газы: C, O, H, N – в молекулярном состоянии неактивны, в атомарном – высоко активны;
- инертные газы: Ne, Ar, Cr – не вступают в химические соединения с другими веществами.
Слайд 22В связи с открытиями в ядерной физике, стало известно, что
валентность отражает количество электронов на последней орбитали, а также химическую
активность элементов:
чем меньше электронов на последней орбитали, - тем более они активны: щелочные и щелочно-земельные металлы – это 1-2 электрона, которые слабо удерживаются ядром и легко теряются атомом.
Чем больше электронов на последней орбите, тем пассивнее химический элемент: например, медь, серебро, золото - среди металлов.
Неметаллам с нарастающей валентностью свойственно захватывать электроны других элементов.
У инертных газов валентность равна 8, и они не вступают в химические реакции. Поэтому их еще называют «благородными».
Слайд 23Современная картина химических знаний
Важнейшей особенностью основной проблемы химии является то,
что она имеет всего четыре способа решения вопроса. Свойства вещества
зависят от четырех факторов:
1) от элементного и молекулярного состава вещества;
2) от структуры молекул вещества;
3) от термодинамических и кинетических условий, в которых вещество находится в процессе химической реакции;
4) от уровня химической организации вещества.
Современную картину химических знаний объясняют с позиций четырех концептуальных систем. На рисунке показано последовательное появление новых концепций в химической науке, которые опирались на предыдущие достижения.
Слайд 24Химическим элементом называют все атомы, имеющие одинаковый заряд ядра.
Особой разновидностью химических элементов являются изотопы, у которых ядра
атомов отличаются числом нейтронов (поэтому у них разная атомная масса), но содержат одинаковое число протонов и поэтому занимают одно и тоже место в периодической системе элементов.
Термин «изотоп» был введен в 1910 г. английским радиохимиком Ф. Содди. Различают стабильные (устойчивые) и нестабильные (радиоактивные) изотопы. Наибольший интерес вызвали радиоактивные изотопы, которые стали широко использоваться в атомной энергетике, приборостроении, медицине.
Первым был открыт химический элемент фосфор в 1669 г., потом кобальт, никель и другие.
Открытие французским химиком А. Л. Лавуазье кислорода и установление его роли в образовании различных химических соединений позволило отказаться от прежних представлений об «огненной материи» (флогистоне).
В Периодической системе Д.И. Менделеева насчитывалось 62 элемента, в 1930-е гг. она заканчивалась ураном. В 1999 г. было сообщено, что путем физического синтеза атомных ядер открыт 114-й элемент

Слайд 25Концепция химических соединений
В начале XIX в.
Ж. Пруст сформулировал закон постоянства состава, в соответствии с которым
любое химическое соединение обладает строго определенным, неизменным составом и тем самым отличается от смесей.
Теоретически обосновал закон Пруста Дж. Дальтон в законе кратных отношений. Согласно этому закону состав любого вещества можно было представить как простую формулу, а эквивалентные составные части молекулы - атомы, обозначавшиеся соответствующими символами, - могли замещаться на другие атомы.
Химическое соединение состоит из одного, двух и более разных химических элементов.
С открытием сложного строения атома стали ясны причины связи атомов, взаимодействующих друг с другом, которые указывают на взаимодействие атомных электрических зарядов, носителями которых оказываются электроны и ядра атомов.
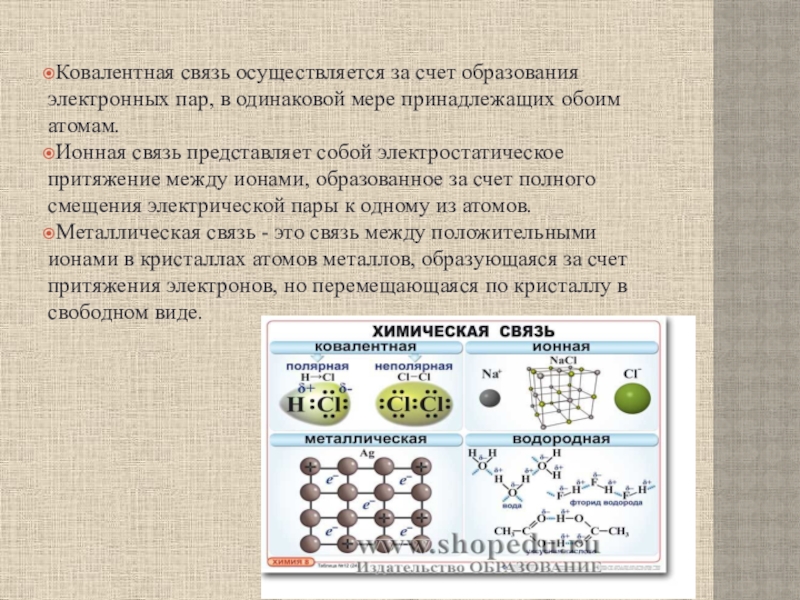
Слайд 26Ковалентная связь осуществляется за счет образования электронных пар, в одинаковой
мере принадлежащих обоим атомам.
Ионная связь представляет собой электростатическое притяжение
между ионами, образованное за счет полного смещения электрической пары к одному из атомов.
Металлическая связь - это связь между положительными ионами в кристаллах атомов металлов, образующаяся за счет притяжения электронов, но перемещающаяся по кристаллу в свободном виде.
Слайд 27Органогены
Первая половина XIX в
Ученые убеждены, что свойства веществ
и их
качественное разнообразие обусловлены не
только составом элементов, но
и структурой
их молекул.
Сотни тысяч химических соединений, состав
которых состоит из нескольких
элементов-органогенов (углерода, водорода, кислорода, серы, азота, фосфора).
Органогены - элементы, составляющие основу живых систем.
В состав биологически важных компонентов живых систем входят еще 12 элементов: натрий, калий, кальций, магний, железо, цинк, кремний, алюминий, хлор, медь, кобальт, бор.
На основе шести органогенов и еще около 20 других элементов природа создала около 8 млн. различных химических соединений, обнаруженных к настоящему времени. 96% из них приходится на органические соединения.
Слайд 28Возникновение структурной химии означало, что появилась возможность для целенаправленного качественного
преобразования веществ, для создания схемы синтеза любых химических соединений.
Основы структурной
химии были заложены Дж. Дальтоном, который показал, что любое химическое вещество представляет собой совокупность молекул, состоящих из определенного количества атомов одного, двух или трех химических элементов.
И.-Я. Берцелиус выдвинул идею, что молекула представляет собой не простое нагромождение атомов, а определенную упорядоченную структуру атомов, связанных между собой электростатическими силами.
Бутлеров впервые в истории химии обратил внимание на энергетическую неравноценность разных химических связей. Эта теория позволила строить структурные формулы любого химического соединения, так как показывала взаимное влияние атомов в структуре молекулы, а через это объясняла химическую активность одних веществ и пассивность других.
Слайд 29
Учение о химических процессах
В основе учения находятся
химическая термодинамика и кинетика. Основоположник этого направления стал русский химик
Н.Н. Семенов, основатель химической физики.
Важнейшей задачей химиков становится умение управлять химическими процессами, добиваясь нужных результатов.
Методы управления химическими процессами делятся
термодинамические (влияют на смещение химического равновесия реакции)
кинетические (влияют на скорость протекания химической реакции).
Французский химик Ле Шателье в конце XIX в. сформулировал принцип равновесия, т.е. метод смещения равновесия в сторону образования продуктов реакции. Каждая реакция обратима, но на практике равновесие смещается в ту или иную сторону. Это зависит как от природы реагентов, так и от условий процесса.
Реакции проходят ряд последовательных стадий, которые составляют полную реакцию. Скорость реакции зависит от условий протекания и природы веществ, вступивших в нее:
концентрация
температура
катализаторы
Слайд 30Катализ(1812 г) - ускорение химической реакции в присутствии особых веществ
- катализаторов, которые взаимодействуют с реагентами, но в реакции не
расходуются и не входят в конечный состав продуктов.
Типы:
гетерогенный катализ - химическая реакция взаимодействия жидких или газообразных реагентов на поверхности твердого катализатора;
гомогенный катализ - химическая реакция в газовой смеси или в жидкости, где растворены катализатор и реагенты;
электрокатализ - реакция на поверхности электрода в контакте с раствором и под действием электрического тока;
фотокатализ - реакция на поверхности твердого тела или в жидком растворе, стимулируется энергией поглощенного излучения.
Применение катализаторов:
при производстве маргарина
многих пищевых продуктов
средств защиты растений
Слайд 31Антропогенный химизм и его влияние на среду обитания
Задача
органического синтеза – создание веществ со специфическими свойствами, не существующие
в природе и обладающие почти неограниченным сроком жизни.
Все искусственные полимеры практически не разрушаются в естественных условиях, не теряют своих свойств в течение 50-100 лет. Единственный способ их утилизации – уничтожение: либо сжигание, либо затопление.
При сжигании углеводородов, выделяется углекислота – один из основных загрязнителей атмосферы, наряду с метаном и хлорсодержащими веществами. Именно она ответственна за катастрофические процессы в атмосфере, которые находят выражение в эффекте климатических изменений.
Новые популярные источники энергии ХХI: биоэтанол, электричество, энергия солнечная батарей, водород и обычная вода.
Слайд 32Биоэтанол – это возобновляемый вид топлива. Этанол может добываться
различными способами. Например, из зерновых культур: кукурузы, пшеницы, ячменя и
корнеплодов - из картофеля, сахарной свеклы и т.п.
Сложность заключается в том, что это не совсем рентабельный источник энергии: для его развития необходимы дополнительные территории и вода. Кроме того, добыча этанола в технических целях – угроза пищевой безопасности на планете.
Еще одно популярное направление исследований альтернативных источников энергии – возможность использования энергии нашей звезды.
В 2009 г. на ежегодной выставке-ярмарке автомобилей японские автопроизводители демонстрировали автомобили, которые работают на основе энергии расщепления молекул воды. Энергия синтеза воды из молекул водорода и кислорода сопровождается выбросом энергии, которая используется в двигателях.
Слайд 33 Прикладная химия предлагает новые материалы, которые
способны заменить металлы, хлопок, лен, шелк, дерево.
Французы нашли способ производства бумаги из отходов сахарного производства.
Долговечность пластика и синтетических материалов в данном случае – благо, спасение от техногенных катастроф.
Силикон, который уже давно и с успехом используют в пластической хирургии и косметологии, японские инженеры рискнули применить для замены металлического корпуса автомобиля. Машины не деформируются, люди не страдают в авариях.
Дедерон, лайкра, эластан – материалы, которые активно используют в легкой, текстильной, чулочно-носочной индустрии. Очень популярны гибридные ткани, в которых присутствуют молекулы натуральных материалов: льна, хлопка и синтетические материалы вроде эластанов.
Искусственные шелка, искусственные мех, искусственные кожи – все это пути снижения антропогенного давления на животные и растительные виды.
Органический синтез и прикладная химия открывает широкую дорогу для замены естественного – искусственным, снижая индустриальный прессинг на среду обитания.

Слайд 34Вопрос утилизации пластмасс, твердых промышленных и бытовых отходов решается за
счет улучшения дорог.
В 1980-е гг. были изобретены и синтезированы
первые пластики, способные к биологическому разложению. Канадский химик Джеймс Гуиллер, которого ужаснули груды пустых пластиковых бутылок, разбросанные вдоль итальянских дорог, задумался о возможности их разрушения в естественных условиях и в небольшие сроки. Гуиллер синтезировал первый экологически чистый пластик – биопал, который разлагается бактериями, живущими в почве.
В 90-е гг. химики занялись поиском технологий отхода от традиционного сырья для производства пластмасс - нефтепродуктов. В ХХI в. был наконец найден катализатор, позволяющий создавать пластик из апельсиновой кожуры и углекислоты. Он был синтезирован на основе лимонина – органического вещества, входящего в состав цитрусовых.
Пластик получил название полилимонин карбонат.
Внешне он похож на пенопласт, а его качества
не уступают качествам традиционных пластмасс
Слайд 35Создание искусственных материалов на основе нанотехнологий. Корень «нано» с древнегреческого
переводится как «малыш», «карлик».
«Нанотехнологии – это способы манипулирования веществом
на атомном и молекулярном уровне, в результате чего оно приобретает принципиально новые, уникальные химические, физические и биологические свойства».
Один из опытов по наноманипулированию датируется уже IХ столетием. Это изобретение знаменитой дамасской стали, не заменимой в жестоких сражениях Средневековья.
Сегодня нанопроизводства заняты созданием сверхтонких, сверхпрочных материалов, которые можно использовать на нашей планете и в космическом пространстве.
Лидеры в создании наноматериалов – США
и Европа.
Слайд 36Успехи в синтезе наноматериалов российскими учеными
Наноструктурированные композитные материалы для изготовления
арф высокого качества, которые гораздо дешевле в производстве, чем традиционные
музыкальные инструменты.
Очень возможно, что драгоценные скрипки, созданные искусными руками Гварнери и Страдивари, также имеют отношение к нанопроизводству.
Радиоэкранирующие и радиозащищающие материалы на основе кремния, которые отражают вредные излучения и могут быть использованы для защиты военной техники, экранируют более 99% электромагнитного излучения.
Наноалмазы. Это искусственные материалы, содержащие алмазы, – твердые, стойкие к коррозии, к износу. Их можно использовать в нефтяной и металлургической промышленности
для бурения скважин и при резке металла.
Наноалмазы добавляют в смазочно-охлаждающие
жидкости в качестве катализаторов химических
реакций.
Слайд 37ВЫВОДЫ
Химическая наука на ее высшем эволюционном уровне углубляет представления о
мире. Концепции эволюционной химии, в том числе о химической эволюции
на Земле, о самоорганизации и самосовершенствовании химических процессов, о переходе от химической эволюции к биогенезу, являются убедительным аргументом, подтверждающим научное понимание происхождения жизни во Вселенной.
Химическая эволюция на Земле создала все предпосылки для появления живого из неживой природы.
Жизнь во всем ее многообразии возникла на Земле самопроизвольно из неживой материи, она сохранилась и функционирует уже миллиарды лет.
Жизнь полностью зависит от сохранения соответствующих условий ее функционирования. А это во многом зависит от самого человека.