Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
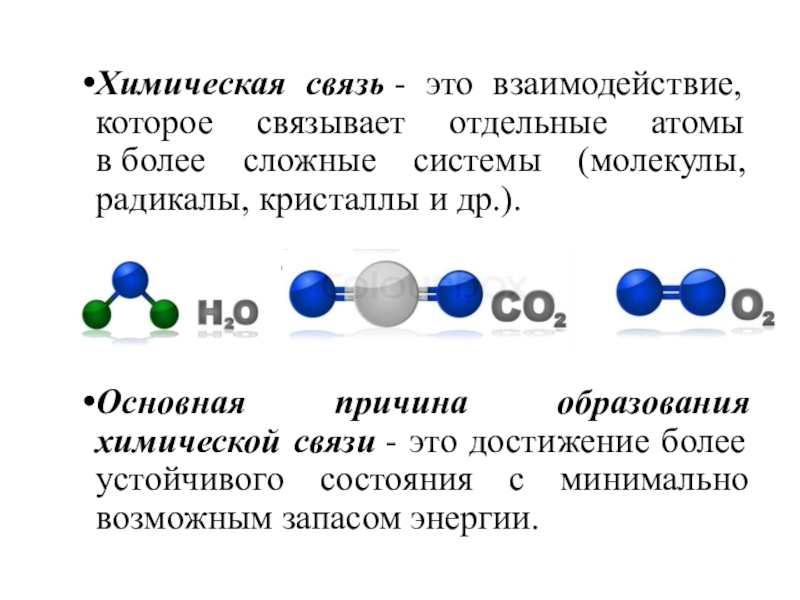
ХИМИЧЕСКАЯ СВЯЗЬ
Содержание
- 1. ХИМИЧЕСКАЯ СВЯЗЬ
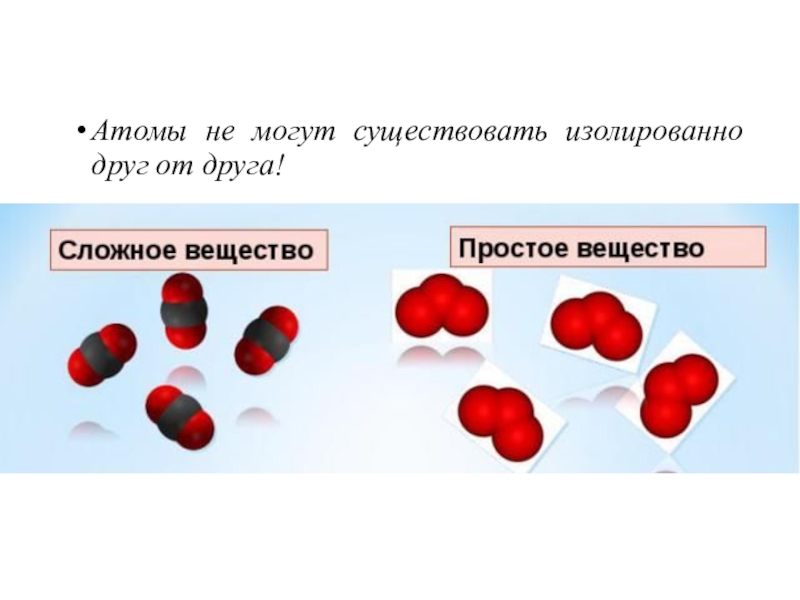
- 2. Атомы не могут существовать изолированно друг от друга!
- 3. Основная причина образования химической связи - это достижение
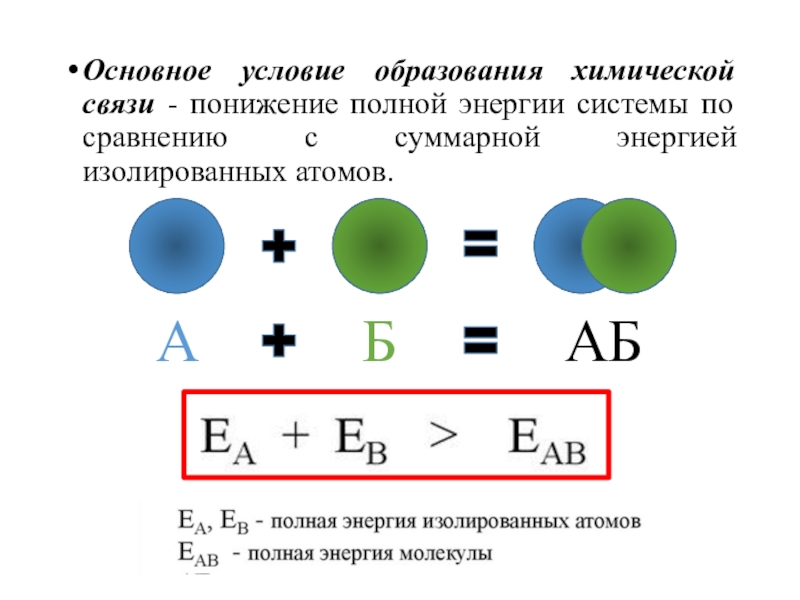
- 4. Основное условие образования химической связи - понижение
- 5. Отличительные признаки химической связи:Понижение энергии системы по
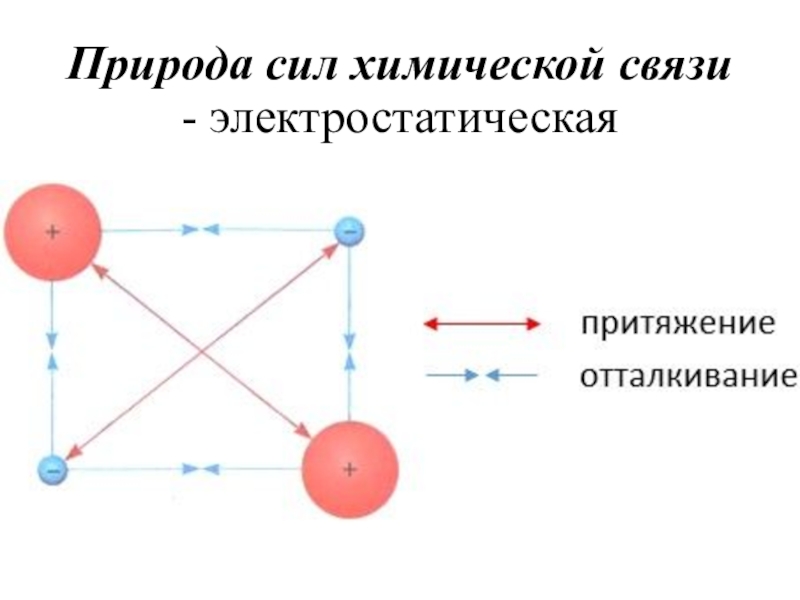
- 6. Природа сил химической связи - электростатическая
- 7. В образовании химической связи принимают участие валентные электроны.При
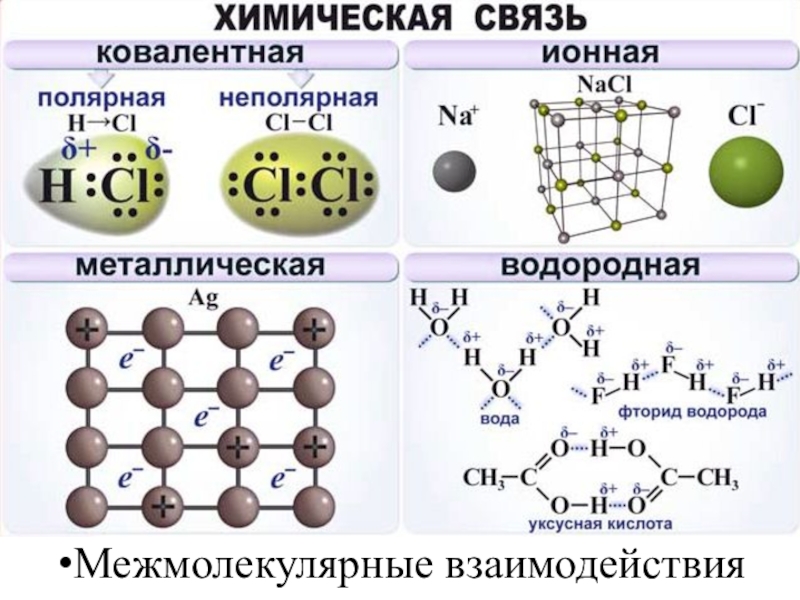
- 8. Межмолекулярные взаимодействия
- 9. Характеристики химической связиДлина химической связи (lсв) –
- 10. Особенности lсвДлина связи зависит от степени перекрывания
- 11. Характеристики химической связиЭнергия химической связи (Есв) –
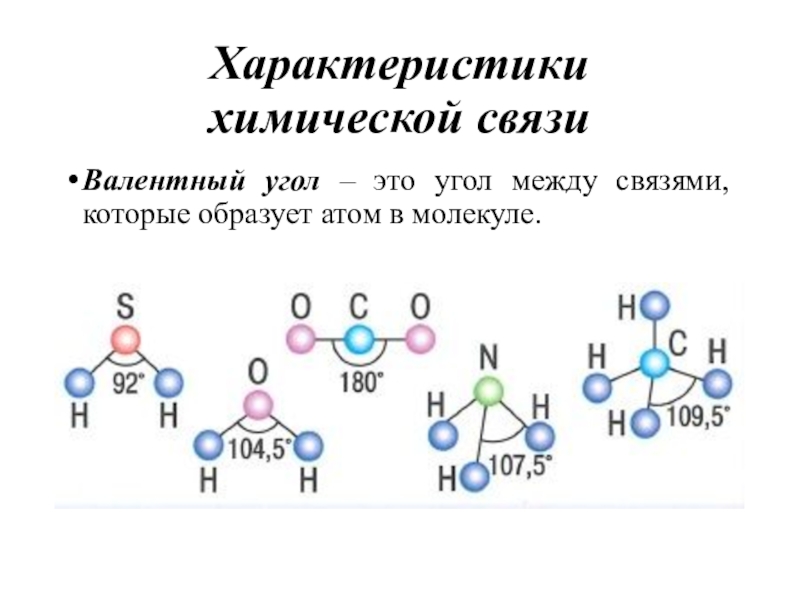
- 12. Характеристики химической связиВалентный угол – это угол между связями, которые образует атом в молекуле.
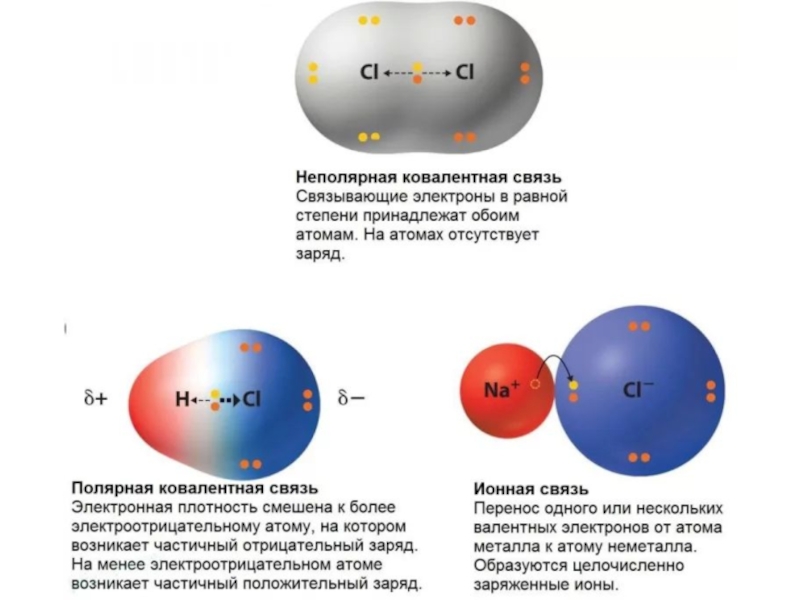
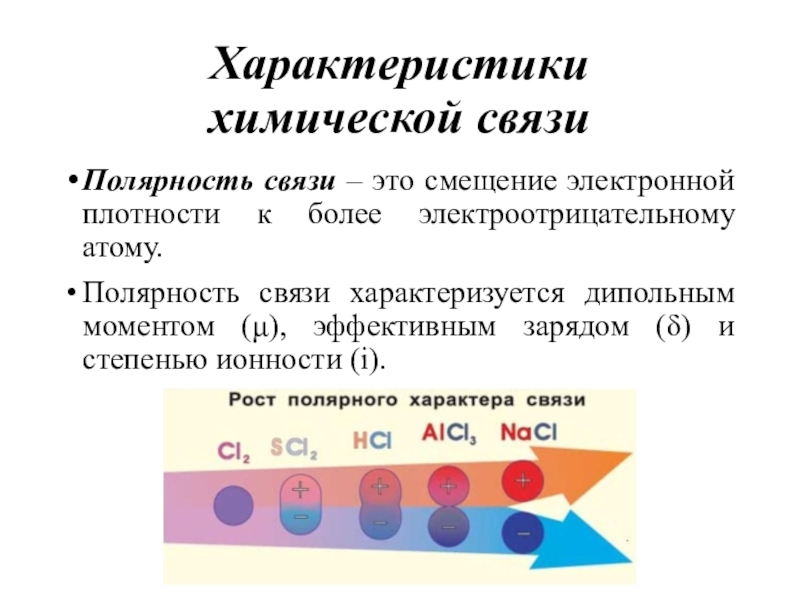
- 13. Характеристики химической связиПолярность связи – это смещение
- 14. Дипольный момент [Кл·м] = [D]ℓ – длина диполя;q – абсолютная величина заряда в кулонах
- 15. Эффективный заряд – безразмерная величина, определяемая отношением
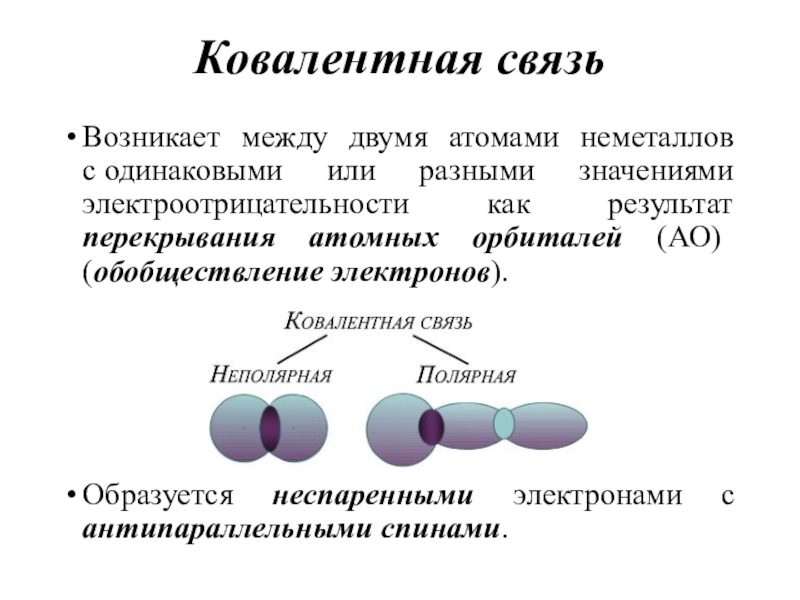
- 16. Ковалентная связьВозникает между двумя атомами неметаллов с одинаковыми
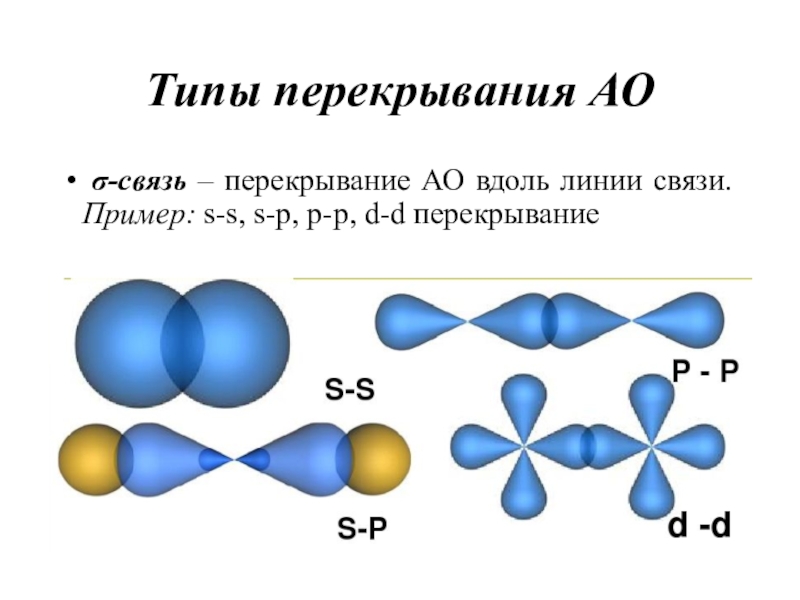
- 17. Типы перекрывания АО σ-связь – перекрывание АО вдоль линии связи. Пример: s-s, s-p, p-p, d-d перекрывание
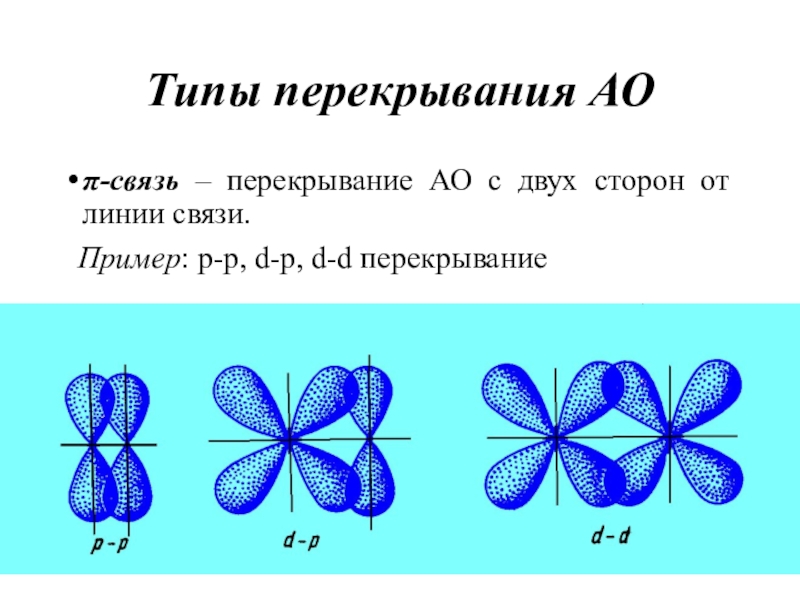
- 18. Типы перекрывания АОπ-связь – перекрывание АО с
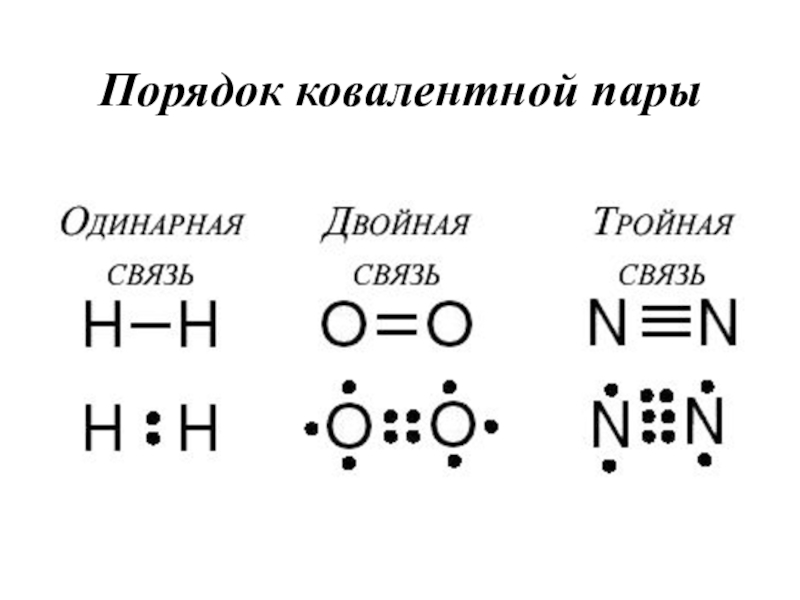
- 19. Кратность связиЭто число общих электронных пар (количество связей) между взаимодействующими атомами
- 20. Механизмы образования ковалентной связиОбменныйДонорно-акцепторныйДативный
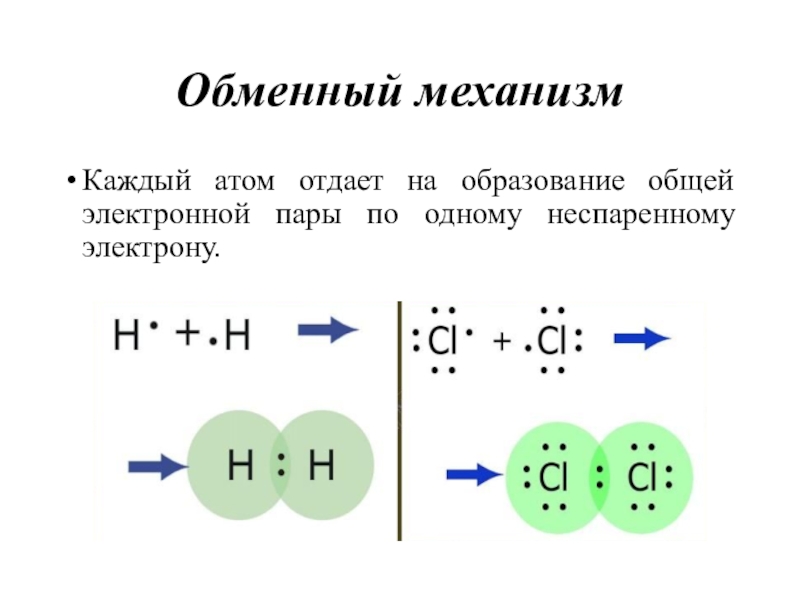
- 21. Обменный механизмКаждый атом отдает на образование общей электронной пары по одному неспаренному электрону.
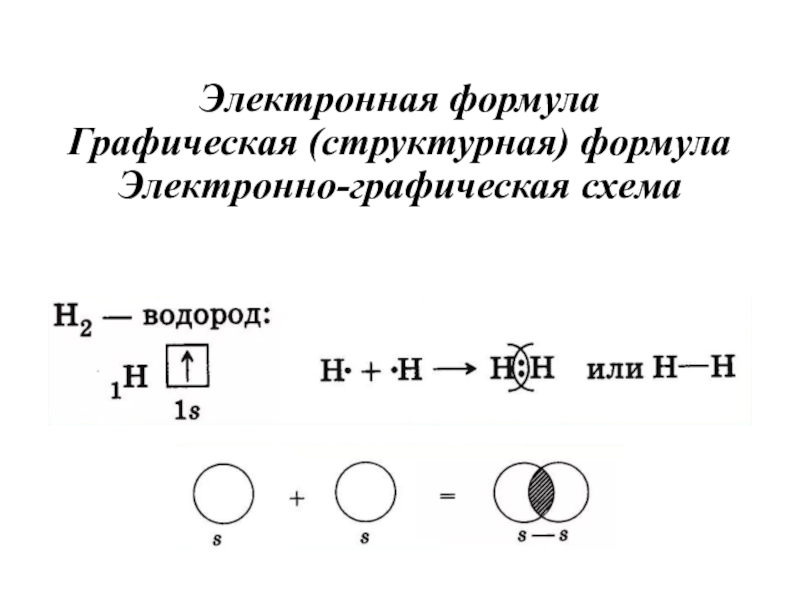
- 22. Электронная формула Графическая (структурная) формула Электронно-графическая схема
- 23. Порядок ковалентной пары
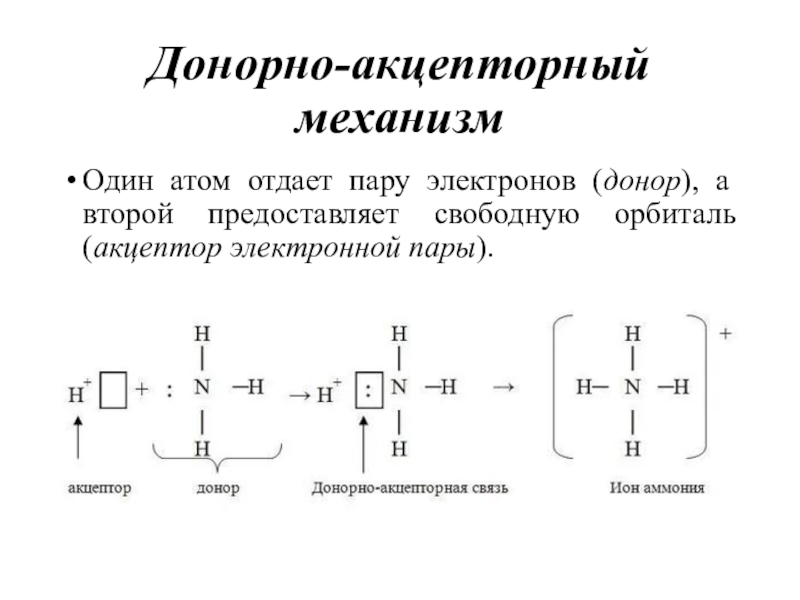
- 24. Донорно-акцепторный механизмОдин атом отдает пару электронов (донор), а второй предоставляет свободную орбиталь (акцептор электронной пары).
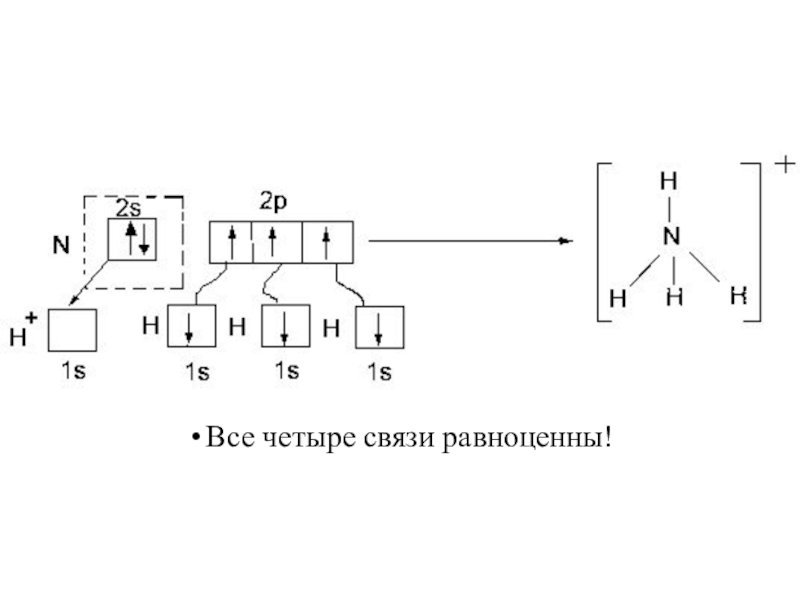
- 25. Все четыре связи равноценны!
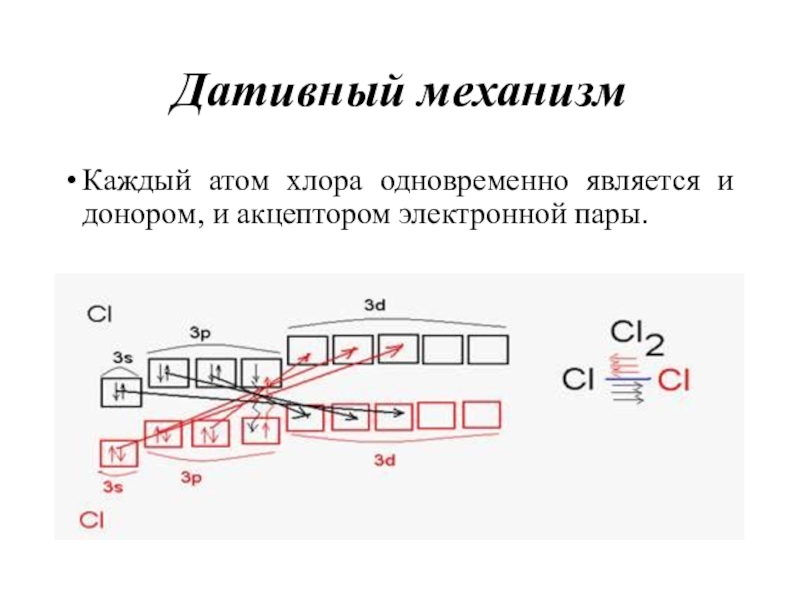
- 26. Дативный механизмКаждый атом хлора одновременно является и донором, и акцептором электронной пары.
- 27. Свойства ковалентной связиПолярность – смещение электронной плотности
- 28. Слайд 28
- 29. Свойства ковалентной связиНасыщаемость – определенное число химических
- 30. Свойства ковалентной связиНаправленность – молекулы и ионы
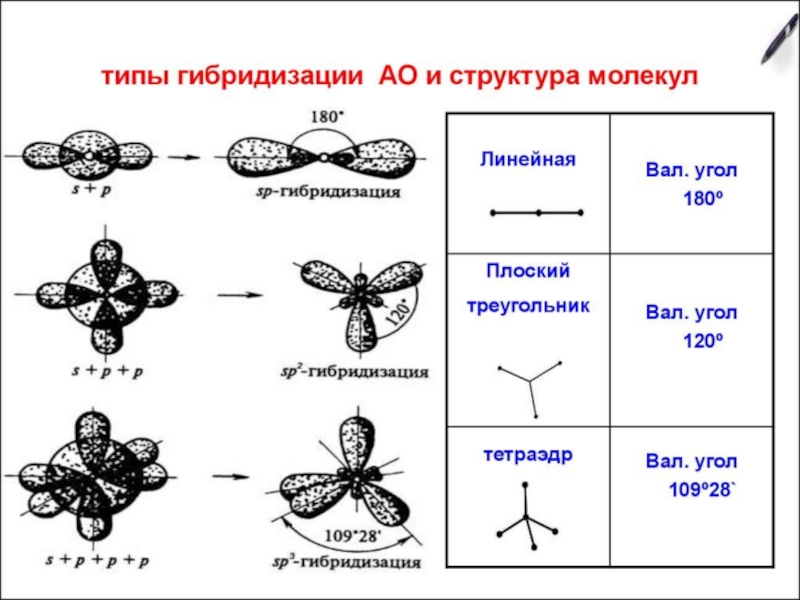
- 31. Теория гибридизацииГибридизация – это выравнивание атомных орбиталей
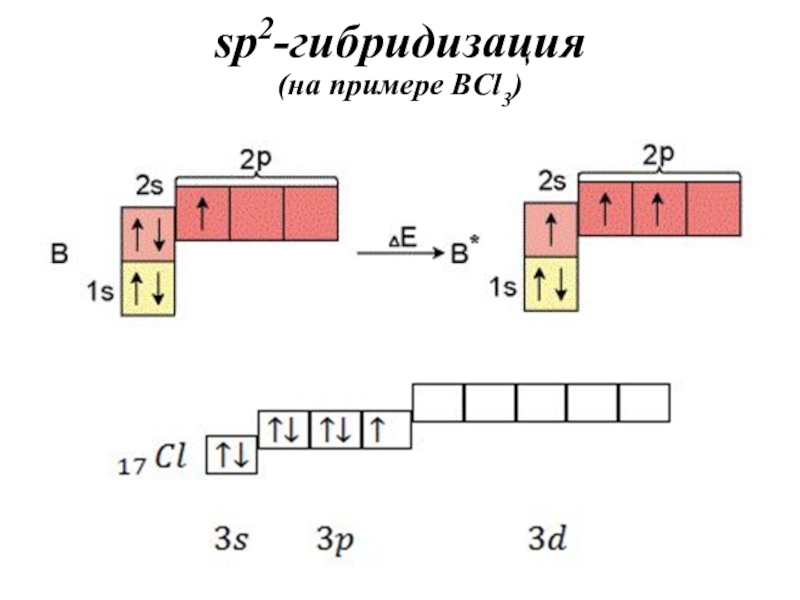
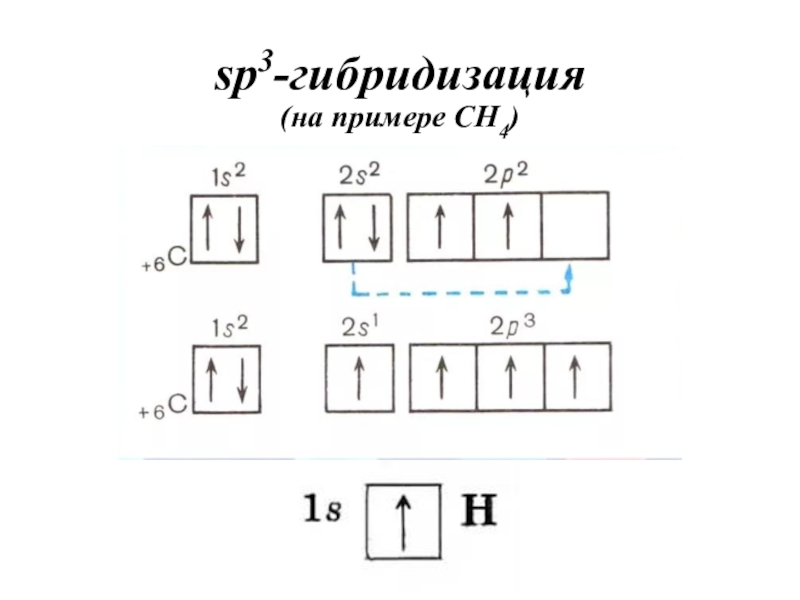
- 32. Алгоритм определения типа гибридизации в молекулахЗаписать электронно-графическую
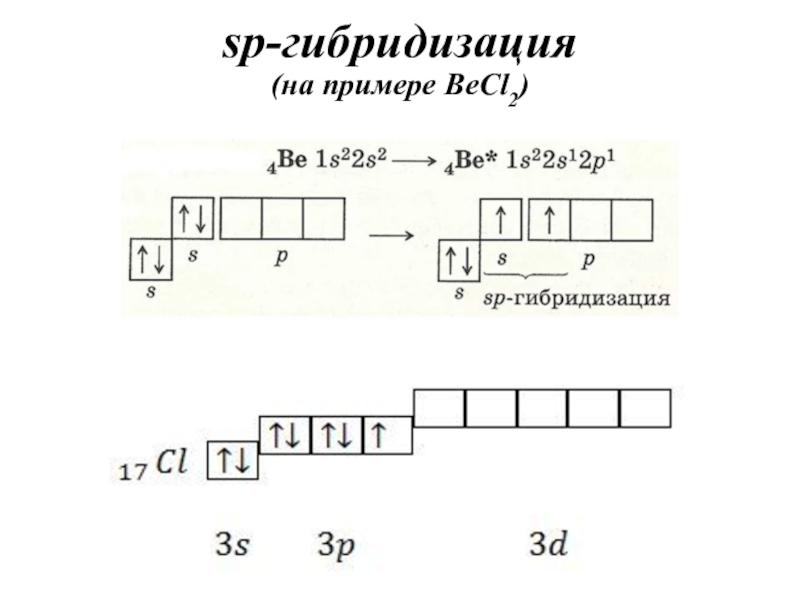
- 33. sp-гибридизация (на примере BeCl2)
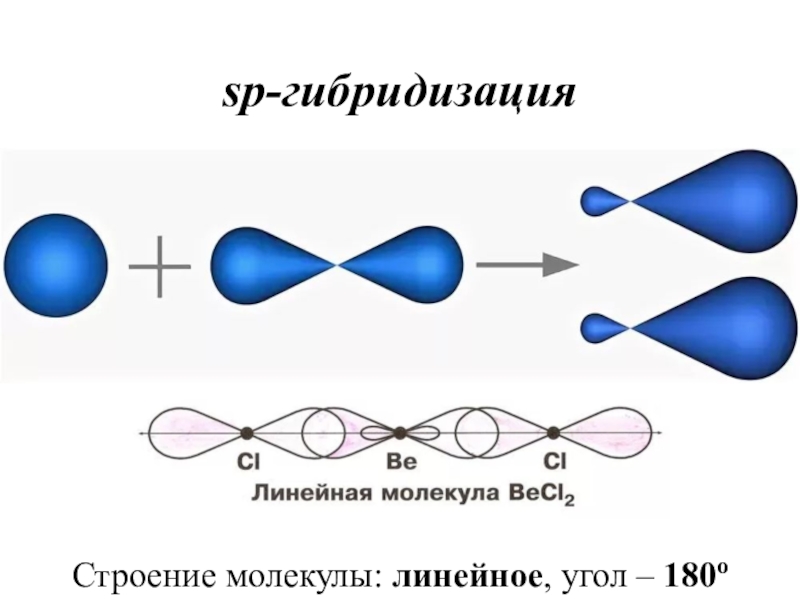
- 34. sp-гибридизацияСтроение молекулы: линейное, угол – 180о
- 35. sp2-гибридизация (на примере BCl3)
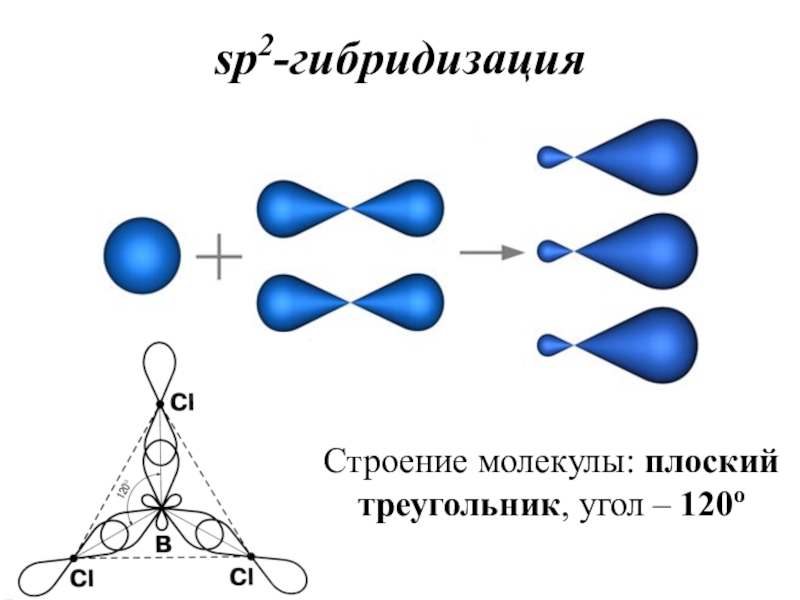
- 36. sp2-гибридизацияСтроение молекулы: плоский треугольник, угол – 120о
- 37. sp3-гибридизация (на примере CH4)
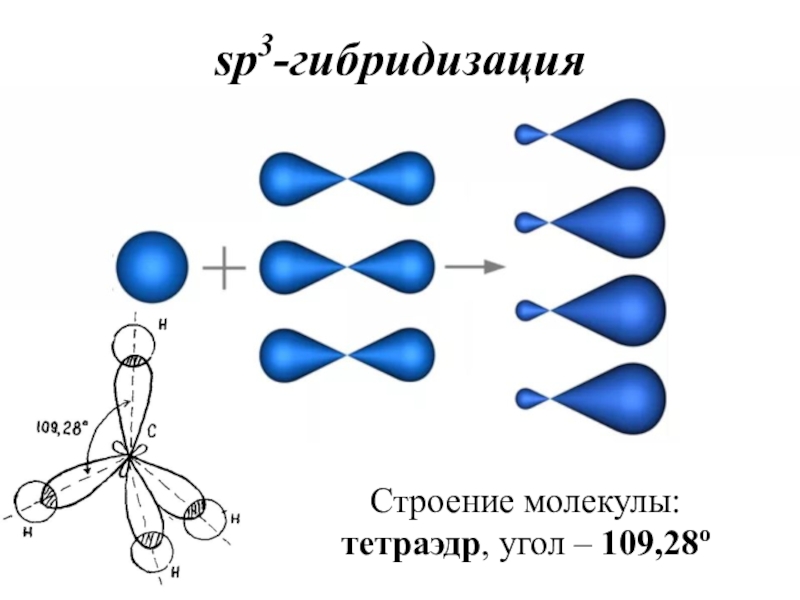
- 38. sp3-гибридизацияСтроение молекулы: тетраэдр, угол – 109,28о
- 39. Слайд 39
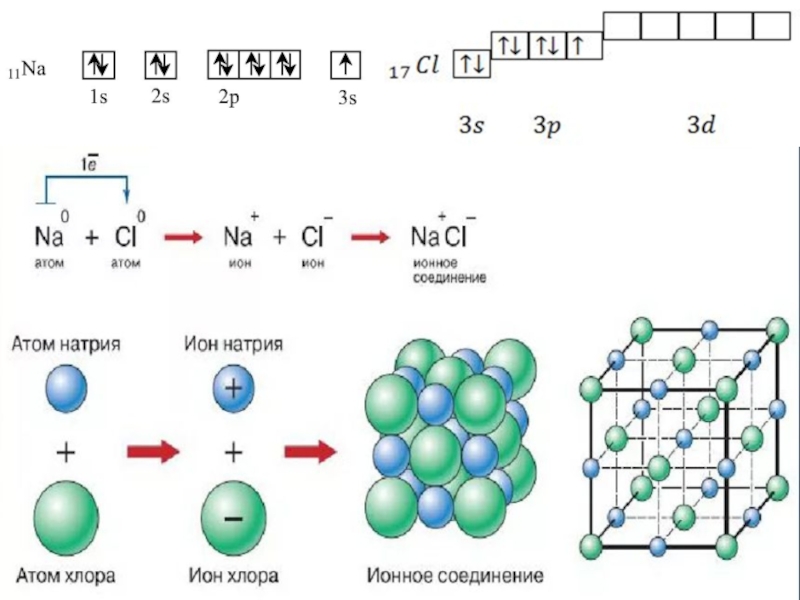
- 40. Ионная связьОсуществляется за счет электростатического взаимодействия противоположно
- 41. Слайд 41
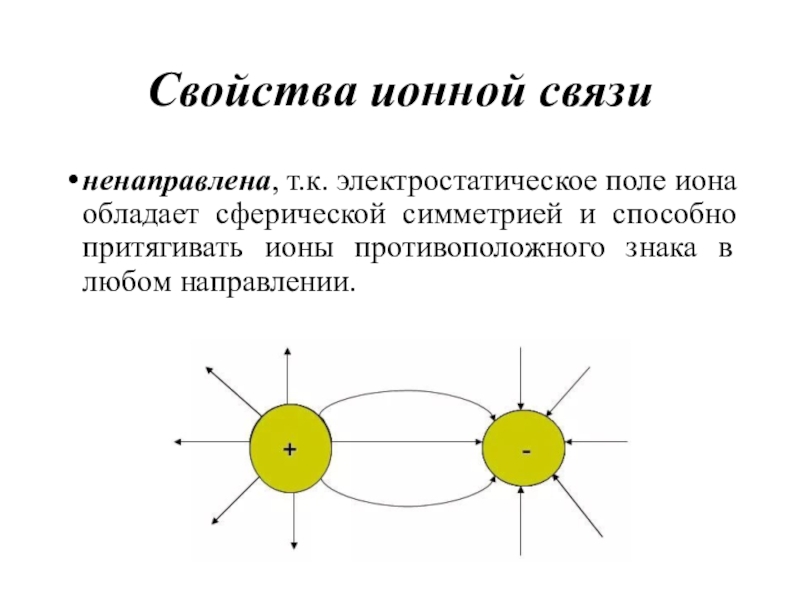
- 42. Свойства ионной связиненаправлена, т.к. электростатическое поле иона
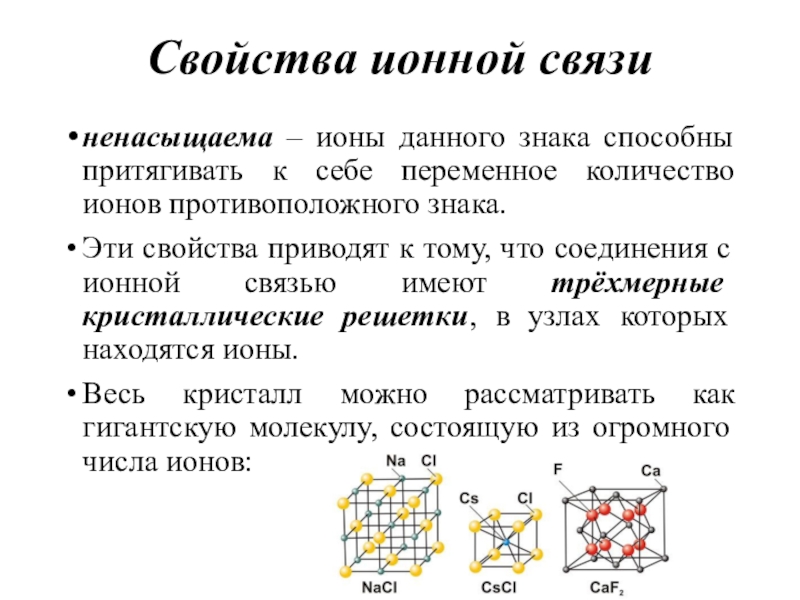
- 43. Свойства ионной связиненасыщаема – ионы данного знака
- 44. Слайд 44
- 45. Металлическая связьВозникает за счет обобществления валентных электронов,
- 46. Водородная связьВозникает в молекулах или между молекулами,
- 47. Межмолекулярная водородная связь – это химическая связь
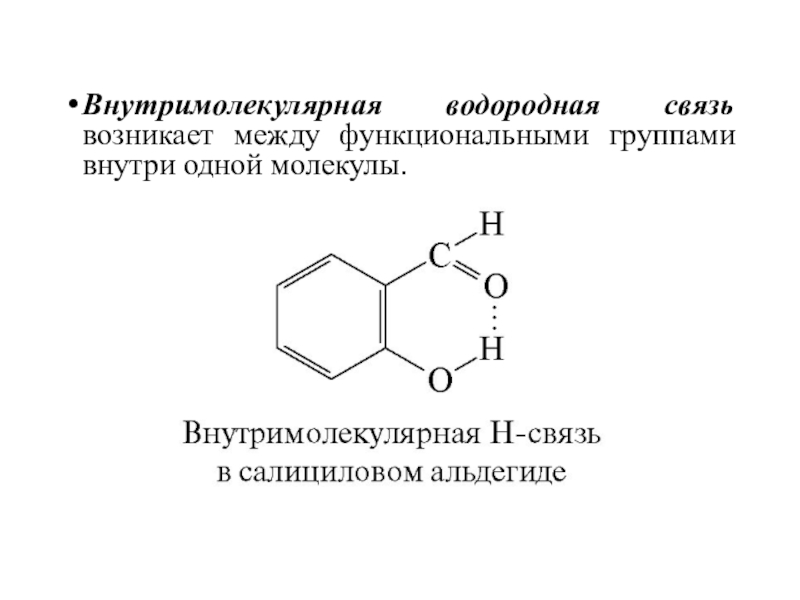
- 48. Внутримолекулярная водородная связь возникает между функциональными группами внутри одной молекулы.
- 49. Силы Ван-дер-ВаальсаСвязи между молекулами, обусловленные электростатическим взаимодействием.Различают
- 50. Слайд 50
- 51. Слайд 51
- 52. Слайд 52
- 53. Слайд 53
- 54. Скачать презентанцию
Атомы не могут существовать изолированно друг от друга!
Слайды и текст этой презентации
Слайд 3Основная причина образования химической связи - это достижение более устойчивого состояния
с минимально возможным запасом энергии.
отдельные атомы в более сложные системы (молекулы, радикалы, кристаллы и др.).Слайд 4Основное условие образования химической связи - понижение полной энергии системы
по сравнению с суммарной энергией изолированных атомов.
А
Б
АБ
Слайд 5Отличительные признаки химической связи:
Понижение энергии системы по сравнению с суммой
энергий несвязанных атомов;
Перераспределение электронной плотности в области образования химической связи.
Слайд 7В образовании химической связи принимают участие валентные электроны.
При образовании химической связи
каждый атом хочет завершить свой внешний энергетический уровень.
Слайд 9Характеристики
химической связи
Длина химической связи (lсв) – расстояние между ядрами соседних
атомов в молекуле или кристалле [нм].
Химическая связь консервативна – каждый
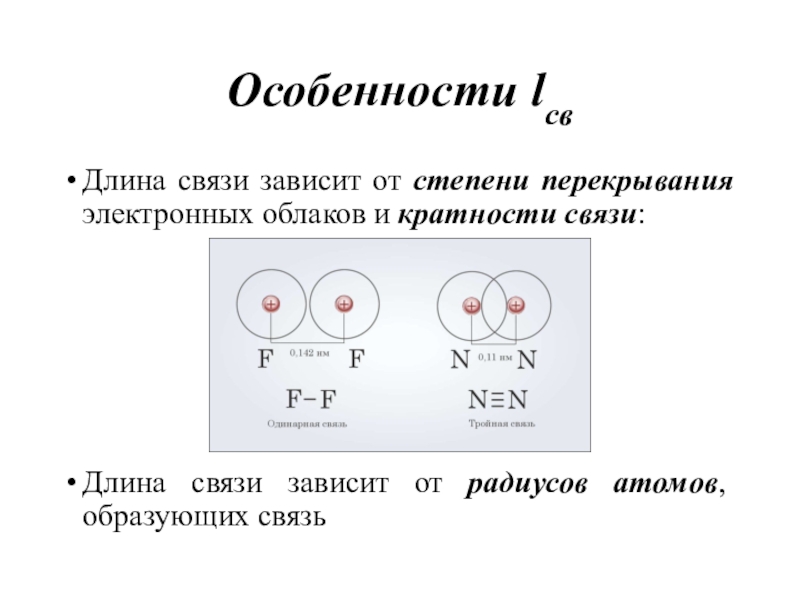
атом вносит всегда определенный вклад в длину химической связи, не зависимо от того, в состав какой молекулы он входит.Слайд 10Особенности lсв
Длина связи зависит от степени перекрывания электронных облаков и
кратности связи:
Длина связи зависит от радиусов атомов, образующих связь
Слайд 11Характеристики
химической связи
Энергия химической связи (Есв) – энергия, которую необходимо затратить
для разрыва химической связи [кДж/моль].
Чем больше длина связи, тем меньше
её энергия:Слайд 12Характеристики
химической связи
Валентный угол – это угол между связями, которые образует
атом в молекуле.
Слайд 13Характеристики
химической связи
Полярность связи – это смещение электронной плотности к более
электроотрицательному атому.
Полярность связи характеризуется дипольным моментом (μ), эффективным зарядом (δ)
и степенью ионности (i).Слайд 15Эффективный заряд – безразмерная величина, определяемая отношением экспериментально найденного μ
к теоретически рассчитанному.
Степень ионности – реальный заряд иона в кристаллической
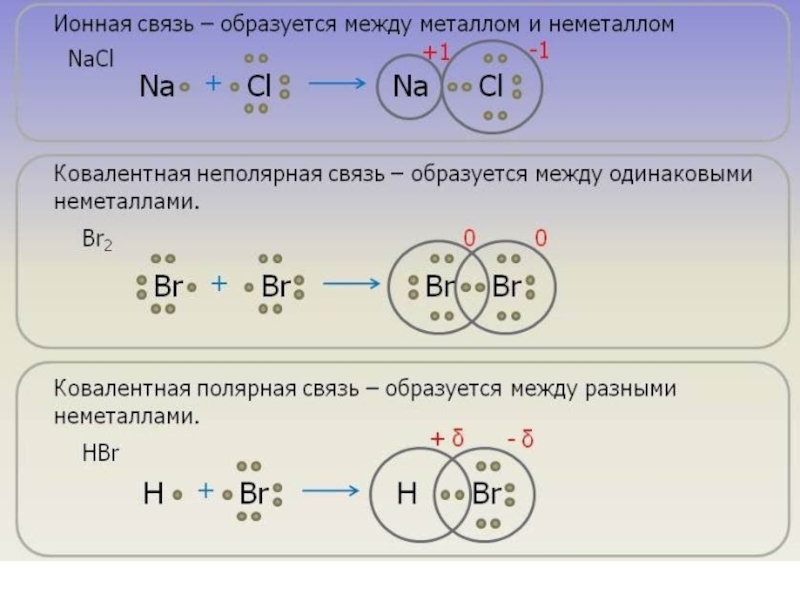
структуре. Может быть, оценена по разности электроотрицательностей атомов.Слайд 16Ковалентная связь
Возникает между двумя атомами неметаллов с одинаковыми или разными значениями
электроотрицательности как результат перекрывания атомных орбиталей (АО) (обобществление электронов).
Образуется неспаренными
электронами с антипараллельными спинами.Слайд 17Типы перекрывания АО
σ-связь – перекрывание АО вдоль линии связи.
Пример: s-s, s-p, p-p, d-d перекрывание
Слайд 18Типы перекрывания АО
π-связь – перекрывание АО с двух сторон от
линии связи.
Пример: p-p, d-p, d-d перекрывание
Слайд 19Кратность связи
Это число общих электронных пар (количество связей) между взаимодействующими
атомами
Слайд 21Обменный механизм
Каждый атом отдает на образование общей электронной пары по
одному неспаренному электрону.
Слайд 24Донорно-акцепторный механизм
Один атом отдает пару электронов (донор), а второй предоставляет
свободную орбиталь (акцептор электронной пары).
Слайд 26Дативный механизм
Каждый атом хлора одновременно является и донором, и акцептором
электронной пары.
Слайд 27Свойства ковалентной связи
Полярность – смещение электронной плотности к более электроотрицательному
атому.
Ковалентная неполярная связь – образована атомами с одинаковыми значениями ЭО:
Н-Н, О=О (ΔЭО = 0).Ковалентная полярная связь – образуется между атомами с разными значениями ЭО: H2O, NH3.
Слайд 29Свойства ковалентной связи
Насыщаемость – определенное число химических связей атома, вызванное
ограниченным числом валентных связей и АО.
Отсюда следует, что максимальная валентность
(ковалентность):элементов первого периода равна 1,
второго – 4 (одна 2s-АО + три 2р-АО),
третьего – 9 (одна 3s-АО + три 3р-АО и + 5d-АО).
Слайд 30Свойства ковалентной связи
Направленность – молекулы и ионы с ковалентными связями
имеют определённое геометрическое строение.
Геометрическое строение молекул и ионов объясняется гибридизацией
атомных орбиталей.Слайд 31Теория гибридизации
Гибридизация – это выравнивание атомных орбиталей по форме и
энергии.
Основные положения теории гибридизации:
гибридизуются АО центрального атома
гибридные АО имеют
определённую форму, которая обеспечивает максимальное перекрываниегибридизуются АО с неспаренными электронами, а также занятые парой электронов
гибридизуются АО, участвующие в сигма-связывании
гибридные АО располагаются в пространстве таким образом, чтобы испытывать минимальное межэлектронное отталкивание
Число АО = числу ГАО!
Слайд 32Алгоритм определения типа гибридизации в молекулах
Записать электронно-графическую формулу для валентных
электронов (участвуют в образовании химической связи).
Записать электронно-графическую формулу центрального атома
в возбужденном состоянии (если необходимо).По числу АО построить ГАО.
Определить тип гибридизации по числу атомных орбиталей, участвующих в гибридизации.
Слайд 40Ионная связь
Осуществляется за счет электростатического взаимодействия противоположно заряженных ионов в
химическом соединении.
Возникает между катионами s-металлов I и II группы п.с.
и анионами неметаллов VI и VII группы.ΔЭО > 1,9
Пример: NaCl, LiF, K2O, MgO
Слайд 42Свойства ионной связи
ненаправлена, т.к. электростатическое поле иона обладает сферической симметрией
и способно притягивать ионы противоположного знака в любом направлении.
Слайд 43Свойства ионной связи
ненасыщаема – ионы данного знака способны притягивать к
себе переменное количество ионов противоположного знака.
Эти свойства приводят к тому,
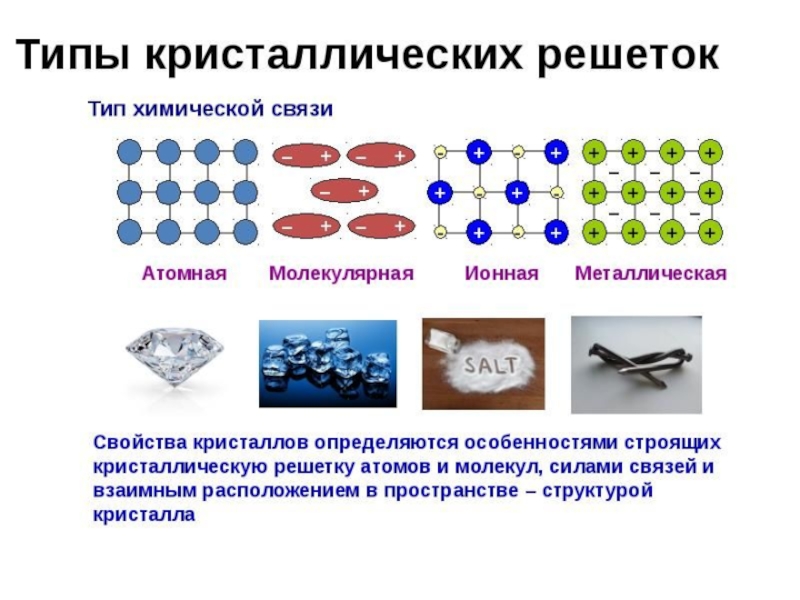
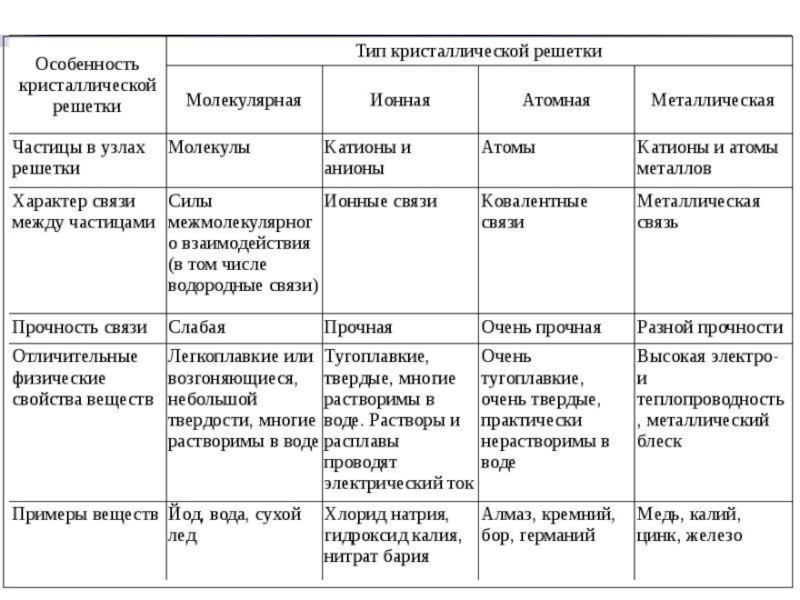
что соединения с ионной связью имеют трёхмерные кристаллические решетки, в узлах которых находятся ионы.Весь кристалл можно рассматривать как гигантскую молекулу, состоящую из огромного числа ионов:
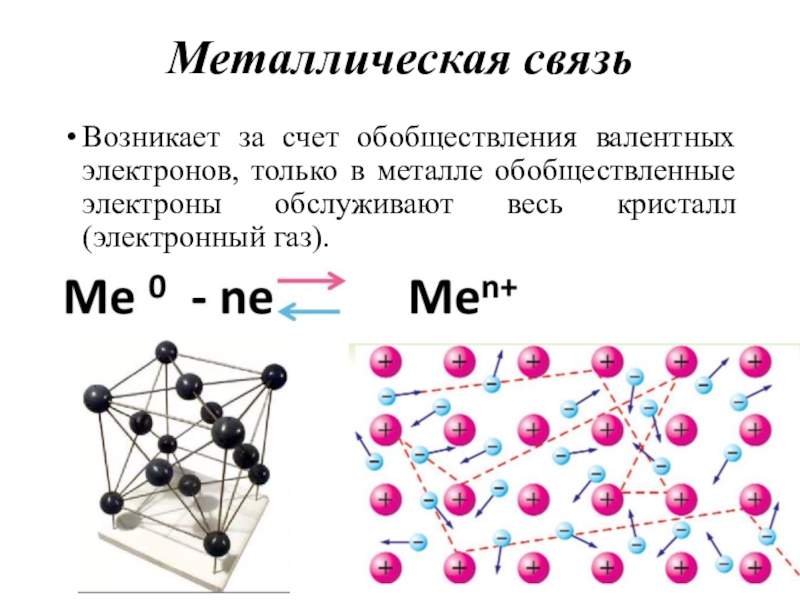
Слайд 45Металлическая связь
Возникает за счет обобществления валентных электронов, только в металле
обобществленные электроны обслуживают весь кристалл (электронный газ).
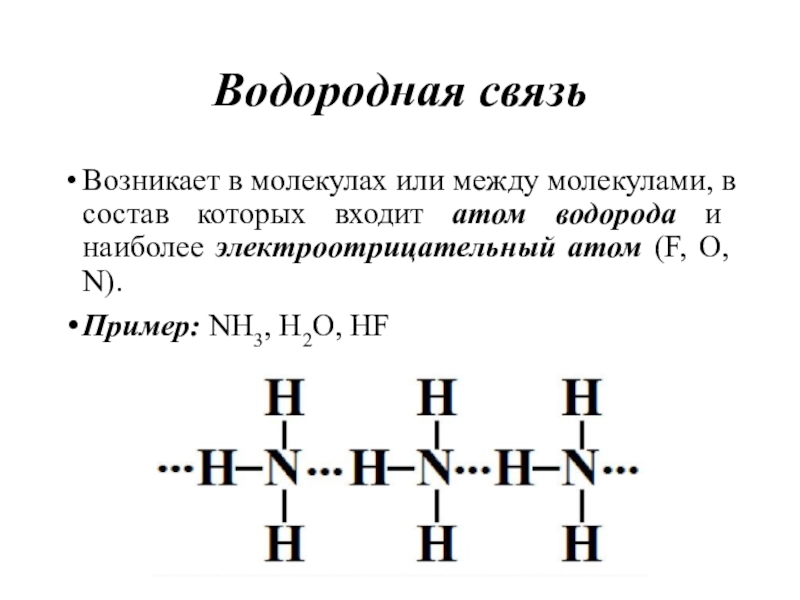
Слайд 46Водородная связь
Возникает в молекулах или между молекулами, в состав которых
входит атом водорода и наиболее электроотрицательный атом (F, O, N).
Пример:
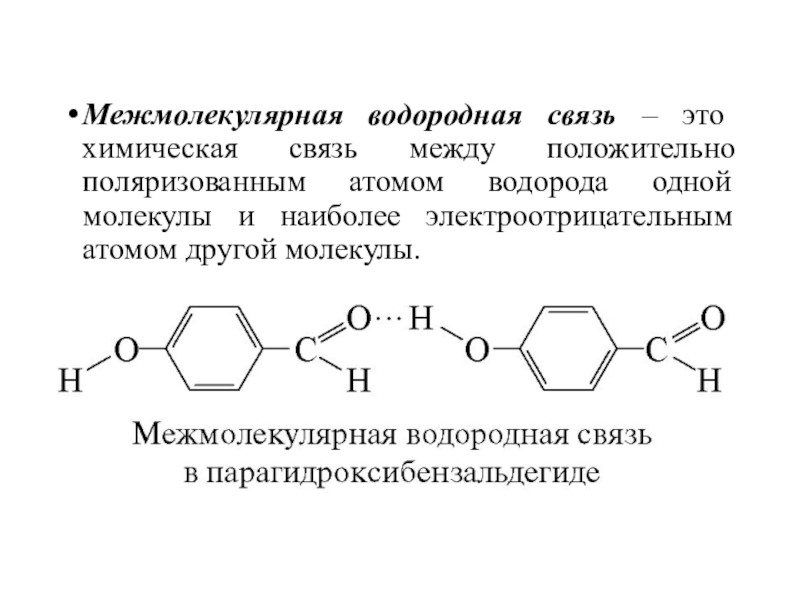
NH3, H2O, HFСлайд 47Межмолекулярная водородная связь – это химическая связь между положительно поляризованным
атомом водорода одной молекулы и наиболее электроотрицательным атомом другой молекулы.
Слайд 48Внутримолекулярная водородная связь возникает между функциональными группами внутри одной молекулы.
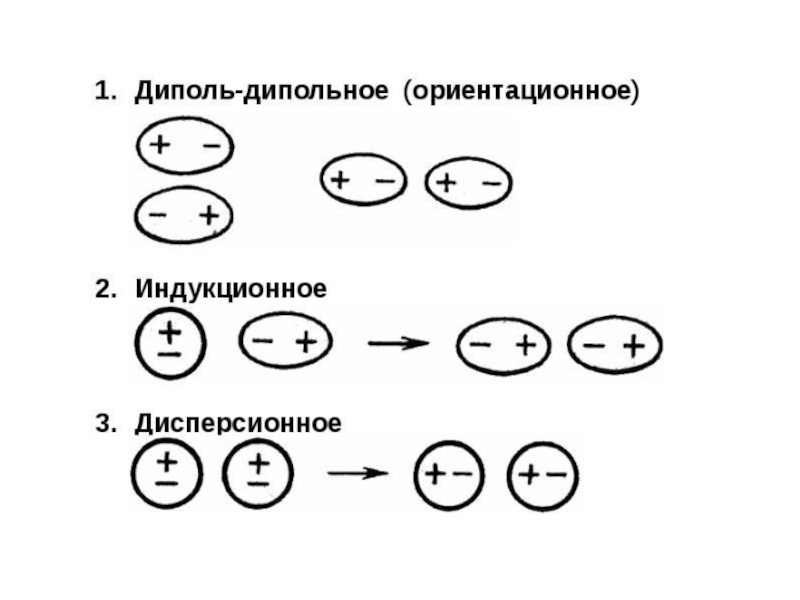
Слайд 49Силы Ван-дер-Ваальса
Связи между молекулами, обусловленные электростатическим взаимодействием.
Различают 3 типа сил:
Ориентационное
(диполь-дипольное) взаимодействие возникает между полярными молекулами (HCl-HCl).
Индукционное взаимодействие возникает между
полярными и неполярными молекулами (H2-HCl). Дисперсионное взаимодействие возникает между неполярными молекулами (H2-H2).



![ХИМИЧЕСКАЯ СВЯЗЬ Характеристики химической связиДлина химической связи (lсв) – расстояние между ядрами соседних Характеристики химической связиДлина химической связи (lсв) – расстояние между ядрами соседних атомов в молекуле или кристалле [нм].Химическая](/img/tmb/7/608888/8e9702ec245db5f8b4160177830a5f54-800x.jpg)
![ХИМИЧЕСКАЯ СВЯЗЬ Характеристики химической связиЭнергия химической связи (Есв) – энергия, которую необходимо затратить Характеристики химической связиЭнергия химической связи (Есв) – энергия, которую необходимо затратить для разрыва химической связи [кДж/моль].Чем больше](/img/tmb/7/608888/a2085529bafda774c3ce5dd7d5a4bf24-800x.jpg)
![ХИМИЧЕСКАЯ СВЯЗЬ Дипольный момент [Кл·м] = [D]ℓ – длина диполя;q – абсолютная величина заряда в кулонах Дипольный момент [Кл·м] = [D]ℓ – длина диполя;q – абсолютная величина заряда в кулонах](/img/tmb/7/608888/aaa1cdb2efbc3b35fc360c775d25240d-800x.jpg)