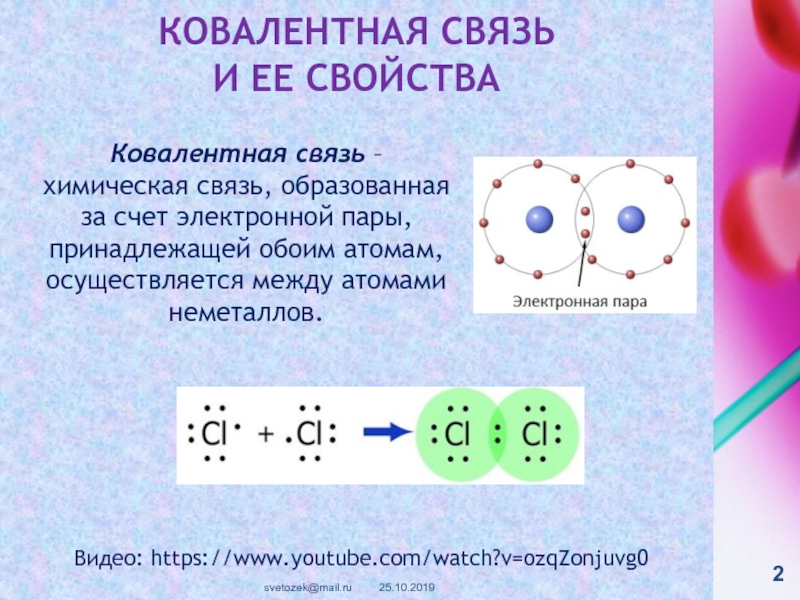
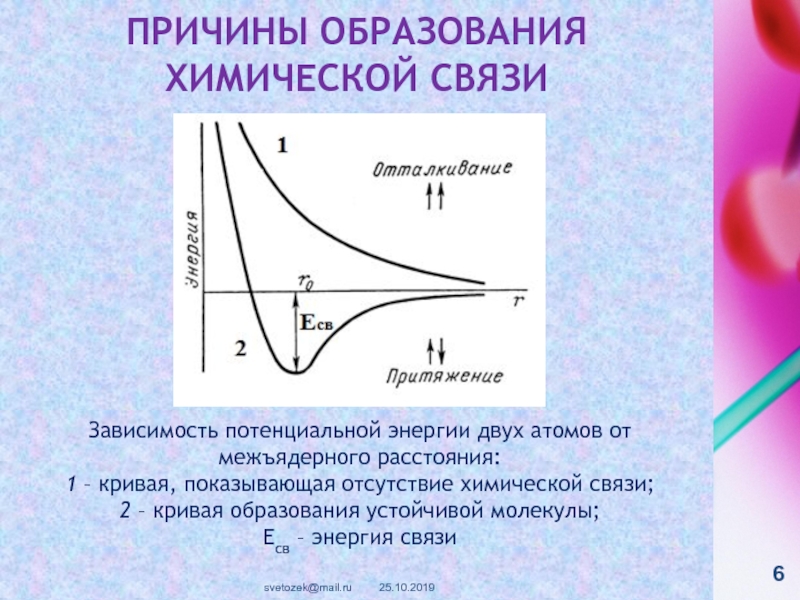
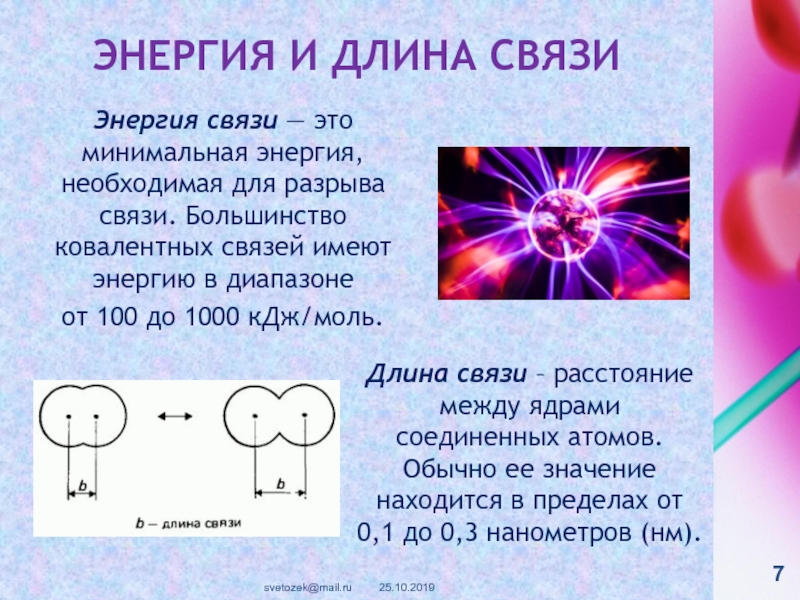
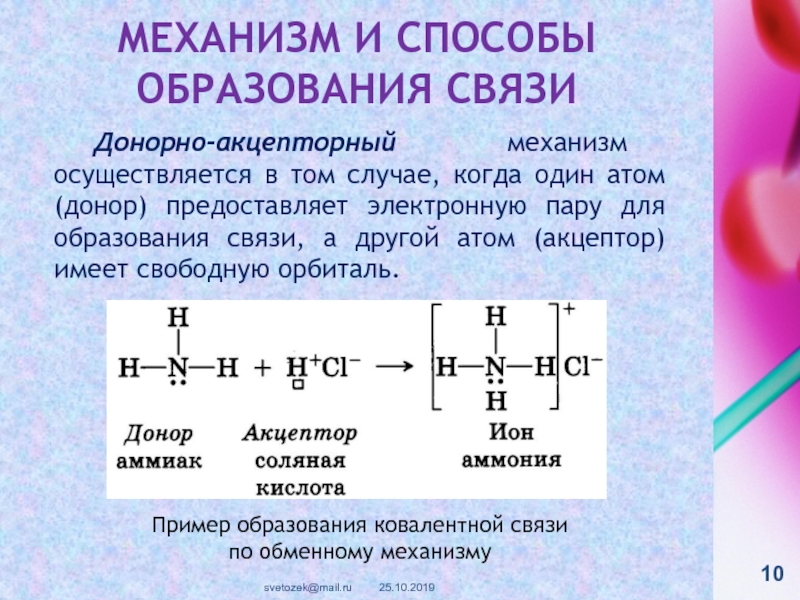
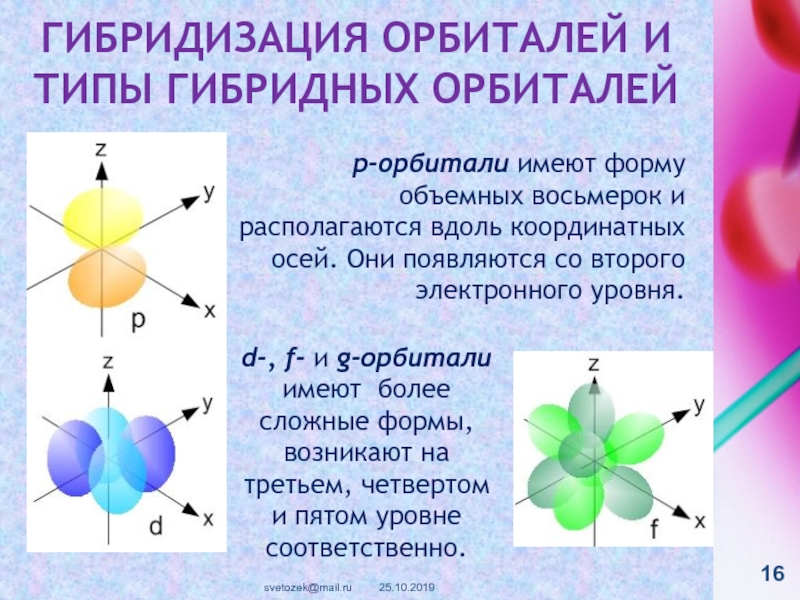
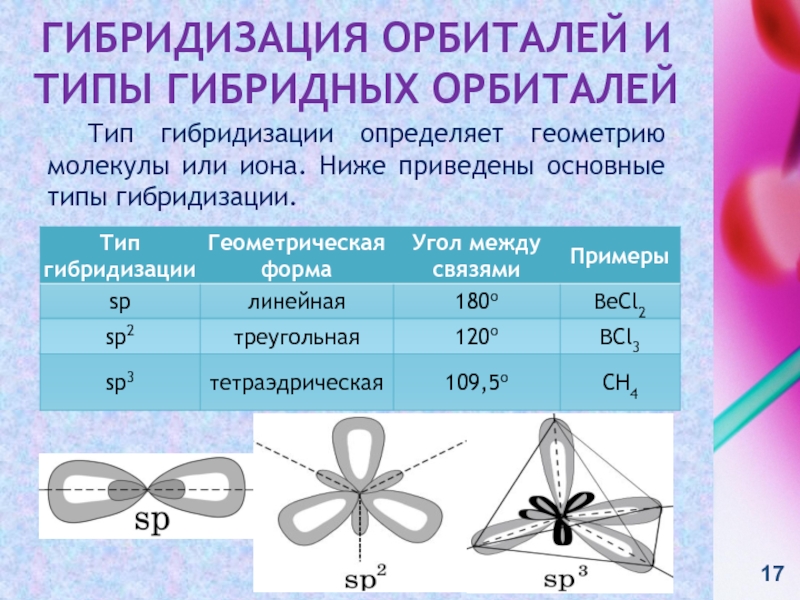
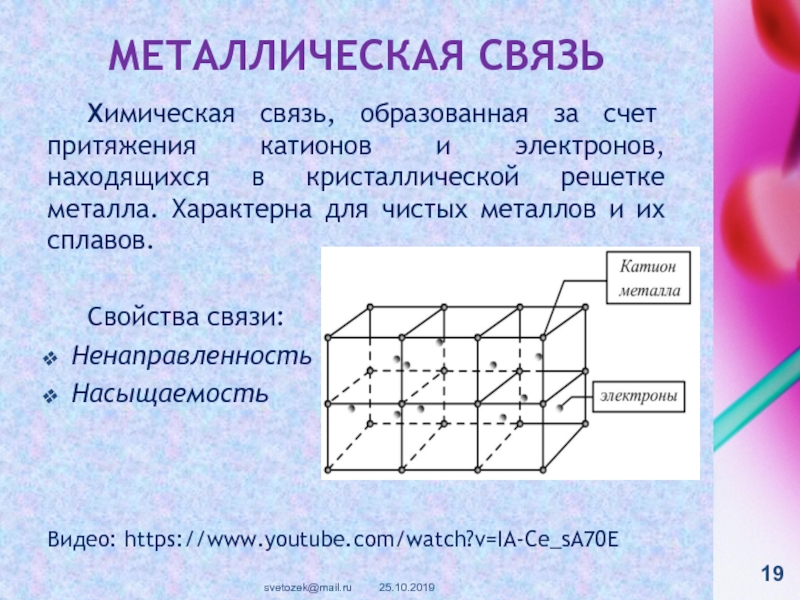
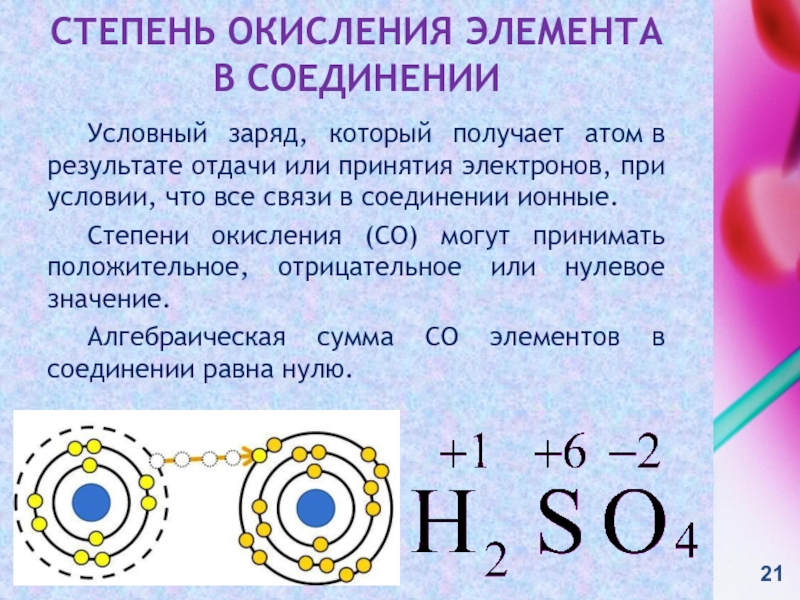
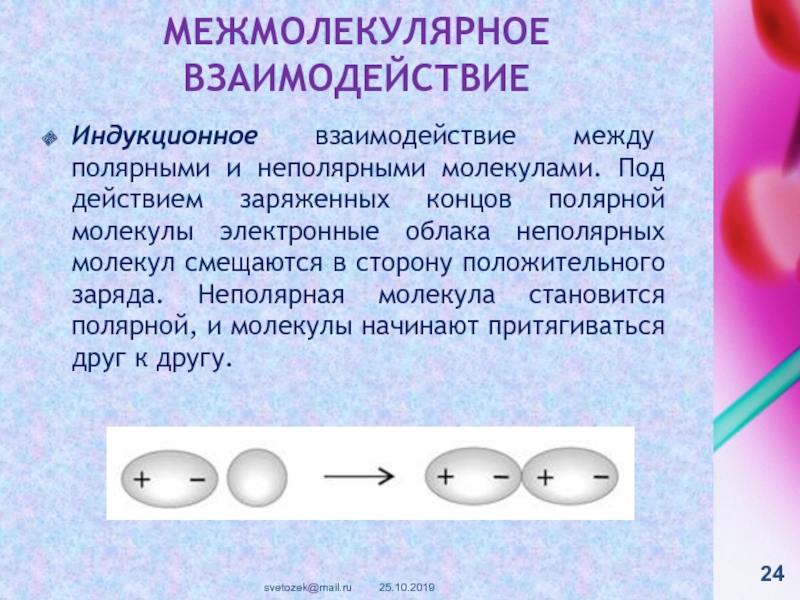
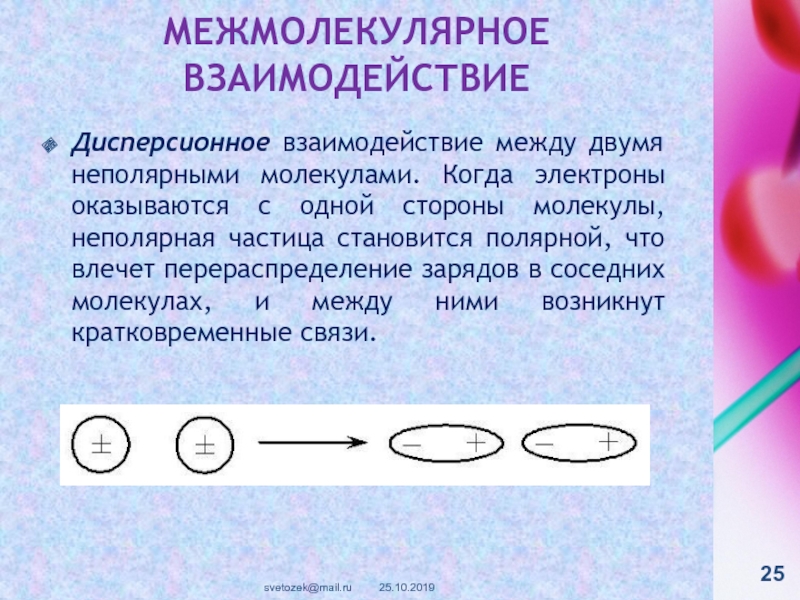
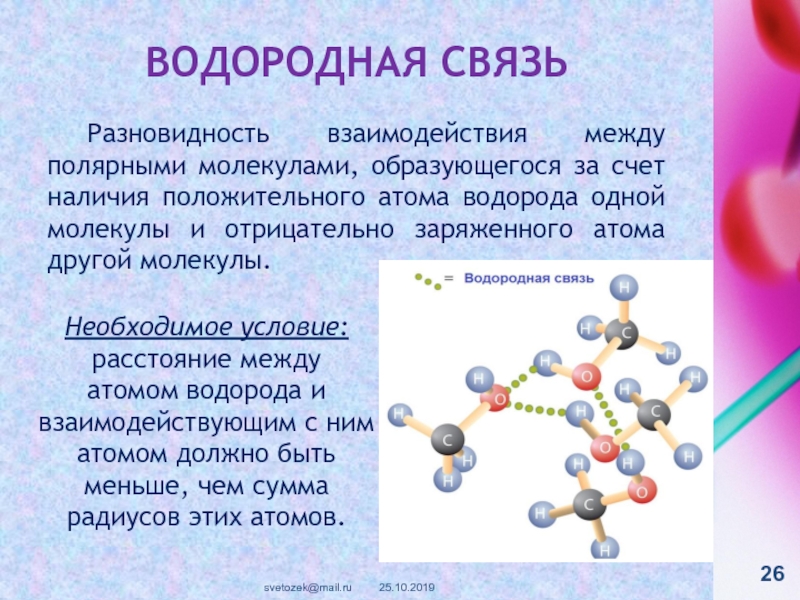
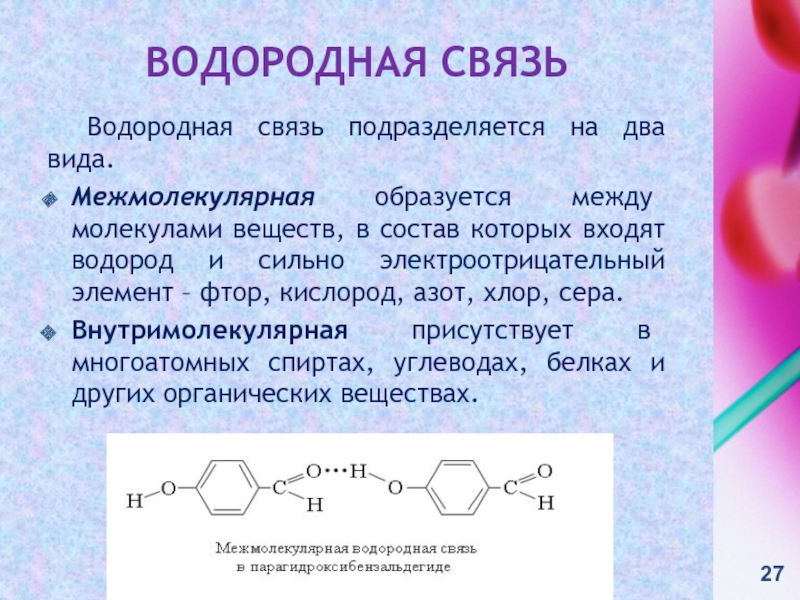
контакте «Живая Химия» : http://vk.com/sibsiukoax
Институт фундаментального образования
Кафедра естественнонаучных дисциплин
имени
профессора В.М. Финкеля Доклад по дисциплине «Химия» на тему: