Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХИМИЧЕСКАЯ СВЯЗЬ Лекция 3
Содержание
- 1. ХИМИЧЕСКАЯ СВЯЗЬ Лекция 3
- 2. ХИМИЧЕСКАЯ СВЯЗЬТеория химической связи – центральный вопрос
- 3. Рассмотрение химической связи требует ответа на три
- 4. 1. ЧТО ТАКОЕ ХИМИЧЕСКАЯ СВЯЗЬ?«Под химической связью
- 5. 2. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ?Почему большинство элементов
- 6. 2. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ?Ответ вытекает из
- 7. 2. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ?Таким образом, образование
- 8. 3. КАК ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ, ИЛИ КАКОВА
- 9. У s- и p- элементов внешними электро-нами
- 10. В зависимости от характера распреде-ления электронной плотности
- 11. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИИоннаяКовалентнаяМеталлическая.ОСНОВНЫЕ ТИПЫ:1. Водородная химическая связь.2. Вандерваальсовы взаимодействия.КРОМЕ ТОГО, МЕЖДУ МОЛЕКУЛАМИ ВОЗНИКАЮТ:
- 12. С В О Й С Т
- 13. Ионная химическая связь представляет собой электростатическое взаимодействие
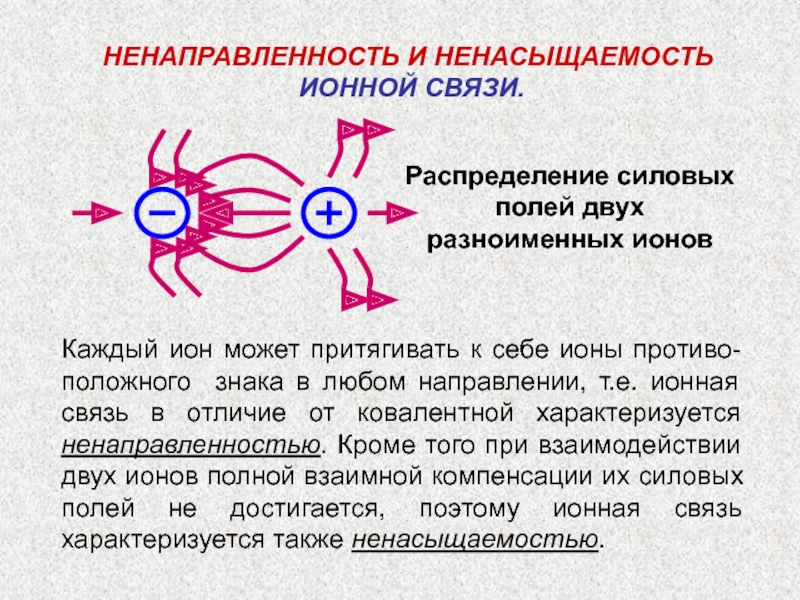
- 14. НEНАПРАВЛЕННОСТЬ И НЕНАСЫЩАЕМОСТЬ ИОННОЙ СВЯЗИ.Распределение силовых полей
- 15. Чисто ионной связи не существует. Можно лишь
- 16. ВЫВОД. Связи ионными на 100% практически не
- 17. Li0,98Na0,93К0,91Rb0,89Be1,5Mg1,2Ca1,04Sr0,99В2,0Al1,6Ga1,8In1,5С2,5Si1,9Ge2,0Sn1,7N3,07P2,2As2,1Sb1,8О3,5S2,6Se2,5Те2,1F4,0Сl3,0Br2,8I2,6Н 2,1ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ АТОМОВ (по Полингу)
- 18. Ковалентная связь – связь, образуемая парой электронов,
- 19. Стремление атомов к достижению устойчивых электронных конфигураций,
- 20. ОБРАЗОВАНИЕ ОКТЕТАCl· + ·Cl ׃
- 21. ТЕОРИИ ХИМИЧЕСКОЙ СВЯЗИВ современной теории химической связи
- 22. КОВАЛЕНТНАЯ СВЯЗЬ. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙМетод ВС основан
- 23. 3. Согласно методу ВС атомы, вступающие в
- 24. 2. Донорно-акцепторный:КОВАЛЕНТНАЯ СВЯЗЬ. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙСуществуют два
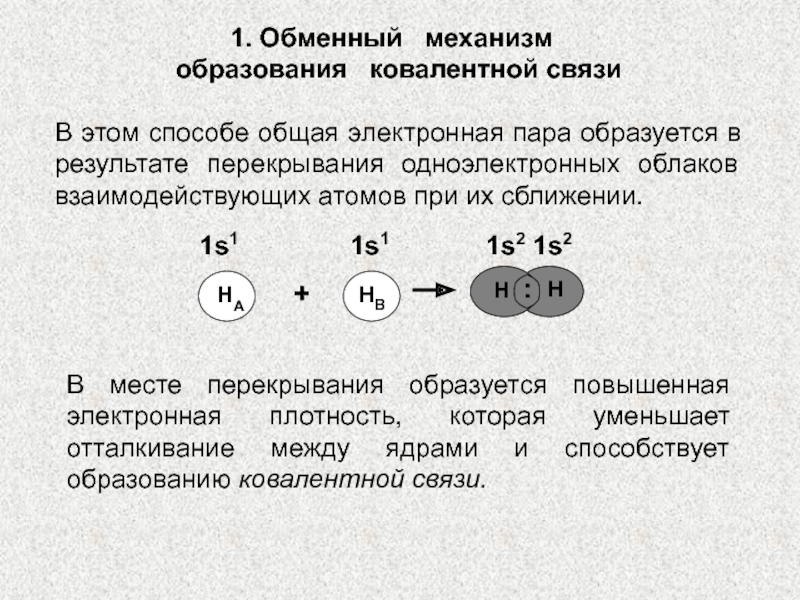
- 25. 1. Обменный механизм образования
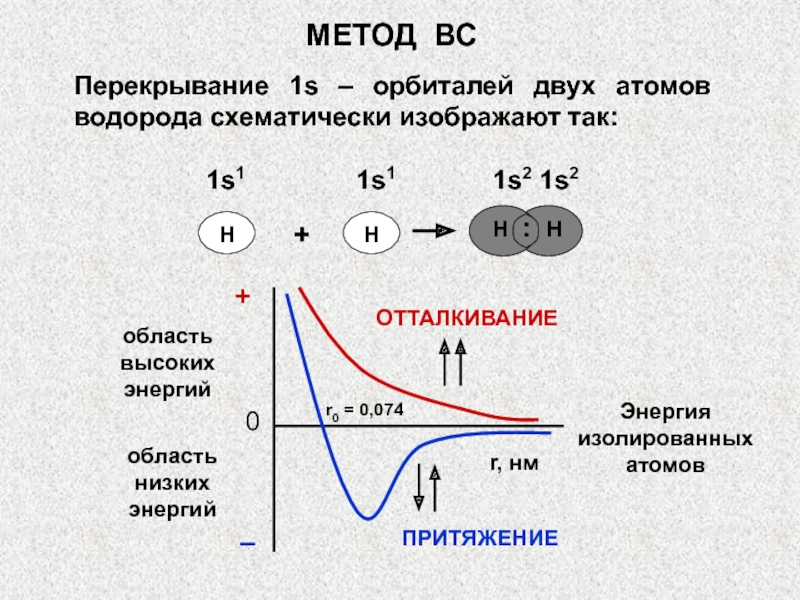
- 26. МЕТОД ВСПерекрывание 1s – орбиталей двух атомов
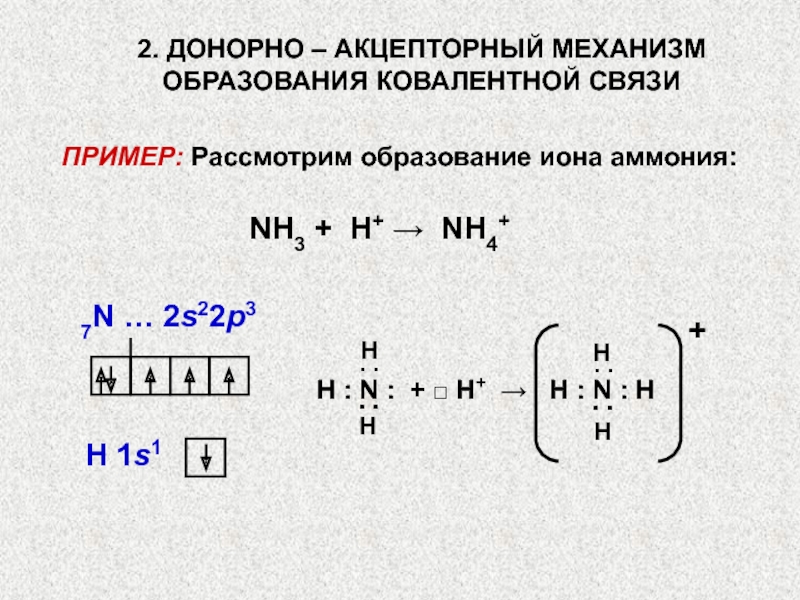
- 27. ПРИМЕР: Рассмотрим образование иона аммония:NH3 + H+
- 28. N2S2PH+1S1S1S1SHHHН+ + :NH3 → NH4+ ОБРАЗОВАНИЕ ИОНА АММОНИЯ: АЛЬТЕРНАТИВНАЯ СХЕМА
- 29. СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ1. НАСЫЩАЕМОСТЬ 2. НАПРАВЛЕННОСТЬ 3.
- 30. Возбужденное состояние атома возникает в результате распаривания
- 31. Валентность определяемая числом имеющихся в атоме неспаренных
- 32. ВАЛЕНТНОСТЬ. Таким образом, суммарная валентность элемента равна
- 33. Полярность связи количественно оценивается дипольным моментом μ,
- 34. Полярность молекулы, как и полярность связи, оценивают
- 35. Дипольные моменты молекул μ, Кл • м
- 36. Кратность связи определяется числом общих электронных пар.
- 37. КЛАССИФИКАЦИЯ КОВАЛЕНТНЫХ СВЯЗЕЙ ПО СПОСОБУ ПЕРЕКРЫВАНИЯ АОа)
- 38. НАПРАВЛЕННОСТЬ СВЯЗЕЙ. СОСОБЫ ПЕРЕКРЫВАНИЯ АОσ-связьπ-связьδ-связьs-s s-p p-p
- 39. σ-связьπ-связьОбычно σ-π-связи иллюстрируют на примере p-p-перекрывания Ось
- 40. ϭ- связьπ-связиМолекула ацетилена линейна!180оH − C ≡
- 41. Гибридизация – смешение в процессе образования
- 42. Благодаря гибридизации достигается бо′льшая прочность химических связей!Гибридная
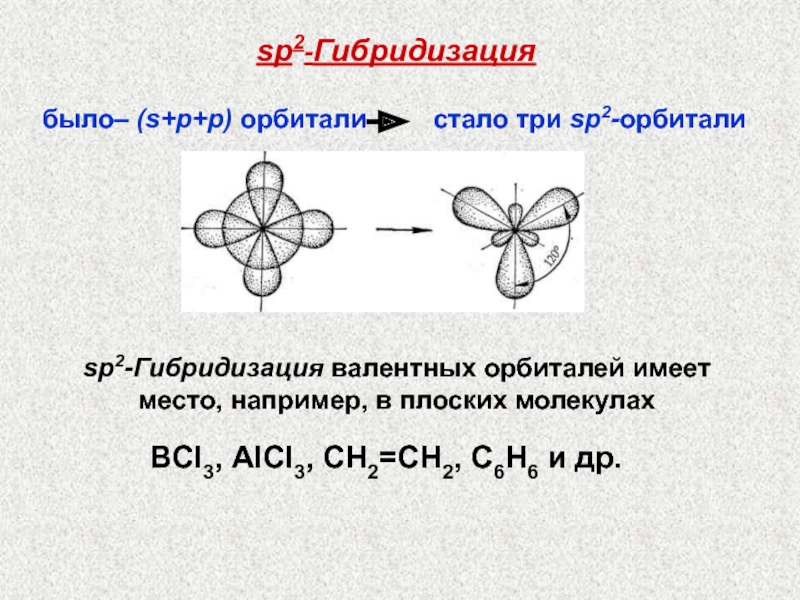
- 43. sp2 – гибридизацияТИПЫ ГИБРИДИЗАЦИИ АОsp – гибридизация120º
- 44. sp3 – гибридизацияCН4Н2ОNН3ОNC104,50107,30Н-C-Н = 109,50Н-О-Н = 104,50Н-N-Н = 107,30····••••••··ТИПЫ ГИБРИДИЗАЦИИ АО
- 45. ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ МОЛЕКУЛ. Гибридизация АО определяет пространствен-ную
- 46. Лекция №8. ГИБРИДИЗАЦИЯ ВАЛЕНТНЫХ ОРБИТАЛЕЙ(s + р)-орбитали
- 47. sp2-Гибридизацияsр2-Гибридизация валентных орбиталей имеет место, например, в
- 48. sp3-гибридизацияСтруктура молекул СН4, Н2О и NН3CН4Н2ОNН3ОNC104,50107,30Н-C-Н = 109,50Н-О-Н = 104,50Н-N-Н = 107,30····••••••··
- 49. ТИПЫ ГИБРИДИЗАЦИИ АО И ФОРМА МОЛЕКУЛ
- 50. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ. Основные положения
- 51. г) распределение электронов по новым МО или
- 52. Энергетическая диаграмма АО и МО двухатомных молекул
- 53. б) АО должны возможно полнее перекрываться; в)
- 54. По возрастанию энергии МО орбитали двухатомных молекул
- 55. Энергетическая схема образования гомоатомных двуядерных молекул элементов
- 56. ПОРЯДОК СВЯЗИ = число связ. эл-ов –
- 57. ХИМИЧЕСКАЯ СВЯЗЬПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 58. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧОпределить разность относительных электро-отрицательностей атомов
- 59. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧР е ш е н
- 60. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧОбъяснить механизм образования молекулы SiF4
- 61. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧР е ш е н
- 62. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧР е ш е н
- 63. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧР е ш е н
- 64. Определите максимальную валентность кислорода и фтора.ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧПример 3.
- 65. Кислород и фтор во всех соединениях проявляют
- 66. Какую валентность проявляет хлора ?ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧПример 4.
- 67. Решение 4. Хлор проявляет переменную валентность 1,
- 68. Пример 5. Определите возможные валентности атома кобальта.ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 69. Решение 5. Отсутствие неспаренных электронов у атома
- 70. В возбужденном состоянии происходит рас-спаривание
- 71. Пример 6. Определите пространственную структуру молекулы H2S. Почему валентный угол чуть больше 90°?ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 72. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧННSхуz9203sН 1s1Н 1s1S 3s23p43рРешение 6.
- 73. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 7. Вычислите дипольный
- 74. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 8. Одинаковая ли полярность молекул ВН3 и SbH3?
- 75. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧРешение. Для оценки полярности молекулы
- 76. Решение 8(а). Молекула ВН3 имеет плоскую
- 77. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧРешение 8(б). Молекула SbH3 имеет
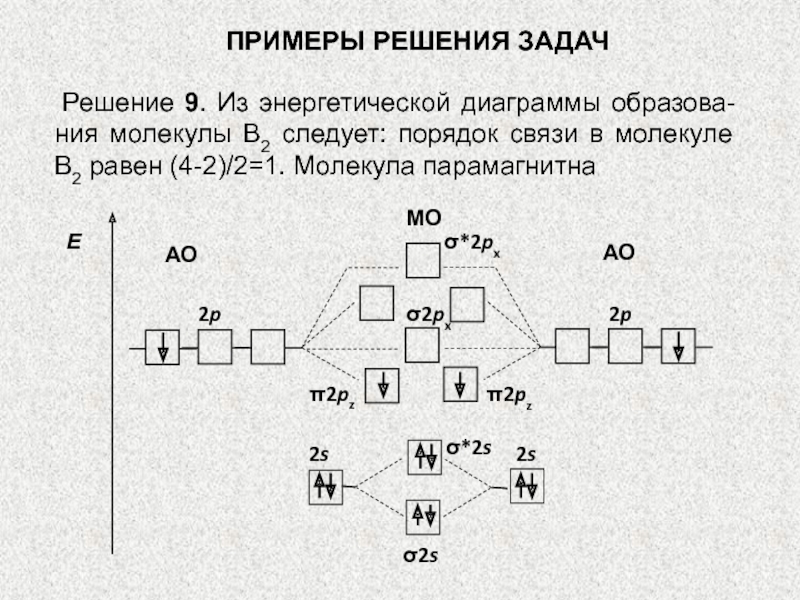
- 78. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧПример 9. Какая из молекул
- 79. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Решение 9. Из энергетической
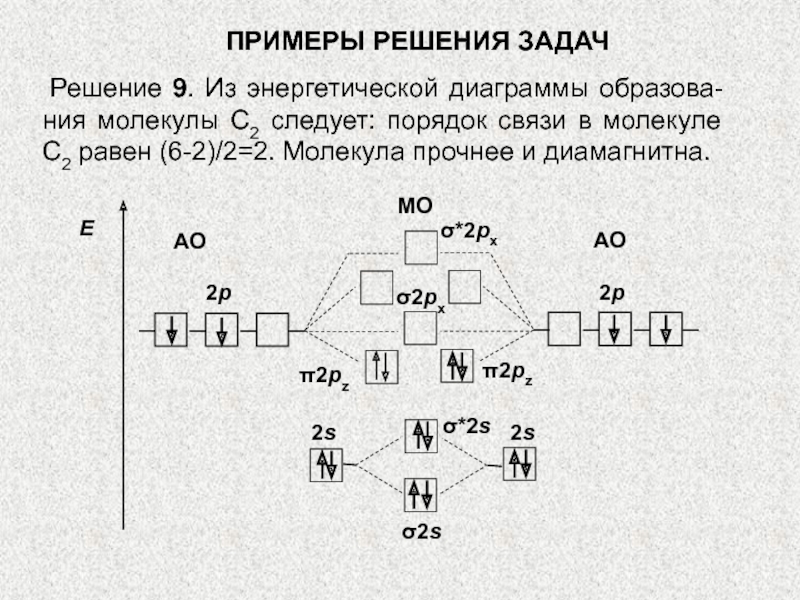
- 80. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ2pАОАОМОЕ2pπ2pzσ*2sπ2pzσ2s2s2sσ2pxσ*2px Решение 9. Из энергетической
- 81. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- 82. 236. Описать с позиций метода ВС электронное
- 83. ИНДИВИДУАЛЬНЫЕ ЗАДАЧИЗадача 1:1) покажите распределение валентных электронов
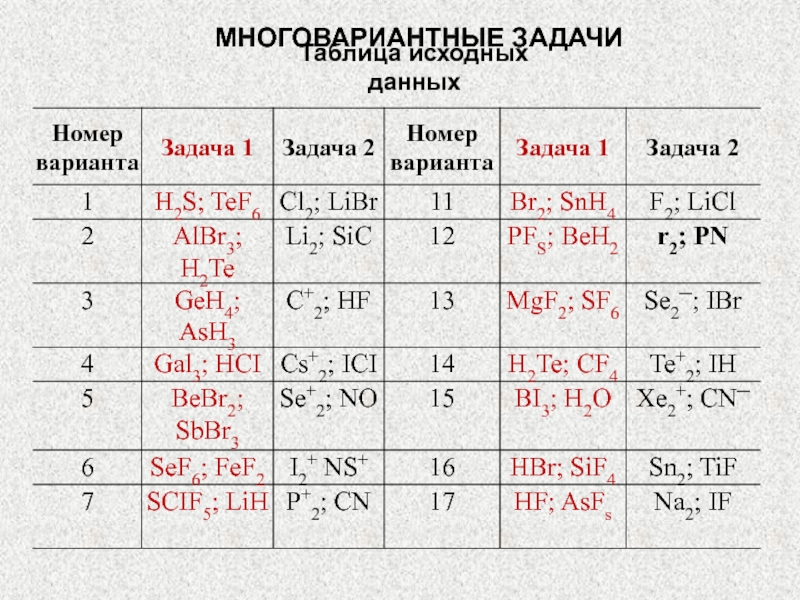
- 84. МНОГОВАРИАНТНЫЕ ЗАДАЧИЗадача 2:1) напишите электронные формулы атомов,
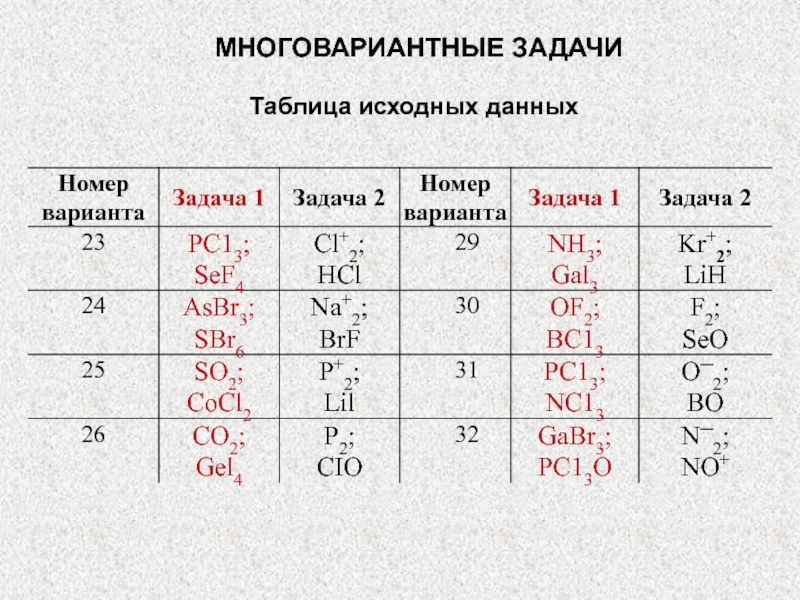
- 85. Таблица исходных данныхМНОГОВАРИАНТНЫЕ ЗАДАЧИ
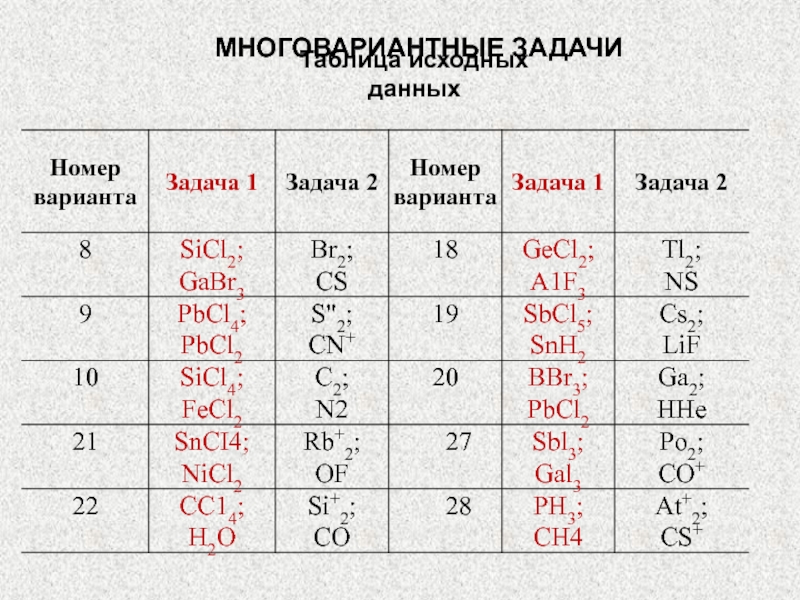
- 86. МНОГОВАРИАНТНЫЕ ЗАДАЧИТаблица исходных данных
- 87. МНОГОВАРИАНТНЫЕ ЗАДАЧИТаблица исходных данных
- 88. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Рассмотрение химической связи требует ответа на три извечных вопроса: Что?
Почему? Как ?
Что такое химическая связь.
Почему образуется химическая
связь?Как образуется химическая связь, или какова природа химической связи ?
ХИМИЧЕСКАЯ СВЯЗЬ
Слайд 41. ЧТО ТАКОЕ ХИМИЧЕСКАЯ СВЯЗЬ?
«Под химической связью следует понимать силу,
удерживающую атомы друг около друга в молекулах, ионах или кристаллах»
По
другому: химическая связь — это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.Слайд 52. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ
СВЯЗЬ?
Почему большинство элементов (кроме благородных газов)
обычно существуют в природе не в виде изолированных атомов, а
в виде более сложных агрегатов: молекул или кристаллов? Что заставляет атомы объединяться друг с другом?Слайд 62. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ
СВЯЗЬ?
Ответ вытекает из следующего термодина-мического принципа:
«минимуму
энергии системы соответствует максимум устойчивости и, наоборот, минимуму устойчивости отвечает
максимум энергии»Вспомним: санки всегда скатываются с горы вниз, а не наоборот!
Слайд 72. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ
СВЯЗЬ?
Таким образом, образование химических соединений происходит
потому, что возникает энергетическое состояние с более низкой полной энергией,
чем у непрореагировавших исходных атомов.Иными словами молекулярное состояние вещества устойчивее, чем атомное.
При образовании связей всегда выделяется энергия:
Слайд 83. КАК ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ,
ИЛИ КАКОВА ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ
?
Фундаментальная роль в образовании химических связей принадлежит электронам, именно они
выполняют роль своеобразного «клея», удерживающего атомы друг около друга.Доказано, что главную роль при этом играют электроны, расположенные на внешней оболочке и, следовательно, связанные с ядром наименее прочно, так называемые валентные электроны.
Слайд 9У s- и p- элементов внешними электро-нами являются:
… ns1-2 или
…ns2np1-6
2. У d-элементов внешними ns- и пред-внешними (n-1) d- электронами:
…(n-1)d1-10ns2
3.
У f-элементов nS, (n-1)d и (n-2)f- электро-нами.…(n-2)f 1-14 ns2
Химическая связь осуществляется валентными электронами:
Слайд 10В зависимости от характера распреде-ления электронной плотности между взаимодействующими атомами
различают различные типы химической связи:
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
Слайд 11ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
Ионная
Ковалентная
Металлическая.
ОСНОВНЫЕ ТИПЫ:
1. Водородная химическая связь.
2. Вандерваальсовы взаимодействия.
КРОМЕ ТОГО,
МЕЖДУ МОЛЕКУЛАМИ ВОЗНИКАЮТ:
Слайд 12 С В О Й С Т В А Х
И М И Ч Е С К ОЙ С
В Я З ИЭНЕРГИЯ И ДЛИНА СВЯЗИ.
Длиной связи называется межъядерное расстояние взаимодействующих атомов. Она зависит от размеров электронных оболочек и степени их перекрывания.
С уменьшением длины связи обычно увеличива-ется энергия связи и соответственно устой-чивость молекул.
Энергией химической связи Есв кДж/моль называ-ется количество энергии, выделяющееся при образо-вании химической связи. Чем больше энергия хими-ческой связи, тем устойчивее молекулы.
Слайд 13Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно
заряженных ионов в химическом соединении.
Такая связь возникает лишь в
случае большой разности ЭО атомов, например между катионами s-металлов I и II групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, K2O и др.).ИОННАЯ СВЯЗЬ
Слайд 14НEНАПРАВЛЕННОСТЬ И НЕНАСЫЩАЕМОСТЬ
ИОННОЙ СВЯЗИ.
Распределение силовых полей двух разноименных ионов
Каждый
ион может притягивать к себе ионы противо-положного знака в любом
направлении, т.е. ионная связь в отличие от ковалентной характеризуется ненаправленностью. Кроме того при взаимодействии двух ионов полной взаимной компенсации их силовых полей не достигается, поэтому ионная связь характеризуется также ненасыщаемостью.Слайд 15Чисто ионной связи не существует. Можно лишь говорить о степени
(доле) ионности связи.
Для оценки способности атома данного элемента оттягивать к
себе электроны, осуществляющие связь, пользуются значением относительной электро-отрицательности (ЭО)СТЕПЕНЬ (ДОЛЯ) ИОННОСТИ СВЯЗИ
Под ЭО атома понимают его способность притягивает к себе обобществленные электро-ны. Поэтому, чем больше разность электроотрица-тельностей (∆ЭО) взаимодействующих атомов, тем выше степень ионности связи.
Слайд 16ВЫВОД. Связи ионными на 100% практически не бывают.
РАЗНОСТЬ ЭО
АТОМОВ И
СТЕПЕНЬ ИОННОСТИ СВЯЗИ
Разность
ОЭО
Степень
ионности, %
0 0,5 1
1,5 2 2,5 3 3,30 6 18 34 54 71 82 89
Слайд 17Li
0,98
Na
0,93
К
0,91
Rb
0,89
Be
1,5
Mg
1,2
Ca
1,04
Sr
0,99
В
2,0
Al
1,6
Ga
1,8
In
1,5
С
2,5
Si
1,9
Ge
2,0
Sn
1,7
N
3,07
P
2,2
As
2,1
Sb
1,8
О
3,5
S
2,6
Se
2,5
Те
2,1
F
4,0
Сl
3,0
Br
2,8
I
2,6
Н
2,1
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
АТОМОВ (по Полингу)
Слайд 18Ковалентная связь – связь, образуемая парой электронов, распределенной (обобществленной) между
двумя или большим числом атомов.
Первую модель ковалентной связи, основанную на
представлении об обобществлении электронов предложил американский ученый Льюис, 1916г.Льюис выдвинул следующий принцип:
ТЕОРИЯ КОВАЛЕНТНОЙ СВЯЗИ
«атомы образуют химические связи в результате потери, присоединения или обобществления такого количества электронов, чтобы приобрести структуру наружной оболочки как у благородного газа (ns2np6)».
Слайд 19Стремление атомов к достижению устойчивых электронных конфигураций, как в атомах
благородных газов составляет суть положения, известного как «правило октета»:
ПРАВИЛО ОКТЕТА
(Льюис,
1875-1946)«при образовании химической связи атомы стремятся к достижению устойчивой восьмиэлектронной (октетной) или двух-электронной (дублет) наружной оболочки».
Слайд 20ОБРАЗОВАНИЕ ОКТЕТА
Cl· + ·Cl ׃ → ׃Cl
׃ Cl ׃
. . . . Na· + ·Cl ׃ → Na ׃ Cl ׃
▪ ▪ ▪ ▪
2s22p53s1 3s23p5 2s22p6 3s23р6
+
–
. .
. .
. .
. .
1. Обобществление электронов (ковалентная связь)
··
▪ ▪
▪ ▪
▪ ▪
▪ ▪
3s23p5 3s23p5 3s23p6 3s23p6
2. Перенос электрона (ионная связь)
электронный октет
Слайд 21ТЕОРИИ ХИМИЧЕСКОЙ СВЯЗИ
В современной теории химической связи для описания ковалентной
связи и строения молекул используют два метода:
1. Метод валентных
связей (МВС).2. Метод молекулярных орбиталей (ММО).
Слайд 22КОВАЛЕНТНАЯ СВЯЗЬ. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Метод ВС основан на следующих идеях:
1.
Химическая ковалентная связь возникает в результате перекрывания атомных орбиталей (одноэлектронных
облаков) взаимодействующих атомов; получающаяся связь является двух-центровой двухэлектронной связью.2. При образовании молекулы электронная структура составляющих ее атомов в основном сохраняется, а все химические связи в молекуле могут быть представлены набором локализованных (фиксированных) двухцентровых двухэлектронных связей.
Слайд 233. Согласно методу ВС атомы, вступающие в химическую связь, обмениваются
между собой электронами, которые образуют связывающие пары. Энергия обмена электронами
между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи.Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ.
Слайд 242. Донорно-акцепторный:
КОВАЛЕНТНАЯ СВЯЗЬ. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Существуют два принципиальных механизма образования
ковалентной связи:
1. Обменный:
А· + ·В А:В
А:
+ □В А – В Слайд 251. Обменный механизм
образования ковалентной связи
В
этом способе общая электронная пара образуется в результате перекрывания одноэлектронных
облаков взаимодействующих атомов при их сближении.НА
НВ
Н :
Н
+
1s1 1s1 1s2 1s2
В месте перекрывания образуется повышенная электронная плотность, которая уменьшает отталкивание между ядрами и способствует образованию ковалентной связи.
Слайд 26МЕТОД ВС
Перекрывание 1s – орбиталей двух атомов водорода схематически изображают
так:
Н
Н
Н :
Н
+
1s1
1s1 1s2 1s2область
высоких
энергий
область
низких
энергий
ОТТАЛКИВАНИЕ
ПРИТЯЖЕНИЕ
r0 = 0,074
r, нм
+
0
–
Энергия
изолированных
атомов
Слайд 27ПРИМЕР: Рассмотрим образование иона аммония:
NH3 + H+ → NH4+
H ׃
N ׃ + □ H+ → H ׃ N
׃ H▪ ▪
H
H 1s1
H
H
7N … 2s22p3
. .
. .
▪ ▪
H
2. ДОНОРНО – АКЦЕПТОРНЫЙ МЕХАНИЗМ
ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ
+
Слайд 29СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
1. НАСЫЩАЕМОСТЬ
2. НАПРАВЛЕННОСТЬ
3. ПОЛЯРИЗУЕМОСТЬ
НАСЫЩАЕМОСТЬ КОВАЛЕНТНОЙ СВЯЗИ.
ВАЛЕНТНОСТЬ
Вследствие насыщаемости ковалентной связи, атомы элементов могут образовывать лишь ограниченное
число химических связей.Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью
Слайд 30Возбужденное состояние атома возникает в результате распаривания электронов и перехода
их на свободные орбитали того же энергетического уровня. Например, электронная
конфигурация и валентность магния в основном и возбужденном состояниях следующие:ВАЛЕНТНОСТЬ.
Mg
Mg*
3s
3p
3s
3p
Количественной мерой валентности считают число неспаренных электронов у атома в основном или возбужденном состоянии
Слайд 31Валентность определяемая числом имеющихся в атоме неспаренных электронов или образую-щихся
при его возбуждении называется СПИНВАЛЕНТНОСТЬЮ.
С учетом донорно-акцепторного механизма образования ковалентной
связи численное значение валентности будет определяться не только наличием одноэлектронных облаков, но и двух – электронных облаков и свободных орбиталей.НАСЫЩАЕМОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ВАЛЕНТНОСТЬ.
Слайд 32ВАЛЕНТНОСТЬ.
Таким образом, суммарная валентность элемента равна числу неспаренных электронов
(обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму.
Слайд 33Полярность связи количественно оценивается дипольным моментом μ, который является произведением
длины диполя l — расстояния между двумя равными по величине
и противоположными по знаку зарядами +q и -q — на абсолютную величину заряда:μ = l ∙ q
ПОЛЯРНОСТЬ КОВАЛЕНТНОЙ СВЯЗИ
Дипольный момент является величиной векторной и направлен по оси диполя от отрицательного заряда к положительному.
Следует различать дипольные моменты (поляр-ность) отдельных связей и молекулы в целом:
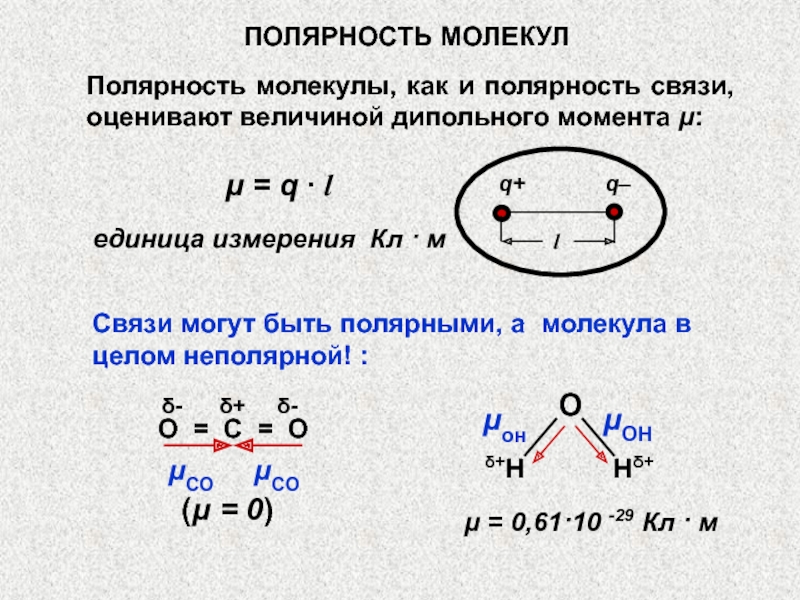
Слайд 34Полярность молекулы, как и полярность связи, оценивают величиной дипольного момента
μ:
μ = q ∙ l
q+
q– l
единица измерения Кл · м
Связи могут быть полярными, а молекула в целом неполярной! :
δ- δ+ δ-
O = C = O
μ = 0,61·10 -29 Кл · м
(μ = 0)
O
μон
δ+H Hδ+
μОН
ПОЛЯРНОСТЬ МОЛЕКУЛ
μСО μCO
Слайд 36Кратность связи определяется числом общих электронных пар. Так кратность связи
в молекуле хлороводорода (Н-Cl) равна одному, кратность связи углерод-углерод в
молекуле этилена (H2C=CH2) равна двум, в молекуле азота (N ≡ N) – трем:КЛАССИФИКАЦИЯ КОВАЛЕНТНЫХ
СВЯЗЕЙ ПО КРАТНОСТИ
Таким образом по кратности ковалентные связи подразделяются на одинарные (или простые), двойные и тройные.
Слайд 37КЛАССИФИКАЦИЯ КОВАЛЕНТНЫХ СВЯЗЕЙ
ПО СПОСОБУ ПЕРЕКРЫВАНИЯ АО
а) Связь, образованная перекрыванием
АО по линии, соединяющей ядра взаимодействующих атомов, называется ϭ-связью (сигма-свяью);
б)
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью; в) Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью (дельта-связью).
Слайд 38НАПРАВЛЕННОСТЬ СВЯЗЕЙ. СОСОБЫ
ПЕРЕКРЫВАНИЯ АО
σ-связь
π-связь
δ-связь
s-s
s-p
p-p
d-d
p-p
d-p
d-dd-d-перекрывание
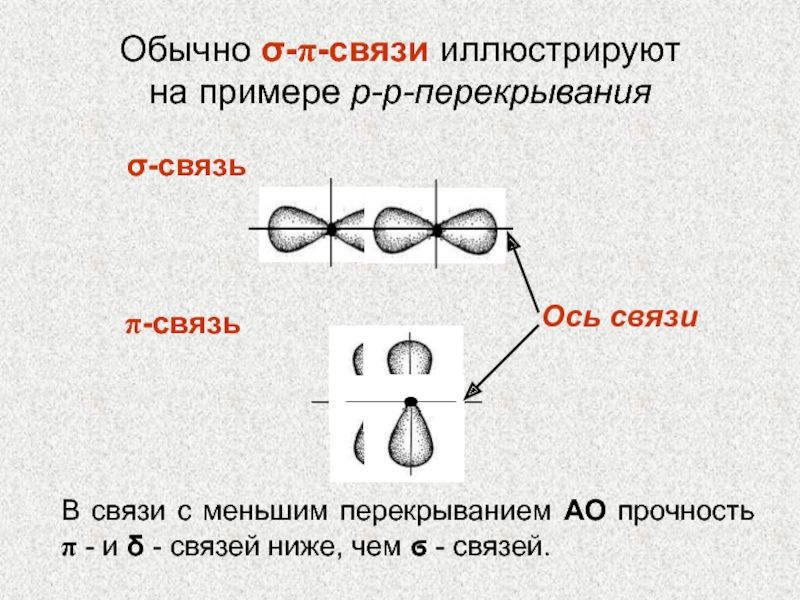
Слайд 39σ-связь
π-связь
Обычно σ-π-связи иллюстрируют на примере p-p-перекрывания
Ось связи
В связи с
меньшим перекрыванием АО прочность π - и δ - связей
ниже, чем ϭ - связей.Слайд 40ϭ- связь
π-связи
Молекула ацетилена линейна!
180о
H − C ≡ C − H
Ϭ-
и π- СВЯЗИ В МОЛЕКУЛЕ АЦЕТИЛЕНА
H − C ≡ C
− HСлайд 41 Гибридизация – смешение в процессе образования химической связи разных
по форме и энергии АО (s-, p-, d- или f),
с образованием новых, но уже одинаковых по форме и энергии орбиталей.В гибридизации участвуют близкие по значению энергии орбитали. Химические связи, образован-ные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
ГЕОМЕТРИЯ МОЛЕКУЛ
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Слайд 42Благодаря гибридизации достигается бо′льшая прочность химических связей!
Гибридная sр - орбиталь
асимметрична и сильно вытянута, по одну сторону от ядра, т.
е. электронная плотность в ней сконцентрирована по одну сторону в большей степени, чем по другую.ГЕОМЕТРИЯ МОЛЕКУЛ
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
гибридная
sр - орбиталь
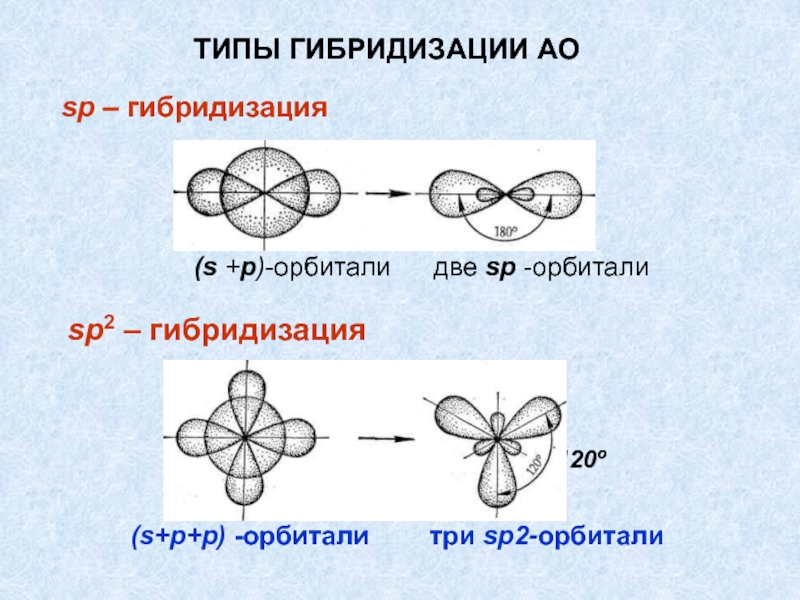
Слайд 43sp2 – гибридизация
ТИПЫ ГИБРИДИЗАЦИИ АО
sp – гибридизация
120º
(s +р)-орбитали
две sр -орбитали
(s+p+p) -орбитали три sp2-орбитали
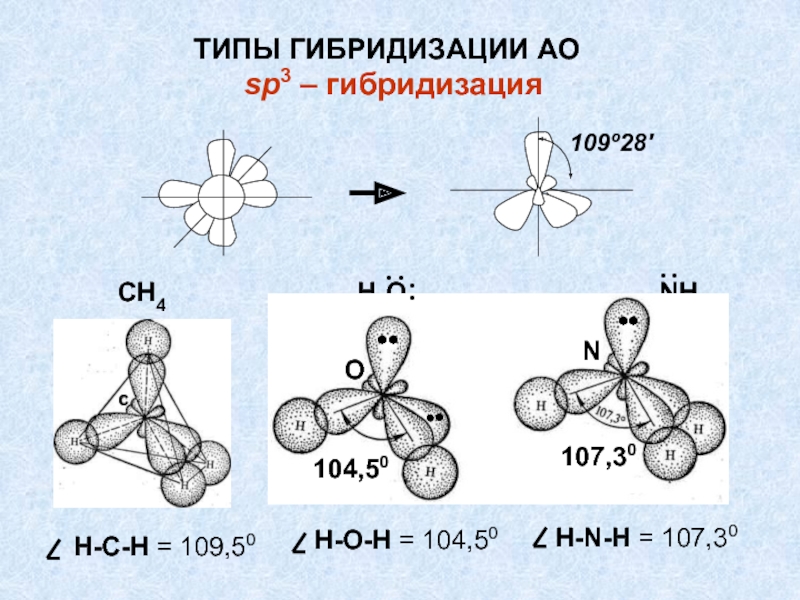
Слайд 44sp3 – гибридизация
CН4
Н2О
NН3
О
N
C
104,50
107,30
Н-C-Н = 109,50
Н-О-Н = 104,50
Н-N-Н = 107,30
··
··
••
••
••
··
ТИПЫ ГИБРИДИЗАЦИИ
АО
Слайд 45ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ МОЛЕКУЛ.
Гибридизация АО определяет пространствен-ную конфигурацию молекул. Так,
при sp-гибридизации образуются линейные молекулы, при sр2-гибридизации образуются плоские треугольные
молекулы с валентными углами 120°. В случае sр3-гибридизации имеют место тетраэдрические структуры с валентными углами 109° (см. [1, § 2.3]).Слайд 46Лекция №8.
ГИБРИДИЗАЦИЯ ВАЛЕНТНЫХ ОРБИТАЛЕЙ
(s + р)-орбитали
две sр-орбитали
sp – гибридизация
sр -гибридизация валентных орбиталей наблю-дается
у ц. а. таких молекул как ВеСl2, СН≡СН и др. Такие молекулы имеют линейую формуСлайд 47sp2-Гибридизация
sр2-Гибридизация валентных орбиталей имеет место, например, в плоских молекулах
было– (s+p+p)
орбитали стало три sp2-орбитали
ВCl3, АlСl3, CН2=CH2,
С6Н6 и др.Слайд 48sp3-гибридизация
Структура молекул СН4, Н2О и NН3
CН4
Н2О
NН3
О
N
C
104,50
107,30
Н-C-Н = 109,50
Н-О-Н = 104,50
Н-N-Н
= 107,30
··
··
••
••
••
··
Слайд 50МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
Основные положения метода МО:
а)
образование химических связей является результа-том перехода электронов с АО на
новые, называемые МО;б) каждой МО соответствует определенная энергия, приближенно характеризуемая энергией энергией ионизации молекулы;
в) электроны в молекуле не локализованы в межядерных пространствах, они могут перемещаться в электрическом поле нескольких ее ядер;
Слайд 51г) распределение электронов по новым МО или энергетическим уровням производится
в соответствии с принципом наименьшей энергии, правилами Паули и Гунда;
д) если переход электронов на МО энергетически выгоден, т. е. приводит к понижению энергии моле-кулы по сравнению с суммарной полной энергией взаимодействующих атомов, то химическая связь возникает.
Если же переход электронов на МО связан с затратой энергии, то молекула не образуется;
Основные положения метода МО:
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
Слайд 52Энергетическая диаграмма АО и МО двухатомных молекул 1-го периода
Энергетическая диаграмма
АО атомов водорода и МО молекул врдорода
1S
АО
АО
МО
МО
1S
Е
σ2s
*σ2s
σ2s – связывающая МО
*σ2s – разрыхляющая МО
Образование молекулярных орбиталей можно предста-влять в виде энергетических диаграмм.
ЭНЕРГЕТИЧЕСКИЕ ДИАГРАММЫ
Слайд 53б) АО должны возможно полнее перекрываться;
в) АО должны иметь
одинаковую симметрию относительно межядерной оси.
ЭНЕРГЕТИЧЕСКИЕ ДИАГРАММЫ.
УСЛОВИЯ ВЗАИМОДЕЙСТВИЯ АО
С ОБРАЗОВАНИЕМ
МО :а) энергии комбинируемых АО должны быть близки
Слайд 54По возрастанию энергии МО орбитали двухатомных молекул первого периода и
начала второго периода (до N2) можно расположить в следующий ряд:
σ1s
< σ*1s < σ2s < σ*2s < < π2ру == π2pz σ2рх < π*2ру = π*2рг < σ*2рх.
Молекулярные орбитали двухатомных молекул конца второго периода по возрастанию энергии располага-ются в несколько иной ряд:
σ1s < σ*1s < σ2s < σ*2s < σ2рх < π2ру =
= π2pz < π*2ру = π*2рг < σ*2рх.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
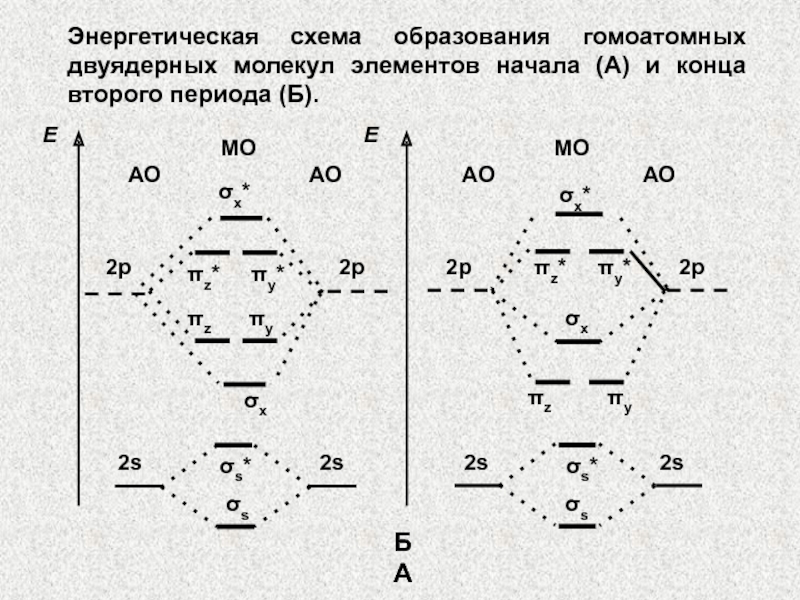
Слайд 55Энергетическая схема образования гомоатомных двуядерных молекул элементов начала (А) и
конца второго периода (Б).
МО АО АО
МО
АО АО
σx*
πz* πy*
πz πy
σx
πz* πy*
πz πy
σx
σx*
Е
Е
2р
2р
2р
2р
σs*
σs*
σs
σs
2s
2s
2s
2s
Б А
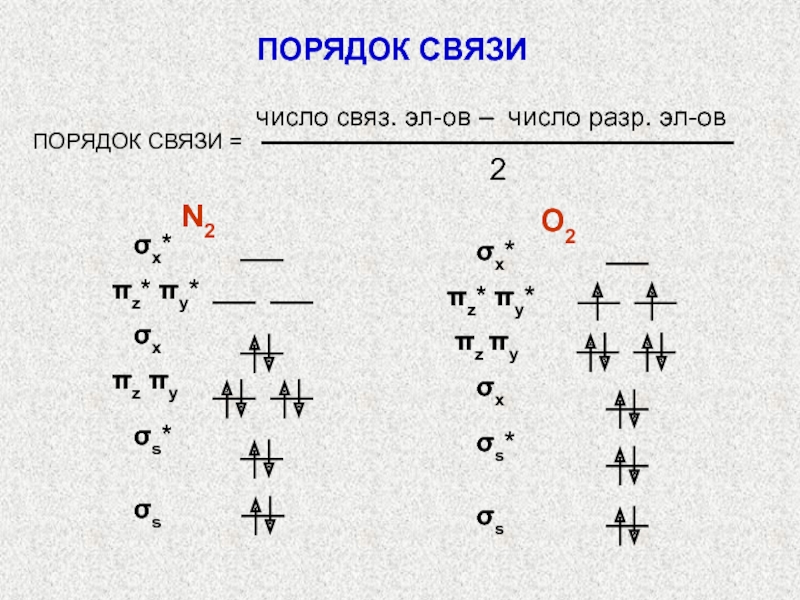
Слайд 56ПОРЯДОК СВЯЗИ =
число связ. эл-ов – число разр. эл-ов
2
ПОРЯДОК
СВЯЗИ
N2
O2
σx*
πz* πy*
σx
πz πy
σs*
σs
σx*
πz* πy*
πz πy
σx
σs*
σs
Слайд 58ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Определить разность относительных электро-отрицательностей атомов для связей Н
— О и О — Э в соединениях Э(ОН)2, где
Э — Mg, Ca или Sr, и определить:а) какая из связей Н — О или О — Э характе-ризуется в каждой молекуле большей степенью ионности;
б) каков характер диссоциации этих молекул в водном растворе?
Пример 1.
Слайд 59ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Р е ш е н и е 1.
По данным табл. ЭО вычисляем разность электроотрицательностей ∆ЭО для связей
О-Э:∆ЭО(Mg-O) = 3,5 - 1,2 = 2,3; ∆ЭО(Ca-O) = 3,5 - 1,04 = 2,46; ∆ЭО(Sr-O) = 3,5 — 0,99 = 2,51. Разность ЭО для связи О-Н составляет 1,4.
Т а к и м о б р а з о м: а) во всех рассмотренных молекулах связь Э-О более полярна, т. е. характе-ризуется большей степенью ионности; б) диссоциация на ионы в водных растворах будет осуществляться по наиболее ионной связи в соответствии со схемой:
Э(ОН)2 = Э2+ + 2ОН‾;
следовательно, все рассматриваемые соединения будут диссоциировать по типу оснований.
Слайд 60ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Объяснить механизм образования молекулы SiF4 и иона SiF62
‾. Может ли существовать ион CF62‾ ?
Пример 2.
Слайд 61ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Р е ш е н и е 2(a).
Электронная конфигурация атома кремния 1s22s22p63s23p2. Электронное строение его валентных орбиталей
в невозбужденном состоянии может быть представлено следующей графической схемой:3s
3p
3d
При возбуждении атом кремния переходит в состояние 1s22s22p63s13p3, а электронное строение его вален-тных орбиталей соответствует схеме, в связь вступают 4 электрона:
3s
3p
3d
Слайд 62ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Р е ш е н и е 2(б-
продолжение).
Четыре неспаренных электрона возбужденного атома могут участвовать в образовании
четырех ковален-тных связей по обычному механизму с атомами фтора (1s22s22p5), имеющими по одному неспаренному электрону, с образованием молекулы SiF4.Для образования иона SiF62‾ к молекуле SiF4 должны присоединяться два иона F‾ (1s2s22p6 ), все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух вакантных Зd-орбиталей атома кремния.
Слайд 63ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Р е ш е н и е 2(в
- продолжение).
Углерод (1s22s22p2 ) может образовать, подобно кремнию, соединение CF4,
но при этом валентные возможности углерода будут исчерпаны (нет неспа-ренных электронов, неподеленных пар и вакантных орбиталей на валентном уровне). Ион CF62‾ образоваться не может.Слайд 65Кислород и фтор во всех соединениях проявляют постоянную валентность, равную
двум для кислорода и единице для фтора. Валентные электроны этих
элементов находятся на втором энергетическом уровне, где нет свободных орбиталей:ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение 3.
О
2S
2P
В=2
F
2S
2P
В=1
Слайд 67Решение 4. Хлор проявляет переменную валентность 1, 3, 5, 7,
так как на 3-м энергетическом уровне имеются свободные d-орбитали, куда
могут расспа-риваться спаренные 3s- и Зр-электроны.ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Cl
3s
3p
3d
Cl
3p
Cl
Cl
B=1
B=3
B=5
B=7
3s
Слайд 69Решение 5. Отсутствие неспаренных электронов у атома кобальта на внешнем
4-м энергетическом уровне, определяет его валентность в основном состоянии, равную
нулю, несмотря на то, что на предвнешнем 3d-подуровне имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки:ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
B=3
Co
4s
4p
3d
Слайд 70 В возбужденном состоянии происходит рас-спаривание 4s-пары электронов и
валентность кобальта может быть 2, 3, 4.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Co
4s
4p
3d
Слайд 71Пример 6. Определите пространственную структуру молекулы H2S. Почему валентный угол
чуть больше 90°?
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
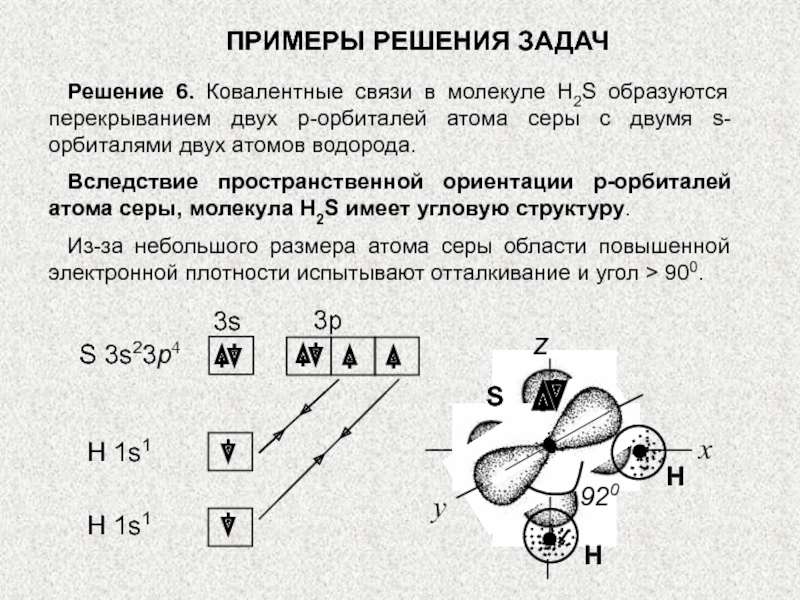
Слайд 72ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Н
Н
S
х
у
z
920
3s
Н 1s1
Н 1s1
S 3s23p4
3р
Решение 6. Ковалентные связи в
молекуле H2S образуются перекрыванием двух p-орбиталей атома серы с двумя
s-орбиталями двух атомов водорода.Вследствие пространственной ориентации р-орбиталей атома серы, молекула H2S имеет угловую структуру.
Из-за небольшого размера атома серы области повышенной электронной плотности испытывают отталкивание и угол > 900.
Слайд 73ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 7. Вычислите дипольный момент молекулы HI,
если длина диполя равна 0,09 • 10-10 м.
Решение. Дипольный
момент молекулы равен произведению длины диполя l на величину элементар-ного электрического заряда g = 1,602∙ 10─19 Кл.μ = gl = 1,602∙10─19 ∙ 0,09∙10─10 = 1,44∙10─30 Кл∙м = 0,43 D(1D = 3,33∙10-30 Кл∙м )
Слайд 75ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение. Для оценки полярности молекулы используют величину электрического
момента диполя молекулы μм, равную векторной (геометрической) сумме электрических моментов
диполей всех связей μсв (и неподеленных электронных пар). У неполярных молекул эта сумма равна нулю (μм = 0), у полярных — больше нуля (μм > 0).Слайд 76 Решение 8(а). Молекула ВН3 имеет плоскую треугольную форму (sp2-гибридизация).
Гибридные связи направлены под углом 120°. Векторная сумма электрических моментов
диполей связей в молекуле равна нулю, следовательно, молекула ВНз неполярна.ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 77ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение 8(б). Молекула SbH3 имеет пирамида-льную форму. Связи
в молекуле SbH3 направлены от вершины тригональной пирамиды, в которой
находит-ся атом сурьмы, к ее основанию, в вершинах которого находятся атомы водорода. Сумма векторов моментов диполей всех связей в молекуле SbH3 не равна нулю, и следовательно, молекула в целом полярна.Sb
Слайд 78ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 9. Какая из молекул В2 или С2
характеризуется более высокой энергией диссоциации на атомы? Сопоставьте магнитные свойства
этих молекул.Слайд 79ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение 9. Из энергетической диаграммы образова-ния молекулы
В2 следует: порядок связи в молекуле В2 равен (4-2)/2=1. Молекула
парамагнитна2p
АО
АО
МО
Е
2p
π2pz
σ*2s
π2pz
σ2s
2s
2s
σ*2px
σ2px
Слайд 80ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
2p
АО
АО
МО
Е
2p
π2pz
σ*2s
π2pz
σ2s
2s
2s
σ2px
σ*2px
Решение 9. Из энергетической диаграммы образова-ния молекулы
С2 следует: порядок связи в молекуле С2 равен (6-2)/2=2. Молекула
прочнее и диамагнитна.Слайд 82236. Описать с позиций метода ВС электронное строение молекулы BF3
и иона BF4‾.
237. Сравнить способы образования ковалентных связей в молекулах
СН4, NH3 и в ионе NH4+. Могут ли существовать ионы СН5+ и NH52+?2.18. Молекула TiF4 имеет тетраэдрическую струк-туру. Предскажите тип гибридизации валентных орбиталей титана.
2.35. Составьте энергетическую диаграмму МО частиц NO+, NO и NO− и сравните их порядок и энергию связей.
2.36. Нарисуйте энергетическую диаграмму молекулы СО. Какая электронная формула отражает строение этой молекулы?
ЗАДАЧИ
Слайд 83ИНДИВИДУАЛЬНЫЕ ЗАДАЧИ
Задача 1:
1) покажите распределение валентных электронов по орбиталям для
каждого атома в рассматриваемых молекулах;
2) определите механизм образования связи и
ее вид;3) определите полярность связи;
4) укажите, имеет ли место гибридизация, ее тип;
5) покажите геометрическую структуру молекул;
6)напишите полные электронные формулы атомов, образующих данную молекулу;
7) наблюдается ли смещение электронной плотности к одному из ядер, полярна ли молекула?
Слайд 84МНОГОВАРИАНТНЫЕ ЗАДАЧИ
Задача 2:
1) напишите электронные формулы атомов, образующих данную молекулу;
2)
нарисуйте энергетическую схему АО и МО для данных молекул;
3) определите
порядок связи, возможно ли существование данной молекулы?4) объясните, диамагнитна или парамагнитна данная молекула;
5) наблюдается ли смещение электронной плотности к одному из ядер, полярна ли молекула?