Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия
Содержание
- 1. Химия
- 2. Рекомендуемые учебникиГлинка Н.Л. Общая химия.Коровин Н.В., Масленникова
- 3. Химия - это наука о веществах и
- 4. Строение атома
- 5. Атом Атом – наименьшая (неделимая химическим путем)
- 6. Планетарная модель атома РезерфордаПротон имеет положительный заряд,
- 7. Составная часть вещества, содержащая одинаковые атомы, называется
- 8. .Элемент обозначается одно- или двухбуквенным символом. Левые
- 9. Атомная масса – масса атома в атомных
- 10. Молекула – наименьшая частица вещества, определяющая его
- 11. Классификация атомно-молекулярных частиц и образований
- 12. Важнейшие классы неорганических соединений
- 13. Химические реакции Взаимодействие химических соединений записывается с
- 14. 1. Реакции соединения:
- 15. 2. Реакции замещения:
- 16. 3. Реакции разложения:
- 17. 4. Реакции обмена:
- 18. Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ, называются окислительно-восстановительными. К таковым относятся:
- 19. Способы получения солейВзаимодействие простых веществ Взаимодействие оксидовВзаимодействие кислот и оснований (нейтрализация)
- 20. Взаимодействие соли и кислоты: Взаимодействие соли и
- 21. Замещение водорода: Замещение металла: Термолиз кислых солей: Взаимодействие двух солей (присоединение):(Взаимодействие двух солей комплексообразование):
- 22. Способы получения оксидовОкисление элемента Разложение гидроксидов Разложение
- 23. Способы получения кислотВзаимодействие кислотного оксида с водой:
- 24. Взаимодействие водорода с элементом с образованием бескислородной кислоты: Комплексные кислоты:
- 25. Способы получения основанийВзаимодействие металла с водой: Взаимодействие
- 26. Одноатомные катионы называют по русскому названию элемента
- 27. Номенклатура неорганических соединений Анионы, состоящие из одного
- 28. Слайд 28
- 29. Слайд 29
- 30. Квантовые числаПолная энергия электрона Е атома химического
- 31. n - главное квантовое число определяет полный
- 32. l - побочное (орбитальное) квантовое числоустанавливает уровень
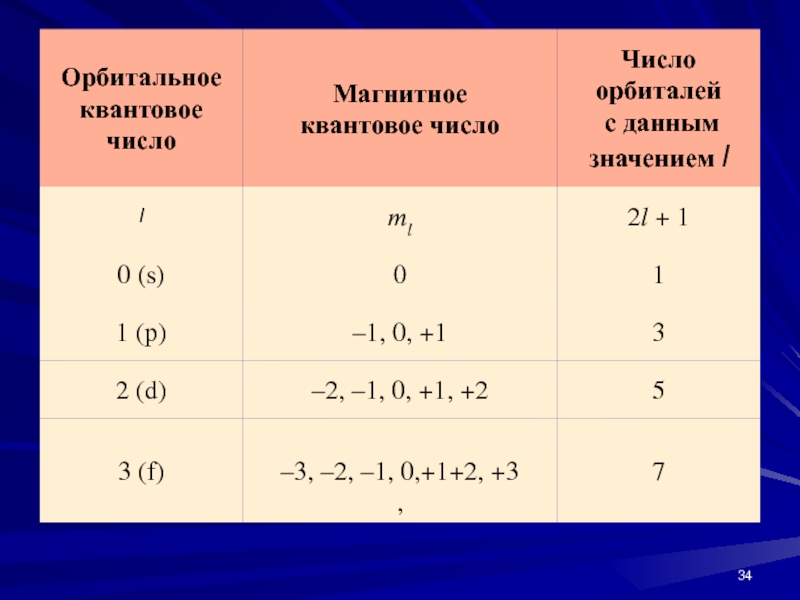
- 33. ml - магнитное квантовое число Оно определяет
- 34. Слайд 34
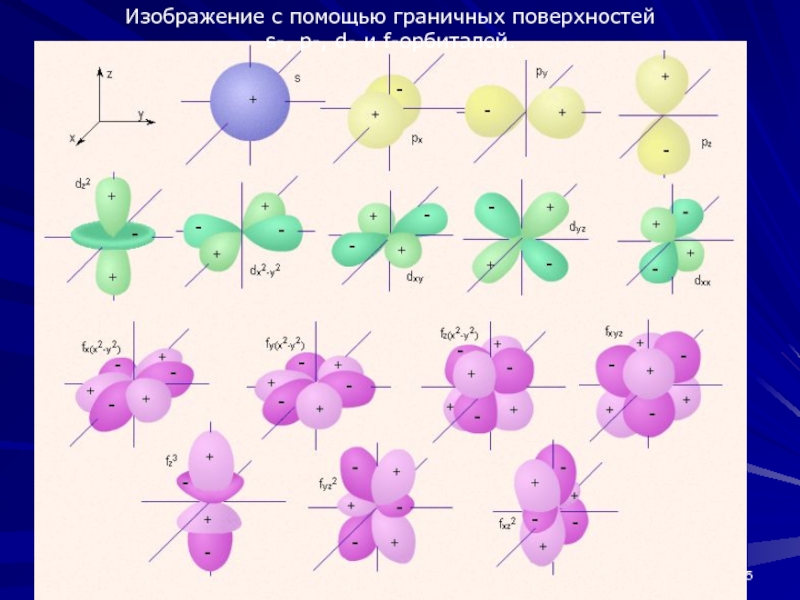
- 35. Изображение с помощью граничных поверхностей s-, p-, d- и f-орбиталей.
- 36. s-Орбитали сферически симметричны для любого n и
- 37. d-Орбитали определяются квантовым числом l = 2
- 38. ms -спиновое квантовое число Экспериментально установленно, что электрон
- 39. Заполнение атомных орбиталей
- 40. Принцип наименьшей энергииПри застройке атома каждый электрон
- 41. Принцип ПаулиВ атоме не может быть двух
- 42. Последовательность застройки электронной оболочки многоэлектронного атома подчиняется
- 43. Правило Хунда (Гунда): суммарное спиновое число электронов
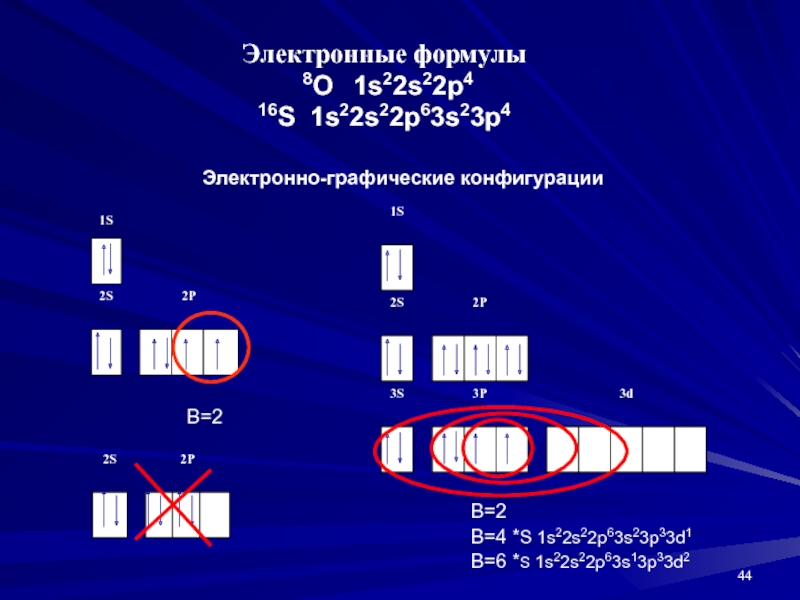
- 44. Электронные формулы 8О 1s22s22p416S 1s22s22p63s23p4Электронно-графические конфигурацииВ=2В=2В=4 *S 1s22s22p63s23p33d1В=6 *S 1s22s22p63s13p33d2
- 45. правилa Клечковского1. Минимумом энергии обладают обитали с
- 46. правилa Клечковского2. При одинаковых значениях суммы n+l
- 47. Энергия атомных орбиталей возрастает согласно ряду 1s
- 48. Периодическая система элементов Исследуя изменение химических свойств
- 49. Физическая основа периодического закона была установлена в
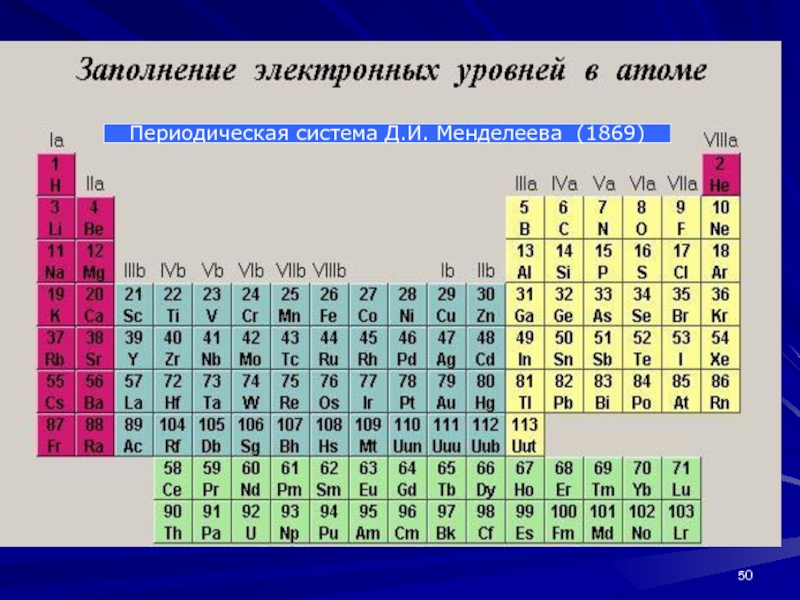
- 50. Периодическая система Д.И. Менделеева (1869)
- 51. периодическая система состоит из горизонтальных и вертикальных
- 52. По вертикали периодическая система подразделяется на восемь
- 53. В главных подгруппах валентные электроны (электроны, способные
- 54. Первый период (n = 1, l = 0) состоит из двух
- 55. четвертый период. Следующие за Ar калий и
- 56. Начиная со скандия (Z = 21) заполняется
- 57. Дальше в четвертом периоде после десяти d-элементов
- 58. Седьмой период отчасти повторяет шестой. 5f-элементы называются
- 59. Периодичность атомных характеристик орбитальный радиус. При изучении
- 60. В подгруппах радиусы в основном увеличиваются из-за
- 61. Образование ионов приводит к изменению ионных радиусов
- 62. Энергией ионизации атома (I) называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
- 63. I выражается в кДж∙моль–1 или эВ∙атом–1. Значения
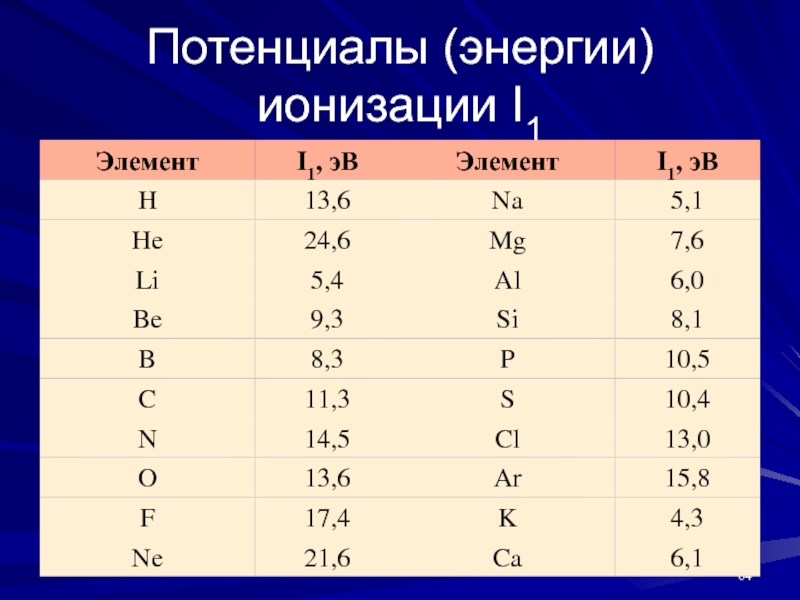
- 64. Потенциалы (энергии) ионизации I1
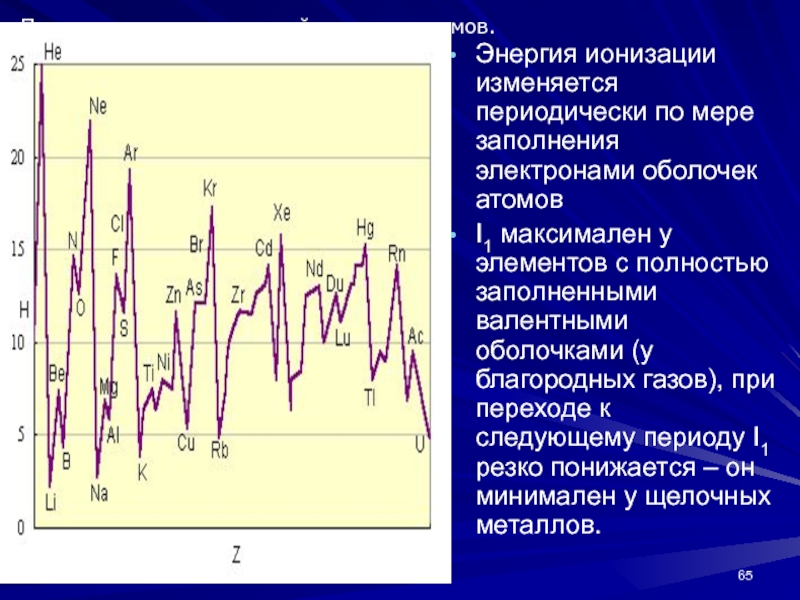
- 65. Энергия ионизации изменяется периодически по мере заполнения
- 66. Энергия связи электрона с ядром пропорциональна Z
- 67. В побочных подгруппах d-электроны экранируются не только
- 68. Энергия сродства к электрону (Е)– энергия, выделяющаяся
- 69. Окислительной способностью не обладают нейтральные атомы с
- 70. Рассмотрим кислородсодержащие кислоты хлора, в
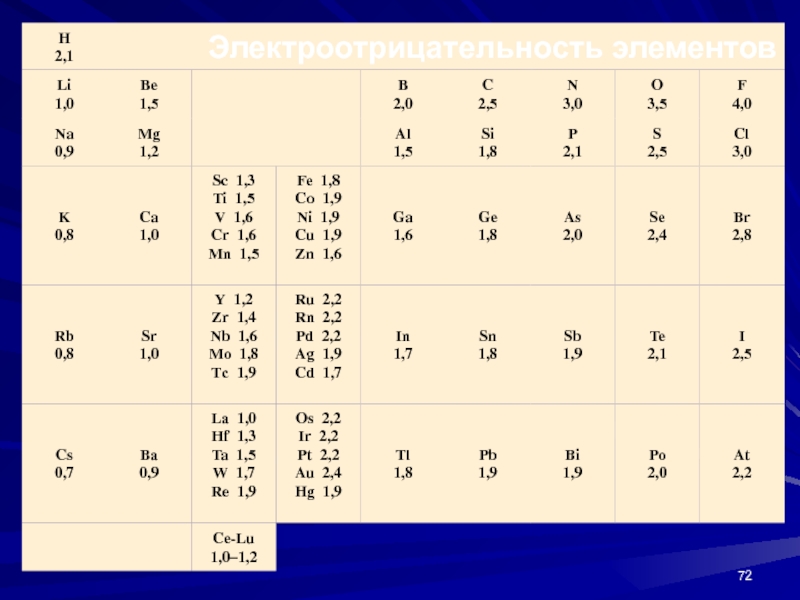
- 71. Электроотрицательность (ЭО)Для более полной характеристики тенденции элемента
- 72. Слайд 72
- 73. Значения квантовых чисел и максимальные числа электронов в слоях
- 74. Слайд 74
- 75. Химическая связь
- 76. Образование из атомов молекул, молекулярных ионов, ионов,
- 77. Согласно электронной теории валентности, химическая связь возникает
- 78. Коссель Вальтер (4.I.1888–22.V.1956)Немецкий физик. Основные исследования
- 79. Льюис Гильберт (23.X.1875–23.III.1946) Льюис Гильберт Ньютон Американский
- 80. Типы химических связей Ковалентная связь – наиболее
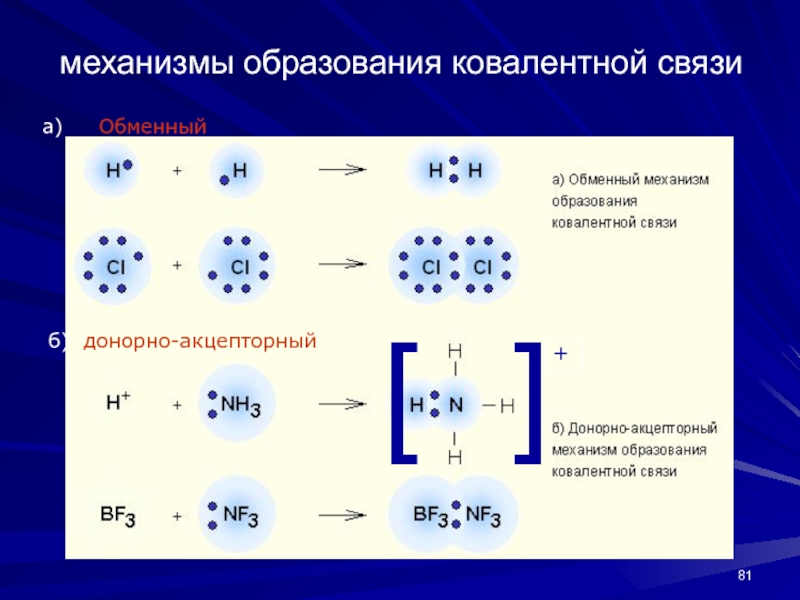
- 81. механизмы образования ковалентной связиа)Обменныйб) донорно-акцепторный+
- 82. Химическая связь характеризуется энергией и длиной. Мерой
- 83. Свойства ковалентной связиНасыщаемость – это способность атома
- 84. Направленность. Атомные орбитали направлены в пространстве, следовательно,
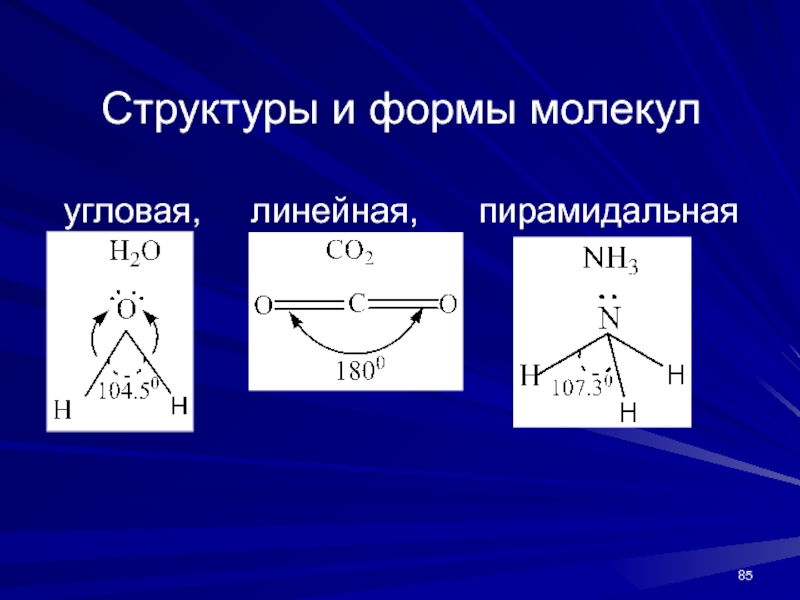
- 85. Структуры и формы молекул угловая, линейная, пирамидальная
- 86. Ионная связь– частный случай ковалентной, когда образовавшаяся
- 87. Полярность молекулы определяется разностью электроотрицательностей атомов,
- 88. Диполь – система из двух равных, но
- 89. Химическая связь в твердых телахСвойства твердых веществ
- 90. Ионные кристаллы, содержащие многоатомные ионы, имеют более
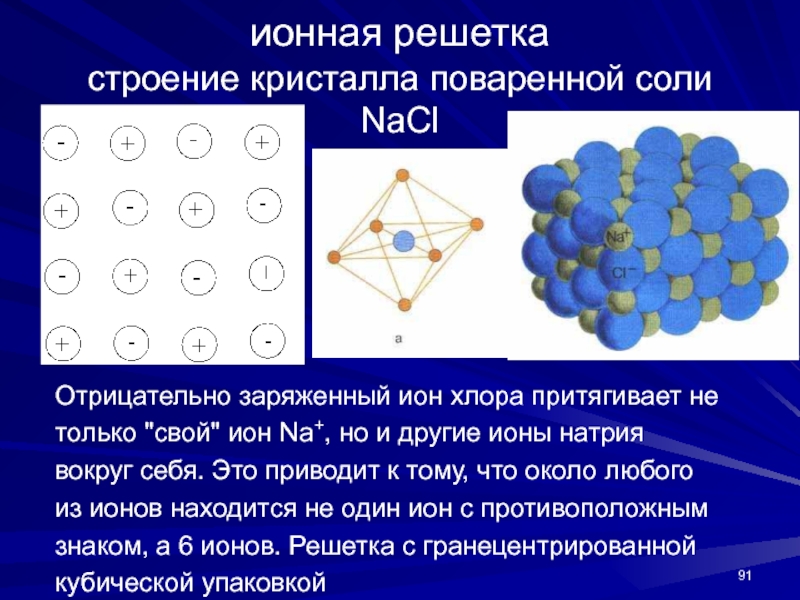
- 91. ионная решетка строение кристалла поваренной соли NaClОтрицательно
- 92. Ионные соединения более твердые и хрупкие. Такие
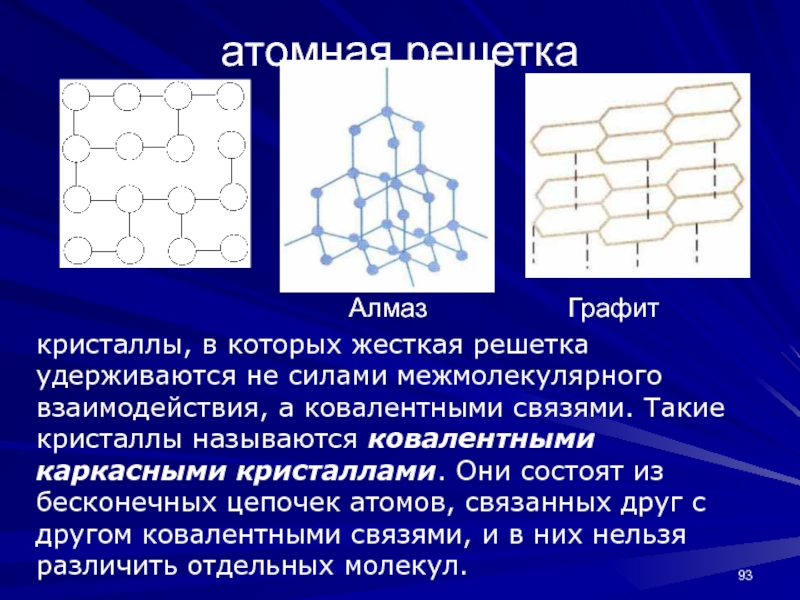
- 93. атомная решеткакристаллы, в которых жесткая решетка удерживаются
- 94. Графит и алмаз - две аллотропные модификации
- 95. Молекулярные кристаллыМолекулярными называют кристаллические решётки, в узлах
- 96. Ван-дер-ваальсова (межмолекулярная) связь Ван-дер-ваальсовы силы (Van-der-Vaalse
- 97. Молекулярная решеткаТипичные молекулярные кристаллы образуют водаH2O и
- 98. Кварц – кристаллическая форма оксида кремния
- 99. Металлическая связьвозникает в результате частичной делокализации валентных
- 100. Кристаллические решетки, образуемые металлами, называются металлическими. В
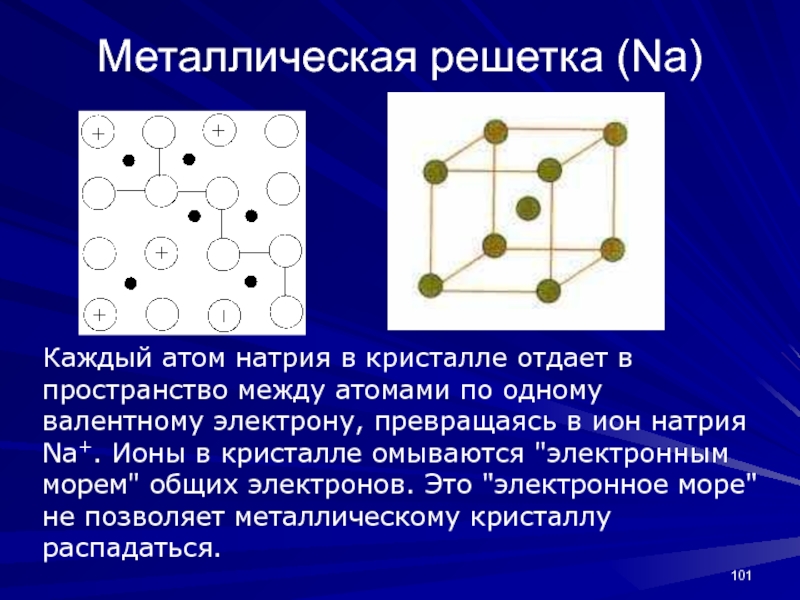
- 101. Металлическая решетка (Na)Каждый атом натрия в кристалле
- 102. металлическую связь склонны образовывать элементы, атомы которых на внешних оболочках имеют мало валентных электронов.
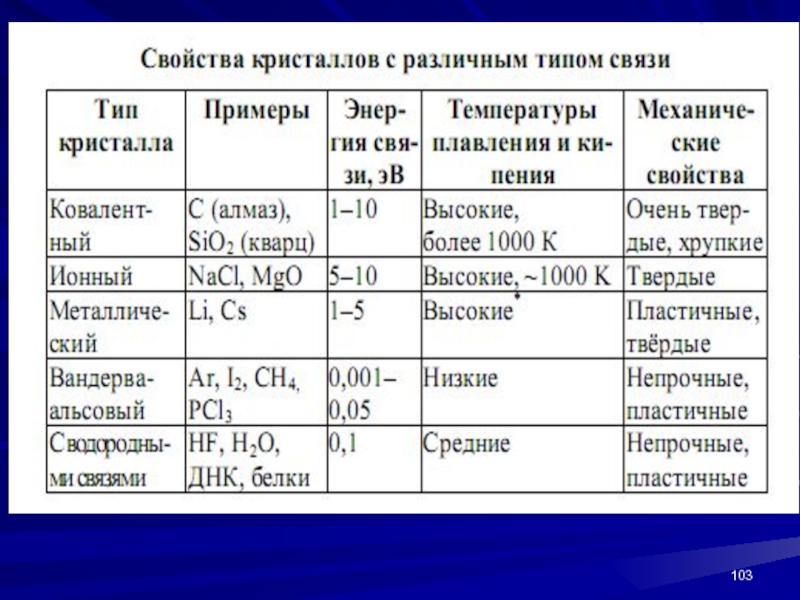
- 103. Слайд 103
- 104. ТЕРМОХИМИЯ Тепловые эффекты химических реакций
- 105. В процессе протекания химических реакций происходит изменение
- 106. Важнейшими термодинамическими функциями являются: U
- 107. Термодинамические параметры:Р – давление (Па) , V
- 108. Результаты термохимических измерений – тепловые эффекты реакций
- 109. термохимическое уравнение реакции образования жидкой воды имеет
- 110. Все тепловые эффекты, приводимые в
- 111. изменение энтальпии записывается как ∆H0298 . Верхний
- 112. пример записи термохимического уравнения :N2 + O2
- 113. Закон Гесса тепловой эффект химической реакции не
- 114. Например, получение СО2 из углерода и кислорода
- 115. Следствия закона Гесса Теплотой сгорания называют тепловой
- 116. Теплотой образования вещества называют тепловой эффект образования
- 117. Первое следствие. Тепловой эффект образования сложного вещества
- 118. Второе следствие.Тепловой эффект реакции равен разности между
- 119. аА + bВ = nN + mM;
- 120. S - Энтропия Mакросостояние системы тем
- 121. Наименьшую энтропию имеют идеально правильно построенные кристаллы
- 122. Возрастает она также при превращении вещества из
- 123. ∆G - изобарно-изотермический потенциал, или свободная
- 124. Энергия Гиббса связана с энтальпией, энтропией и
- 125. При обратимом и изотермическом проведении процесса ΔG
- 126. самопроизвольно могут протекать только те реакции, за счет энергии которых можно совершать полезную работу.
- 127. поэтому приΔG0 – реакции несамопроизвольные
- 128. Стандартное изменение энергии Гиббса реакции связано с
- 129. Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ принимаются равными нулю.
- 130. Задача 2. Вычислить ΔН0298, - тепловой
- 131. Вычисление ΔG°х.р. реакции. Находим в табл. ΔG0298Fe2O3
- 132. Полученное отрицательное значение °298 подтверждает вывод, сделанный
- 133. Скачать презентанцию
Рекомендуемые учебникиГлинка Н.Л. Общая химия.Коровин Н.В., Масленникова Г.Н. и др. Курс общей химии. - М.: Высшая школа, 1990.Глинка Н.Л. Задачи и упражнения по общей химии.
Слайды и текст этой презентации
Слайд 2Рекомендуемые учебники
Глинка Н.Л. Общая химия.
Коровин Н.В., Масленникова Г.Н. и др.
Курс общей химии. - М.: Высшая школа, 1990.
и упражнения по общей химии.Слайд 3Химия - это наука о веществах и законах их превращений.
Объектом изучения в химии являются химические элементы и их соединения.
Слайд 5Атом
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая
все свойства, определенные зарядом ядра и электронной оболочкой
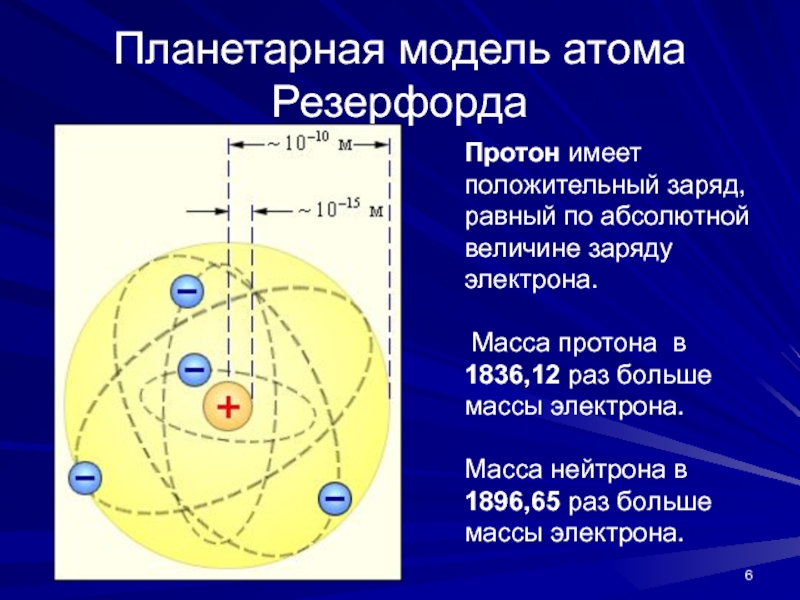
Слайд 6Планетарная модель атома Резерфорда
Протон имеет положительный заряд, равный по абсолютной
величине заряду электрона.
Масса протона в 1836,12 раз больше массы
электрона. Масса нейтрона в 1896,65 раз больше массы электрона.
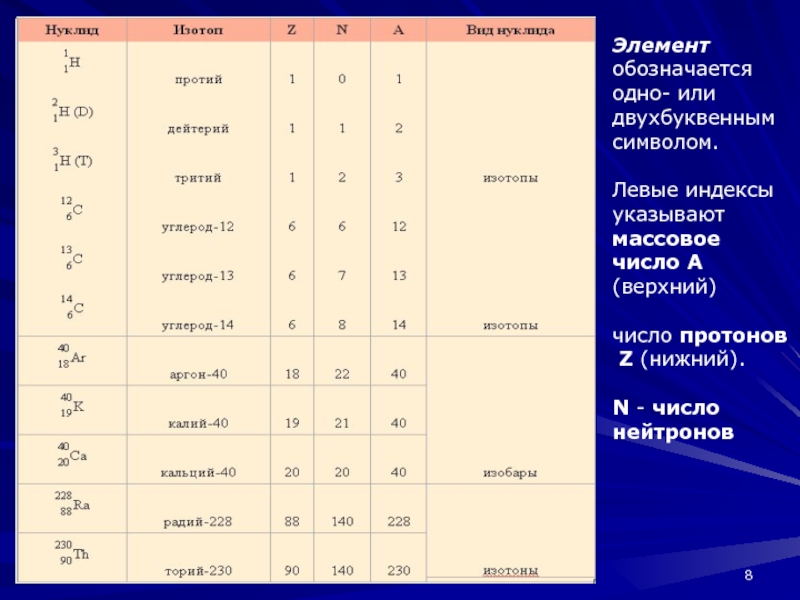
Слайд 7Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z
равен числу протонов в атомном ядре. В электронной оболочке электронейтрального
атома содержится Z электронов.Массовое число А равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N.
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Слайд 8.
Элемент обозначается одно- или двухбуквенным символом.
Левые индексы указывают массовое
число A (верхний)
число протонов
Z (нижний).
N - число
нейтроновСлайд 9Атомная масса – масса атома в атомных единицах массы (а. е. м.).
За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса
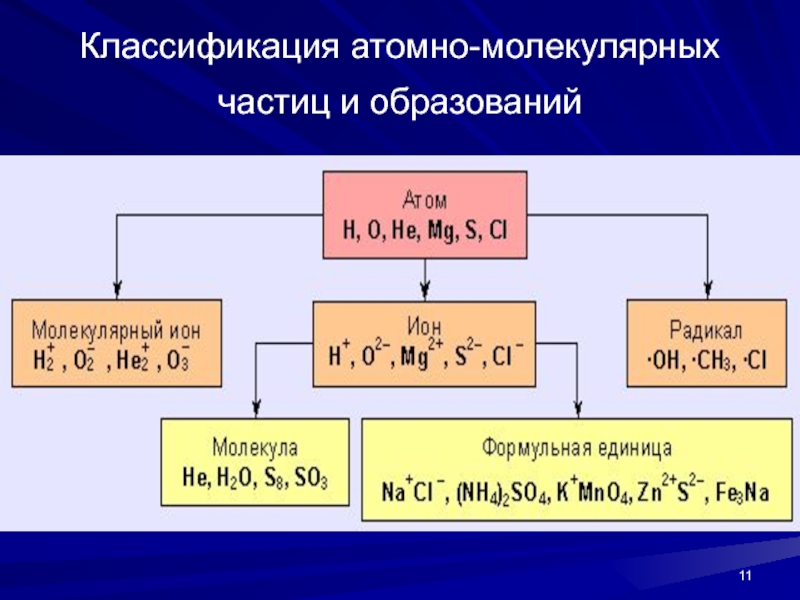
(безразмерная величина) она численно равна атомной массе элемента.Слайд 10Молекула – наименьшая частица вещества, определяющая его свойства, способная к
самостоятельному существованию. Состоит из одинаковых или разных атомов.
Соединения, образованные одинаковыми
атомами, называют простыми (He, O2, O3, H2, S8), а образованные разными атомами – сложными (H2O, H2O2, NH3, CCl4, C2H5OH).Слайд 13Химические реакции
Взаимодействие химических соединений записывается с помощью химических уравнений,
отражающих материальный баланс всех реагирующих веществ. Это достигается с помощью
стехиометрических коэффициентов перед формулами соединений:где A, B, C, D – реагирующие вещества; a, b, c, d – стехиометрические коэффициенты.
Можно выделить четыре основных типа химических реакций:
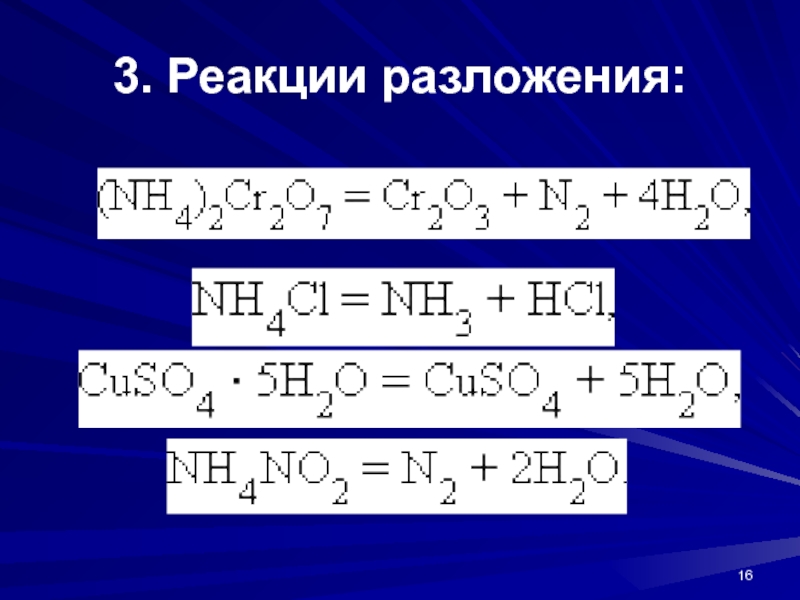
Слайд 18Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ,
называются окислительно-восстановительными. К таковым относятся:
Слайд 19Способы получения солей
Взаимодействие простых веществ
Взаимодействие оксидов
Взаимодействие кислот и оснований
(нейтрализация)
Слайд 20Взаимодействие соли и кислоты:
Взаимодействие соли и щелочи:
Взаимодействие двух
солей (обменная реакция):
Взаимодействие оксида с кислотой:
Слайд 21Замещение водорода:
Замещение металла:
Термолиз кислых солей:
Взаимодействие двух солей
(присоединение):
(Взаимодействие двух солей комплексообразование):
Слайд 22Способы получения оксидов
Окисление элемента
Разложение гидроксидов
Разложение карбонатов и других
солей
Взаимодействие металла с другим оксидом
Слайд 23Способы получения кислот
Взаимодействие кислотного оксида с водой:
Вытеснение летучих кислот:
Взаимодействие соли и кислоты с образованием нерастворимой соли:
Слайд 24Взаимодействие водорода с элементом с образованием бескислородной кислоты:
Комплексные кислоты:
Слайд 25Способы получения оснований
Взаимодействие металла с водой:
Взаимодействие оксида с водой:
Разложение соли водой (гидролиз):
Взаимодействие соли и щелочи:
Слайд 26Одноатомные катионы называют по русскому названию элемента в родительном падеже
и указанием степени окисления в скобках в виде арабской (n+)
или римской цифры: Au+ – катион золота (I), Au3+ – катион золота (III), P5+ – катион фосфора (V).Указание степени окисления опускают, если возможен только один катион:
K+ – катион калия, Ba2+ – катион бария.
Слайд 27Номенклатура неорганических соединений
Анионы, состоящие из одного атома или нескольких
одинаковых атомов, называют по элементу с окончанием «-ид»: H– – гидрид,
Cl– – хлорид, O2– – оксид, As3– – арсенид,Si4– – силицид, O22- – пероксид, N3 –– азид.
Некоторые многоатомные анионы имеют собственное название:, CN– – цианид, C2-2-ацетиленид, HO– – гидроксид, N3 –– азид.
Сложные гетероатомные анионы элементов в высшей степени окисления оканчивается на «-ат» (SO42-– сульфат, NO3-– нитрат, PO43-– фосфат); окончание «-ит» указывает на более низкую степень окисления (SO32-– сульфит, NO2-– нитрит).
Название соли начинается с аниона в именительном падеже с соответствующим окончанием (-ид, -ат, -ит) и катиона в родительном падеже (NaCl – хлорид натрия, MgSO4 – сульфат магния, AgNO3 – нитрат серебра).
Слайд 30Квантовые числа
Полная энергия электрона Е атома химического элемента складывается из
кинетической Екин и потенциальной Епот энергий. В многоэлектронном атоме состояние
каждого электрона определяется четырьмя квантовыми числами: n, l, ml , ms .Слайд 31n - главное квантовое число
определяет полный запас энергии электрона
в размер электронной обитали.
n принимает значения от 1 до
7 (стремится к ∞). При n = 1 электрон находится на первом слое, при n= 2 - на втором и т.д., т.е. n указывает номер электронного слоя (уровня) и номер периода, в котором расположен элемент в периодической системе элементов Д.И. Менделеева.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и так далее.
Слайд 32l - побочное (орбитальное) квантовое число
устанавливает уровень (подуровень) энергии и
форму орбитали, а следовательно, форму электронного облака.
принимает значения l
=(n-1), численно равное значению орбитального момента количества движения электрона. Кроме числовых l имеет буквенные обозначения
l = 0 1 2 3 4…
l = s p d f g…
Слайд 33ml - магнитное квантовое число
Оно определяет пространственное расположение атомной
орбитали и принимает целые значения
от –l до + l
через нуль, то есть 2l + 1 значений.
Слайд 36s-Орбитали сферически симметричны для любого n и отличаются друг от
друга только размером сферы. Их максимально симметричная форма обусловлена тем,
что при l = 0 и ml = 0.p-Орбитали существуют при n ≥ 2 и l=1, поэтому возможны три варианта ориентации в пространстве: ml= –1, 0,+1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
Слайд 37d-Орбитали определяются квантовым числом l = 2 (n ≥ 3),
при котором ml = –2, –1, 0, +1, +2, то
есть характеризуются пятью вариантами ориентации в пространстве. d-Орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz. Называются условно бабочкой.Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, имеют сложную конфигурацию.
Слайд 38ms -спиновое квантовое число
Экспериментально установленно, что электрон имеет еще одно
свойство – спин. Спиновое квантовое число ms имеет только два значения
ms = ±1/2, определяет собственный момент количества движения электрона.Упрощенно спин можно представить как вращение электрона вокруг собственной оси.
Электроны с разными ms обозначаются стрелками, направленными вверх
и вниз .
Слайд 40Принцип наименьшей энергии
При застройке атома каждый электрон размещается на той
обитали, которой соответствует минимальное значение энергии, т.е. ближе расположенной к
ядру атома.Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии электронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Слайд 41Принцип Паули
В атоме не может быть двух электронов с одинаковым
набором всех четырех квантовых чисел, или данными значениями квантовых чисел
характеризуется только один электрон.Отсюда на S-уровне может быть не более двух, p- шести, d- десяти, f- четырнадцати электронов.
На каждом энергетическом слое должно быть 2n2 электронов.
Слайд 42Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам:
при
застройке на последнем слое не должно быть больше восьми электронов;
застройка
любого слоя начинается с S-уровне;р-уровни для элементов малых периодов периодической системы застраиваются после S-уровней, а для элементов больших периодов- после d-уровней предыдущего слоя;
d-уровни предыдущего слоя застраиваются после S- орбиталей последнего энергетического слоя;
f-уровни IV и V слоев застраиваются соответственно после S-уровня VI и VII слоев.
Слайд 43Правило Хунда (Гунда):
суммарное спиновое число электронов данного уровня должно
быть максимальным.
Иными словами, орбитали данного уровня заполняются сначала по
одному, затем по второму электрону. Поскольку основной запас энергии электрона определяют квантовые числа n и l, то последовательность застройки атомных орбиталей определяется суммой n+l.Слайд 44Электронные формулы
8О 1s22s22p4
16S 1s22s22p63s23p4
Электронно-графические конфигурации
В=2
В=2
В=4 *S 1s22s22p63s23p33d1
В=6
*S 1s22s22p63s13p33d2
Слайд 45правилa Клечковского
1. Минимумом энергии обладают обитали с наименьшей суммой главного
и побочного квантовых чисел n+l.
Сравним 4S-орбиталь и 3d-орбиталь
4S :
n+l = 4+0 = 4, 3d : n+l = 3+2 = 5.
n 1 2 3 4
l 0 1 2 3
s p d f
В соответствии правилом электроны в первую очередь заполняют 4S, а потом 3d-орбиталь
Слайд 46правилa Клечковского
2. При одинаковых значениях суммы n+l меньшей энергией обладает
орбиталь с меньшем значением главного квантового числа n, поэтому оно
заполняется раньше3d: n+l =3+2=5,
4р: n+l =4+1=5,
т.к. сумма n+l в обоих случаях одинакова и равна 5, то электроны заполняют вначале 3d орбиталь, для которой главное квантовое число меньше.
Слайд 47Энергия атомных орбиталей возрастает согласно ряду
1s < 2s
2p < 3s < 3p < 4s ≈ 3d
4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p.Слайд 48Периодическая система элементов
Исследуя изменение химических свойств элементов в зависимости
от величины их относительной атомной массы (атомного веса), Д. И.
Менделеев в 1869 г. открыл закон периодичности этих свойств:«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от величины атомных весов элементов».
Слайд 49Физическая основа периодического закона была установлена в 1922 г. Н.
Бором. Поскольку химические свойства обусловлены строением электронных оболочек атома, периодическая
система Менделеева – это естественная классификация элементов по электронным структурам их атомов. Простейшая основа такой классификации – число электронов в нейтральном атоме, которое равно заряду ядра. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому современная формулировка периодического закона гласит:«Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов».
Слайд 51периодическая система состоит из горизонтальных и вертикальных рядов – периодов
и групп.
Период – горизонтальный ряд, имеющий одинаковое число электронных
слоев, номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя); таких периодов в периодической системе семь.
Второй и последующие периоды начинаются щелочным элементом (ns1) и заканчивается благородным газом(ns2np6).
Слайд 52По вертикали периодическая система подразделяется на восемь групп, которые делятся
на главные – А – состоящие из s- и p-элементов,
и побочные – B-подгруппы, содержащие d-элементы.III B-подгруппа, кроме d-элементов, содержит по 14 4f- и 5f-элементов (4f- и 5f-семейства).
Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы
Слайд 53В главных подгруппах валентные электроны (электроны, способные образовывать химические связи)
расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных
– на s-орбиталях внешнего и d-орбиталях предвнешнего слоя.Для f-элементов валентными являются (n – 2)f, (n – 1)d- и ns-электроны.
Слайд 54Первый период (n = 1, l = 0) состоит из двух элементов H (1s1)
и He (1s2).
Во втором периоде (n = 2, l = 0, 1) заполняются s- и
p-орбитали от Li до Ne. Элементы называются соответственно s- и p-элементами.В третьем периоде появляются пять d-орбиталей (n = 3, l = 0, 1, 2). Пока они вакантны и третий период, как и второй, содержит восемь элементов от Na до Ar.
Слайд 55четвертый период. Следующие за Ar калий и кальций имеют внешним
4s-электроны. Появление 4s-электронов при наличии свободных 3d-орбиталей обусловлено экранированием ядра
плотным 3s23p6-электронным слоем. В связи с отталкиванием от этого слоя внешних электронов для калия и кальция реализуются [Ar]4s1- и [Ar]4s2-состояния. Сходство K и Ca с Na и Mg соответственно, кроме чисто «химического» обоснования, подтверждается также электронными спектрами, называются электронными аналогами.Слайд 56Начиная со скандия (Z = 21) заполняется 3d-орбиталь, а во
внешнем слое остаются 4s-электроны.
в четвертом периоде в ряду от
Sc до Zn - десять 3d-элементов – переходные металлы с низшей степенью окисления, как правило, 2, за счет внешних 4s-электронов. Общая электронная формула этих элементов –3d1–104s1–2.
Для хрома и меди наблюдается проскок (или провал) электрона на d-уровень: Cr – 3d54s1,
Cu – 3d104s1. Такой проскок с ns- на (n – 1)d-уровень наблюдается также у Mo, Ag, Au, Pt и у других элементов и объясняется близостью энергий ns- и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней.
Слайд 57Дальше в четвертом периоде после десяти d-элементов появляются p-элементы от
Ga (4s24p1) до Kr (4s24p6)
Пятый период повторяет четвертый – в
нем также 18 элементов, и 4d-элементы, как и 3d образуют вставную декаду (4d1–10 5s0–2). В шестом периоде после лантана (5d16s2) – аналога скандия и иттрия следует четырнадцать 4f-элементов - лантаноидов. Свойства этих элементов очень близки, поскольку идет заполнение глубоколежащего (n – 2)f-подуровня. Общая формула лантаноидов 4f2–145d0–16s2. После 4f-элементов заполняются 5d- и 6p-орбитали. Всего 32 элемента.
Слайд 58Седьмой период отчасти повторяет шестой.
5f-элементы называются актиноидами. Их общая
формула 5f2–146d0–17s2.
Далее следует еще шесть искусственно полученных 6d-элементов незавершенного
седьмого периода. Слайд 59Периодичность атомных характеристик
орбитальный радиус. При изучении строения молекул и
кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный
радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
Слайд 60В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных
оболочек
У s- и p-элементов изменение радиусов как в периодах, так
и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы:Слайд 61Образование ионов приводит к изменению ионных радиусов по сравнению с
атомными. При этом радиусы катионов всегда меньше, а радиусы анионов
всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ.Слайд 62Энергией ионизации атома (I) называется количество энергии, необходимое для отрыва
электрона от невозбужденного атома или иона.
Слайд 63I выражается в кДж∙моль–1 или эВ∙атом–1. Значения I в электронвольтах
численно равны потенциалам ионизации, выраженным в вольтах, поскольку
E =
ē∙IЭ – ē = Э+, ΔH = I1 – первый потенциал ионизации;
Э – ē = Э2+, ΔH = I2 – второй потенциал ионизации и т.д.
I1 < I2 < I3 < I4...
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
Слайд 65Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов
I1
максимален у элементов с полностью заполненными валентными оболочками (у благородных
газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов.Потенциалы ионизации нейтральных атомов.
Слайд 66Энергия связи электрона с ядром пропорциональна Z и обратно пропорциональна
среднему (орбитальному) радиусу оболочки. Атомные радиусы d- и f-элементов с
ростом Z в периоде уменьшается незначительно по сравнению с s- и p-элементами, поэтому их потенциалы ионизации растут также незначительно.В главных подгруппах потенциалы ионизации с ростом Z уменьшаются вследствие увеличения числа электронных подоболочек и экранирования заряда ядра электронами внутренних подоболочек.
Слайд 67В побочных подгруппах d-электроны экранируются не только электронами заполненных оболочек,
но и внешними s-электронами. Поэтому потенциал ионизации d-элементов с ростом
Z в подгруппе увеличивается незначительно.Чем меньше потенциал ионизации, тем легче атом отдает электрон.
Поэтому восстановительная способность нейтральных атомов с ростом Z в периоде уменьшается, в главных подгруппах растет, а в побочных – падает.
Слайд 68Энергия сродства к электрону (Е)– энергия, выделяющаяся при присоединении электрона
к нейтральному атому.
Чем больше электронное сродство, тем более сильным
окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону E значительно сложнее, чем энергия ионизации.
Слайд 69Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2
и s2p6 и переходные элементы.
У остальных элементов в таблице
Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх. Слайд 70 Рассмотрим кислородсодержащие кислоты хлора, в молекулах которых хлор
проявляет различные степени окисления:
хлорноватистая
хлористая хлорноватая хлорная кислота. кислота; кислота; кислота;
Усиление кислотных свойств, повышение устойчивости
Усиление окислительной активности
Слайд 71Электроотрицательность (ЭО)
Для более полной характеристики тенденции элемента к присоединению или
отдаче электронов введено понятие электроотрицательности (ЭО)
ЭО= 1/2 (I + Е
)В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
Слайд 76Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и
других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами.
При этом минимальной энергии соответствует определенное расположение атомов относительно друг друга, которому отвечает существенное перераспределение электронной плотности.Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь».
Важнейшие виды химической связи: ковалентная, ионная, металлическая, водородная, межмолекулярная.
Слайд 77Согласно электронной теории валентности, химическая связь возникает за счет перераспределения
электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация
благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис).Слайд 78Коссель Вальтер
(4.I.1888–22.V.1956)
Немецкий физик. Основные исследования посвящены развитию электронных представлений
в химии. Предложил (1916) статическую электронную теорию строения атомов и
молекул, согласно которой:а) атомы благородных газов обладают особенно устойчивой восьмиэлектронной внешней оболочкой (атом гелия – двухэлектронной);
б) атомы других элементов во внешней оболочке имеют неполный электронный октет;
в) образование химических соединений происходит вследствие перехода электронов от атома одного элемента к атому другого и появления ионной химической связи, т. е. благодаря электростатическому притяжению.
Наиболее устойчивыми должны быть те соединения, в которых валентные электроны распределяются так, чтобы каждый атом был окружен оболочкой, имитирующей электронную оболочку благородного газа. Гипотеза Косселя легла в основу теории ионной связи.
Слайд 79Льюис Гильберт
(23.X.1875–23.III.1946)
Льюис Гильберт Ньютон Американский физикохимик. Основные работы посвящены химической
термодинамике и теории строения вещества. Определил свободную энергию многих соединений.
Ввел понятие термодинамической активности. Уточнил формулировку закона действующих масс. Развил (1916) теорию ковалентной химической связи. Его концепция обобщенной электронной пары оказалась очень плодотворной для органической химии. Предложил (1926) новую теорию кислот как акцепторов пары электронов и оснований как доноров пары электронов. Ввел (1929) термин «фотон».Слайд 80Типы химических связей
Ковалентная связь – наиболее общий вид химической
связи, возникающий за счет обобществления электронной пары посредством обменного механизма,
когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донор) другому атому (акцептору)Слайд 82Химическая связь характеризуется энергией и длиной.
Мерой прочности связи служит
энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при
образовании соединения из отдельных атомов (Eсв.). (На разрыв связи H–H затрачивается 435кДж∙моль–1 , а на атомизацию метана CH4 – 1648 кДж∙моль–1, в этом случае EC–H = 1648 : 4 = 412 кДж.)Длина связи (нм) (нанометр) – расстояние между ядрами в том или ином соединении. (Обычно чем больше длина связи, тем меньше ее энергия.)
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов.
В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
Слайд 83Свойства ковалентной связи
Насыщаемость – это способность атома использовать все свои
валентные возможности.
Валентность – это свойство атома элемента присоединять или замещать
определенное число атомов другого элемента. Количественно она определяется номером группы в периодической системе Д.И. Менделеева, т.е. от единицы до восьми.Мерой валентности может служить число химических связей, образуемых данным атомом с другими атомами. В представлении метода валентных связей числовое значение валентности равно числу ковалентной связей, которые образует атом.
Слайд 84Направленность. Атомные орбитали направлены в пространстве, следовательно, и химические связи,
возникающие при перекрывании атомных орбиталей, имеют также определенную направленность.
Направленность и
валентный угол обусловливают геометрию молекулы. При изучении геометрии молекул было обнаружено два противоречия:1. отклонение реальных валентных углов от теоретически ожидаемых;
2. равноценность связей, образованных энергетически неравноценными орбиталями. Для объяснения этих противоречий в химию была ведена концепция гибридизации.
Слайд 86Ионная связь
– частный случай ковалентной, когда образовавшаяся электронная пара полностью
принадлежит более электроотрицательному атому, становящемуся анионом.
ионную связь обусловленна электростатическим притяжением
положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености.
Слайд 87Полярность молекулы
определяется разностью электроотрицательностей атомов, образующих двухцентровую связь,
геометрией молекулы, наличием неподеленных электронных пар, так как часть электронной
плотности в молекуле может быть локализована не в направлении связей.Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому.
Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя
μ = e∙l
Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
Слайд 88Диполь – система из двух равных, но противоположных по знаку
зарядов, находящихся на расстоянии l друг от друга.
Дипольный момент
измеряется в кулон∙метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м. Все эти факторы следует учитывать. Например, для линейной молекулы CO2 μ = 0, но для SO2 μ = 1,79 D вследствие ее углового строения. Дипольные моменты NF3 и NH3 при одинаковой гибридизации атома азота (sp3), примерно одинаковой полярности связей N–F и N–H (ОЭО N = 3; ОЭО F = 4; ОЭО H = 2,1) и сходной геометрии молекул существенно различаются, поскольку дипольный момент неподеленной пары электронов азота при векторном сложении в случае NH3 увеличивает μ молекулы, а в случае NF3 уменьшает его
Слайд 89Химическая связь в твердых телах
Свойства твердых веществ определяются природой частиц,
занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон
и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.Слайд 90Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления;
так для NaCl tпл.= 801°C, а для NaNO3 tпл.= 311°C.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовые силы
Слайд 91ионная решетка
строение кристалла поваренной соли NaCl
Отрицательно заряженный ион хлора притягивает
не
только "свой" ион Na+, но и другие ионы натрия
вокруг себя.
Это приводит к тому, что около любогоиз ионов находится не один ион с противоположным
знаком, а 6 ионов. Решетка с гранецентрированной
кубической упаковкой
Слайд 92
Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами
с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов).
В ковалентных
кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.Слайд 93атомная решетка
кристаллы, в которых жесткая решетка удерживаются не силами межмолекулярного
взаимодействия, а ковалентными связями. Такие кристаллы называются ковалентными каркасными кристаллами.
Они состоят из бесконечных цепочек атомов, связанных друг с другом ковалентными связями, и в них нельзя различить отдельных молекул. Алмаз Графит
Слайд 94Графит и алмаз - две аллотропные модификации углерода.
Аллотропные модификации
при определенных условиях могут переходить друг в друга.
Например, при
очень высоких давлениях и температурах графит может переходить в алмаз. Именно так из графита делают искусственные алмазы.В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью.
Алмаз - самый твёрдый природный материал.
Слайд 95Молекулярные кристаллы
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы.
Химические связи в них ковалентные, как полярные, так и неполярные.
Связи в молекулах прочные, но между молекулами связи не прочные.
Молекулы удерживаются рядом друг с другом благодаря силам межмолекулярного взаимодействия.
Слайд 96Ван-дер-ваальсова (межмолекулярная) связь
Ван-дер-ваальсовы силы (Van-der-Vaalse force) -слабое взаимодействие
между нейтральными молекулами на расстояниях, значительно превосходящих их размеры. Или:
это силы взаимодействия, возникающие между электрически нейтральными атомами и молекулами и имеющие электрическую природу.Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Слайд 97Молекулярная решетка
Типичные молекулярные кристаллы образуют вода
H2O и кварц SiO2.
Для
воды характерен особый вид межмолекулярного
взаимодействия - водородная связь
кристаллический
иод tпл=1130ССлайд 99Металлическая связь
возникает в результате частичной делокализации валентных электронов, которые достаточно
свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными
ионами.Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность, ковкость и пластичность, характерный металлический блеск.
Ковкий и пластичный металл легко расплющивается в тонкий лист, вытягивается в тонкую проволоку.
Слайд 100Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток
находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный
газ).Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованной s-электронами.
Слайд 101Металлическая решетка (Na)
Каждый атом натрия в кристалле отдает в пространство
между атомами по одному валентному электрону, превращаясь в ион натрия
Na+. Ионы в кристалле омываются "электронным морем" общих электронов. Это "электронное море" не позволяет металлическому кристаллу распадаться.Слайд 102металлическую связь склонны образовывать элементы, атомы которых на внешних оболочках
имеют мало валентных электронов.
Слайд 105В процессе протекания химических реакций происходит изменение внутренней энергии системы
.
Изменение внутренней энергии происходит путем выделения или поглощения теплоты и
совершения работы Слайд 106
Важнейшими термодинамическими функциями являются:
U - внутренняя энергия,
Q -
теплота,
А - работа,
Н – энтальпия,
G – изобарно-изотермический коэффициент
или свободная энергия Гиббса,S – энтропия.
Слайд 107Термодинамические параметры:
Р – давление (Па) ,
V - объем системы
(м3),
Т - температура (К),
n - количество частиц определенного
типа.Слайд 108Результаты термохимических измерений – тепловые эффекты реакций – принято относить
к одному молю образующегося вещества.
Количество теплоты, которое выделяется при образовании
1 моля соединения из простых веществ, называется теплотой образования данного соединения.Теплоты образования наиболее устойчивых простых веществ принимаются равными нулю.
∆H(прост.в-в) = 0
Слайд 109термохимическое уравнение реакции образования жидкой воды имеет вид
2H2 + O2
= 2H2O + 571,6 кДж, или
H2 + ½ O2 =
H2O + 285,8 кДжНапример, выражение «теплота образования воды равна 285,8 кДж/моль» означает, что при образовании 18 г жидкой воды из 2 г водорода и 16 г кислорода выделяется 285,8 кДж.
Слайд 110 Все тепловые эффекты, приводимые в таблицах термодинамических величин,
относятся к 250С (298 К), давлению равному 760 мм.рт.ст. Такие
условия проведения реакции называют стандартными.Слайд 111изменение энтальпии записывается как
∆H0298 .
Верхний индекс 0 означает
стандартную величину теплового эффекта реакции, а нижний температуру, при которой
идет взаимодействие.В реакциях, идущих с выделением теплоты (экзотермических), энтальпия системы уменьшается (∆H ‹ 0);
в реакциях, идущих с поглощением теплоты (эндотермических), энтальпия системы увеличивается (∆H › 0 ).
Слайд 112пример записи термохимического уравнения :
N2 + O2 = 2NO, ∆H0298=+
90,25 кДж
Т.е. реакция образования оксида азота (II) идет с поглощением
теплоты и называется эндотермической.Слайд 113Закон Гесса
тепловой эффект химической реакции не зависит от пути ее
протекания, а зависит лишь от природы и физического состояния исходных
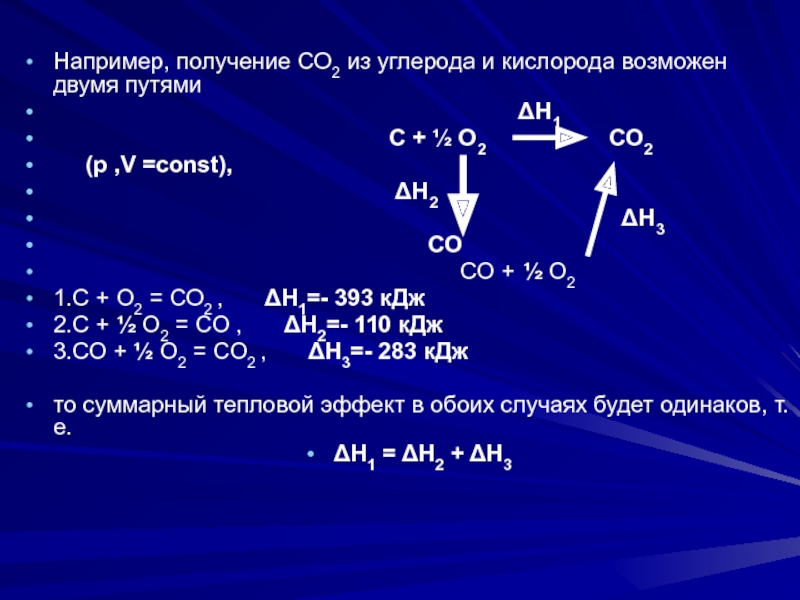
веществ и продуктов реакции.Слайд 114Например, получение СО2 из углерода и кислорода возможен двумя путями
Н1
С + ½ О2 СО2
(р ,V =const),
Н2
Н3
СО
СО + ½ О2
1.С + О2 = СО2 , Н1=- 393 кДж
2.С + ½ О2 = СО , Н2=- 110 кДж
3.СО + ½ О2 = СО2 , Н3=- 283 кДж
то суммарный тепловой эффект в обоих случаях будет одинаков, т.е.
Н1 = Н2 + Н3
Слайд 115Следствия закона Гесса
Теплотой сгорания называют тепловой эффект реакции окисления 1
моля данного вещества кислородом до оксидов элементов, входящих в состав
этого вещества, находящихся в максимальной степени окисленияСлайд 116Теплотой образования вещества называют тепловой эффект образования одного моля данного
вещества из простых веществ при Р, Т = const.
Обычно Р и Т
берут в стандартных условиях, т.е. при Р =1 атм.=1,01105Па и Т = 298 К (25 0С).
В этом случае теплоту образования вещества обозначают Н0обр.
Слайд 117Первое следствие.
Тепловой эффект образования сложного вещества равен по величине
и противоположен по знаку тепловому эффекту разложения этого вещества.
Н2
+½ О2=Н2О(газ) (Н0 = -241,83 кДж/моль)Н2О(газ) =Н2 +½ О2 (Н0 =+241,83 кДж/моль)
Слайд 118Второе следствие.
Тепловой эффект реакции равен разности между суммой теплот образования
продуктов реакции и суммой теплот образования исходных веществ с учетом
коэффициентов перед формулами этих веществ в уравнении реакции (стехиометрических коэффициентов).Н хим.р.= Нобр.(прод) - Н обр.(исх. в-в.)
Слайд 119аА + bВ = nN + mM; Нx.p.=?
Нхим.р.= Нобр.(прод)
- Н обр.(исх. в-в.)=
=(nН0298N + mН0298M) – (aН0298A + bН0298
B)где
А и В – исходные вещества,
М и N – продукты реакции,
a, b, n, m – стехиометрические
коэффициенты
Слайд 120 S - Энтропия
Mакросостояние системы тем более вероятно, чем
большим числом микросостояний оно может осуществиться.
Энтропия (S)
связана с числом (W) равновероятных микроскопических состояний, которыми можно реализовать данное макроскопическое состояние системы, уравнениемS = k lg W ,
где k — коэффициент пропорциональности
Слайд 121Наименьшую энтропию имеют идеально правильно построенные кристаллы при абсолютном нуле.
Энтропия кристалла, в структуре которого имеются какие-либо неправильности, уже при
абсолютном нуле несколько больше, так как нарушения идеальности могут реализоваться не единственным способом.С повышением температуры энтропия всегда возрастает, так как возрастает интенсивность движения частиц, а следовательно, растет число способов их расположения.
Слайд 122Возрастает она также при превращении вещества из кристаллического состояния в
жидкое и, в особенности, при переходе из жидкого состояния в
газообразное.увеличение числа газовых молекул приводит к возрастанию энтропии, уменьшение — к ее понижению.
Слайд 123∆G - изобарно-изотермический потенциал, или свободная энергия Гиббса
∆G -
функция, которая отражает направление протекания процесса как тенденции к уменьшению
внутренней энергии, так и тенденции к достижению наиболее вероятного состояния системы.Слайд 124Энергия Гиббса связана с энтальпией, энтропией и температурой соотношением:
∆ G
= ∆ H –T ∆ S
Полезной работой называется вся производимая в ходе процесса работа за вычетом работы расширения PΔV.Слайд 125При обратимом и изотермическом проведении процесса ΔG равно по абсолютной
величине, но обратно по знаку максимальной полезной работе, которую система
производит в данном процессе:ΔG = - Амакс
Слайд 126самопроизвольно могут протекать только те реакции, за счет энергии которых
можно совершать полезную работу.
Слайд 127поэтому при
ΔG
самопроизвольно (коррозия
металлов, разряд источников
питания) ;
ΔG>0 – реакции несамопроизвольные
(электролиз);
ΔG=0 – состояние равновесия
(ΔН = TΔS ).
Слайд 128Стандартное изменение энергии Гиббса реакции связано с константой равновесия реакции
уравнением:
ΔG0 = - 2,3RTlgKp
При подстановке значения R=8,314 Дж/(моль•К) и Т=298 К; величина ΔG0 выразится формулой: ΔG°298 = - 5,71 lg К298
Это справедливо для любой температуры, но чаще применяется для стандартной.
Слайд 129
Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ
принимаются равными нулю.
Слайд 130Задача 2. Вычислить ΔН0298, - тепловой эффект при
298 К и постоянном давлении и ΔG0298 реакции: Fe2O3
+ 2A1 = А12О3 + 2FeВычислим ΔН°298 (тепловой эффект реакции).
1. Находим в табл. значения ΔН°298 Fe2O3 (-822,2 кДж/моль) и А12О3 (-1676,0 кДж/моль) при 298 К
2. Согласно следствию из закона Гесса:
ΔН°х.р. = ΔН°298 А12О3 +2ΔН°298Fe -ΔН°298 Fe2O3 -2ΔН°298 A1 = - 1676,0 - (-822,2) = - 853,8 кДж
термохимическое уравнение реакции запишется следующим образом:
Fe2O3 + 2A1 = А12О3 + 2Fe; ΔН0х.р. =+ 853,8 кДж.
Слайд 131
Вычисление ΔG°х.р. реакции.
Находим в табл. ΔG0298Fe2O3 (-740,3 кДж/моль) и
А12О3 (-1582 кДж/моль) при 298 К и
Согласно следствию из
закона Гесса ΔG°х.р.= ΔG°298 А12О3 + 2ΔG°298Fe - ΔG°298 Fe2O3 -- 2ΔG°298 A1 = - 1582 — (-740,3) = - 831,7 кДж
Слайд 132Полученное отрицательное значение °298 подтверждает вывод, сделанный на основе оценки
ΔН°х.р. реакции. Близость найденных значений ΔН°х.р. и
ΔG°х.р. связана, в частности, с тем, что при протекании рассматриваемой реакции не меняется число молекул газов (в нашем примере ни исходные вещества, ни продукты реакции не являются газами).При изменении же числа молекул газов может существенно изменяться энтропия системы (переход в газообразное состояние сопровождается сильным возрастанием молекулярного беспорядка!), вследствие чего значения ΔG°298 и ΔН°298 могут не только заметно различаться по величине, но даже иметь разные знаки . Поэтому в подобных случаях знак ΔG°298 не может служить определенным критерием направления самопроизвольного протекания реакции.