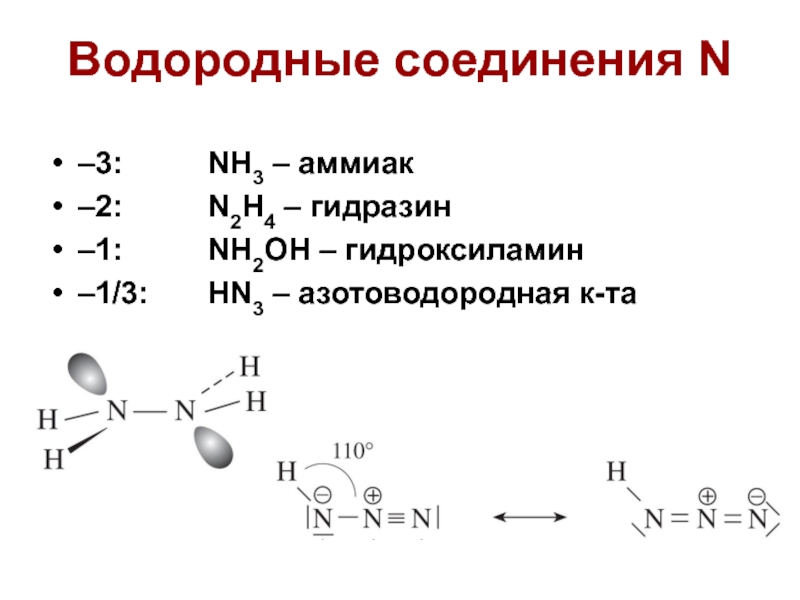
количество соединений с различными степенями окисления.
9 степеней окисления! От
– 3 до +5.
Основные: +5 (нитраты – NO3-)
+4 (NO2)
+3 (нитриты – NO2-)
+2 (NO)
+1 (N2O)
0 (N2)
-3 (NH3)
Для азота нет валентности - ?
5 не бывает! Потому что, валентность это количество обобществленных заполненных орбиталей.
А у азота их только 4! Максимальная валентность 4!
P4 – белый фосфор (куб./ромб.), пары.
Pn – красный фосфор, черный фосфор.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Здесь нет металлического фосфора. Есть «желтый» - смесь красного и белого!