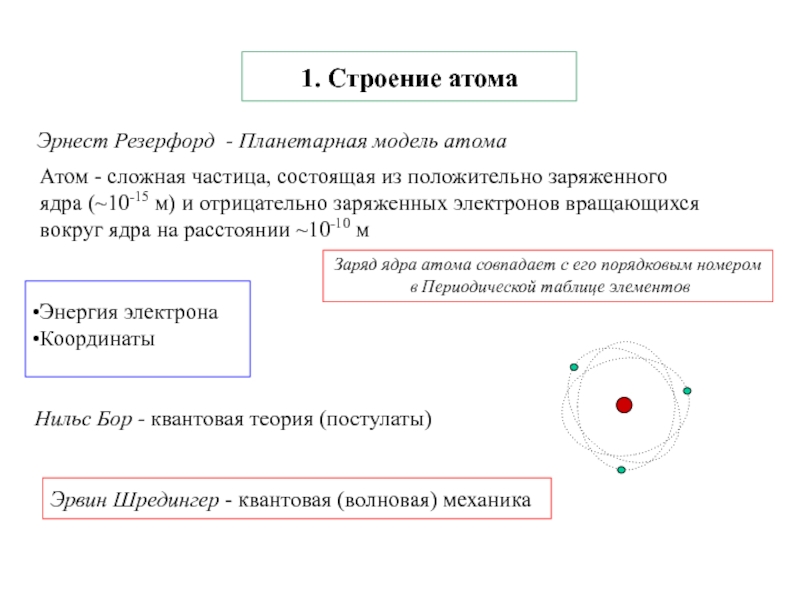
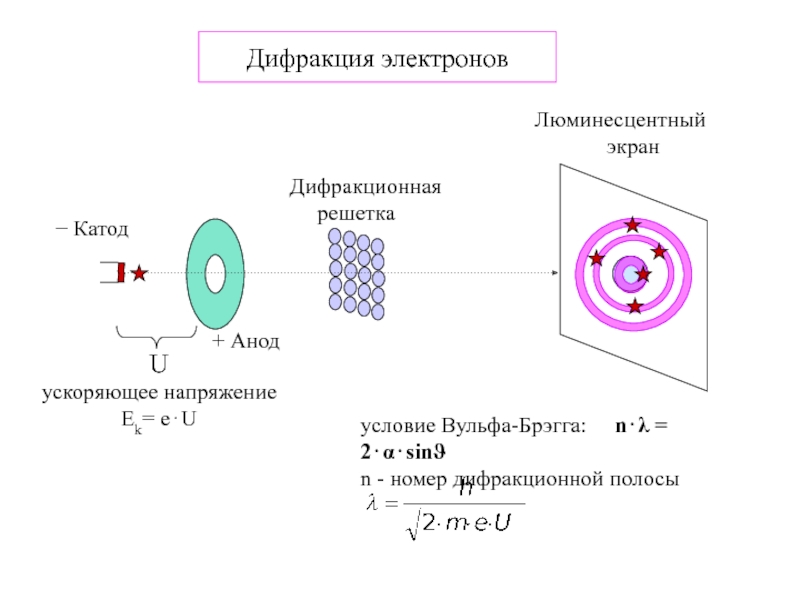
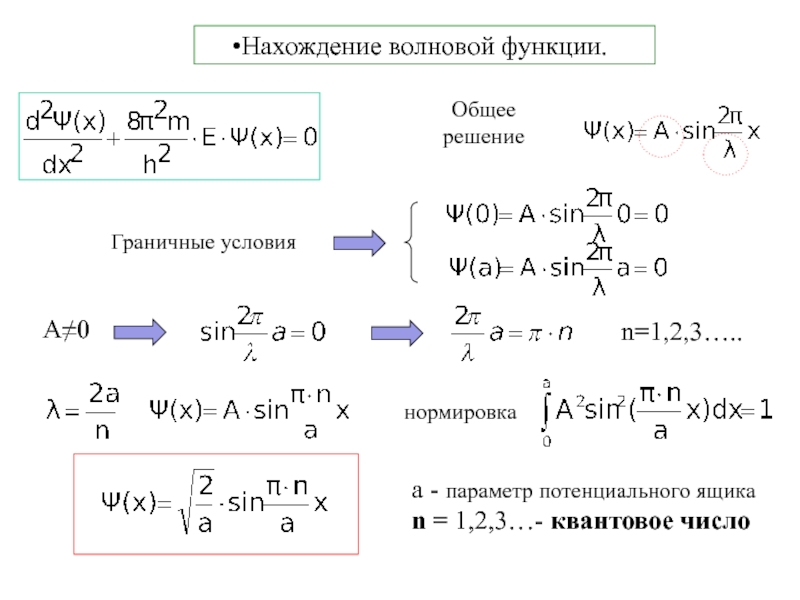
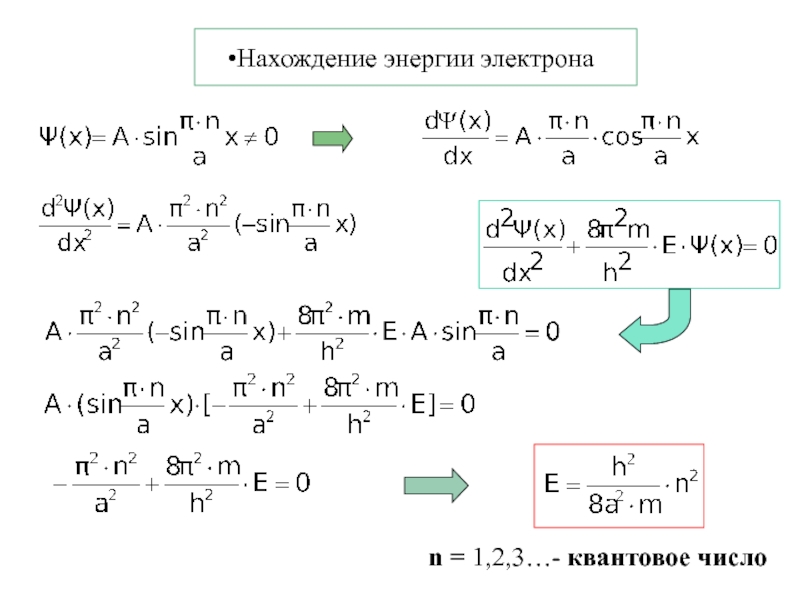
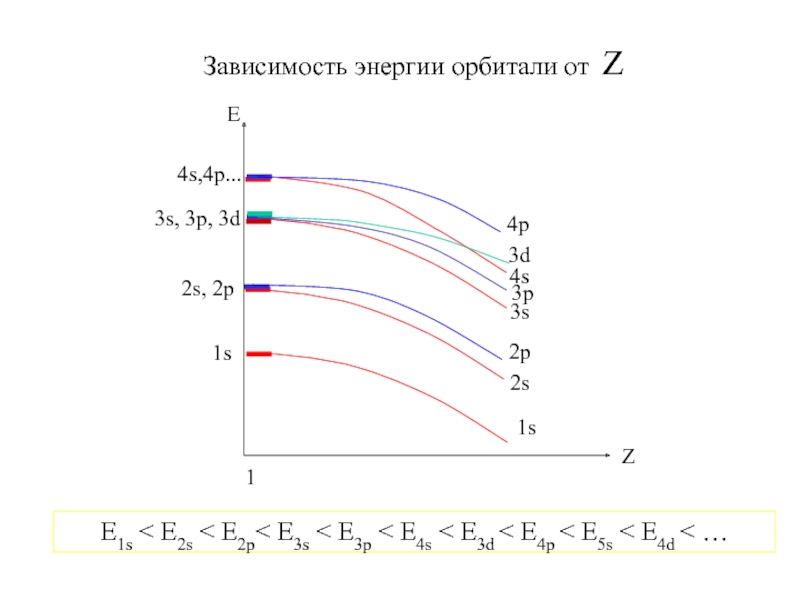
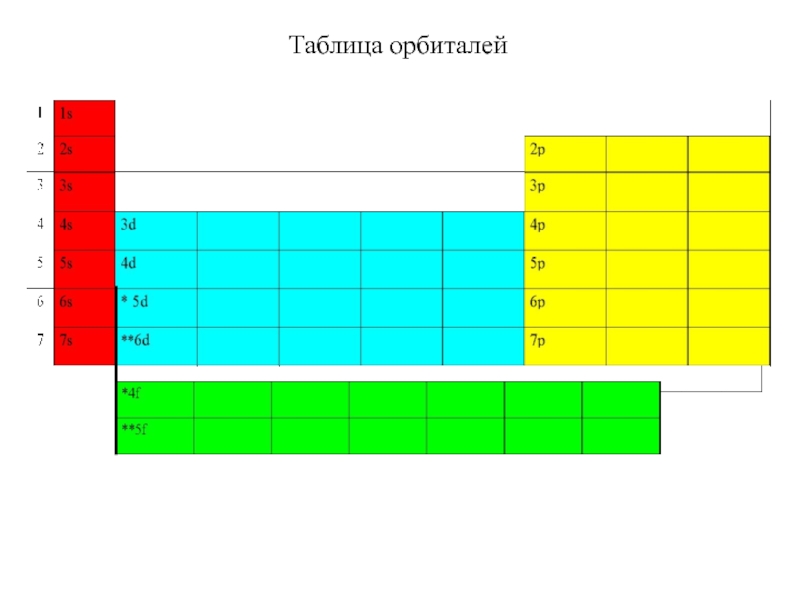
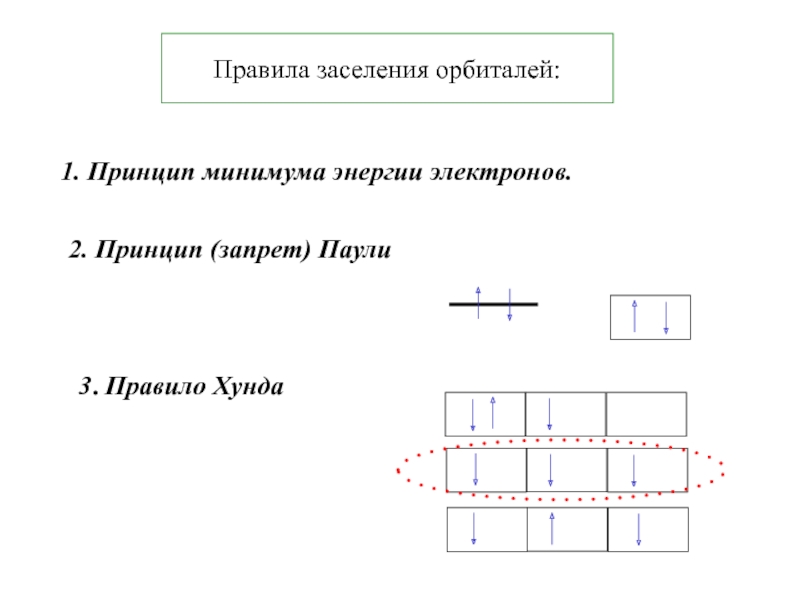
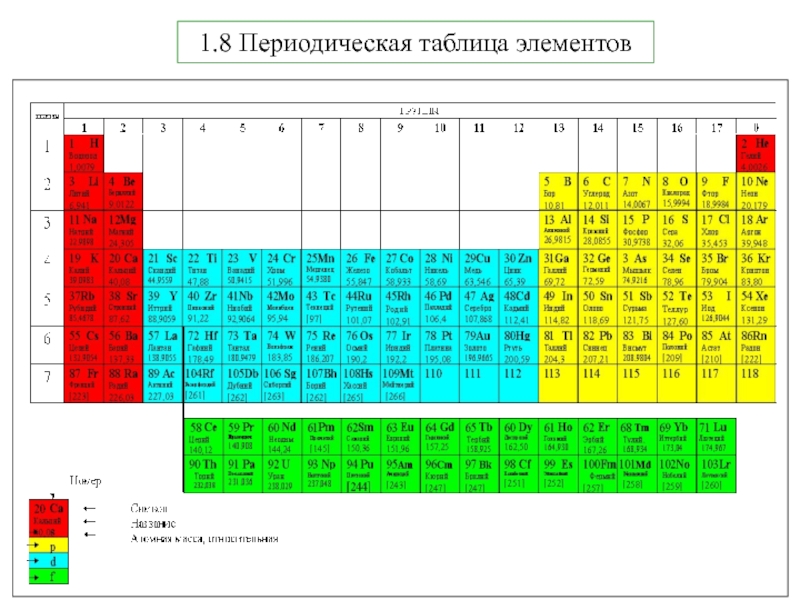
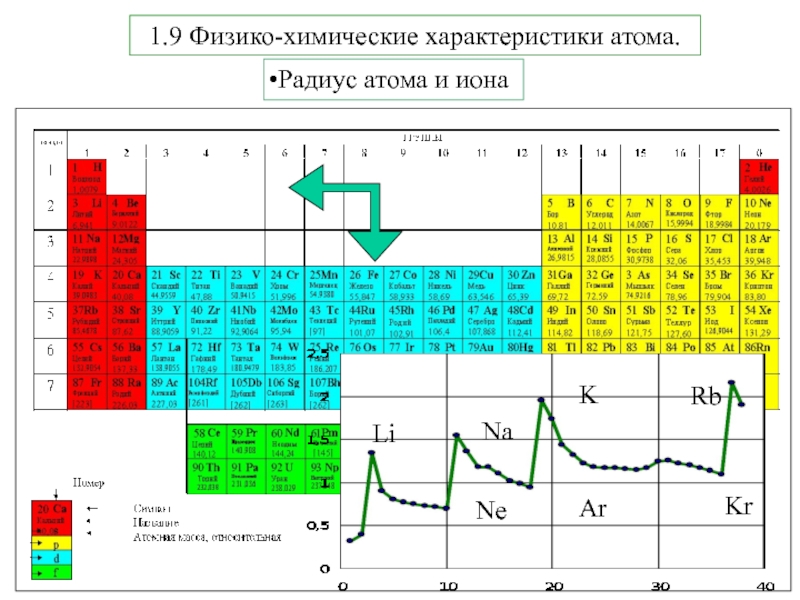
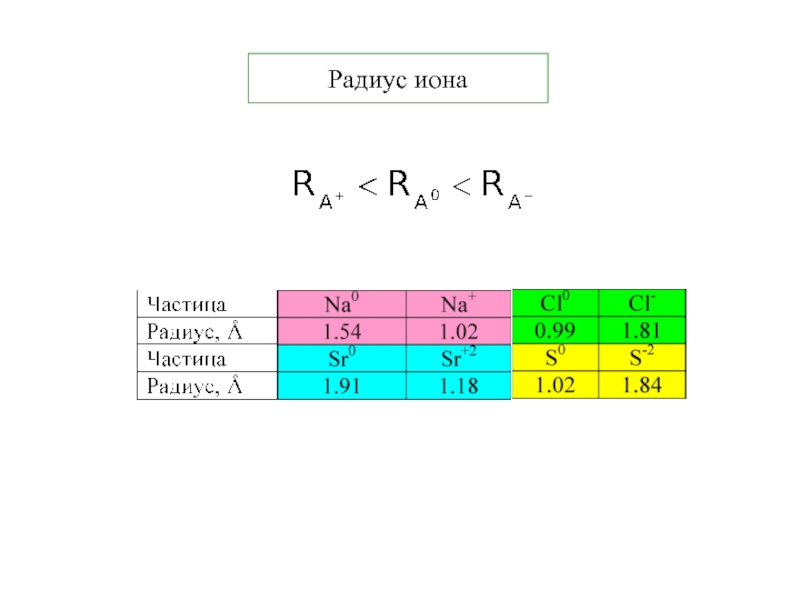
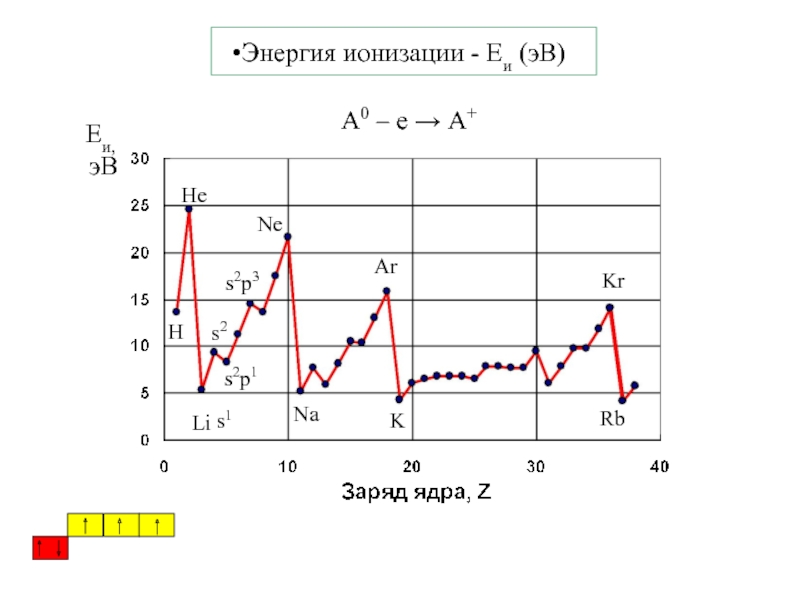
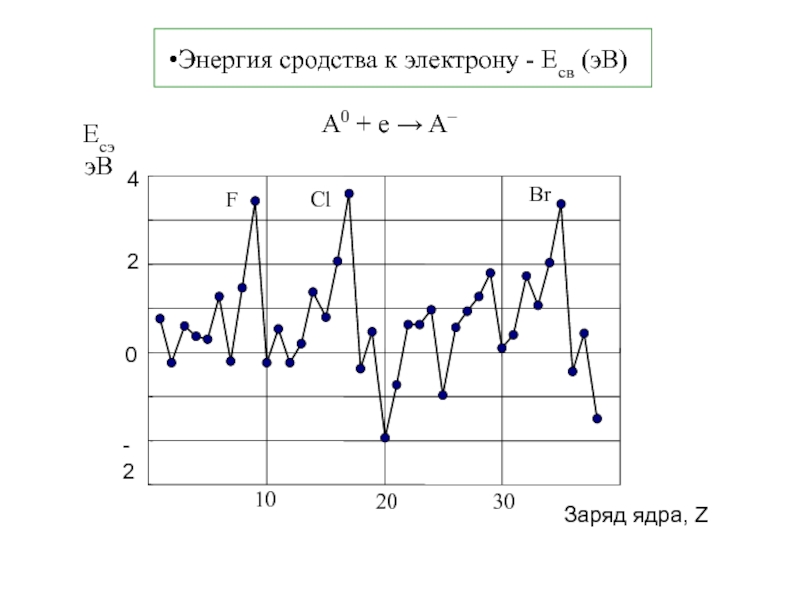
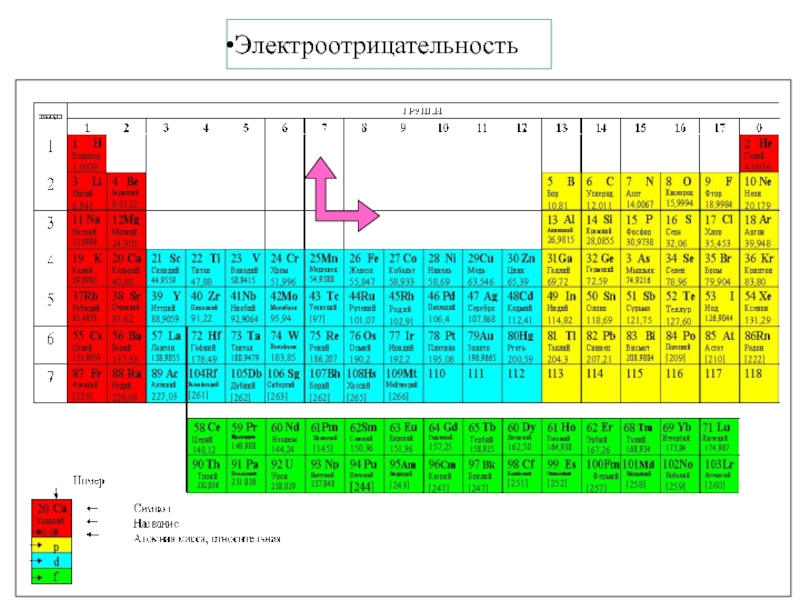
Термодинамика и кинетика химического процесса
- теоретические основы
Часть 3. Электрохимические
и коррозионные процессы4. Физико-химические основы общей химии
под редакцией Б.Т. Плаченова