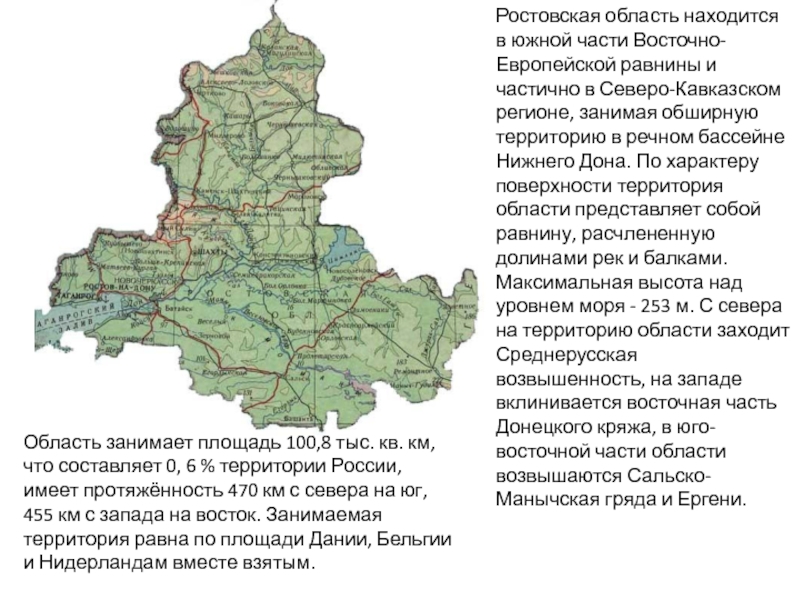
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
Содержание
- 1. Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
- 2. Доказательство подлинности хлорид-иона Реакция осаждения с раствором
- 3. Доказательство подлинности хлорид-иона Реакция осаждения с раствором серебра нитрата ПодлинностьБелый творожистый осадок
- 4. осадок серебра хлорида не растворилсяосадок серебра хлорида
- 5. Доказательство подлинности бромид-иона Реакция осаждения
- 6. Доказательство подлинности бромид-иона Реакция осаждения с раствором серебра нитрата Желтоватыйтворожистый осадок серебра бромидаПодлинность
- 7. желтоватыйтворожистый осадок серебра бромидаосадок серебра бромида трудно растворим в растворе аммиака+ NH4OH
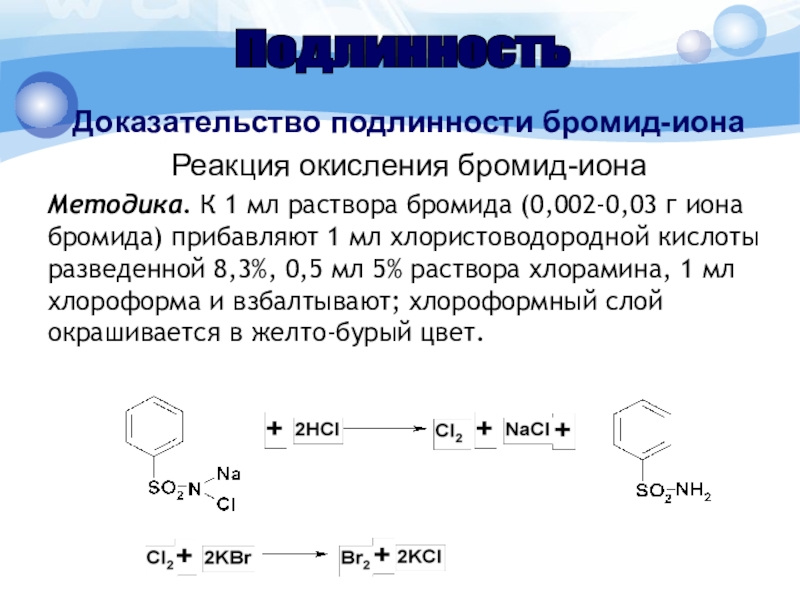
- 8. Доказательство подлинности бромид-ионаРеакция окисления бромид-ионаМетодика. К 1
- 9. Реакция окисления бромид-ионаокрашивание хлороформного слоя в желто-бурый цвет.
- 10. Доказательство подлинности йодид-иона Реакция осаждения с
- 11. желтыйтворожистый осадокДоказательство подлинности йодид-иона Реакция осаждения с раствором серебра нитрата
- 12. Доказательство подлинности йодид-иона
- 13. Доказательство подлинности йодид-ионаРеакция окисления йодид-ионаМетодика. К 2
- 14. Реакция окисления йодид-ионаокрашивание хлороформного слоя в фиолетовый цвет
- 15. Реакция осаждения с раствором серебра нитрата Сравнительная характеристика ПодлинностьAgCl↓(белый)AgBr↓(желтоватый)AgI↓(желтый)
- 16. Реакция окисленияСравнительная характеристика ион йодида (фиолетовый)ион бромида(желто-бурый) Подлинность
- 17. Доказательство подлинности иона натрияМикрокристаллическая реакция с пикриновой
- 18. Доказательство подлинности иона натрияМикрокристаллическая реакция с пикриновой кислотойПодлинность
- 19. Доказательство подлинности иона натрияМикрокристаллическая реакция с пикриновой
- 20. Доказательство подлинности иона калия Реакция образования осадка
- 21. Доказательство подлинности иона калия Реакция образования осадка
- 22. Доказательство подлинности иона калия Реакция образования
- 23. Доказательство подлинности иона калия Реакция с винной кислотой Растворение осадка + HCl+NaOH
- 24. Аргентометрический метод
- 25. Аргентометрический метод
- 26. Взвешивают навеску субстанциина ручных весах
- 27. Переносят навеску на часовое стекло
- 28. Взвешивают стекло с навеской на аналитических весах
- 29. Переносят навеску субстанции в колбу для титрования
- 30. Взвешивают стекло на аналитических весах
- 31. Смывают остатки субстанции со стенок воронки водой очищенной
- 32. Растворяют навеску субстанции в воде
- 33. Прибавляют индикатор эозинат натрия
- 34. Прибавляют кислоту уксусную разведенную
- 35. Слайд 35
- 36. Титруют 0,1 М раствором серебра нитрата до перехода окраскиосадка от желтой до розовой
- 37. Окраска в конце титрования
- 38. Аргентометрический метод
- 39. Методика. 1 мл препарата помещают в колбу
- 40. Отмериваютпипеткойнавеску препарата
- 41. Прибавляют 10 мл воды очищенной
- 42. Прибавляют индикатор калия хромат
- 43. Окраска раствора до начала титрования
- 44. Титруют 0,05 М раствором серебра нитрата до появления оранжево-желтого окрашивания осадка
- 45. Окраска в конце титрования
- 46. Список литературы Беликов, В.Г. Фармацевтическая химия
- 47. Иллюстрированные методики подготовили: Саттарова Ольга Евгеньевна, доцент
- 48. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям по
фармацевтической химии
для студентов 3 курса
Слайд 2Доказательство подлинности хлорид-иона
Реакция осаждения с раствором серебра нитрата
Методика. К
2 мл раствора хлорида (0,002-0,01 г иона хлорида) прибавляют 0,5
мл азотной кислоты разведенной 16% и 0,5 мл 2% раствора серебра нитрата; образуется белый творожистый осадок, нерастворимый в азотной кислоте разведенной 16% и растворимый в 10% растворе аммиака.Подлинность
Слайд 3Доказательство подлинности хлорид-иона
Реакция осаждения с раствором серебра нитрата
Подлинность
Белый творожистый
осадок
Слайд 5Доказательство подлинности бромид-иона Реакция осаждения с раствором серебра нитрата
Методика. К 2 мл раствора бромида (0,002-0,01 г иона бромида)
прибавляют 0,5 мл азотной кислоты разведенной 16% и 0,5 мл 2% раствора серебра нитрата; образуется желтоватый творожистый осадок, нерастворимый в азотной кислоте разведенной 16% и трудно растворимый в 10% растворе аммиака.
Подлинность
Слайд 6Доказательство подлинности бромид-иона
Реакция осаждения с раствором серебра
нитрата
Желтоватый
творожистый
осадок серебра бромида
Подлинность
Слайд 7желтоватый
творожистый
осадок серебра бромида
осадок серебра бромида трудно растворим в растворе
аммиака
+ NH4OH
Слайд 8Доказательство подлинности бромид-иона
Реакция окисления бромид-иона
Методика. К 1 мл раствора бромида
(0,002-0,03 г иона бромида) прибавляют 1 мл хлористоводородной кислоты разведенной
8,3%, 0,5 мл 5% раствора хлорамина, 1 мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.Подлинность
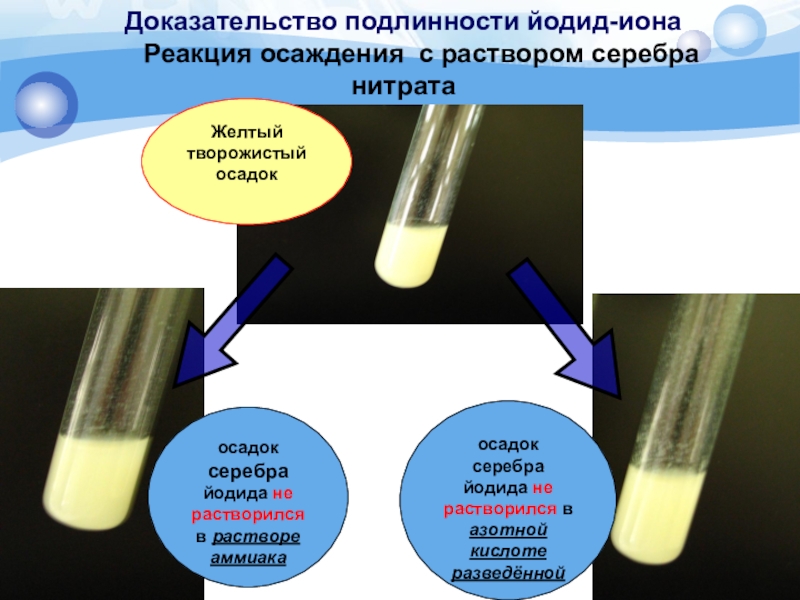
Слайд 10Доказательство подлинности йодид-иона
Реакция осаждения с раствором серебра нитрата
Методика.
К 2 мл раствора йодида (0,002-0,01 г иона йодида) прибавляют
0,5 мл азотной кислоты разведенной 16% и 0,5 мл 2% раствора серебра нитрата; образуется жёлтый творожистый осадок, нерастворимый в азотной кислоте разведенной 16% и 10% растворе аммиака.Подлинность
Слайд 11желтый
творожистый
осадок
Доказательство подлинности йодид-иона
Реакция осаждения с раствором
серебра нитрата
Слайд 12Доказательство подлинности йодид-иона Реакция осаждения с раствором
серебра нитрата
Желтый
творожистый
осадок
осадок серебра йодида не растворился в растворе аммиака
осадок
серебра йодида не растворился в азотной кислоте разведённойСлайд 13Доказательство подлинности йодид-иона
Реакция окисления йодид-иона
Методика. К 2 мл раствора йодида
(0,003-0,02 г иона йодида) прибавляют 0,2 мл серной кислоты разведенной
16%, 0,2 мл 10% раствора натрия нитрита или 3% раствора железа (III) хлорида и 2 мл хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовыйцвет.
или
2KI + 2NaNO2 + 2H2SO4 → I2 + K2 SO4 + Na2SO4 + 2NO↑ + 2H2O
2NaI + 2FeCI3 → I2 + 2FeCI2 + 2NaCI
Подлинность
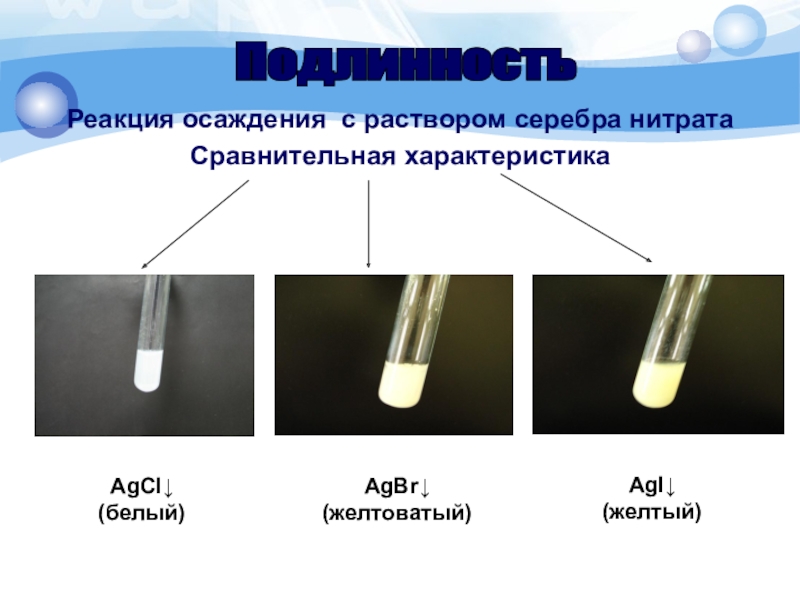
Слайд 15Реакция осаждения с раствором серебра нитрата
Сравнительная характеристика
Подлинность
AgCl↓
(белый)
AgBr↓
(желтоватый)
AgI↓
(желтый)
Слайд 16Реакция окисления
Сравнительная характеристика
ион йодида
(фиолетовый)
ион бромида
(желто-бурый)
Подлинность
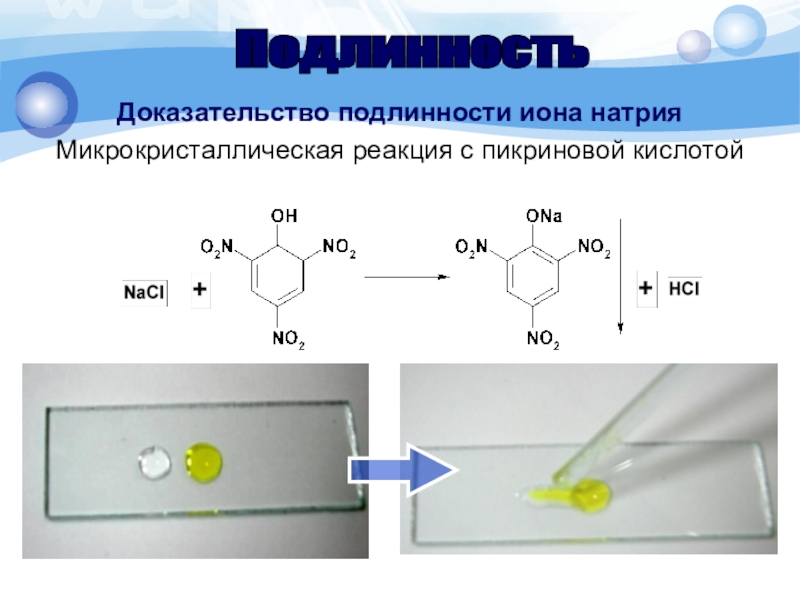
Слайд 17Доказательство подлинности иона натрия
Микрокристаллическая реакция с пикриновой кислотой
Методика. 1 каплю
раствора соли натрия (0,01-0,03 г иона натрия) помещают на предметное
стекло, рядом помещают 1 каплю 1% раствора пикриновой кислоты. Капли соединяют стеклянной палочкой и через 1-2 мин наблюдают под микроскопом по краю капли желтые игольчатые кристаллы, выходящие из одной точки.Подлинность
Слайд 18Доказательство подлинности иона натрия
Микрокристаллическая реакция с пикриновой кислотой
Подлинность
Слайд 19Доказательство подлинности иона натрия
Микрокристаллическая реакция с пикриновой кислотой
Под микроскопом наблюдают
по краям капли жёлтые игольчатые кристаллы, выходящие из одной точки
Подлинность
Слайд 20Доказательство подлинности иона калия
Реакция образования осадка с винной кислотой
Методика.
К 2 мл раствора соли калия (0,01-0,02 г иона калия)
прибавляют 1 мл 20% раствора винной кислоты, 1 мл 10% раствора натрия ацетата, 0,5 мл 95% спирта и встряхивают; постепенно образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких щелочей.HCI + CH3COONa NaCI + CH3COOH
Подлинность
Слайд 21Доказательство подлинности иона калия
Реакция образования осадка с винной кислотой
Условия
проведения реакции:
при охлаждении раствора до 15-20 oC;
при потирании стеклянной
палочкой о стенки пробирки;
в присутствии спирта этилового и натрия ацетата.
Подлинность
Слайд 22Доказательство подлинности иона калия
Реакция образования осадка
с винной кислотой
белый
кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких
щелочейСлайд 23Доказательство подлинности иона калия
Реакция с винной кислотой
Растворение осадка
+ HCl
+NaOH
Слайд 24Аргентометрический метод
(вариант Фаянса, прямое титрование)
Титрант: раствор серебра нитрата.
Индикатор: адсорбционный - натрия
эозинат.Среда: уксуснокислая.
KI + AgNO3 AgI + KNO3
Механизм индикации:
Калия йодид (субстанция)
Количественное определение
а) NaInd Ind + Na+
Эозинат натрия
б) KI + AgNO3 AgI + KNO3
в) Ind- + AgI + AgNO3 [(AgI)Ag+]Ind + NO3
изб. капля розовый осадок
Слайд 25Аргентометрический метод
(вариант Фаянса, прямое титрование)
Методика. Около 0,05 г (точная навеска) субстанции
помещают в колбу для титрования, растворяют в 10 мл воды, прибавляют 0,25 мл 0,1% раствора натрия эозината, 2 мл уксусной кислоты разведенной 30% и титруют 0,1М раствором серебра нитрата до перехода окраски осадка от желтой до розовой. Содержание калия йодида в процентах (Х) рассчитывают по формуле:
Калия йодид (субстанция)
Количественное определение
Слайд 38Аргентометрический метод
(вариант Мора, прямое титрование)
Титрант: раствор серебра нитрата.
Индикатор: калия хромат.
Реакция среды:
нейтральная.NaСI + AgNO3 → AgCI + NaNO3
Индикация:
Раствор натрия хлорида 0,9% для инъекций
Количественное определение
оранжево-желтый осадок
2AgNO3 + K2CrO4 Ag2CrO4 + 2KNO3
Слайд 39
Методика. 1 мл препарата помещают в колбу для титрования, прибавляют
10 мл воды, 0,1 мл 5% раствора калия хромата и
титруют 0,05М раствором серебра нитрата до появления оранжево-желтого окрашиванияосадка.
Содержание натрия хлорида в 1 мл препарата должно быть
0,0087-0,0093 г.
Раствор натрия хлорида 0,9% для инъекций
Количественное определение
Слайд 46
Список литературы
Беликов, В.Г. Фармацевтическая химия / 4-е
изд., перераб. и доп. – М., МЕДпрессинформ", 2008. – 613
с.Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 10-е изд. – М.: Медицина, 1968. – 1079 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1987. Вып. 1. – 336 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1989. Вып. 2. – 400 с.
Государственная фармакопея Российской Федерации [Текст]. – 12-е изд. – М.: Науч. центр экспертизы средств мед. применения, 2007. – Ч. 1. – 696 с.
Практическое руководство к лабораторным занятиям по фармацевтической химии для студентов III курса / Т.И. Ярыгина, О.Л. Визгунова, В.А. Дубовик и др. / под ред. Л.М. Коркодиновой – Пермь, 2011. – 102 с.
Руководство к лабораторным занятиям по фармацевтической химии: учеб. пособие / Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. / под. ред. А.П. Арзамасцева. – 3-е изд., перераб. и доп. – М., Медицина, 2001. – 384 с. : ил.1.