Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иммуногенетика в ревматологий
Содержание
- 1. Иммуногенетика в ревматологий
- 2. План: 1. Что такое главный комплекс
- 3. 2. Что такое главный комплекс гистосовместимости и
- 4. Слайд 4
- 5. 3. Существуют ли отличия между комплексом гистосовместимости
- 6. 8. В чем смысл букв-окончаний (А, В...)
- 7. 10. Как буквы (области) А, В, С,
- 8. 11. Как происходит связывание антигена? Все антигенсвязывающие
- 9. Антигенсвязывающий участок
- 10. Иммуноглобулины, Т-клеточные рецепторы и молекулы ГКГ класса
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. HLA-B27 относится к наиболее изученным антигенам и
- 15. Слайд 15
- 16. СПАСИБО ЗА ВНИМАНИЕ!
- 17. Скачать презентанцию
План: 1. Что такое главный комплекс гистосовместимости и какова его функция? 2. Как происходит связывание антигена? 3. Механизмы связи HLA - сыстемы с болезнями 4. Антиген HLA-B27
Слайды и текст этой презентации
Слайд 32. Что такое главный комплекс гистосовместимости и какова его функция?
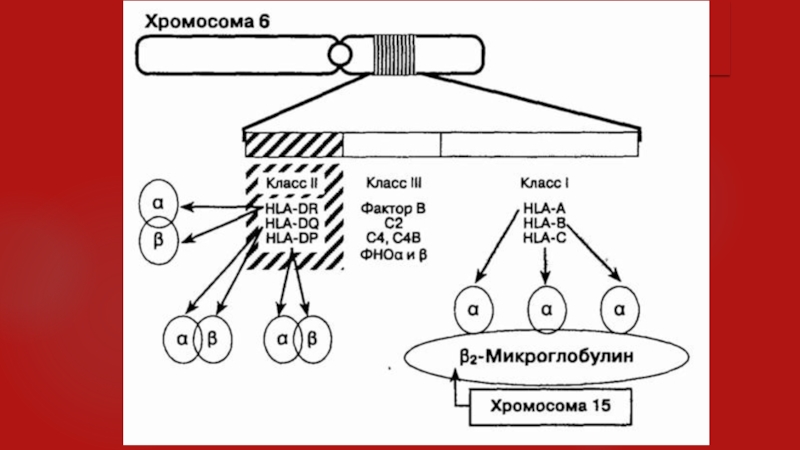
ГКГ локализован в коротком плече 6-й хромосомы в области, содержащей
почти 4 млн пар оснований. Существуют три области, кодирующие три различных класса белков,— комплекс гистосовместимости класса I, II и III (см. рисунок). Самый большой по протяженности участок (почти 2 млн пар нуклеотидов) кодирует молекулы класса I. Более короткий участок (около 1 млн пар нуклеотидов) кодирует молекулы класса П. Функция молекул этих двух классов заключается в презентации антигенов Т-клеткам. Оставшийся участок комплекса гистосовместимости между областями, относящимися к классам I и II, кодирует различные белки, и не способные выявлять антиген.
Однако многие белки класса III участвуют в регуляции иммунного ответа, и некоторые из них связаны с возникновением ревматических заболеваний, в том числе С2, С4 и фактор В системы комплемента, факторы некроза опухоли и некоторые белки теплового шока. Молекулы класса I и класса II являются димерами. Комплекс гистосовместимости кодирует а- и р-цепи молекул класса II, но только сх-цепи класса I. Р2-Микроглобулин, р-цепь всех молекул класса II, кодируется относительно инвариантной аллелью 15-й хромосомы.
Слайд 53. Существуют ли отличия между комплексом гистосовместимости и человеческим лейкоцитарным
антигеном (HLA)?
В практических целях эти термины взаимозаменяемы. И все же
они различны. Термин "главный комплекс гистосовместимости" преимущественно используется для обозначения генов, локализованных в 6-й хромосоме. Этот комплекс кодирует HLA. Термин "человеческий лейкоцитарный антиген" применяется для обозначения молекулярных продуктов генов комплекса гистосовместимости, т. е. HLA-молекулы — белки клеточной поверхности, кодируемые различными локусами комплекса гистосовместимости. Эти белки являются антигенами, поскольку похожи на большинство белков клеточной поверхности и могут быть распознаны Т-клеточными рецепторами и иммуноглобулинами. Впервые они были описаны как человеческие лейкоцитарные антигены (HLA). Однако известно, что они распределены значительно шире, чем только в лейкоцитах. С точки зрения специальной терминологии, "комплекс гистосовместимости" и "HLA" не идентичны. Слайд 68. В чем смысл букв-окончаний (А, В...) при аббревиатуре HLA?
В аббревиатурах HLA с последующим написанием буквы через дефис, например
HLA-A, обозначена специфическая локализация гена в ГКГ, кодирующем конкретную молекулу HLA. HLA-A, HLA-B и HLA-C описывают самые важные характеристики локуса I гена комплекса гистосовместимости. 9. Почему HLA-D получает дополнительные обозначения буквами — R, P, Q?
Буква D характеризует внутреннюю область II класса комплекса гистосовместимости, а не только локус одного гена. Следовательно, чтобы описать фактически существующий локус гена, необходимо большее количество букв. Например, HLA-DP, -DQ и -DR указывают на локусы гена, кодирующего самые важные молекулы класса II.
Ситуацию усугубляет и то, что каждая молекула класса II ГКГ состоит из двух отдельных полипептидных цепей, обозначаемых а и р. Поэтому, если написано "HLA-DRA" или "HLA-DRB", это означает локус для HLA-DR а- или (3-цепи относительно каждого в отдельности.
Слайд 7
10. Как буквы (области) А, В, С, D соотносятся с
классом комплекса гистосовместимости?
Молекулы класса I и II главного комплекса
гистосовместимости
КЛАСС 1 IIHLA-A HLA-B HLA-C
Класс 2 HLA-DR HLA-DP HLA-DQ
HLA-A, -В, -С являются самыми важными молекулами класса I ГКГ. Все молекулы HLA-D представляют класс II; HLA-DP, -DQ и -DR — самые значимые из них. Используют и другие буквы — Е, F, G, H, M, N, О, но они относятся к молекулам класса I (менее важным). Необходимо знать:
• если обозначение HLA не содержит букву D, то это означает класс I ГКГ;
• если буква D присутствует в любом сочетании, то это класс 2.
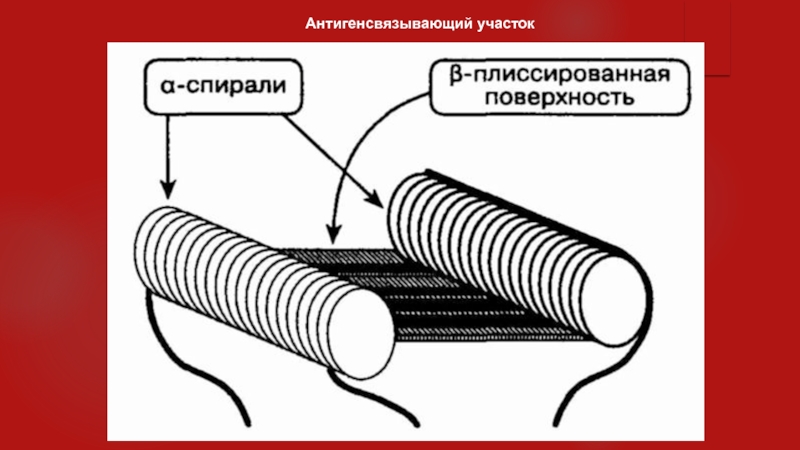
Слайд 811. Как происходит связывание антигена?
Все антигенсвязывающие участки имеют схожую
конфигурацию. Существует углубление-борозда, стенки которой образуют а-спирали. Группы непараллельных молекул
образуют дно борозды Р-складчатой поверхности. В Т-клеточном рецепторе и ГКГII такое строение обуславливает наличие взаимодействия между аминоконцами а- и р-цепей. У иммуноглобулинов антигенсвязывающий участок формируется за счет взаимодействия аминоконцов тяжелых и легких цепей. Молекулы ГКГ типа I отличаются тем, что антигенсвязывающий участок формируется при взаимодействии двух аминоконцов одинаковых а-цепей.Антигены прикрепляются как в зоне стенок из а-спиралей, так и к р-складчатому дну. Если Т-клеточный рецептор принимает комплекс пептидов — белок-молекула ГКГ, то он распознает уникальную структуру и заряд антигенного белка и а-спиралей. Т-клеточный рецептор, в отличие от антигена, не может различать детерминанты (3-складчатого дна.
Три области с самыми значительными генетическими отличиями (гипервариа-бельные участки) экспрессируются в каждом сегменте а-спирали и р-складчатой области. Такая генетическая изменчивость специфично влияет или выбирает антигены, которые могут быть связаны определенными молекулами. К тому же, она обеспечивает специфичный "отбор" Т-клеточных рецепторов, которые способны взаимодействовать с комплексом антиген-молекула ГКГ, что рассматривается как трех-молекулярное взаимодействие.
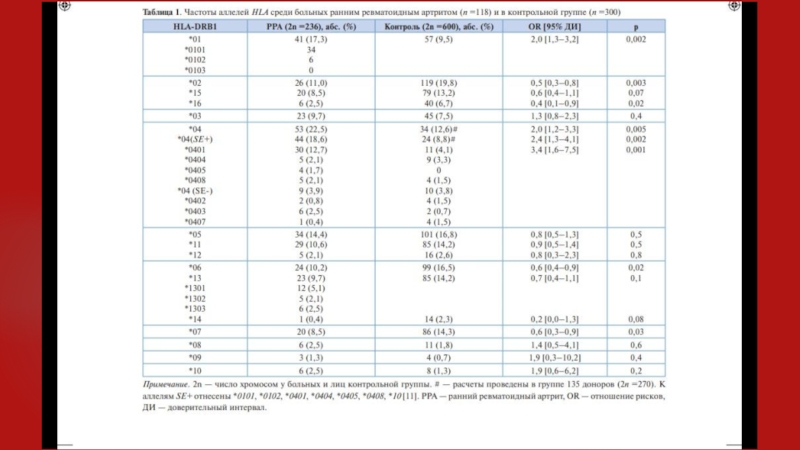
Данные области коррелируют с предрасположенностью к определенным заболеваниям. При ревматоидном артрите, например, специфичная последовательность аминокислот гипервариабельной области имеет высокую корреляцию с восприимчивостью к заболеванию — между аминокислотами в позиции 67-74 HLA-DR р-цепи.
Слайд 10
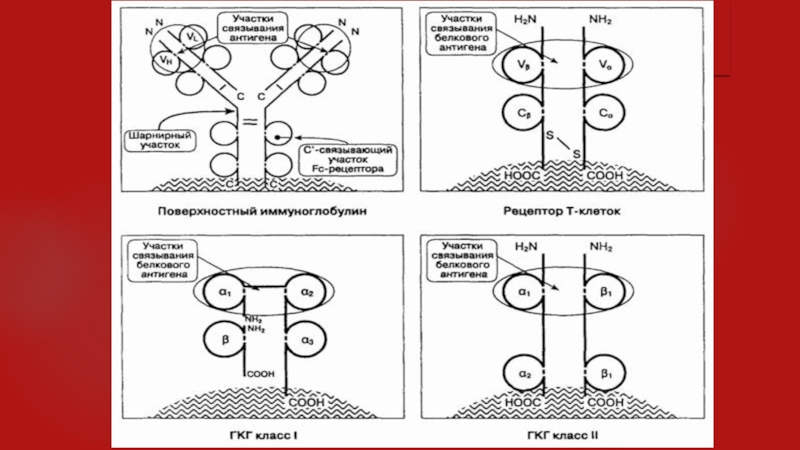
Иммуноглобулины, Т-клеточные рецепторы и молекулы ГКГ класса I и II
являются трансмембранными, поверхностно-клеточными молекулами (см. рисунок). Каждая из них является
димером, имеет две связанных цепи или более. Цепи представляют собой однородную повторяющуюся структуру, происходящую от примордиального гена, известного как "иммуноглобулиновый суперген". У любой молекулы внекле-точно расположено амино-окончание; внутриклеточно — карбокси-окончание (СООН). Связывание антигена происходит около аминоокончания молекулы. Длялюбой такой молекулы существуют гены, кодирующие необычно большое разнообразие антигенсвязывающей области. Наибольшее разнообразие характерно для трех гапервариабельных участков (ГВУ 1, 2 и 3), расположенных у аминотерминалов; максимально — в ГВУ 3. В отличие от этих участков, оставшиеся чрезвычайно малоизменчивы, что способствует связыванию комплекса антиген-молекулы ГКГ и его распознаванию Т-клеточным рецептором.
Как устроены четыре молекулы, распознающие антиген?
Слайд 14HLA-B27 относится к наиболее изученным антигенам и выявление его носительства
имеет большое значение в ранней диагностике и выборе тактики лечения
при ряде аутоиммунных заболеваний. Антиген HLA-B27 является молекулой главного комплекса гистосовместимости 1-го класса - MHC-I (MHC-major histocompatibility complex), располагающегося на коротком плече хромосомы 6 и кодирующего молекулярные структуры системы HLA (лейкоцитарные антигены человека).Антиген HLA-B27 обнаруживают при ревматоидном артрите, псориатическом артрите, хронических воспалительных заболеваниях кишечника, протекающих с сакроилеитом и спондилитом, увеите и реактивном артрите инфекционного генеза.
В качестве инфекционных триггеров предполагаются Klebsiella pneumoniae, Salmonella, Yersinia, Shigella, Chlamidia trachomatis.
С выявлением антигена HLA–B27, также ассоциируется группа заболеваний, при которых поражаются не только периферические суставы, но и крестцово-подвзошные сочленения, позвоночник по типу анкилозирующего спондилоартрита.
Эти заболевания часто сопровождаются развитием грозных осложнений в виде периферических артритов, офтальмопатий, поражений мочеполового тракта, кишечника и кожи.
По современным представлениям роль антигена HLA–B27 состоит в презентации Т–клеткам артритогенного пептида, что вызывает аутоиммунный ответ, направленный против собственных тканей организма.
Маркер
Высокочувствительный (ДЧ 90%) и высокоспецифичный (ДС 92%) маркер диагностики анкилозирующего