Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кафедра химической технологии лекарственных веществ (ХТЛВ)
Содержание
- 1. Кафедра химической технологии лекарственных веществ (ХТЛВ)
- 2. Учебные материалы1. Полный курс лекций, установочные лекции
- 3. МЕТОДЫ СУЛЬФирования И НИТРОВАНИЯСуществуют разные методы введения
- 4. Основные сульфирующие агенты:1.Безводная серная кислота (H2SO4). 2.Олеум
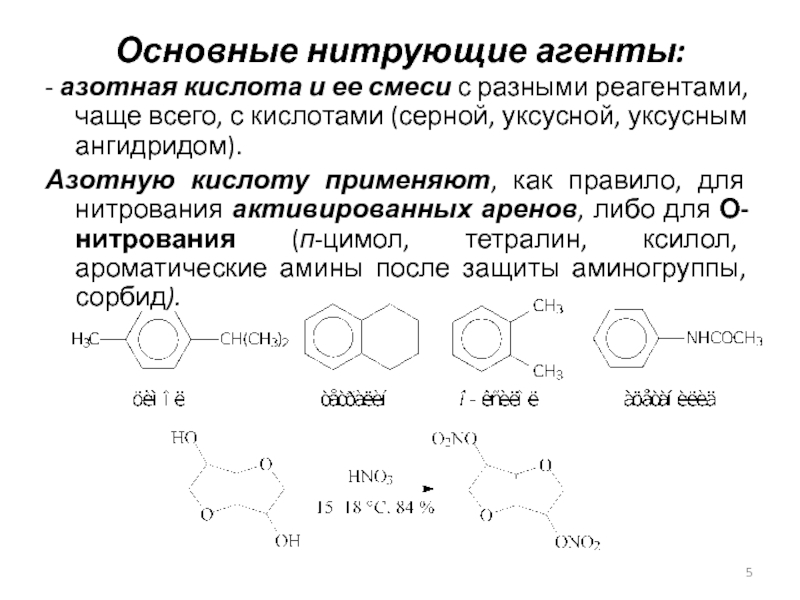
- 5. Основные нитрующие агенты: - азотная кислота и
- 6. Химические схемы сульфирования и нитрования аренов(в зависимости от типа используемого реагента):
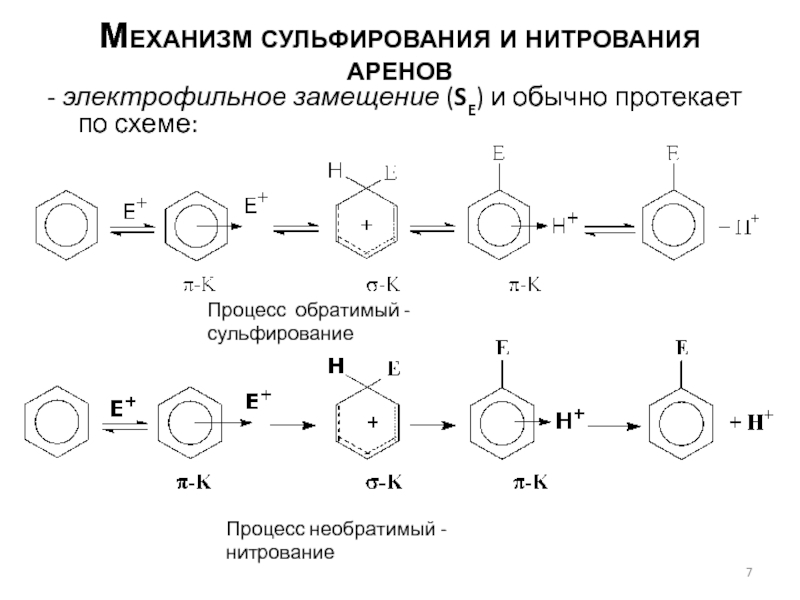
- 7. Механизм сульфирования и нитрования аренов- электрофильное замещение
- 8. Механизм сульфирования и нитрования ареновОтличием сульфирования от
- 9. Скорость и направление реакциив большой степени определяется
- 10. Сульфирующие частицы поляризованные молекулы и катионы Н3SO4+
- 11. Нитрующие частицы нитроний-катион NO2+, в виде сольватированного
- 12. Тепловой эффект сульфирования аренов серной кислотой, рассчитанный
- 13. Особенности сульфирования и нитрования аренов кислотами1.Сульфирование серной
- 14. Реакционная вода способствует кислотной диссоциации кислот (равновесие
- 15. - «-Сульфирования» (с)- минимальную концентрацию серной кислоты
- 16. Влияние концентраций серной кислоты на направление реакции
- 17. 3.Влияние температуры реакцииА.Температурный коэффициент: Для бензола и
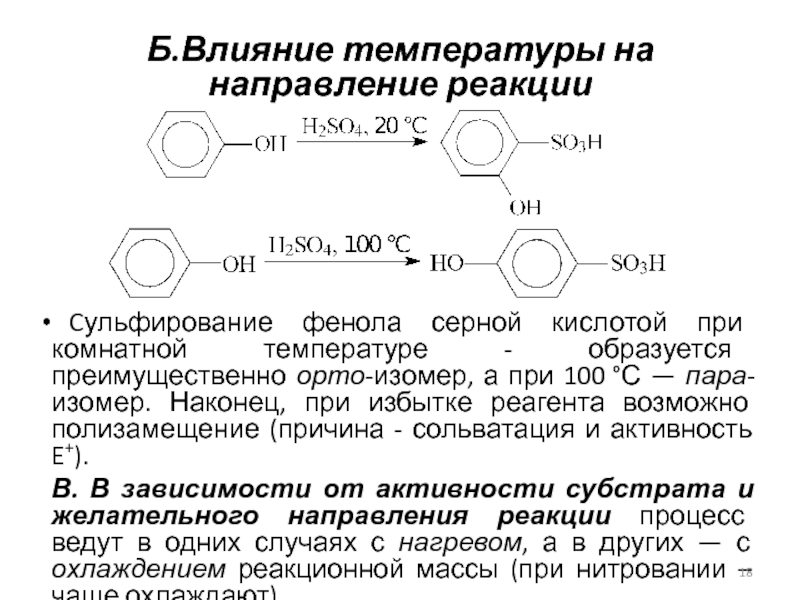
- 18. Б.Влияние температуры на направление реакции Cульфирование фенола
- 19. Г.Особенности теплового режима процесса нитрованияСкорость процесса значительная
- 20. Отвод тепла процесса нитрованияДля увеличения скорости отвода
- 21. Другие параметры процесса нитрованияА.Модуль ванны — отношение
- 22. Б. Интенсивность перемешивания гетерогенной массы(vпер) ↑ vпер
- 23. В.Порядок слива компонентовПрямой – к субстрату приливают
- 24. Основные недостатки сульфирования H2SO4 :1.Малая концентрация электрофильных
- 25. Основные недостатки нитрования HNO3 - низкая концентрация
- 26. Другие методы сульфирования и нитрования1.Сульфирование олеумом и
- 27. 2.Сульфирование аренов растворами SO3 в инертных растворителяхМетод
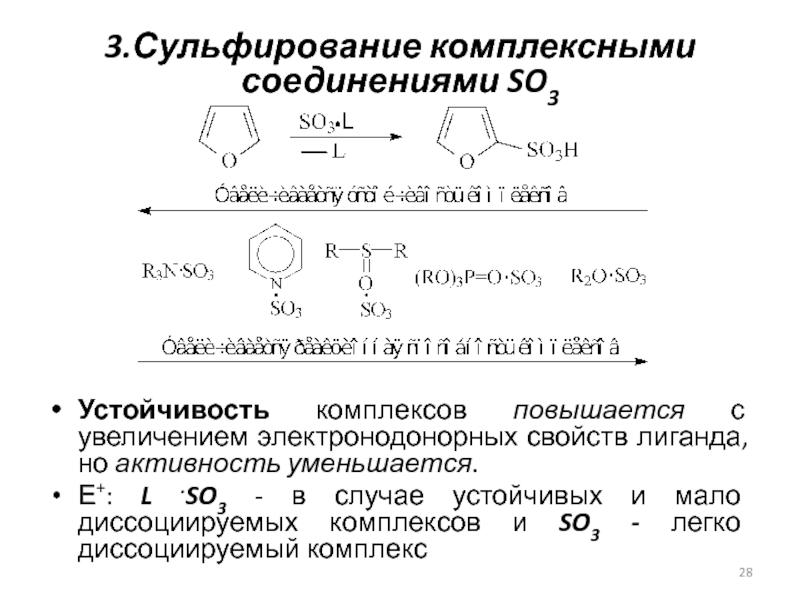
- 28. 3.Сульфирование комплексными соединениями SO3Устойчивость комплексов повышается с
- 29. Самостоятельно:1.Способы выделения аренсульфокислот.2. Сульфирование аренов «в парах»,
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Кафедра химической технологии лекарственных веществ (ХТЛВ)
Зав.кафедрой -
Лалаев Борис Юрьевич,
к.хим.н., доцент
кафедры ХТЛВ, д.фарм.наук, профессор.Слайд 2Учебные материалы
1. Полный курс лекций, установочные лекции (текст и презентация)
2.
Вопросы – программы - МК (10), КР (3), экзаменационные
3. Технологическая
карта4. Календарные планы
5.Другие материалы (МУПЗ, МУСР)
Учебник:
А.А. Иозеп, Б.В. Пассет, В.Я. Самаренко, О.Б.Щенникова
Химическая технология лекарственных веществ. Основные процессы химического синтеза биологически активных веществ.– СПб.: Изд. «Лань», 2016
Слайд 3МЕТОДЫ СУЛЬФирования И НИТРОВАНИЯ
Существуют разные методы введения сульфо- и нитрогрупп
в молекулу органического соединения, но в промышленности наиболее широко применяют
реакции
сульфирования и нитрования - прямое замещение атома водорода на сульфо- или нитро- группу. Различают С-, N- и О-сульфирование и нитрование в зависимости от того, у какого элемента замещается атом водорода. О-Сульфирование называют также сульфатированием.
Сульфо- и нитрогруппы находятся в молекуле многих ценных лекарственных веществ (сульфаниламиды, левомицетин и др.). Кроме того, сульфо- и нитросоединения являются промежуточными продуктами в синтезе лекарственных веществ и витаминов.
Другие понятия: субстрат, реагент, промежуточный и целевой продукт
Слайд 4Основные сульфирующие агенты:
1.Безводная серная кислота (H2SO4).
2.Олеум - образуется при
растворении серного ангидрида в концентрированной серной кислоте и представляет собой
раствор SO3 в смеси кислот: серной, двусерной (H2S2O7), трисерной (H2S3O10) и других полисерных кислот.3.Серный ангидрид — это общее название нескольких модификаций триоксида серы, который существует в виде мономера, циклического тримера, полимера и других формах.
Область применения реагентов:
бензол и более активированные арены - серная кислота;
малоактивные субстраты - олеум различной концентрации или сульфотриоксид.
Слайд 5Основные нитрующие агенты:
- азотная кислота и ее смеси с
разными реагентами, чаще всего, с кислотами (серной, уксусной, уксусным ангидридом).
Азотную кислоту применяют, как правило, для нитрования активированных аренов, либо для О-нитрования (п-цимол, тетралин, ксилол, ароматические амины после защиты аминогруппы, сорбид).
Слайд 6Химические схемы сульфирования и нитрования аренов
(в зависимости от типа используемого
реагента):
Слайд 7Механизм сульфирования и нитрования аренов
- электрофильное замещение (SE) и обычно
протекает по схеме:
Процесс обратимый - сульфирование
Процесс необратимый - нитрование
Слайд 8Механизм сульфирования и нитрования аренов
Отличием сульфирования от реакции нитрования является
ее обратимость, которая в наибольшей степени проявляется лишь в серной
кислоте.Реакционная вода способствует диссоциации серной и сульфоновой кислот с образованием протона (электрофила), что приводит к десульфированию. В случае олеума и сульфотриоксида концентрация протона крайне низка и реакция сульфирования практически необратима
Слайд 9Скорость и направление реакции
в большой степени определяется строением субстрата, т. е.
устойчивостью s-комплекса (кинетический фактор), однако при сульфировании серной кислотой направление
реакции, в связи с её обратимостью, может зависеть и от устойчивости продуктов реакции (термодинамический фактор)Электронодонорные (Д) заместители в арене стабилизируют s-комплекс и облегчают прохождение реакции, а электроноакцепторные (А) — затрудняют.
Если принять скорость нитрования бензола за единицу, то относительная скорость нитрования толуола в тех же условиях будет 24,5, хлорбензола — 0,03, а нитробензола — 6.10–8.
Слайд 10Сульфирующие частицы
поляризованные молекулы и катионы Н3SO4+ < SO3, S2O6,
S3O9 < НSO3+ (в порядке возрастания активности),
которые имеются в
серном ангидриде или образуются в олеуме и при диссоциации кислоты:- Сама H2SO4 не является электрофилом и не способна сульфировать органические соединения.
- Молекулы органического соединения могут одновременно взаимодействовать с разными электрофильными частицами, и реакция может протекать по нескольким схемам.
Слайд 11Нитрующие частицы
нитроний-катион NO2+, в виде сольватированного иона в протонных
растворителях; соли нитрония (NO2+ClO4–), в виде сольватированной ионной пары в
диполярных апротонных растворителях (например, в сульфолане и т. п.); ацетилнитрат (CH3COONO2) и его протонированная форма в среде уксусного ангидрида.Активность частиц уменьшается в ряду:
- Нитроний-катион NO2+ встречается чаще всего. Схема его образования в случае чистой азотной кислоты и смеси ее с серной кислотой имеет вид:
Слайд 12Тепловой эффект
сульфирования аренов серной кислотой, рассчитанный по закону Гесса,
~ 73 кДж/моль (является суммой экзотермического процесса взаимодействия SO3 с
субстратом и эндотермического — диссоциации H2SO4 с образованием SO3). В реальном процессе ~150 кДж/моль, за счет теплоты разбавления серной кислоты реакционной водой.сульфирования серным ангидридом (олеумом) высок и составляет около 200 кДж/моль (нет затрат на образование SO3).
нитрования 150 кДж/моль, но скорость реакции значительно больше сульфирования, поэтому нитрование является быстрой, необратимой и экзотермической реакцией, менее селективной, чем процесс сульфирования, вследствие меньшего размера и большей активности атакующей частицы.
Слайд 13Особенности сульфирования и нитрования аренов кислотами
1.Сульфирование серной кислотой, обычно, протекает
как гомогенная реакция. Наоборот, нитрование является гетерогенным процессом.
2. Влияние
концентраций кислот, которые диссоциируют по следующим схемам: - Чем больше концентрация кислоты (меньше воды), тем в большей степени равновесие смещается влево, больше образуется электрофильных частиц и тем быстрее идет реакция.
Слайд 14Реакционная вода
способствует кислотной диссоциации кислот (равновесие смещается вправо). Концентрация
электрофильных частиц, которая даже в 100 %-ных кислотах составляет до 1%,
уменьшается, и скорость реакции резко снижается.- Добавление серной кислоты к азотной связывает воду и способствует образованию нитроний катиона NO2+.
- Фактор нитрующей активности (ФНА) - минимальная концентрация отработанной серной кислоты, обеспечивающая полное использование азотной кислоты
- образуется в результате реакций
Слайд 15- «-Сульфирования» (с)
- минимальную концентрацию серной кислоты (выраженную в % SO3),
при которой она еще способна сульфировать соединение.
За величину «-сульфирования»
принимают концентрацию серной кислоты, при которой скорость образования продукта составляет менее 1 % за час. Эта величина полезна при определении концентрации и массы реагента, необходимых для сульфирования данного субстрата.
Минимальное количество серной кислоты или олеума, необходимое для моносульфирования 1 моль соединения, может быть вычислено по формуле:
где С — начальная концентрация сульфирующего агента в % SO3
Слайд 16Влияние концентраций серной кислоты на направление реакции
Основная причина –
обратимость процесса.
Для получения α-нафталинсульфокислоты рационально применять 100% кислоту, чтобы
уменьшить содержание воды в реакционной массе и предотвратить десульфирование продукта реакции. При получении β-нафталинсульфокислоты следует брать серную кислоту, содержащую воду, чтобы способствовать гидролизу побочного α-изомера (β-изомер в этих условиях не десульфируется).
Слайд 173.Влияние температуры реакции
А.Температурный коэффициент:
Для бензола и его гомологов
в зависимости от энергии активации, повышение температуры на каждые 10 °С
увеличивает скорость сульфирования в 1,5—2 раза.В гетерогенных процессах нитрования температурный коэффициент зависит от диффузии, и, следовательно, от перемешивания. Повышая интенсивность перемешивания реакционной массы, можно перевести реакцию в кинетическую область и увеличить его до 2—3.
Слайд 18Б.Влияние температуры на направление реакции
Cульфирование фенола серной кислотой при
комнатной температуре - образуется преимущественно орто-изомер, а при 100 °С —
пара-изомер. Наконец, при избытке реагента возможно полизамещение (причина - сольватация и активность E+).В. В зависимости от активности субстрата и желательного направления реакции процесс ведут в одних случаях с нагревом, а в других — с охлаждением реакционной массы (при нитровании – чаще охлаждают).
Слайд 19Г.Особенности теплового режима процесса нитрования
Скорость процесса значительная и в единицу
времени выделяется большое количество тепла, что может быть причиной самопроизвольного
неуправ-ляемого повышения температуры и скорости реакции (взрыв!).Вопросы отвода тепла реакции имеют решающее значение при организации производства.
Обращают особое внимание на:
а) размер и оформление теплообменной поверхности нитратора;
б) обеспечение высокого коэффициента теплопередачи;
в) необходимость предварительного охлаждения реагентов;
а также на организацию процесса смешения реагентов — правильный выбор порядка слива компонентов.
Слайд 20Отвод тепла процесса нитрования
Для увеличения скорости отвода тепла, а, следовательно,
уменьшения времени процесса
- предварительно охлаждают исходные реагенты,
нитраторы помимо рубашки
обычно имеют дополнительные теплообменные элементы (диффузоры, змеевики). Это уменьшает полезную емкость нитратора, но позволяет проводить процесс с большей скоростью. В ряде случаев применяют выносные теплообменники. Подачу охлаждающей жидкости во внутренний змеевик целесообразно вести, засасывая ее с помощью вакуума для того, чтобы в случае течи змеевика вода не попадала в реакционную массу.
Слайд 21Другие параметры процесса нитрования
А.Модуль ванны — отношение объемов кислотного и
органического слоев (характеристика гетерогенных процессов):
Увеличение объема кислотного слоя повышает общую
скорость гетерогенного процесса нитрования, так кака) в нем максимальная концентрация нитроний-катиона;
б) растворимость углеводорода в смеси кислот значительно больше, чем растворимость NO2+ в углеводороде.
Обычно величина модуля ванны составляет 1,5—4.
Слайд 22Б. Интенсивность перемешивания гетерогенной массы(vпер)
↑ vпер → ↑ Sр.ф.
→ ↑vдиф. → ↑vр.,
до vдиф. > vр. – (кинетическая область),
где: Sр.ф. – поверхность раздела фаз;
vдиф. – скорость диффузии;
vр. – скорость реакции.
Используют пропеллерную или турбинную мешалку.
Остановка мешалки при нитровании опасна, идет расслоение реакционной массы: ↓ Sр.ф. → ↓vдиф. → ↓vр., и при продолжающейся загрузке реагентов они накапливаются в аппарате. Последующий пуск мешалки может привести к взрыву из-за высокой скорости реакции, с большим выделением тепла.
Существуют специальные устройства, прекращающие подачу реагентов в случае остановки мешалки.
Слайд 23В.Порядок слива компонентов
Прямой – к субстрату приливают нитрующую смесь
Обратный
– к реагенту приливают субстрат
Параллельный – в реактор одновременно
подают субстрат и реагент Скорость выделения тепла регулируется скоростью смешения реагентов.
Первые два способа используются при периодическом ведении процесса, а третий — при непрерывном.
Достоинства и недостатки см. самостоятельно
Слайд 24Основные недостатки сульфирования H2SO4 :
1.Малая концентрация электрофильных частиц;
2.Быстрое снижение
скорости реакции (вследствие разбавления кислоты реакционной водой);
3.Отсутствие возможности сульфирования
малоактивных субстратов; 4.Окислительные и агрессивные свойства реакционной среды;
5.Технологические и экологические трудности на стадии выделения продукта (избыток реагента требует больших количеств нейтрализующих средств, усложняет технологию и образует большое количество отходов).
Некоторые из этих недостатков можно устранить удалением образующейся воды из реакционной массы и другими методами («Сульфирование в парах» «Сульфирование запеканием») – см. самостоятельно.
Слайд 25Основные недостатки нитрования HNO3
- низкая концентрация нитроний-катиона; быстро теряется
реакционная способность при разбавлении реакционной водой; более сильное окислительное действие
азотной кислоты на субстрат и оборудование по сравнению с нитрующей смесью; большой расход азотной кислоты обычно в 1,5 раза выше теоретического.Устранение недостатков (уменьшение окислительных свойств кислоты и увеличение концентрации NO2+):
чем выше концентрация азотной кислоты и ниже температура, тем реакция идет быстрее и меньше сопровождается окислением,
а также применяют нитрование
с использование кислот Льюиса (↑NO2+);
в среде инертного органического растворителя (↓ окислительное действие; регулирование концентрации NO2+, катализ сильными кислотами);
с азеотропной отгонкой воды.
Слайд 26Другие методы сульфирования и нитрования
1.Сульфирование олеумом и серным ангидридом отличаются
универсальностью и большой активностью, которая сохраняется до конца процесса. Это
объясняется высокой концентрацией электрофильных частиц (SO3 и HSO3+), и отсутствием реакционной воды:Недостатки: возможны побочные реакции (окисление, образование дисульфокислот, сульфонов и др.), поэтому их чаще всего используют в случае малоактивных аренов; серный ангидрид в отсутствие жидкого разбавителя использовать технологически сложно.
При сульфировании анилинов олеумом сульфогруппа направляется в м-положение:
Слайд 272.Сульфирование аренов растворами SO3 в инертных растворителях
Метод универсальный, позволяет сульфировать
лабильные и ацидофобные соединения, без дезактивации аминов, пиридина и др.
субстратов, создавать практически безотходные производства.Растворители: жидкий SO2, полихлорэтаны, метиленхлорид и др.
Сульфирование аренов идет по механизму SE, при этом в неполярных средах (1,2-дихлорэтан) и мольном соотношении реагентов в качестве электрофила помимо SO3 выступает продукт его взаимодействия с образовавшейся сульфокислотой ArSO3SO3H — пиросульфат.
Слайд 283.Сульфирование комплексными соединениями SO3
Устойчивость комплексов повышается с увеличением электронодонорных свойств
лиганда, но активность уменьшается.
Е+: L .SO3 - в случае устойчивых
и мало диссоциируемых комплексов и SO3 - легко диссоциируемый комплекс Слайд 29Самостоятельно:
1.Способы выделения аренсульфокислот.
2. Сульфирование аренов «в парах», «запеканием».
3.Нитрование аренов смесью
азотной и серной кислот.
4.Нитрование аренов смесью азотной кислоты и уксусного
ангидрида.5.Нитрование аренов и алканов разбавленной азотной кислотой.
6. Типовой процесс выделения нитропродуктов.