Слайд 1Карбонатное равновесие и растворение карбонатных пород
Слайд 2На какую максимальную глубину, за счет растворения карбоната кальция в,
выпадающей на плато, дождевой воде может опуститься уровень природного известнякового
плато за 100 лет, если дождевая вода полностью стекает с поверхности плато, но лишь после установления равновесия между дождевой водой, карбонатом кальция (кальцит) и атмосферным воздухом? Содержание ионов кальция при этом принять равным
[Ca2+] = 4,69 10-4 моль/л
Уровень осадков выпадающих на плато в течении 100 лет принять одинаковым и равным 800 мм/год. Температура все время составляла 298К, давление 101,3 кПа, концентрация диоксида углерода в атмосферном воздухе составляла 0,035% (об) Плотность известняка принять равной 2,7 г/см3. В качестве «активной» примеси в воздухе присутствует только диоксид углерода.
Слайд 3Решение.
Уменьшение уровня поверхности известнякового плато произойдет в следствии растворения карбоната
кальция в дождевой воде. Этот процесс можно представить уравнением реакции
:
CaCO3 + CO2 (р-р) + H2O = Ca2+ + 2НCO32
Слайд 4Объем дождевой воды, который выпадет на каждый квадратный метр поверхности
плато за 100 лет можно определить по уравнению:
V = 100
* H
где: V- объем дождевой воды, выпадающий на каждый квадратный метр плато за 100 лет (м3/м2); Н – ежегодный уровень атмосферных осадков ( м3/ (м2 * год) или м /год).
Слайд 5Поскольку, по условию примера Н = 800 мм = 0,8
м, объем воды, выпадающий на каждый квадратный метр плато за
100 лет составит:
V = 100 *0,8 = 80 м3/м2
Слайд 6Общее количество молей карбоната кальция переходящих в раствор с поверхности
плато равно количеству молей ионов кальция в дождевой воде, после
установления равновесия. Поэтому общее количество молей карбоната кальция (М(кальцит)), растворившихся за 100 лет на каждом квадратном метре плато, составит:
М(кальцит) = V * [Ca2+] * 103 = 80 * 0,469 =
37,52 моль/м2 за 100 лет.
Слайд 7Масса карбоната кальция (m(кальцит)), растворившихся за 100 лет на каждом
квадратном метре плато, составит (в г):
m(кальцит) = М(кальцит) * М.М(кальцит),,
где
М.М(кальцит) молярная масса кальцита
Слайд 8 М(кальцит) = 40 + 12 + 16 * 3
= 100 г/моль
m(кальцит) = 37,52 * 100 = 3752
г/м2 за 100 лет.
Слайд 9Объем карбоната кальция растворившихся за 100 лет на каждом квадратном
метре плато, можно найти, зная плотность кальцита. По условию примера
плотность кальцита. равна 2,7г/см3, что соответствует 2,7 * 106 г/м3. Поэтому объем растворившегося кальцита составит:
Уровень, на который опустится каждый квадратный метр плато за сто лет составит:
h = v(кальцит) / S
Слайд 10v(кальцит) = 3752 / (2,7 * 106) = 1,39 *10-3
м3/м2 за 100 лет.
h = v(кальцит) / S = 1,39
*10-3 / 1 = 1,39 *10-3 м.
Ответ:
Уровень известнякового плато, в результате процесса растворения карбоната кальция, за 100 лет, может опуститься на 1,39 *10-3м.
Слайд 11Окислительно-восстановительные процессы в природных водоемах
Растворение кислорода атмосферы
Слайд 12Процессы растворения газов в природных водах
Закон Генри
[Сi] р-р= КГi
* Рi
где Сi,р-р – концентрация i газа в растворе (моль/л); КГi – константа Генри, для данной температуры раствора (моль/л*Па или моль/л*атм); Рi – парциальное давление i газа в газовой смеси, находящейся в равновесии с раствором (Па или атм.).
При равновесии приземным воздухом это количество составит
[С(кисл.)] = К Г(кисл.) * Р (кисл.)= 8,3 мг/л
Слайд 13
На сколько изменится равновесное содержание кислорода в воде при снижении
температуры с 298 К до 278 К?
Ответ дайте в мг/л
и в %.
Слайд 14Окислительно-восстановительные процессы в гидросфере
Окислительно-восстановительные реакции исключительно важную роль
в описании процессов протекающих в природных водоемах. Предыстория и качество
природных вод в значительной степени зависят от вида окислительно-восстановительных реакций, их кинетических характеристик и величины окислительно-восстановительного потенциала, который соответствовал бы данной системе при установлении равновесия.
Слайд 15 Процесс окисления органического вещества общей формулой {CH2О}
можно представить следующим уравнением реакции:
{CH2О} + О2 =
СО2 + Н2О
В связи с отсутствием, по условию примера, дополнительного поступления кислорода, максимальное количество органического вещества, которое может быть окисленно в воде будет определяться содержанием кислорода в воде, которое будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления.
Слайд 16Какое количество органического вещества, общей формулой {CH2О}, может быть окислено
в открытом водоеме, если его содержание в воде соответствовало равновесным
значениям, при условии отсутствия дополнительного поступления кислорода, при температуре 298 К?
Как изменится это количество, если равновесие с воздухом было достигнуто при температуре 278 К и контакт с атмосферой был прерван?
Слайд 17СТРАТИФИКАЦИЯ
ВОДОЕМОВ
Разделение водоема на слои при температурной стратификации
Верхний слой
ЭПИЛИМНИОН
Средний слой
Зона термоклина
Нижний
слой
гиполимнион
Слайд 18Эвтрофикация водоемов
Это - повышение биологической продуктивности водных экосистем в результате
накопления в воде биогенных элементов естественного или антропогенного происхождения.
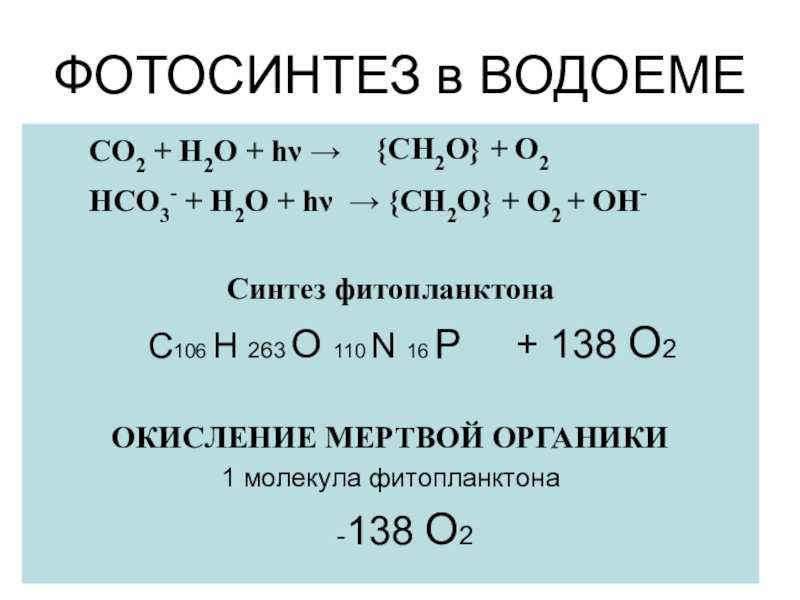
Слайд 19ФОТОСИНТЕЗ в ВОДОЕМЕ
СО2 + Н2О + hν
→
НСО3- + Н2О + hν
→ {CH2О} + О2 + ОН-
Синтез фитопланктона
C106 H 263 O 110 N 16 P + 138 О2
ОКИСЛЕНИЕ МЕРТВОЙ ОРГАНИКИ
1 молекула фитопланктона
-138 О2
{CH2О} + О2
Слайд 20БИОГЕНЫ - нитрат, фосфат, калий
Удобрения
Отходы животноводства
Отходы человека
Фосфат- содержащие моющие средства.
Обогащение
водоема биогенными элементами, поступающими со сточными водами, а также с
поверхностным стоком с удобряемых полей, приводит к “цветению” воды и к резкому ухудшению ее качества.
Слайд 21Сульфатредукция
2Cорг + SO42- + 2H2O = H2S + 2HCO3-
Слайд 22Какой объем природной воды, находившейся в равновесии с атмосферным воздухом
необходимо взять, чтобы после окисления 10 г сахара (среднее количество
в стакане чая) содержание кислорода в этой воде составляло более 4 мг/л (количество при котором рыбы еще не погибают)? Принять, что атмосферный воздух содержал среднее для приземного воздуха значение концентрации кислорода, температура равна 298 К, общее давление –101,3 кПа, парциальное давление паров воды равно 3,1*103 Па, сахар имеет молекулярную формулу С12Н22О11.
Слайд 23Поскольку в растворе после окисления сахара, по условию примера, остается
растворенный кислород, процесс окисления протекает при высоких значениях окислительно-восстановительного уровня
системы и может быть представлен следующим уравнением;
С12Н22О11. + 12О2 = 12СО2 + 11Н2О
Слайд 24Количество кислорода (г), которое в этом случае, потребуется для окисления
сахара составит:
m(кисл.) = 12*М.М(кисл.) * m(сахара) / М.М(орг. соед)
где: 12-
количество молекул кислорода, необходимых для окисления одной молекулы сахара; М.М(кисл.) и М.М(орг. соед) - молярная масса кислорода и сахара, соответственно; m(сахара) количество сахара, вступившего в реакция окисления.
m(кисл.) = 12*32 * 10/ 342 = 11,23 г.
Слайд 25По условию примера, содержание кислорода в природной воде соответствует значениям,
наблюдаемым при равновесии между водой и приземным воздухом. Эта величина
составляет 8,4 мг/л , см пример.
Поскольку по условию, примера остаточное содержание кислорода в воде не должно быть меньше 4 мг/л, на окисление сахара из каждого литра природной воды не должно расходоваться больше чем:
m`(кисл) = [С(кисл.)] - [С(кисл. ост.) ]
где: m`(кисл) – количество кислорода, которое может быть израсходовано на окисление сахара из каждого литра природной воды; [С(кисл.)] – концентрация кислорода в воде при равновесии с приземным воздухом; [С(кисл. ост.) ] – минимальное содержание кислорода в воде после окисления сахара.
Слайд 26m`(кисл) = 8,4 – 4 = 4,4 мг/л.
Определим минимальный объем
природной воды, кислород из которой будет расходоваться на окисления сахара:
V
= m(кисл.) / m`(кисл) = 11,23 * 103 / 4,4 = 2552 л.
Ответ: необходимо взять не менее 2552 литров природной воды.
Слайд 27Какой минимальный объем природной воды необходим для растворения сероводорода, образовавшегося
при окислении 10 г сахара в процессе сульфатредукции, если весь
выделившийся сероводород переходит в раствор в котором концентрация Н2S не превышает значений подпороговой концентрации определяемой по запаху ( ППК(орг) = 0,05 мг/л)? Сахар имеет молекулярную формулу С12Н22О11.
Слайд 28В процессе сульфат редукции приокислении органического вещества происходит образование сероводорода
по реакции:
2Cорг + SO42 + 2H2O H2S + 2HCO3-
На каждые
два моля углерода, связанных в органическое соединение образуется молекула сероводорода.
Слайд 29Количество молей углерода (N(угл.)) содержащихся в m г органических соединений,
имеющих молярную массу М.М(орг) и содержащих n атомов углерода в
каждой молекуле органического соединения, можно определить по уравнению:
N = m * n / М.М(орг)
Слайд 30Для условий примера количество молей углерода, содержащихся в 10 г
сахара, с молекулярной формулой С12Н22О11 составит:
N(угл.) = 10 * 12/
342 = 0,35 молей углерода.
В процессе сульфат редукции этого количества молей углерода, может образоваться N(серовод.) молей сероводорода:
N(серовод.) = ½ N(угл.) = 0,175 молей сероводорода.
Слайд 31Масса образующегося сероводорода в мг составит:
М(серовод.) = N(серовод.) * М.М(серовод.)
* 103 (мг)
М(серовод.) = 0,175 * 34 * 103 =
5950 мг.
Слайд 32Объем природной воды необходимый для растворения этого количества сероводорода при
конечной концентрации ниже ППК(орг) составит:
V = М(серовод.) / ППК(орг) =
5950 / 0,05 = 119000 л = 119 м3.
Ответ: минимальный объем природной воды равен 119 м3.
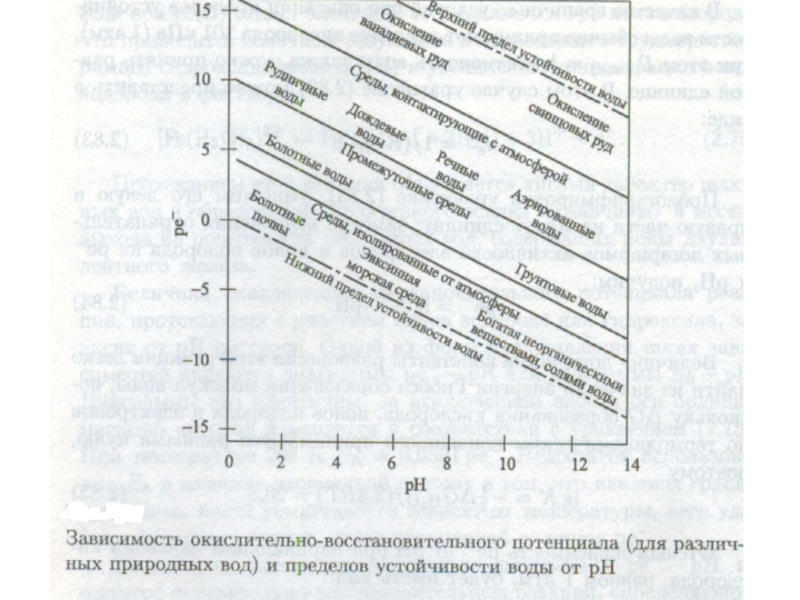
Слайд 33Окислительно-восстановительные процессы в гидросфере
Слайд 34Активность электронов
Под активностью электронов понимается способность системы поставлять электроны для
окислительно-восстановительного процесса. Разумеется, следует отдавать себе отчет в том, что
раствор свободных электронов в воде, также как и раствор свободных несольватированных протонов - это не более чем удобная абстракция, которую широко используют при описании кислотно-основных равновесий в природных водах.
Слайд 35Активность электронов
Вода с высокой активностью свободных электронов а(электронов) (которую в
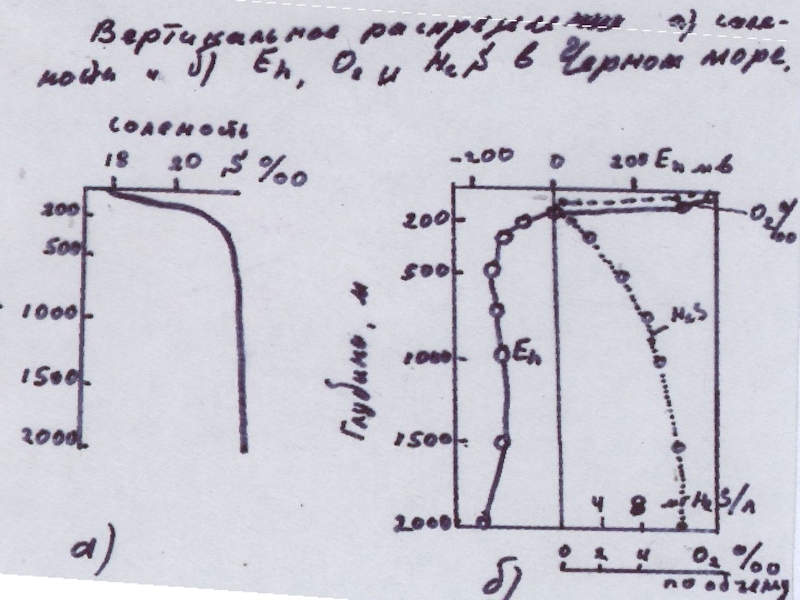
дальнейшем будем обозначать как аe) называется восстановительной (сероводородные воды Черного
моря, "мертвая" вода из народных сказок), а с низкой - окислительной (хлорированная или озонированная вода, "живая" вода).
Слайд 36Активность электронов
Удобным путем выражения активности свободных электронов является шкала рē.
По аналогии со шкалой рН величина рē определяется соотношением:
рē = -lg(ae)
Величина активности электронов или значение рē являются удобным способом выражения окислительно-восстановительного потенциала системы. Эти понятия широко используются в настоящее время наряду с хорошо известным способом выражения окислительно-восстановительного потенциала в вольтах.
Слайд 37В общем виде окислительно-восстановительный процесс можно представить следующим уравнением:
окисленные
формы + nē восстановленные формы где nē- количество (n) электронов,
принимающих участие в данной окислительно-восстановительной реакции.
Константа равновесия этого процесса может быть представлена в виде:
К = П аi(восстан. форм) / [Паi(окисл. форм) *( а(электронов) )n]
где: Паi(восстан. форм) и [Паi(окисл. форм) произведения активности восстановленных и окисленных форм, соответственно; n- количество электронов, участвующих в процессе; а(электронов) – активность электронов.
Слайд 38Покажем связь между двумя этими способами выражения окислительно-восстановительного потенциала системы.
Выразим
рē из общего уравнения константы равновесия окислительно-восстановительного процесса получим:
рē =
[lgK + lg(Паi(окисл. форм) / П аi(восстан. форм) )] / n
Величина активности электронов или значение рē являются удобным способом выражения окислительно-восстановительного потенциала системы. Эти понятия широко используются в настоящее время наряду с хорошо известным способом выражения окислительно-восстановительного потенциала в вольтах.
Слайд 39Строгое термодинамическое обоснование концепции рē базируется на рассмотрении реакции:
2Н+ + 2
e- = Н2 (газ)
G реакции принимается равным нулю и является
базой для определения изменения свободной энергии в ходе окислительно-восстановительных реакций в воде. Потенциал, измеренный по отношению к стандартному водородному электроду (СВЭ), называется величиной Eh раствора (h- символ стандартного водородного электрода). Eh может быть положительным или отрицательным в зависимости от того, будет ли активность электронов в исследуемом растворе выше или ниже их активности в СВЭ. По конвенции Eh считается положительным, если активность электронов в растворе меньше, чем в СВЭ.
Слайд 40По термодинамическим конвенциям, относящимся к стандартному водородному электроду, стандартная свободная
энергия образования электрона в растворе, также как и стандартная свободная
энергия образования протона в растворе, принимается, равной нулю.
В стандартных условиях значение энергии Гибса для окислительно-восстановительной реакции можно представить в виде:
∆G0реакц. = -n*F*E0h где: ∆G0 – значение энергии Гибса в стандартных условиях; n - число электронов, участвующих в процессе; F – число Фарадея; . E0h – окислительно-восстановительный потенциал, измеренный в стандартных условиях относительно стандартного водородного электрода.
Знак устанавливается в соответствии с конвенцией. Уравнение верно,, только в том случае, когда в записи полуреакции электроны расположены в правой части уравнения.
Слайд 41Подставив это выражение в уравнение зависимости значения логарифма константы равновесия
от температуры, получим:
lgK0 = n*F*E0/(2,3*R*T)
Это уравнение можно представить в виде:
рē
= [n*F*E0h /(2,3*R*T) + lg(Паi(окисл. форм) / П аi(восстан. форм) )] / n
Разделив левую и правую часть этого уравнения на дробь вида –
n*F*E0h /(2,3*R*T), получим:
рē * 2,3*R*T/(n*F*)= [E0h + 2,3*R*T/(n*F*)lg(Паi(окисл. форм) / П аi(восстан. форм) )] / n
Слайд 42В тоже время из основ электрохимии известно, что обобщенное уравнение
Нернста имеет вид:
Поскольку правые части уравнений и равны между
собой, то равны и левые части этих уравнений:
рē =*n*F*Еh /(2,3*R*T)
Или при подстановке соответствующих величин получим:
рē =*n*Еh / 0,0591
Слайд 43Необходимо отметить, что Eh и рē являются вполне определенными величинами
всякий раз, когда оба члена данной редокc-пары присутствуют вместе в
растворе или в контакте с ним. В то же время в реальных природных водах практически всегда содержится более одной редокс-пары. Каждая пара будет определять присущее ей значение рē (или Eh), однако для разных пар эти две величины могут оказаться неодинаковыми, поскольку для природы характерно скорее отсутствие равновесия каждой из форм со всеми другими формами, чем его наличие. Если не все редокс-пары находятся в равновесии, нельзя говорить о рē (или Eh) раствора. Можно говорить лишь о значении рē (или Eh), определяемом отдельной парой в растворе.
Слайд 44Для природных вод, контактирующих с воздухом, содержащим кислород, не принято
давать точной оценки величины рē системы, даже при фиксированном значении
рН.
Это связано с тем, что полное восстановление кислорода происходит в две ступени, протекают две последовательных реакции:
O2 + 2H+ + 2ē = H2O2 при рН = 7, рē = 4,5,
H2O2 + 2H+ + 2ē = 2H2O
Реальные природные редокс-системы
¼ O2 + H+ + ē = ½ H2O при рН = 7, рē = 13,8
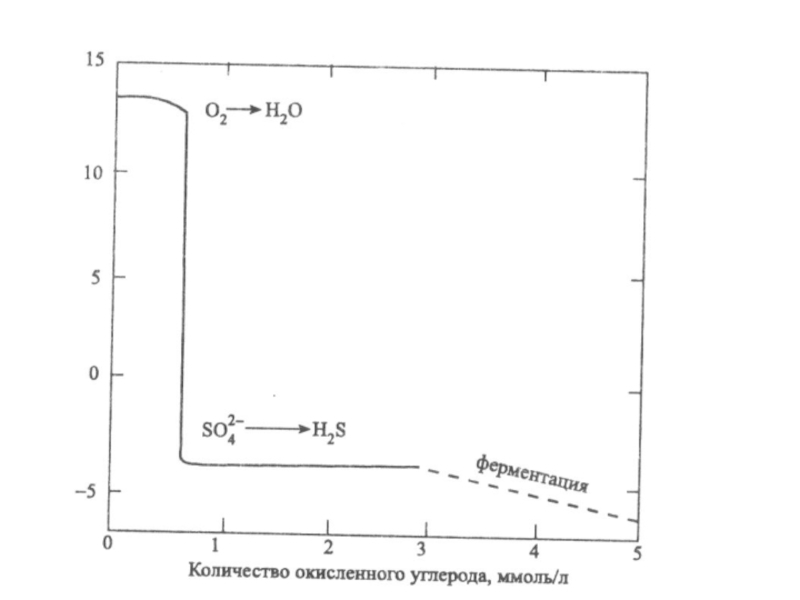
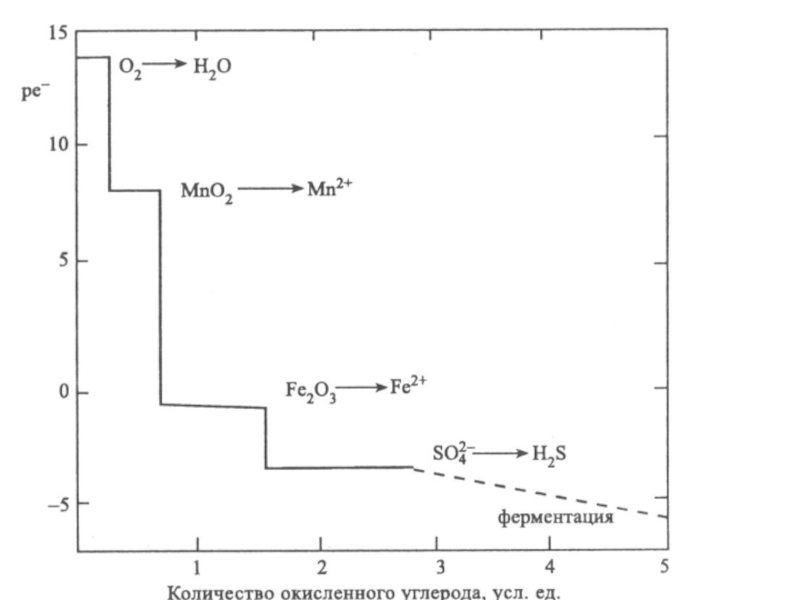
Слайд 46Денитрификация.
Роль реакции состоит в превращении нитрата (важного питательного вещества) в
биологически инертный молекулярный азот. При этом бактерии используют кислород нитратных
ионов для окисления органического вещества и перевода его в СО2:
2.5Сорг + 2 NO3- +2H+ = N2 + 2.5CO2 + H2O
Слайд 47Сульфат-редукция
Или Восстановление сульфатов.
Это реакции, в которых бактерии используют для
окисления органического вещества кислород сульфатных ионов, образуя в качестве продуктов
жизнедеятельности сульфидные формы:
2Cорг + SO42 + 2H2O ®H2S + 2HCO3-
Слайд 48Сульфат-редукция
Поскольку сульфат-ионы относятся к главным ионам природных вод, имеют широкое
распространение и содержатся в природных водах, во многих случаях в
достаточно больших концентрациях они способны на некоторое время стабилизировать редокс - уровень системы, несмотря на возможное поступление восстановителей. При этом рē системы будет отрицательным, поскольку при рН=7, рē = -4,5.
Слайд 49Ферментация
Процесс разрушения органических веществ, протекающий при участии микроорганизмов, приводит к
появлению новых, более простых органических соединений.
Брутто-уравнение бактериальной ферментации выглядит
следующим образом:
[органическое соединение А]Þ [органическое соединение B] + CO2
Слайд 50На сколько единиц снизится редокс уровень системы, определяемый верхней границей
устойчивости воды, если парциальное давление кислорода в, находящемся в равновесии
с водой, воздухе снизится: с Р = 1атм до:
а) парциального давления соответствующего средним значениям в приземном воздухе, с относительной влажностью 90%, при температуре 298 К и общемдавлении равном 1 атм.;
б) в миллион раз.
Какое значение будет иметь pē, для случаев а) и б) при рН раствора, равном 7.
Слайд 51В стандартных условиях значение энергии Гибса для окислительно-восстановительной реакции можно
представить в виде:
∆G0реакц. = -n*F*E0h
где: ∆G0 – значение энергии Гибса
в стандартных условиях; n - число электронов, участвующих в процессе; F – число Фарадея; . E0h – окислительно-восстановительный потенциал, измеренный в стандартных условиях относительно стандартного водородного электрода.
Слайд 52Верхняя граница устойчивости воды связана с возможностью протекания процесса ее
окисления. Окислительно-восстановительная реакция, протукающая при этом, может быть представлена уравнением
:
½ H2O = ¼ O2 + H+ + ē
или
¼ O2 + H+ + ē = ½ H2O
Зависимость величины редокс потенциала системы от парциального давления кислорода в равновесном воздухе и от рН раствора описывается уравнением :
рē = 20,8 +1/4 lg(Р(кисл.) ) – рН
При парциальном значении кислорода равном 1 атм. и рн=7 значение рē составит:
рē = 20,8 – 7 = 13,8
Слайд 53При относительной влажности, равной 90%, и температуре 298 К парциальное
давление кислорода в приземном воздухе можно определить по уравнению:
Р(кисл.) =
(Р(общ.) – φР(паров. воды)) С*(кисл.)
где: Р(кисл.) – парциальное давление кислорода; (Р(общ.) и Р(паров. воды) общее давление и равновесное давление паров воды при заданной температуре (см. Приложение); φ – относительная влажность воздуха; С*(кисл.) –объемная доля кислорода в приземном слое воздуха (0,209)
В условиях а), рассматриваемого примера, Р(кисл.) составит:
Р(кисл.) = (1 – 0,9*0,031) 0,2095 = 0,20 атм.
Значение рē составит:
рē = 20,8 – 1/4lg(0,20) – 7 = 13,6
Слайд 54Для случая а), изменение рē составит:
∆рē = 13,8 –
13,6 = 0,2
В случае б), значение рē составит:
рē = 20,8
– 1/4lg 10-6– 7 = 12,3
Для случая б), изменение рē составит:
∆рē = 13,8 – 12,3 = 1,5
Ответ: в случае а) редокс уровень системы изменится на 0,2 единицы рē и будет равен рē = 13,6; в случае б) - ∆рē = 1,5 и рē = 12,3.
Слайд 57Какое парциальное давление кислорода должно соответствовать редокс уровню системы, в
которой протекает анаэробный процесс восстановления диоксида углерода до метана (рē=-4,2),
при наступлении равновесия, если рН раствора равен 7?
Слайд 58При установлении равновесия в системе редокс потенциалы всех окислительно- восстановительных
реакций должны быть равны друг другу. Поэтому окислительно-восстановительный потенциал реакции
определяющей верхнюю границу устойчивости воды будет равен окислительно-восстановительному потенциалу реакции восстановления диоксида углерода:
рē = 20,8 +1/4 lg(Р(кисл.) ) – рН = -4,2.
Слайд 59Из этого равенства легко найти Р(кисл), при рН = 7,
получим:
1/4 lg(Р(кисл.) ) = -4,2.-20,8 + рН = -4,2 –20,8
+7 = -18,0
lg(Р(кисл.) )= -72
Р(кисл.) = 10-72 атм.
Ответ: Парциальное давление кислорода в воздухе должно соответствовать значениям Р(кисл.) = 10-72 атм.











![Карбонатное равновесие и растворение карбонатных пород Процессы растворения газов в природных водах Закон Генри[Сi] р-р= КГi * Процессы растворения газов в природных водах Закон Генри[Сi] р-р= КГi * Рi](/img/thumbs/ef4d92db74f80aa597d9e71963d98526-800x.jpg)